人结直肠癌肝转移瘤中CD11b+髓系细胞分选方法的建立与鉴定*
2017-09-22王东旭霍婷婷田耀文磊1
王东旭, 霍婷婷, 田耀文, 赵 磊1, △
(1济南大学,山东省医学科学院医学与生命科学学院, 山东 济南 250200; 2郑州大学第一附属医院,河南 郑州 450001; 3山东大学附属山东省肿瘤医院肝胆外科, 山东 济南 250117)
·实验技术·
人结直肠癌肝转移瘤中CD11b+髓系细胞分选方法的建立与鉴定*
王东旭1, 3, 霍婷婷2, 3, 田耀文1, 3, 赵 磊1, 2, 3△
(1济南大学,山东省医学科学院医学与生命科学学院, 山东 济南 250200;2郑州大学第一附属医院,河南 郑州 450001;3山东大学附属山东省肿瘤医院肝胆外科, 山东 济南 250117)
目的: 从结直肠癌肝转移瘤组织中分选出高纯度的CD11b+髓系细胞,从而建立从一种组织中获得特异单细胞的方法。方法: 采用机械联合酶消化法将实体瘤组织制备成单细胞悬液;利用流式细胞术分选出CD11b+髓系细胞,并回测细胞纯度;采用免疫细胞化学技术对分选出细胞的特异性进行鉴定;采用吉姆萨和台盼蓝染色对获得细胞进行评价。结果: 流式细胞术能从机械联合酶消化法制备的单细胞悬液中分选出高纯度、足够数量的CD11b+细胞;分选前细胞阳性率与分选后纯度的差异有统计学意义(P<0.01),分选后纯度达到实验研究的要求(P<0.05);免疫细胞化学技术验证了分选细胞的特异性;分选后的细胞形态完整,活性良好。结论: 机械联合酶消化法制备的单细胞悬液,经过流式细胞术分选,能够分选出高纯度、活性良好且形态完整的特异性细胞,操作方法稳定可重复,满足进一步研究的要求。
结直肠癌肝转移瘤; 流式细胞术; 细胞分选; CD11b+髓系细胞; 免疫细胞化学
结直肠癌是世界范围内最常见的肿瘤类型之一,肝转移是结直肠癌患者的主要致死因素[1-2]。目前而言结直肠癌肝转移患者的五年生存期并没有多大改观,有效治疗率依旧保持在低水平[3]。肿瘤的转移是一个多步骤的复杂过程,对肝转移的抑制是治疗结直肠癌有效的手段[4]。大量研究表明髓系细胞广泛参与了肿瘤转移灶的形成与进展[5-6],而在结直肠癌肝转移中,不同亚群的髓系细胞发挥着不同的作用。分泌肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)与诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的树突状细胞(TNF-α/iNOS producing dendritic cells,Tip-DCs)是一群表面分子表型为CD11b的特殊类型髓系细胞[7]。前期研究发现,在结直肠癌肝脏转移灶中,机体通过趋化因子CCL2结合其受体CCR2,募集大量的CD11b+髓系细胞浸润。而在动物实验中,选择性地去除该群CD11b+髓系细胞后肝转移灶的生长明显受到抑制,一些已形成的转移灶缩小甚至消失[8-9]。
因此,对该群髓系细胞参与结直肠癌肝转移的研究有利于更好地了解肝转移的分子机制,为临床工作提供新的方向。我们进一步研究发现肝转移灶中CD11b+髓系细胞则较多存在于肿瘤浸润组织的边缘以及瘤组织的基质中[9]。因此我们探寻从手术取下的肝转移瘤组织中,对该髓系细胞进行特异分离与提取。本实验联合机械-酶消化法与流式细胞术分选出目标细胞,并对获取的细胞进行鉴定和评价,从而建立了一种从结直肠癌肝转移瘤组织中获取特异性细胞的分选方法。
材料和方法
1标本来源
收集2016.02~2016.11期间山东省肿瘤医院外科七病区肝胆外科中10例结直肠癌肝转移瘤患者的手术切除组织标本(年龄35~78岁,平均62.8岁),所有患者病理结果确诊为结直肠癌肝转移。取离体30 min内肿瘤边缘组织1 cm×1 cm×1 cm,立即放入备好的装有冰冷PBS的保存管内。
2试剂、材料与主要仪器
RPMI-1640培养基、红细胞裂解液和胎牛血清(Gibco);胶原酶(Roche);胰酶抑制剂(Invitrogen);70 μm细胞筛网(北京优尼康生物科技有限公司);台盼蓝染液(Sigma);吉姆萨工作液(北京索莱宝科技有限公司);细胞计数板、载玻片与盖玻片(ThermoFisher);抗体CD11b-FITC(11-0113)、抗体IgG1-K-FITC(11-4714)和抗体CD11b-PE(11-0128)均购自eBioscience;即用型DAPI溶液和抗荧光衰减封片剂(北京索莱宝科技有限公司);流式细胞检测仪(BD,FACSCalibur);流式细胞分选仪(BD,FACSAria Ⅱ);恒温水浴箱(常州精达仪器);造冰机(上海知信实验仪器技术有限公司);离心机(Kendro);荧光显微镜(Olympus)。
3方法
3.1瘤组织分离成单细胞悬液 将转移瘤组织放入小培养皿中(保持操作在冰上进行),剪成小块,越小越好;将剪碎的转移瘤组织转移至装有10 mL RPMI-1640培养基(内含有0.05%的胶原酶100 μL,0.01%的胰酶抑制剂200 μL)的50 mL离心管内;置于37 ℃恒温水浴箱中保持30 min,每5 min摇晃1次;置于冰上冷却,后用70 μm的细胞筛网过滤到另一个50 mL试管,用10~20 mL的冰冷PBS冲洗,确保过滤完全; 4 ℃下1 400 r/min离心5 min,去上清,可观察到一些黏液状黄色的絮状物在试管底,用30 mL的冰冷PBS重悬;4 ℃下1 400 r/min离心5 min,去上清,用预热的红细胞裂解液(3~5)mL重悬裂解沉淀,室温下裂解液中保持3 min以裂解红细胞;用20 mL冰冷FACS缓冲液(PBS、2% FCS和0.09% NaN3)稀释;再次用70 μm细胞筛网过滤到另一离心管中,去除脂质碎片;4 ℃下1 400 r/min离心5 min,去上清,用20 mL冰冷FACS缓冲液重悬; 4 ℃下1 400 r/min离心5 min,去上清;加入1 mL的FACS染色缓冲液,调整细胞密度到(1~2)×1010/L,取100 μL于显微镜下细胞计数;各取100 μL单细胞悬液到2个流式试管(细胞数目1×106左右),分对照(control)组和实验(experimental)组,6 h内上机检测。
3.2流式细胞术检测与分选 实验组试管加入CD11b-FITC抗体5 μL,对照组试管加入IgG1-K-FITC抗体5 μL,避光,4 ℃孵育(30~40) min;加3 mL FACS缓冲液到每个FACS试管,4 ℃下1 200 r/min离心3 min,去上清;再次加入3 mL FACS缓冲液,4 ℃下1 200 r/min离心3 min,去上清;(200~500) μL冰浴FACS缓冲液重悬细胞;调整流式细胞分选仪到最佳状态,以CD11b+细胞设门,先检测样品中1万个细胞中免疫表型为CD11b的髓系细胞的百分比,即分选前阳性率,然后对样品进行分选,收集尽可能多的细胞。
3.3流式细胞术检测分选后的细胞纯度 取分选后的细胞悬液100 μL,加入100 μL冰PBS,以原对照管为基础荧光,检测分选得到的细胞悬液中CD11b+细胞的比例,即分选后的纯度。
3.4鉴定分选后细胞的特异性 取分选得到的细胞悬液100 μL,加入CD11b-PE(与分选所用的CD11b-FITC克隆号以及结合表位均不同)抗体5 μL, 4 ℃避光孵育30 min;加入FACS缓冲液3 mL,4 ℃下1 200 r/min离心3 min,去上清; 加入适量FACS缓冲液,取细胞悬液滴于载玻片上,保持避光;待玻片上细胞涂层均匀后,滴加100 μL DAPI溶液,保持避光;滴加1滴抗荧光衰减封片剂,避免气泡生成,加盖盖玻片;静置1 min,立即置于荧光显微镜下观察。
3.5分选后细胞的存活率 将0.4%的台盼蓝染液与分选出的细胞按1∶9混匀,滴入改良牛鲍计数板,3 min内显微镜下观察细胞存活率。计算公式如下:细胞存活率(%)=染色阴性细胞数/细胞总数×100%。
3.6对比观察细胞形态 取吉姆萨浓缩液0.1 mL和吉姆萨稀释液0.9 mL充分混匀成1 mL染色液;细胞悬液滴于载玻片上,推片成膜,自然干燥,水平放置;用甲醇固定2~3 min;将细胞涂片放置于染色架上,滴加稀释好的染色液,使其覆盖全部细胞,室温下静置15~30 min;用PBS缓慢从玻片的一端冲洗(不要先倒去染液或直接对细胞冲洗);趁湿加盖玻片或待干燥后镜检;用分选前后的细胞悬液分别进行染色,对比观察。
4统计学处理
用软件SPSS 19.0进行统计学分析。肝瘤组织中CD11b+髓系细胞的数量不一,因此分选前检测单细胞悬液的阳性细胞的比例各不相同。采用配对样本t检验对10例样本的分选前阳性率以及分选后纯度进行比较,以P<0.01为差异有统计学意义。同时根据以往研究[10-11],流式分选可以达到95%~100%的纯度,采用单样本均数t检验,判断本研究的10例样本分选纯度是否不低于一般流式分选纯度,以标准95%为已知总体的分选纯度,以P<0.05为差异有统计学意义。
结 果
1流式细胞术检测CD11b阳性细胞并分选
原始数据通过流式分析软件FlowJo 7.6.1 分析。除去微小细胞碎片,选取对照组80%左右的样品设门;以对照组的样品区域划分界线,非特异表达的阳性率控制在2%左右;将操作应用于实验组样品数据,结果显示能够将阳性细胞与阴性细胞分为2个细胞群,实验组的阳性细胞比率为20%,即为分选前阳性率。表明从瘤组织中能够分离出阳性细胞,而且分群明显,进而将图1C中Q2区域进行分选,见图1。

Figure 1. The single cell suspension in control group and experimental group was sorted by flow cytometry. A: selecting the 80.4% sample data in control group; B: defining the boundary according to the data of control group; C: in the experimental group, the negative and positive cells were clearly divided, and the positive rate was 20%.
图1流式细胞术分选单细胞悬液
2流式细胞术分选后CD11b+细胞纯度的测定
流式细胞术分选后得到的单细胞悬液中,检测阳性细胞的比例,即为分选后纯度。图2A、B为对照组的基础荧光结果;图2C为分选后细胞的检测结果,显示阳性细胞率达到98%左右。结果表明分选后细胞具有较高纯度,可以进行后续的细胞生物学和免疫学研究。

Figure 2. The sorted cells were tested, based on the original control group. A: selecting the 80.1% sample data in control group; B: defining the boundary, nonspecific expression 4.06%; C: the percentage of positive cells was 98.7%.
图2分选所得单细胞悬液的阳性细胞纯度的测定
3分选后细胞的特异性鉴定
采用直接免疫荧光技术对分选出细胞的特异性进行鉴定。荧光显微镜3个通道下观察,1号通道下DAPI染色细胞核呈现蓝色荧光(图3A),2号通道下细胞表面黄绿色荧光为流式分选时标记的CD11b-FITC抗体(图3B),3号通道下细胞表面呈现均匀的CD11b-PE红色荧光(图3C),图3D为细胞DAPI染色和PE染色的图片融合,显示细胞膜呈现红色荧光,核显示蓝色荧光。结果表明CD11b-PE抗体可以特异性地结合在分选后的细胞表面,证明分选后的细胞为一致的CD11b阳性细胞。

Figure 3. Direct immunofluorescence was observed (×40). A: under channel 1, DAPI staining showed that the nuclei were stained blue; B: under channel 2, the cell membrane showed yellow fluorescence; C: under channel 3, CD11b-PE staining showed that the cell membrane was stained with red; D: the fusion photograph of channel 1 and 3 showed that the cell membrane was red and nuclear was blue.
图3直接免疫荧光观察
4分选前后细胞的形态对比
采用吉姆萨染色法对分选前后的细胞形态对比观察(图片经过处理)。分选前的细胞成团成块,形态各不相同,为各种细胞混合;分选后的细胞,不再成团块,形态类型相似。证明分选后的细胞类型单一,且形态完整,见图4。
5分选后细胞成活率的计算和分选差异的统计学分析
对10例分选后的细胞样品进行台盼蓝染色后,根据染色结果计算平均存活率约为(90.2±1.2)%。
统计分析10例样本分选前细胞阳性率与分选后细胞纯度。分选前的阳性细胞率为(18.87±3.14)%,分选后细胞的纯度为(96.97±0.66)%(P<0.01),分选效果明显;分选后细胞纯度与一般流式分选纯度的差异比较有统计学意义,可以认为该10例样本平均分选纯度高于95%,同时表明所建立的方法具有良好的可重复性,见图5。

Figure 4. The morphological changes of the cells before and after sorting were observed with Giemsa staining. A: the Giemsa staining showed that the cells were agglomerate before sorting; B: the cells were dissociative after sorting.
图4吉姆萨染色下细胞分选前后的形态观察
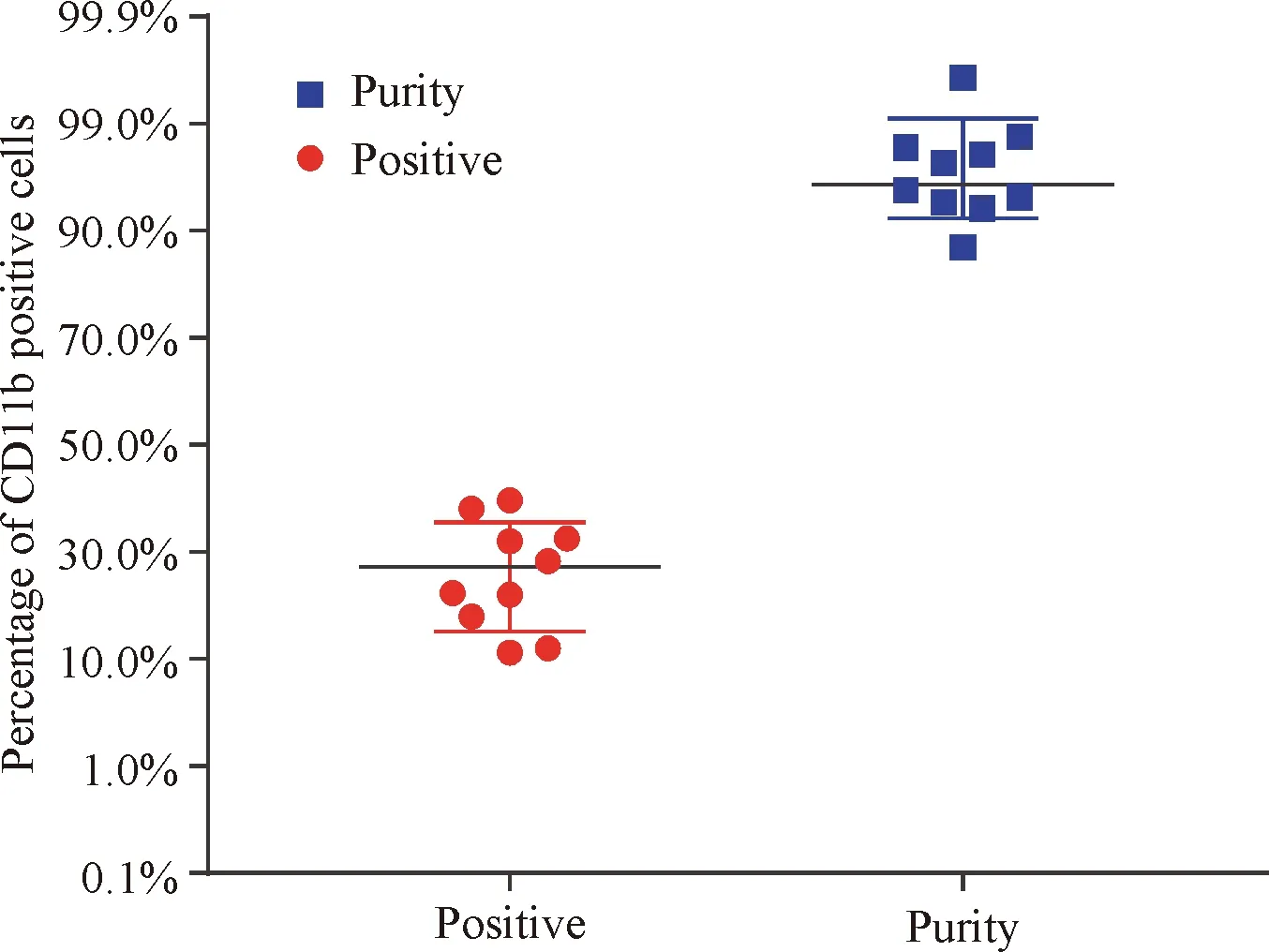
Figure 5. The statistical distribution of the positive rate before sorting and the purity after sorting. Thettest of paired samples proved that the difference was obvious between the positive rate [(18.87±3.14)%] and purity [(96.97±0.66)%] (P<0.01). The single-samplettest showed that the purity of the sorting was higher than that of the general flow sorting, and the difference was significant (single tail,P<0.05/2).n=10.
图5分选前细胞阳性率以及分选后阳性细胞纯度的统计分布
讨 论
目前,从实体组织中分离出单细胞的方法分为机械法和化学法两大类,机械法包括研磨法、网搓法等,化学法有酶消化法、化学试剂分解法等[12]。各类方法的原理各不相同,效果也参差不齐。由于肿瘤组织病理类型的不同,适用的分离方法也不相同[13-15]。结直肠癌肝转移瘤中,单纯的利用机械法处理组织制成单细胞悬液,经过流式检测,发现分离的细胞数量很有限,同时单细胞悬液中的阳性细胞比例很少,达不到流式分选的上样条件;而单纯利用化学消化法,我们发现,结直肠癌肝转移瘤的结缔组织较多导致并不能充分消化组织块,难以制成有效的单细胞悬液。因此,我们首先采用机械法将瘤组织剪成匀浆状态,增大酶消化的接触面积,然后采用胶原酶消化间质组织进而使充盈其中的髓系细胞游离出来,二者相互配合,不可或缺。同时,在37 ℃水浴消化时加入的胰酶抑制剂可以尽可能地避免细胞死亡破碎时释放的胰酶对髓系细胞的破坏。
单细胞悬液的细胞纯化方法主要有密度梯度离心法、磁珠分选和流式细胞术分选[16]。密度梯度离心法依靠细胞沉降系数,所得到的细胞纯度低,并且细胞的表面标记不明确,现已很少使用。对于我们的研究来说,转移瘤组织的取材部位不同、实验操作时间的长短都会导致制备的单细胞悬液中CD11b阳性髓系细胞并不多,有时会低于10%。同时尽可能高的细胞纯度和数量对于我们来说也是十分必要的,因此尽管磁珠分选能够使细胞纯度达到90%以上,但仍然达不到我们要求的95%以及更高,同时对于表达较低(10%以下)的细胞来说并不适合,而且容易污染[17-18]。流式细胞术具有高的精准度,操作过程封闭,能够避免污染,分选纯度以及回收率均高于磁珠分选,是目前公认的细胞纯化的金指标。流式细胞术操作复杂、耗时长、费用昂贵,但是很好地满足了我们的研究要求[19]。在分选出阳性细胞后,我们依然需要对所获细胞进行鉴定以及评价。细胞免疫荧光技术鉴定了细胞的特异性,证明所分选的确实是CD11b阳性细胞,而吉姆萨染色表明分选后细胞的形态稳定。结直肠癌肝转移瘤中的CD11b+髓系细胞的数量受个体差异的影响,实验分选样品的阳性率也因此有所不同,因而最后我们通过统计分析证明所建立的方法操作稳定,分选效果显著。同时10例分选后细胞纯度达到了一般流式分选的纯度,满足后续的分子生化以及免疫学研究的要求。通常,在国内外研究中采用细胞培养技术,特异地诱导培养出待研究观察的细胞,并进行各种细胞生物学的实验研究,在某些情况下特异性细胞株难以培养或是各种原因难以获得;而利用手术标本中直接获得特异性细胞,同样可以满足对细胞进行生物化学实验的要求[20]。因此,这对于相类似的肠道肝转移瘤组织获取单细胞进行实验研究来说,该实验提供了一种可以参考的实验技术。
总而言之,CD11b+髓系细胞参与了肝转移瘤的进展过程,我们对该细胞的分选直接为后续进行的深入研究提供了条件,同时确立了一套结直肠癌肝转移瘤获取特异细胞的操作方法。但是受限于离体组织的活性较差且实验中复杂的操作过程,获取的细胞在活力与细胞状态上与体外培养的细胞仍然有较大差距,这也是我们今后不断改进研究的方向。
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012, 62(1):10-29.
[2] Weiss L, Grundmann E, Torhorst J, et al. Haematogenous metastatic patterns in colonic carcinoma: an analysis of 1541 necropsies[J]. J Pathol, 1986, 150(3):195-203.
[3] Cidón EU. The challenge of metastatic colorectal cancer[J]. Clin Med Insights Oncol, 2010, 4:55-60.
[4] Arru M, Aldrighetti L, Castoldi R, et al. Analysis of prognostic factors influencing long-term survival after hepatic resection for metastatic colorectal cancer[J]. World J Surg, 2008, 32(1):93-103.
[5] Medina-Echeverz J, Eggert T, Han M, et al. Hepatic myeloid-derived suppressor cells in cancer[J]. Cancer Immunol Immunother, 2015, 64(8):931-940.
[6] Sevko A, Umansky V. Myeloid-derived suppressor cells interact with tumors in terms of myelopoiesis, tumorigenesis and immunosuppression: thick as thieves[J]. J Cancer, 2013, 4(1):3-11.
[7] Wilsmann-Theis D, Koch S, Mindnich C, et al. Generation and functional analysis of human TNF-α/iNOS-producing dendritic cells (Tip-DC)[J]. Allergy, 2013, 68(7):890-898.
[8] Yang L, DeBusk LM, Fukuda K, et al. Expansion of myeloid immune suppressor Gr+CD11b+cells in tumor-bearing host directly promotes tumor angiogenesis[J]. Cancer Cell, 2004, 6(4):409-421.
[9] Zhao L, Lim SY, Gordon-Weeks AN, et al. Recruitment of a myeloid cell subset (CD11b/Gr1mid) via CCL2/CCR2 promotes the development of colorectal cancer liver metastasis [J]. Hepatology, 2013, 57(2):829-839.
[10] 陈朱波, 曹雪涛. 流式细胞术: 原理、操作及应用[M]. 第2版. 北京: 科学出版社, 2014: 14-32.
[11] Rieseberg M, Kasper C, Reardon KF, et al. Flow cytometry in biotechnology[J]. Appl Microbiol Biotechnol, 2001, 56(3-4):350-360.
[12] 任兴昌, 方 黎, 陈洪勋. 实体组织单细胞悬液制备方法[J]. 临床与实验病理学杂志, 2007, 23(4):490-491.
[13] 颜 政, 方驰华.人肝细胞癌细胞亚群的克隆分离及异质性机制的初步研究[J]. 世界华人消化杂志, 2006, 14(5):481-485.
[14] Yovchev MI, Dabeva MD, Oertel M. Isolation, characterization, and transplantation of adult liver progenitor cells[J]. Methods Mol Biol, 2013,976:37-51.
[15] 刘胜军, 方驰华. 流式细胞仪、免疫磁珠及亲和板结合分离法分选c-kit+肝癌细胞的比较[J]. 中华消化外科杂志, 2007, 6(3):206-208.
[16] Fulwyler MJ. Flow cytometry and cell sorting[J]. Blood Cells, 1980, 6(2):173-184.
[17] 黄莹莹, 尹盛夏, 曹文强, 等. 高端流式分选与免疫磁珠法纯化T细胞的比较[J]. 国际医药卫生导报, 2016, 22(22):3377-3383.
[18] 徐 勇, 霍 梅. 免疫磁珠分离及流式细胞仪分选纯化外周血CD34+/CD90+干细胞[J]. 临床检验杂志, 2004, 22(4):246-248.
[19] 胡 凡. 流式细胞分选术在生物医学研究中的应用[J]. 药物与人, 2014, 27(11):53-54.
[20] Xue K, Xia W, Zhang X, et al. Isolation and identification of stem cells in different subtype of cartilage tissue[J]. Expert Opin Biol Ther, 2015, 15(5):623-632.
(责任编辑: 陈妙玲, 宋延君)
Identification and establishment of sorting method for isolating CD11b+myeloid cells in human hepatic metastases from colorectal cancer
WANG Dong-xu1, 3, HUO Ting-ting2, 3, TIAN Yao-wen1, 3, ZHAO Lei1, 2, 3
(1School of Medicine and Life Sciences, University of Jinan-Shandong Academy of Medical Sciences, Jinan University, Jinan 250200, China;2The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450001, China;3Department of Hepatobiliary Surgery, Shandong Cancer Hospital Affiliated to Shandong University, Jinan 250117, China. E-mail: drzhaolei@hotmail.com)
AIM: To establish a method for obtaining specific cells in solid tumor tissue by sorting of CD11b+myeloid cells in hepatic metastases from colorectal cancer.METHODS: Tumor tissues were prepared into single cell suspension by mechanical method combined with enzyme digestion, and then the CD11b+myeloid cells were isolated by flow cytometry. The sorted cells were identified by immunocytochemistry. The viability and morphologiy of the sorted cells were evaluated by Giemsa and Typan blue staining. The cell purity was evaluated by flow cytometry.RESULTS: Sufficient numbers of CD11b+cells with high purity were isolated by sorting with flow cytometry from the single cell suspension prepared by mechanical and enzyme digestion. The purity of the cells was confirmed by statistical analysis (P<0.05). The positive rates of the cells before and after sorting were significantly different (P<0.01). The positive cells were verified by immunocytochemical method. Meanwhile, the sorted cells had complete morphology and good activity.CONCLUSION: The CD11b+myeloid cells in solid tumor tissue can be isolated by flow cytometry from the machine-enzyme digestion suspension with high purity, good activity and complete morphology.
Colorectal liver metastases; Flow cytometry; Cell sorting; CD11b+myeloid cells; Immunocytochemistry
1000- 4718(2017)09- 1723- 06
2017- 03- 20 [
] 2017- 06- 13
国家自然科学基金资助项目(No. 81272375; No. 81472713)
R735.3; R392.32
A
10.3969/j.issn.1000- 4718.2017.09.031
△通讯作者: Tel: 0531-67626242; E-mail: drzhaolei@hotmail.com
