黄颡鱼20β-羟基类固醇脱氢酶Ⅰ和Ⅱ基因特征分析和表达模式研究
2017-09-12李英文王雅琴刘智皓
尹 盼 李英文 王雅琴 刘智皓
(重庆师范大学生命科学学院, 重庆市高校动物生物学重点实验室, 重庆 401331)
黄颡鱼20β-羟基类固醇脱氢酶Ⅰ和Ⅱ基因特征分析和表达模式研究
尹 盼 李英文 王雅琴 刘智皓
(重庆师范大学生命科学学院, 重庆市高校动物生物学重点实验室, 重庆 401331)
为探讨20β-羟基类固醇脱氢酶Ⅰ和Ⅱ(20β-HSDⅠ/Ⅱ)在黄颡鱼中的基因特征和表达模式, 研究从黄颡鱼中克隆了这2个基因的全长cDNA。对鱼类2个20β-HSD的系统进化分析和共线性分析结果发现, 20β-hsd基因的复制可能不是TSGD的结果。序列对比结果表明, 鱼类2个20β-HSD可能具有相似的空间结构, 结合相似的辅酶和底物, 但催化产物可能有差异。黄颡鱼2个20β-hsd基因均表达于多个组织, 其中20β-hsdⅠ主要表达于精巢、卵巢、头肾和肾脏中, 而20β-hsdⅡ则高表达于精巢、卵巢、心脏、头肾、肾脏、肠、垂体和肝脏。季节表达模式的研究发现, 在繁殖季节(5月)的黄颡鱼精巢中, 20β-hsdⅠ的表达相对较低, 而20β-hsdⅡ高表达。对黄颡鱼雄性成鱼注射人绒毛膜促性腺激素(hCG)(1000 IU/kg体重)后, 20β-hsd Ⅰ的表达先显著升高,随后迅速显著下调; 而20β-hsdⅡ的表达则持续显著上升。上述结果表明, 黄颡鱼20β-hsdⅠ和20β-hsdⅡ在hCG处理下表达模式存在较大差异。
黄颡鱼; 20β-HSD; 复制基因; cDNA克隆; 表达模式; hCG处理
20β-羟基类固醇脱氢酶(20β-hydroxysteroid dehydrogenase, 20β-HSD)是SDR超家族的一员, 也被称为3α, 20β-HSD、3α/β, 20β-HSD、羰基还原酶(Carbonyl reductase)和短链脱氢酶[1,2]等。20β-HSD能在NADPH的存在下, 参与一大类羰基化合物(如: 外源化合物、内源前列腺素和多种类固醇激素)的降解[3,6]。在对猪的研究中发现, 20β-HSD表达于新生猪的精巢中, 参与类固醇激素水平的调节[7]。鸡的20β-HSD与11β-HSD共表达, 能调节糖皮质激素对肠中Na+的吸收[8]。对大鼠的研究发现, 20β-HSD不仅参与类固醇激素的降解, 还对乙酰苯磺酰环己脲(降压药)和口服降血糖药物的降解起重要作用[9]。
在硬骨鱼类中, 二羟黄体酮(17α, 20β-dihydroxy-4-pregnen-3-one, DHP)是主要的孕激素, 在鱼类卵母细胞的成熟中扮演重要角色; 而20β-HSD则是DHP合成的关键酶[4,5]。另外, 20β-HSD还参与鱼类的排精[10]。在鱼类生殖周期的大多数时期, DHP均维持低水平, 但在排精前, DHP水平则显著升高[11,15]。研究还发现, 在鱼类配子成熟过程中, 促性腺激素能上调20β-hsd的表达[3,5,14,15], 表明20β-HSD受下丘脑/垂体/性腺(HPG)轴的调控。由于辐鳍鱼类特有的基因组倍增事件(Teleost Specific Genome Duplication, TSGD)[16], 使其基因组中含有大量的平行进化同源基因, 其中也包括多种类固醇合成酶基因, 如cyp19、cyp17等[17,21]。然而, 在除鲑鳟类[14,22,23]以外的所有脊椎动物的基因组中, 迄今为止均只发现一个20β-hsd (20β-hsd Ⅱ)[8,9,24]。
本研究首次在硬骨鱼类中分离到了由2个不同基因编码的20β-HSD, 并在黄颡鱼中克隆了上述复制基因的全长cDNA。为进一步了解20β-hsd复制基因的进化、表达和调控模式, 本研究对鱼类2个20β-hsd基因进行了系统发生分析、共线性分析, 并研究了黄颡鱼上述基因的组织表达模式、季节表达模式和hCG对其的调控, 为深入研究其功能和表达调控奠定了基础。
1 材料与方法
1.1 样本采集与处理
实验所用黄颡鱼雌雄性成鱼购自重庆盘溪水产市场。解剖雌雄黄颡鱼成鱼各组织(T. 精巢、O.卵巢、H. 心脏、S. 脾脏、HK. 头肾、K. 肾脏、I.肠、P. 垂体、B. 脑、M. 肌肉、L. 肝脏), 迅速放入液氮中速冻, –80℃保存备用。
1.2 总RNA提取和第一链cDNA的合成
根据TRIzol (Invitrogen)说明书, 从黄颡鱼成鱼提取性腺总RNA, 并测定其浓度。取1 μg总RNA,经gDNA Eraser (TaKaRa)去除基因组DNA后, 按PrimeScript RT reagent Kit (TaKaRa)说明书合成第一链cDNA。
1.3 引物设计
根据GenBank (http://www.ncbi.nlm.nih.gov)上公布的斑点叉尾(Ictalurus punetaus)和革胡子鲶(Clarias gariepinus)等20β-hsd Ⅰ的cDNA序列, 在其保守区域设计引物(本实验所用引物见表 1、序列号见表 2)。
1.4 黄颡鱼20β-hsdⅠcDNA的克隆
利用已合成的第一链cDNA在PCR扩增仪(Bio-Rad ⅠQ5)上扩增中间片段(20β-hsd Ⅰ F/R)。扩增条件为: 94℃ 3min, 35个循环的94℃ 30s, 52℃ 30s, 72℃ 30s, 72℃延伸7min。扩增片段在1% 的琼脂糖凝胶上电泳, 溴化乙锭(EB)染色后, 在凝胶成像系统上分析。目的片段用胶回收试剂盒(Geneview)纯化后亚克隆入pMD19-T载体(TaKaRa), 随后转化到大肠杆菌DH5α中, 经蓝白斑筛选后, 将阳性克隆送上海英骏公司(Invitrogen)测序。
根据测序验证后的中间片段序列设计RACE引物(20β-hsd Ⅰ FR/RR), 扩增黄颡鱼20β-hsd ⅠcDNA的5′和3′末端, 步骤参照SMARTTMRACE cDNA Amplification kit (Clontech)说明书进行。根据测序得到5′序列和3′序列进行拼接, 并进行Endto-End PCR扩增验证(20β-hsd Ⅰ F0/R0)。所用引物见表 1。
1.5 黄颡鱼20β-HSD Ⅰ序列的同源性分析
根据已获得的20β-hsd Ⅰ全长cDNA序列, 应用DNAStar和Clustal X软件推导其氨基酸序列并进行多重序列对比分析。用Mega5.0软件构建系统进化树, 进化树中的数值表示随机进行1000次计算的重复率, 代表该进化树的可靠性。分析所用脊椎动物20β-HSD氨基酸序列均从GenBank下载, 序列号见表 2。
1.6 黄颡鱼20β-hsd Ⅰ和Ⅱ的组织表达模式
根据TRIzol (Invitrogen)说明书, 用–80℃保存备用的黄颡鱼各组织提取总RNA。取1 μg总RNA,用gDNA Eraser (TaKaRa)去除基因组DNA后, 合成第一链cDNA。用基因特异性引物(20β-hsdⅠ QF/ QR和20β-hsd Ⅱ QF/QR)研究黄颡鱼20β-hsdⅠ和Ⅱ在黄颡鱼各组织中的表达模式, 并以β-actin (βactin F/R)(252 bp)作为内参。含质粒和蒸馏水为模板扩增的产物分别作为阳性和阴性对照。扩增条件为: 为94℃ 3min, 25(目的基因)和20(β-actin)个循环的94℃ 30s, 60℃ 30s, 72℃ 30s, 72℃延伸7min。PCR产物在1%的琼脂糖凝胶上电泳, EB染色后在凝胶成像系统上进行拍照、分析。

表 1 引物序列Tab. 1 The primer sequences
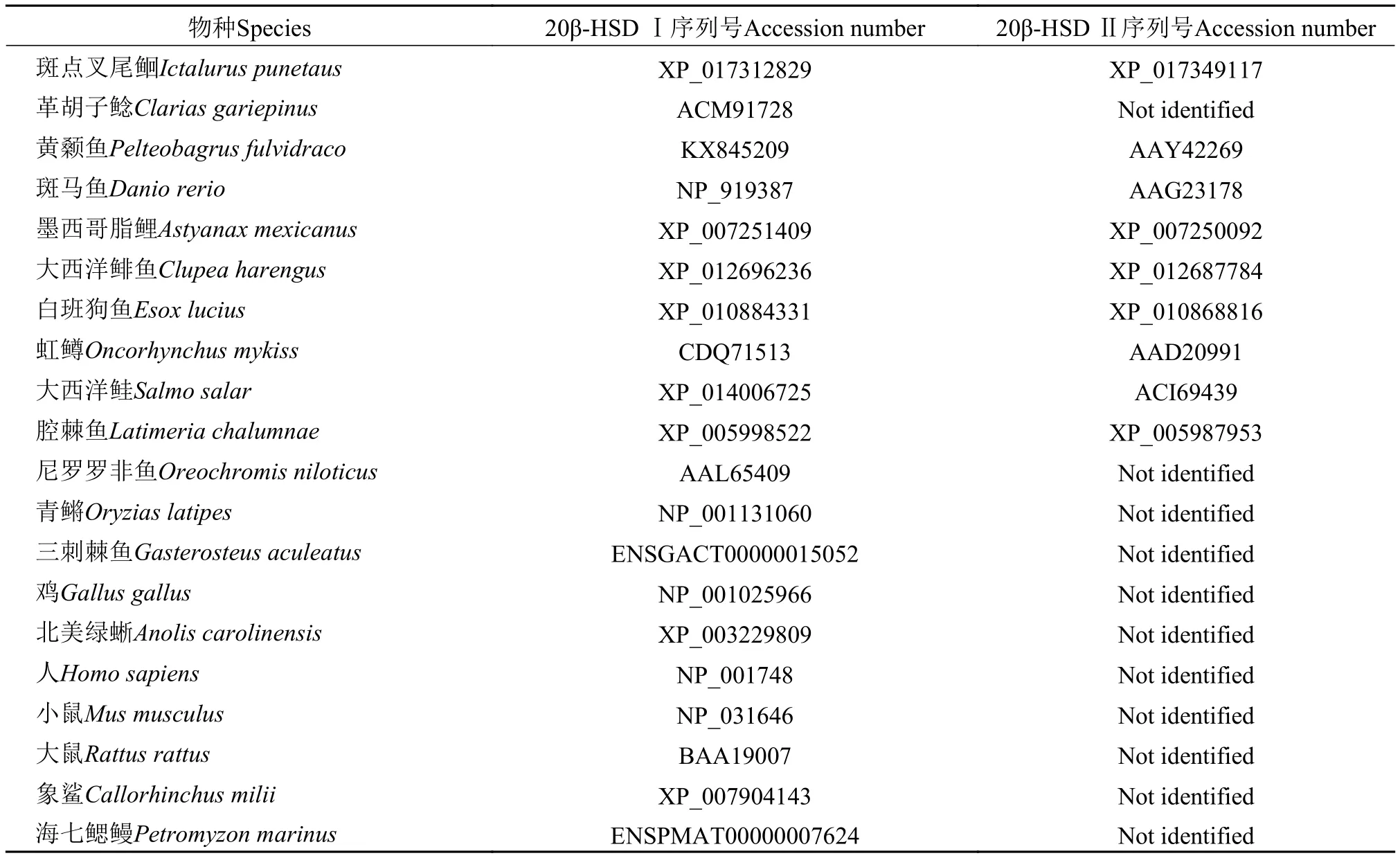
表 2 物种及其序列号Tab. 2 The species and corresponding accession numbers
1.7 季节表达模式和hCG调控的研究
在2016年的1、5、7和11月分别收集黄颡鱼雄性成鱼6尾, 作为6个平行样, 取其精巢, 加1.0 mL TRIzol (Invitrogen)于玻璃匀浆器中匀浆, 提取总RNA, 用1%琼脂糖凝胶电泳检测RNA样品的完整性, 并用Nano-Drop 2000核酸蛋白检测仪测定总RNA样品的纯度和浓度, A260/280在1.8—2.0。总RNA置于–80℃保存备用。
在2016年的5月, 收集黄颡鱼雄鱼108尾, 分为2组(对照组和hCG处理组)。对照组雄鱼注射0.5 mL生理盐水, 处理组按照1000 IU/kg体重注射hCG (生理盐水配制)。在注射后的3h、6h和9h后, 取对照组和处理组黄颡鱼(各6尾)精巢, 加1.0 mL TRIzol (Invitrogen)于玻璃匀浆器中匀浆, 提取总RNA, 用1%琼脂糖凝胶电泳检测RNA样品的完整性, 并用Nano-Drop 2000核酸蛋白检测仪测定总RNA样品的纯度和浓度, A260/280在1.8—2.0。总RNA置于–80℃保存备用。
取1 μg总RNA按照PrimeScript RT reagent Kit (TaKaRa)说明书去除基因组DNA, 并进行反转录。合成的第一链cDNA稀释5倍后于–20℃保存备用。用在线引物设计软件(https://www.ncbi.nlm.nih.gov/ tools/primer-blast/)设计目的基因(20β-hsdⅠ和20βhsdⅡ)和管家基因(β-actin)的定量PCR引物(所用引物见表 1)。定量PCR反应包含0.3 μmol/L引物、1×Sybr Green master mix (TaKaRa)、2 μL cDNA,反应体积20 μL。定量PCR反应参数为: 预变性95℃ 30s, 40 个循环的95℃ 5s, 60℃ 30s。反应时,同时做阴性对照并检测熔解曲线, 以保证每个样品中仅有一个PCR产物, 且cDNA未受污染。本研究所用引物的扩增介于96.3%—105.1%。目的基因与β-actin的相对表达量用2–ΔΔCt的方法进行计算[25]。
1.8 数据处理
结果用SPSS 13.10软件(SPSS, Chicago, ⅠL, USA)进行差异比较, P<0.05, 差异显著。柱形图用GraphPad Prism 6 (San Diego, CA)进行绘制。
2 结果
2.1 多重序列对比分析
采用RT-PCR和RACE的方法克隆得到黄颡鱼20β-hsd Ⅰ (KX845209)全长cDNA序列, 推导的黄颡鱼20β-HSD Ⅰ氨基酸序列中含有20β-HSD保守的7个结构域, 分别为:Ⅰ. 辅酶结合区及中心β折叠维持区;Ⅱ. 辅酶结合的腺嘌呤环及腺嘌呤环稳定区;Ⅲ. 中心β折叠稳定区;Ⅳ. 部分活性位点;Ⅴ. 底物结合位点; Ⅵ. 催化位点; Ⅶ. 烟碱环氨甲酰基结合位点[14]。多重序列对比发现, 鱼类20β-HSD Ⅰ和Ⅱ均具有脊椎动物SDR超家族保守的7个结构域, 其中结构域Ⅰ、Ⅱ、Ⅲ、Ⅴ和Ⅶ在20β-HSDⅠ和Ⅱ中均高度保守, 而结构域Ⅳ和Ⅵ在20β-HSDⅠ和Ⅱ之间有一定差异(图 1)。
2.2 系统发生分析
系统发生分析结果表明, 脊椎动物20β-HSD明显分为2支(图 2)。一支为海七鳃鳗(无颌类), 另一支则分为2个不同的20β-HSD拷贝(20β-HSD Ⅰ和Ⅱ)。20β-HSD Ⅰ类群分为辐鳍鱼类、肉鳍鱼类、四足类和软骨鱼类(象鲨); 而20β-HSD Ⅱ类群则分为2支: 辐鳍鱼类和肉鳍鱼类。
在辐鳍鱼类和肉鳍鱼类均含有2个20β-HSD拷贝, 而四足类、软骨鱼类和无颌类仅含有1个20β-HSD拷贝(图 2)。进一步分析发现, 20β-HSD Ⅱ仅存在于较为原始的辐鳍鱼类种群[如: 骨鳔鱼类(Otocephala)和原棘鳍总目(Protacanthopterygii)鱼类]和肉鳍鱼类中, 而20β-HSD Ⅰ则存在于几乎所有的脊椎动物类群。
2.3 共线性分析
共线性分析结果表明, 鱼类(包括软骨鱼类)和四足类20β-hsd Ⅰ所在染色体区段的基因组成和定位具有高度的保守性(图 3A)。其中, morc3、setd4和dopey2均为20β-hsd Ⅰ基因的临近基因。同时分析发现, 不同鱼类20β-hsd Ⅰ所在染色体区段上的基因发生了方向的转变或重排, 如: 墨西哥脂鲤runx1和dopey2基因发生了丢失; 与人的基因方向相比, 斑马鱼runx1、itsn1和cryzl1基因的方向发生了颠倒(图 3A)。鱼类20β-hsd Ⅱ所在染色体区段的基因组成和基因方向也具有高度的保守性(图 3B), 而b9d2、tgfb1和iptkca基因则是20β-hsd Ⅱ的临近基因。不同鱼类20β-hsd Ⅱ所在染色体区段上的基因也发生了方向的转变或重排, 如: 在斑马鱼和墨西哥脂鲤中, iptkca位于20β-hsd Ⅱ下游, 而在腔棘鱼中, iptkca则位于20β-hsd Ⅱ上游。此外, 斑马鱼和墨西哥脂鲤的kcnk12l和sdhaf1在染色体上的顺序也发生了互换。然而, 鱼类20β-hsd Ⅰ和20β-hsd Ⅱ所在染色体区段之间毫无相似之处(图 3B)。

图 1 黄颡鱼与其他鱼类2种20β-HSD多重序列比对分析Fig. 1 Multiple alignment of 20β-HSD between yellow catfish and other fish罗马数字Ⅰ—Ⅶ. 鱼类20β-HSD保守的7个结构域Roman numerals. Seven motifs of 20β-HSDs conserved in fish
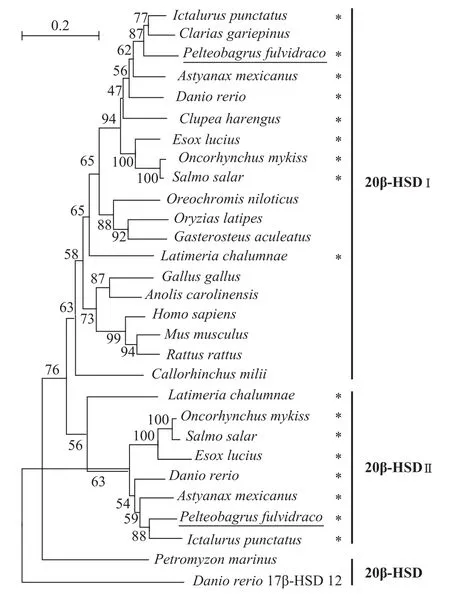
图 2 黄颡鱼与其他脊椎动物20β-HSD的系统进化树
2.4 组织表达分布
组织表达模式的研究结果表明, 黄颡鱼20β-hsdⅠ主要表达于精巢、卵巢、头肾和肾脏中, 在肠中有微弱表达; 而20β-hsd Ⅱ高表达于精巢、卵巢、心脏、头肾、肾脏、肠、垂体和肝脏中, 在肌肉中有微弱表达(图 4)。
2.5 季节表达模式
季节表达模式的结果表明, 黄颡鱼20β-hsdⅠ在精巢中的表达5月最低, 而在11月达到峰值(图5A)。而20β-hsd Ⅱ在精巢中的表达在5月达到峰值, 而在7月显著降低(P<0.05), 随后在11月又显著上升(图 5B)。
2.6 hCG的调控
20β-hsd Ⅰ的表达在hCG注射后3h显著上调, 6h后与对照组相比没有显著差异, 而在9h后则显著下调(图 6A)。20β-hsd Ⅱ的表达在hCG注射后3—9h均显著上调, 且呈明显的时间依赖性(图 6B)。
3 讨论
3.1 鱼类2个20β-hsd基因的复制和进化
在鱼类的进化中, 辐鳍鱼类发生过一次特有的基因组倍增事件(TSGD), 多数的基因都有2个或多个拷贝。20β-HSD是合成DHP的关键酶[20]。然而,多数脊椎动物(包括鱼类)的基因组中只存在1个20β-hsd基因[7,9,26]。本研究从鱼类分离了由2个不同基因编码的20β-HSD。由于新分离的鱼类20β-HSD与其他脊椎动物20β-HSD具有较近的亲缘关系, 命名为20β-HSD Ⅰ; 而另一个20β-HSD则命名为20β-HSD Ⅱ。进一步研究发现, 所有脊椎动物的20β-hsd Ⅰ和鱼类的20β-hsd Ⅱ均分别具有显著的共线性, 表明上述基因所在的染色体区段在进化中相对保守。有研究发现, 由于辐鳍鱼类特有的TSGD, 与四足类相比, 辐鳍鱼类具有大量的复制基因[28,29]。基因组复制会产生平行进化同源基因, 这些基因在染色体上的定位和与临近基因的位置极为相似[27]。然而, 尽管脊椎动物的20β-hsd Ⅰ和鱼类的20β-hsd Ⅱ均分别具有显著的共线性, 但同一物种的2个20β-hsd基因所在染色体区段的临近基因却截然不同。这一结果表明, 鱼类20β-hsd复制基因的产生可能并非TSGD的结果。
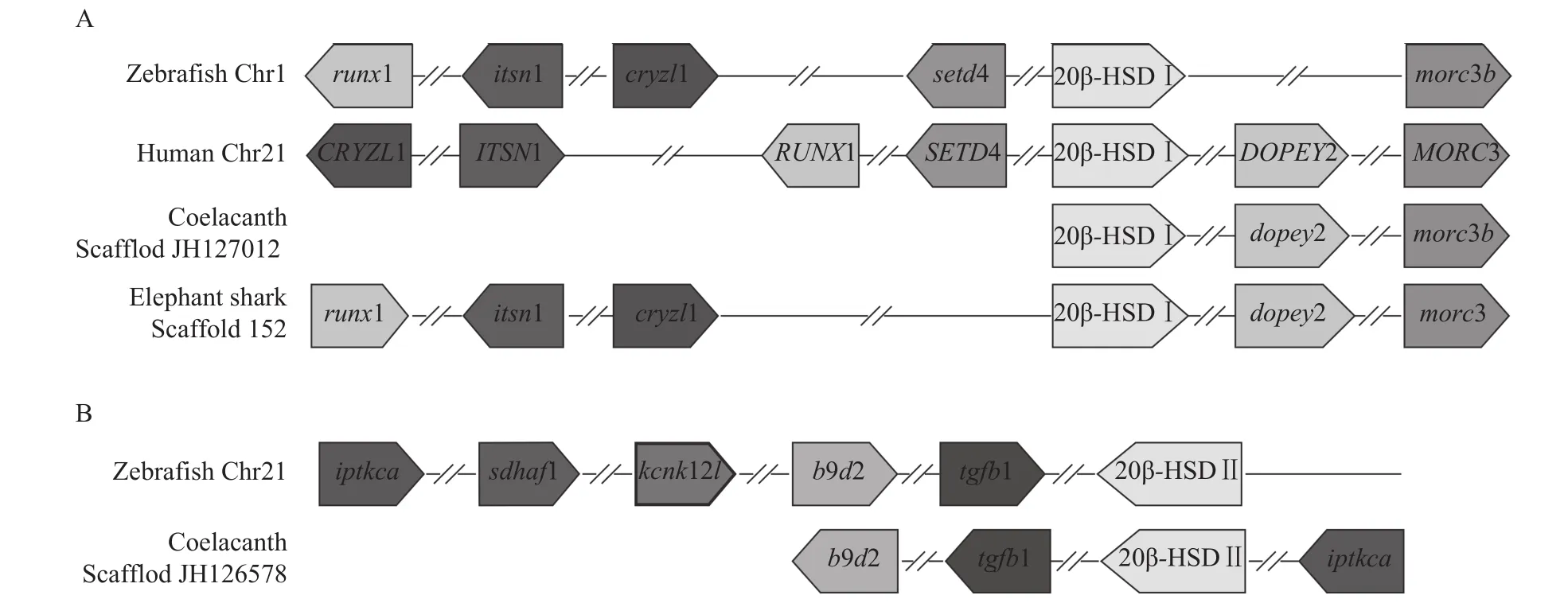
图 3 鱼类20β-HSD Ⅰ (A)和20β-HSD Ⅱ (B)的共线性分析Fig. 3 Syntenic analysis of fish 20β-HSD Ⅰ (A) and 20β-HSD Ⅱ (B)

图 4 20β-hsd Ⅰ和20β-hsd Ⅱ在黄颡鱼各组织中的表达
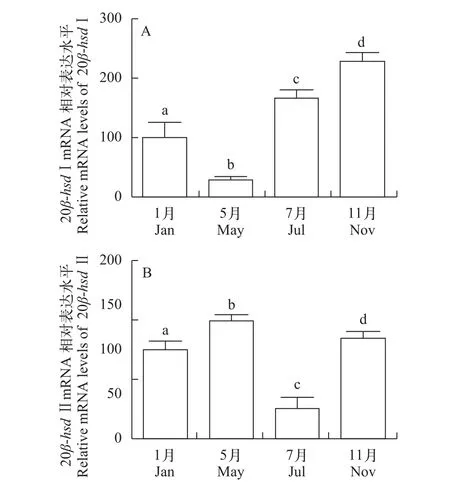
图 5 20β-hsd Ⅰ (A)和20β-hsd Ⅱ (B)在黄颡鱼精巢中的季节表达模式Fig. 5 The seasonal expression patterns of 20β-hsd Ⅰ (A) and 20β-hsd Ⅱ (B) in the testis of Pelteobagrus fulvidracoa, b, c, d, 差异显著(P<0.05); N=6a, b, c and d, were significantly different (P<0.05); N=6
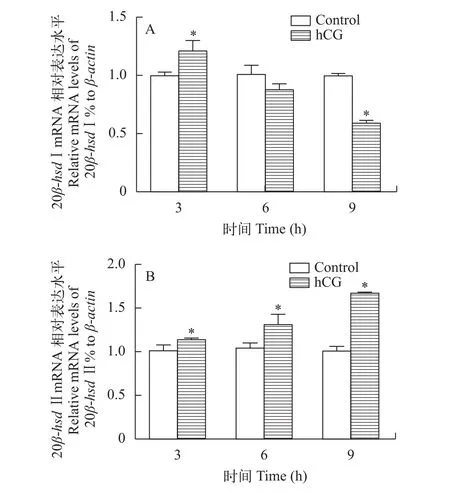
图 6 hCG对黄颡鱼精巢中20β-hsd Ⅰ (A)和20β-hsd Ⅱ (B)表达的调控Fig. 6 Regulation of hCG on the expressions of 20β-hsd Ⅰ (A) and 20β-hsd Ⅱ (B) in the testis of Pelteobagrus fulvidraco星号, 差异显著(P<0.05); N=6Asterisks, significantly different (P<0.05); N=6
有趣的是, 肉鳍鱼类中的腔棘鱼也含有2个20βhsd基因, 而且腔棘鱼20β-hsd Ⅰ和20β-hsd Ⅱ还分别与脊椎动物20β-hsd Ⅰ和鱼类20β-hsd Ⅱ具有显著的共线性。而TSGD则发生于辐鳍鱼类和肉鳍鱼类(包括腔棘鱼、肺鱼和四足类)分化之后[29,30]。根据以上研究结果推测, 鱼类20β-hsd基因的复制可能早于辐鳍鱼类和肉鳍鱼类的分化。更有趣的是, 象鲨(软骨鱼类)20β-hsd Ⅰ在进化树上也与脊椎动物20β-hsd Ⅰ聚为一支。同时, 象鲨20β-hsd Ⅰ还与脊椎动物20β-hsd Ⅰ具有高度保守的共线性。因此,尽管本研究未能在象鲨的基因组中分离到20β-hsdⅡ基因, 我们仍有理由推测, 鱼类20β-hsd基因的复制可能早于软骨鱼类和硬骨鱼类的分化。
此外, 本研究还发现20β-hsd Ⅰ基因几乎存在于所有的辐鳍鱼类(包括骨鳔鱼类和真骨鱼类)。而20β-hsd Ⅱ仅存在于骨鳔鱼类(如: 大西洋鲱、斑马鱼、斑点叉尾、墨西哥脂鲤、虹鳟、大西洋鲑和白斑狗鱼)、鲑鳟类(虹鳟和大西洋鲑)和原棘鳍总目(白斑狗鱼), 不存在于新真骨鱼类(Neoteleostei) (如: 罗非鱼、鳕、青鳉、三刺棘鱼、东方鲀、河鲀)、四足类和软骨鱼类。因此我们推测, 20β-hsdⅡ 基因在上述进化类群中可能发生了独立的次生性丢失。
序列分析发现, 鱼类2个20β-HSD均具有SDR超家族的7个保守结构域[31—33], 且具有较高的相似性, 表明这2种蛋白在结构上较为保守[34]。其中, 参与构象维持、底物结合和辅酶结合的结构域(Ⅰ、Ⅱ、Ⅲ、Ⅴ和Ⅶ)在2种20β-HSD中的相似性最高(71%—100%)。但作为催化活性位点的结构域Ⅳ和Ⅵ, 其相似性较低(不超过60%)。因此, 我们推测, 鱼类2个20β-HSD可能具有相似的空间结构, 能结合相似的底物和辅酶, 但催化的产物可能有一定差异。
3.2 黄颡鱼2个20β-hsd基因的表达模式和调控
20β-hsd Ⅰ和Ⅱ在黄颡鱼各组织中均呈泛表达模式, 与其他的相关研究结果相似[3,14,22,34]。这种泛表达模式的意义尚不明确。20β-hsd mRNA在非性腺组织的表达表明其可能具有多种不同的功能。在哺乳类, 20β-HSD参与多种化合物(比如: 类固醇激素、前列腺素)的代谢[35,36]。在鱼类中, 20βhsd还在鳃和肾间组织表达, 表明其可能参与合成DHP, 并作为性外激素释放[37,38]。而黄颡鱼20β-hsdⅡ在其他非性腺组织中也有微弱表达, 表明其可能还有其他未知的功能[3]。
在鱼类雌性, 卵母细胞在成熟诱导激素(Maturation inducing hormone, MIH)的作用下发生成熟。在多种鱼类中, DHP都是最主要的MIH, 而20β-HSD则在DHP的合成中起重要作用[23,34,39]。在鱼类雄性, 20β-HSD主要定位于未加尾(早期)的生殖细胞中。在革胡子鲶中, 20β-hsd主要表达于间质细胞和早期生殖细胞[15]。在雄性香鱼(Plecoglossus altivelis)和革胡子鲶精巢的成熟期, 20β-hsd的表达均显著上调[14,15,34]。上述证据均表明20β-HSD与鱼类的性腺和配子成熟密切相关。
另一方面, 20β-hsd表达的上调受到垂体分泌的促性腺激素(Gonadotropin, GtH)的精密调控[3,14,15]。在鱼类性成熟的起始阶段, 下丘脑分泌的促性腺激素释放激素(GnRH)刺激垂体分泌GtH, 随后作用于卵巢或精巢, 刺激20β-hsd的表达, 导致DHP水平的急剧上升和配子的成熟[14]。hCG诱导2h后, 罗非鱼性腺中20β-hsd的表达显著上升, 并促进卵母细胞成熟[3]。而在鲇形目鱼类, hCG在精巢和卵巢中均能激活20β-hsd Ⅱ的上调[14,15]。
本研究发现, 在黄颡鱼的繁殖周期中, 黄颡鱼20β-hsd Ⅰ的表达呈先下降, 再上升的趋势, 其表达水平在5月降到最低, 而在11月升到最高。相反, 20β-hsd Ⅱ的表达在5月达到峰值, 随后7月显著降低, 在11月再次上升。众所周知, 黄颡鱼是周年性产卵鱼类, 繁殖季节在5—6月[40]。黄颡鱼20β-hsdⅡ在5月的高表达与其繁殖期高度吻合, 表明20βhsd Ⅱ与黄颡鱼的精巢成熟和排精紧密相关。相反, 尽管hCG处理3h后20β-hsd Ⅰ的表达显著上调,但随后其表达持续下降; 而20β-hsd Ⅱ的表达在hCG处理后持续显著上调, 呈显著的时间依赖性,与其他的报道结果完全一致[14]。结合鱼类2个20β-HSD蛋白序列的差异性、黄颡鱼20β-hsd Ⅰ、Ⅱ的表达模式和调控模式的差异, 我们推测: 黄颡鱼20β-HSD Ⅰ和Ⅱ在精巢中的功能可能有一定的差异。其中, 20β-HSD Ⅱ可能参与DHP的合成, 而20β-HSD Ⅰ的功能还需进一步深入研究。
综上所述, 本研究首次从鱼类分离了2个20βhsd基因。系统发生和共线性分析结果暗示, 鱼类20β-hsd复制基因可能早于软骨鱼类和硬骨鱼类的分化。依据黄颡鱼2个20β-hsd基因表达模式和调控模式的研究结果, 我们推测: 20β-HSD Ⅱ可能参与DHP的合成, 而20β-HSD Ⅰ的功能尚不明确。
[1]Sugiyama T, Ohnoa S, Ghoshb D, et al. 3α/β, 20β-Hydroxysteroid dehydrogenase (porcine testicular carbonylreductase) also has a cysteine residue that is involved in binding of cofactor NADPH [J]. Journal of Steroid Biochemistry & Molecular Biology, 2004, 88(4): 393—398
[2]Persson B, Jornvall H. Short-chain dehydrogenases/reductases (SDR): the 2002 update [J]. Chemico-Biological Interactions, 2003, 143—144(1): 247—253
[3]Senthilkumaran B, Sudhakumari C C, Chang X T, et al. Ovarian carbonyl reductase-like 20beta-hydroxysteroid dehydrogenase shows distinct surge in messenger RNA expression during natural and gonadotropin-induced meiotic maturation in Nile tilapia [J]. Biology of Reproduction, 2003, 67(4): 1080—1086
[4]Nagahama Y, Yamashita M. Regulation of oocyte maturation in fish [J]. Development, Growth & Differentiation, 2008, 50(S1): s195—s219
[5]Sreenivasulu G, Senthilkumaran B. New evidences for the involvement of 20beta-hydroxysteroid dehydrogenase infinal oocyte maturation of air-breathing catfish [J]. General Comparative Endocrinology, 2009, 163(3): 259—269
[6]Senthilkumaran B. Recent advances in meiotic maturation and ovulation: comparing mammals and pisces [J]. Frontiers in Bioscience (Landmark Edition), 2011, 16: 1898—1914
[7]Ohno S, Nakajin S, Shinoda M. 20 beta-hydroxysteroid dehydrogenase of neonatal pig testis: 3 alpha/beta-hydroxysteroid dehydrogenase activities catalyzed by highly purified enzyme [J]. The Journal of Steroid Biochemistry and Molecular Biology, 1991, 38(6): 787—794
[8]Bryndová J, Klusonová P, Kucka M, et al. Cloning and expression of chicken 20-hydroxysteroid dehydrogenase [J]. Journal of Molecular Endocrinology, 2006, 37(3): 453—462
[9]Takada H, Otagiri M, Imamura Y. 20beta-hydroxysteroid dehydrogenase catalyzes ketone-reduction of acetohexamide, an oral antidiabetic drug, in liver microsomes of adult male rats [J]. The Journal of Pharmacology and Experimental Therapenrics, 1998, 287(2): 504—507
[10]Miura T, Yamauchi K, Takahashi H, et al. The role of hormones in the acquisition of sperm motility in salmonid fish [J]. The Journal of Experimental Zoology, 1992, 261(3): 359—363
[11]Kusakabe M, Nakamura I, Evans J, et al. Changes in mRNAs encoding steroidogenic acute regulatory protein, steroidogenic enzymes and receptors for gonadotropins during spermatogenesis in rainbow trout testes [J]. The Journal of Endocrinology, 2006, 189(3): 541—554
[12]Schulz R W, de França L R, Lareyre J J, et al. Spermatogenesis in fish [J]. General and Comparative Endocrinology, 2010, 165(3): 390—411
[13]Scott A P, Sumpter J P, Stacy N. The role of the maturation inducing steroid, 17α, 20β-dihydroxy-4-pregnen-3-one in male fishes: a review [J]. Journal of Fish Biology, 2010, 76: 183—224
[14]Zhuo Q, Zhang Y, Huang W, et al. Cloning, characterization, sequence analysis and expression patterns in vivo of testicular 20β-hydroxysteroid dehydrogenase cDNA in yellow catfish (Pelteobagrus fulvidraco) [J]. Comparative Biotechemistry and Physiology. Part B, Biochemistry Molecular Biology, 2011, 159(3): 171—182
[15]Sreenivasulu G, Senthilkumaran B, Sridevi P, et al. Expression and immunolocalization of 20β-hydroxysteroid dehydrogenase during testicular cycle and after hCG induction, in vivo in the catfish, Clarias gariepinus [J]. General and Comparative Endocrinology, 2012, 175(1): 48—54
[16]Ohno. Evolution by Gene Duplication [M]. S. Springer-Verlag, 1970, 300—305
[17]Chiang E F, Yan Y L, Guiguen Y, et al. Two Cyp19 (P450 aromatase) genes on duplicated zebrafish chromosomes are expressed in ovary or brain [J]. Molecular Biology and Evolution, 2001, 18(4): 542—550
[18]Kwon J Y, McAndrew B J, Penman D J. Cloning of brain aromatase gene and expression of brain and ovarian aromatase genes during sexual differentiation in genetic male and female Nile tilapia Oreochromis niloticus [J]. Molecular Reproduction and Development, 2001, 59(4): 359—370
[19]Liu Z, Wu F, Jiao B, et al. Molecular cloning of doublesex and mab-3-related transcription factor 1, forkhead transcription factor gene 2, and two types of cytochrome P450 aromatase in Southern catfish and their possible roles in sex differentiation [J]. The Journal of Endocrinology, 2007, 194(1): 223—241
[20]Zhou L Y, Wang D S, Kobayashi T, et al. A novel type of P450c17 lacking the lyase activity is responsible for C21-steroid biosynthesis in the fish ovary and head kidney [J]. Endocrinology, 2007a, 148(9): 4282—4291
[21]Zhou L Y, Wang D S, Shibata Y, et al. Characterization, expression and transcriptional regulation of P450c17-I and -II in the medaka, Oryzias latipes [J]. Biochemical and Biophysical Research Communications, 2007b, 362(3): 619—625
[22]Guan G, Tanaka M, Todo T, et al. Cloning and expression of two carbonyl reductase-like 20beta-hydroxysteroid dehydrogenase cDNAs in ovarian follicles of rainbow trout (Oncorhynchus mykiss) [J]. Biochemical and Biophysical Research Communications, 2009, 255(1): 123—128
[23]Wang Y, Ge W. Cloning of zebrafish ovarian carbonyl reductase-like 20 beta-hydroxysteroid dehydrogenase and characterization of its spatial and temporal expression [J]. General and Comparative Endocrinology, 2002, 127(3): 209—216
[24]Ohno S, Nakajin S, Shinoda M. Ontogeny of testicular steroid dehydrogenase enzymes in pig (3 alpha/beta-, 20 alpha- and 20 beta-): evidence for two forms of 3 alpha/beta-hydroxysteroid dehydrogenase [J]. The Journal of Steroid Biochemistry and Molecular Biology, 1992, 42(1): 17—21
[25]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔctmethod [J]. Methods, 2001, 25: 402—408
[26]Pramanick K, Kundu S, Paul S, et al. Changes in plasma steroid levels during oocyte development in Indian shad, Tenualosa ilisha (Hamilton, 1822): role of gonadotropins on in vitro steroid production and development of oocyte maturational competence [J]. Animal Reproductive Science, 2013, 141(3—4): 177—188
[27]Geraldo M T, Valente G T, Braz A S, et al. The discovery of Foxl2 paralogs in chondrichthyan, coelacanth and tetrapod genomes reveals an ancient duplication in vertebrates [J]. Heredity (Edinb), 2013, 111(1): 57—65
[28]Donoghue P C, Purnell M A. Genome duplication, extinction and vertebrate evolution [J]. Trends in Ecology & Evolution, 2005, 20(6): 312—31
[29]Meyer A, Van de Peer Y. From 2R to 3R: evidence for a fish-specific genome duplication (FSGD) [J]. BioEssays: News and Reviews in Molecular, Cellular and Developmental Biology, 2005, 27(9): 937—945
[30]Meyer A, Schartl M. Gene and genome duplications in vertebrates: the one-to-four (-to-eight in fish) rule and the evolution of novel gene functions [J]. Current Opinion Cell Biology, 1999, 11(6): 699—704
[31]Bailey T L, Baker M E, Elkan C P. An artificial intelligence approach to motif discovery in protein sequences: application to steriod dehydrogenases [J]. The Journal of Steroid Biochemistry and Molecular Biology, 1997, 62(1): 29—44
[32]Oppermann U, Filling C, Hult M, et al. Short-chain dehydrogenases/reductases (SDR): the 2002 update [J]. Chenmico-biological Interactions, 2003, 143—144: 247—253
[33]Persson B, Kallberg Y, Oppermann U, et al. Coenzymebased functional assignments of short-chain dehydrogenases/reductases (SDRs) [J]. Chenmico-biological Interactions, 2003, 143(143—144): 271—278
[34]Tanaka M, Nakajin S, Kobayashi D, et al. Teleost ovarian carbonyl reductase-like 20beta-hydroxysteroid dehydrogenase: potential role in the production of maturation-inducing hormone during final oocyte maturation [J]. Biology of Reproduction, 2002, 66(5): 1498—1504
[35]Penning T M. Molecular endocrinology of hydroxysteroid dehydrogenases [J]. Endocrine Reviews, 1997, 18(3): 281—305
[36]Takada H, Uchida A, Kamizono R, et al. Further studies on 20beta-hydroxysteroid dehydrogenase with carbonyl reductase-like activity present in liver microsomes of male rats [J]. Life Sciences, 2000, 67(17): 2075—2082
[37]Ebrahimi M, Scott A P, Kime D E. Extragonadal production of 17, 20-dihydroxy-4-pregnen-3-ones in vitro in cyprinid fish [J]. General and Comparative Endocrinology, 1996, 104(3): 296—303
[38]Kime D E, Ebrahimi M. Synthesis of 17, 20α- and 17, 20β-dihydroxy-4-pregnen-3-ones, 11-ketotestosterone and their conjugates by gills of teleost fish [J]. Fish Physiology and Biochemistry, 1997, 17(1—6): 117—121
[39]Espey L L, Yoshioka S, Russell D, et al. Characterization of ovarian carbonyl reductase gene expression during ovulation in the gonadotropin-primed immature Rat [J]. Biology of Reproduction, 2000, 62(2): 390—397
[40]Yin H B, Jia Z H, Yao D X, et al. Sex differentiation in Pelteobagrus fulvidraco [J]. Chinese Journal of Zoology, 2008, 43(6): 103—108 [尹洪滨, 贾中贺, 姚道霞, 等. 黄颡鱼性腺分化的组织学观察. 动物学杂志, 2008, 43(6): 103—108]
CHARACTERATION OF THE DUPLICATED 20β-HSD GENES IN PELTEOBAGRUS FULVIDRACO AND THEIR EXPRESSION PATTERNS AND REGULATIONS
YIN Pan, LI Ying-Wen, WANG Ya-Qin and LIU Zhi-Hao
(Chongqing Key Laboratory of Animal Biology, College of Life Sciences, Chongqing Normal University, Chongqing 401331, China)
Maturation inducing hormone (MIH) plays pivotal roles in gamete maturation, ovulation and spermiation of fish. In most teleost species, 17α, 20β-dihydroxy-4-pregnen-3-one (DHP) is the major MIH. The steroidogenic enzyme, named 20β-hydroxysteroid dehydrogenase (20β-HSD), is responsible for DHP production in several teleost species. To date, only one copy of 20β-hsd has been characterized in vertebrates, including fish. In this study, two copies of 20βhsd genes were identified in genomes of several fish species. Phylogenetic and syntenic analyses revealed that the duplication of 20β-hsd gene may not result from the teleost specific genome duplication (TSGD). Multiple-alignment results indicated that these two enzymes might possess similar spatial structures and co-enzyme/substrate binding motifs, whereas, their catalytic activities might differ. The duplicated copy of 20β-hsd was further cloned from yellow catfish (Pelteobagrus fulvidraco). Tissue distribution results showed that, 20β-hsd Ⅰ mRNA was mainly expressed in testis, ovary, head kidney and kidney, while 20β-hsd Ⅱ mRNA was mainly located in testis, ovary, heart, head kidney, kidney, intestine, pituitary and liver. Seasonal expression results revealed that, lower 20β-hsd Ⅰ expression and higher 20β-hsd Ⅱ expression were observed in male fish during reproductive time window (in May). Three hours after injection of hCG (1000 IU/kg body weight), the expression of 20β-hsd Ⅰ was up-regulated and then suppressed significantly, while the expression of 20β-hsd Ⅱ was up-regulated in a time dependent manner in male fish. These results demonstrated the differential regulation pattern of 20β-hsd Ⅰ and 20β-hsd Ⅱ in response to hCG.
Pelteobagrus fulvidraco; 20β-HSD; Duplicated gene; cDNA cloning; Expression pattern; hCG treatment
Q173
A
1000-3207(2017)05-0963-09
10.7541/2017.120
2016-11-05;
2017-04-16
重庆市科委项目(cstc2016jcyjA0133); 重庆市教委项目(KJ130622和KJ1600308); 重庆师范大学校级项目(12XLB005和13XLZ08)资助 [Supported by the Natural Science Foundation Project of CQ CSTC (cstc2016jcyjA0133); Ministry of Education Project of CQ (KJ130622, KJ1600308); the Key Project of the CQNU (12 XLB005, 13XLZ08)]
尹盼(1991—), 女, 重庆渝北人; 硕士研究生; 主要研究方向为动物学。E-mail: panyin123@yahoo.com
刘智皓(1979—), E-mail: minenut@163.com
