银鲫卵母细胞体外诱导成熟技术的建立
2017-09-12李熙银张晓娟桂建芳
李 志 汪 洋 周 莉 李熙银 张晓娟 周 剑 桂建芳
(中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072)
银鲫卵母细胞体外诱导成熟技术的建立
李 志 汪 洋 周 莉 李熙银 张晓娟 周 剑 桂建芳
(中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072)
研究以银鲫为材料, 根据银鲫(Carassius auratus gibelio)卵母细胞生发泡(Germinal vesicle, GV)边移程度及剥离GV中减数分裂前期染色体的凝集状态, 将银鲫Ⅳ时相的卵母细胞分为GV0、GV1、GV2和GV3四个时期; 并进一步比较了分别处于这4个时期银鲫卵母细胞体外诱导培养的成熟率、卵裂率和孵化率。结果表明, GV1期之后的卵母细胞均可有效进行体外诱导成熟, 可正常受精发育, 由于GV1期卵母细胞有较长时间用于显微操作, 因此GV1期卵母细胞被选为进行体外诱导的最早时期的卵母细胞。以GV1期卵母细胞为研究材料, 摸索了银鲫卵母细胞体外诱导成熟的适宜条件: 取GV1期的Ⅳ时相卵母细胞, 放置于pH 8.5、加有1 μg/mL孕酮激素(17α, 20β-dihydroxy-4-pregnen-3-one, DHP)的格氏平衡盐溶液(Gey’s balanced salt solution, GBSS)中, 在23℃培养箱中体外诱导12h后, 将滤泡膜剥离后再进行人工体外授精, 其所获胚胎的孵化率可达55.5%。此外, 将体外转录合成的带GFP标签的h2af1o mRNA注射到GV1期卵母细胞, 发现经显微操作和体外诱导后不仅可以通过GFP绿色荧光信号活体观察GVBD、受精、卵裂和早期胚胎发育的全过程, 而且诱导成熟的卵子仍可正常受精和胚胎发育。研究建立的银鲫卵母细胞体外诱导成熟技术为银鲫和其他鱼类卵母细胞发育过程研究及其相关基因和细胞显微操作提供了技术平台。
银鲫; 卵母细胞成熟; 体外诱导; 生发泡; 显微注射
卵母细胞是高度分化的细胞, 它的发育、成熟和受精是生命发生的开端[1,2]。对其母源关键因子的研究将揭示调控这些生命发生基本过程的分子机制, 但由于这些母源因子是在卵母细胞体内成熟阶段发挥作用, 因此对它们的研究需要突破卵母细胞体外成熟技术。在大多数脊椎动物中, 卵母细胞在进入减数分裂期, 会停滞于第一次减数分裂期的双线期, 此时细胞核明显变大, 称为“生发泡Germinal vesicle, GV)期”[3]。在促性腺激素作用下, 卵母细胞可恢复第一次减数分裂, 发生生发泡破裂(Germinal vesicle broken down, GVBD)而成熟[5,6]。卵母细胞的体外成熟(in vitro maturation, IVM), 是指将卵巢中处于未成熟的生发泡期或生发泡破裂前期的卵母细胞, 在体外加入诱导物质经过适宜的条件培养, 促使它们完成减数分裂, 人工诱导成熟,并具备受精及胚胎发育的能力[7,8]。此项技术在哺乳动物中的研究较为多见, 是卵母细胞减数分裂、成熟、受精和早期胚胎发育研究的重要技术之一。在斑马鱼、鳗、泥鳅等少数鱼类中也开展了相关研究[8—10], 结果均表明孕酮激素(17α, 20β-dihydroxy-4-pregnen-3-one, DHP)是体外诱导成熟最有效的荷尔蒙激素, 而且不同鱼类卵母细胞的最适宜的体外诱导成熟系统存在差异[11—13]。譬如, 斑马鱼卵母细胞最适宜的诱导系统是在90%Leibovitz L-15(L-15)培养基(含0.5 mg/L的BSA, pH 9.0)中培养270min[8]; 鳗卵母细胞的体外培养液是格氏培养体系(pH 8.2), 不加BSA, 并在体外培养成熟前3—6h加入了前列腺素2a (PGF2a)[9]; 泥鳅卵母细胞是在75%L-15培养基(pH 9.0)中加入20%鲤卵巢液和人绒毛膜促性腺激素(Human Chorionic Gonadotropin, HCG)处理[10]。在上述研究中, 体外培养的卵母细胞的成熟度都是以其大小达到一定尺寸为标准[13], 均没有从卵母细胞的生发泡和染色体的状态进行评判。
银鲫(Carassius auratus gibelio)是一种广泛分布于亚欧大陆的多倍体鱼类[14,15], 被证明经历了两轮连续的多倍化历程[16], 且具有雌核生殖、两性生殖和类杂种生殖等多重生殖方式[17,18]。这些特性使其成为一种开展发育遗传学研究的独特对象[19,20]。本实验室已鉴定出一批与银鲫卵子发生、卵母细胞成熟、受精和早期胚胎发育相关的重要基因, 并进行了表达特征研究和初步的功能分析, 为研究脊椎动物生殖方式及其调控机制提供了重要线索[21—27],但一些涉及卵母细胞早期发育的相关基因的功能研究需要在卵母细胞减数成熟前进行显微操作, 并体外诱导成熟, 进行授精和发育。因此, 迫切需要建立适宜的银鲫卵母细胞显微注射和体外诱导成熟技术。目前, 有关银鲫卵母细胞体外培养技术的研究报道较少, 且仅仅培养到GVBD期, 仅以第一极体排出作为卵母细胞成熟的形态学标志[28—30]。因此, 目前已报道的银鲫卵母细胞体外培养技术还不足以进行母源因子及胚胎早期发育相关基因的功能研究, 仍然存在着很多技术问题需要解决。譬如, 如何解决平行实验中选择卵母细胞发育时相一致性; 进行显微操作后的卵母细胞能否体外诱导成熟、能否受精和孵化。
本研究借鉴其他鱼类体外成熟的培养系统, 并根据银鲫卵母细胞自身的特点, 利用前期在实验室建立的生发泡剥离技术, 建立了一种适合银鲫卵母细胞显微操作和体外诱导成熟技术。首先, 参照Lodde等[31]的研究将银鲫IV时相的卵母细胞细分为GV0、GV1、GV2和GV3四个发育时期, 并对每个时期的卵母细胞进行体外培养的成熟率、卵裂率和孵化率的比较, 确定了可以进行体外诱导成熟的最早卵母细胞的发育时期为GV1期; 接着, 通过对不同培养条件下GV1期的卵母细胞的卵裂率和孵化率的分析, 确定了体外诱导银鲫卵母细胞最适合的培养条件。此外, 对GV1期卵母细胞显微注射GFP-zfh2af1o mRNA后, 在适宜体外培养条件下, 进行体外诱导成熟、授精, 并通过荧光示踪观察外源基因的表达情况。本研究建立的方法可为银鲫卵母细胞减数分裂和成熟相关基因的功能研究提供技术支撑。
1 材料与方法
1.1 实验材料
银鲫雌性个体取自中国科学院水生生物研究所官桥实验基地。在3月上旬到4月下旬之间的繁殖季节, 选取不同发育程度的雌性个体的卵巢用于分离卵母细胞。体外诱导卵母细胞成熟后, 选取成熟的兴国红鲤(Cyprinus carpio var. Singuonensis)为雄性亲本, 每次采集新鲜的精液用于授精。
1.2 主要试剂及培养液配制
卵母细胞培养液格氏平衡盐溶液(Gey’s balanced salt solution, GBSS)[29](7.25 g NaCl、0.41 g NaH2PO4、0.38 g KCl、0.95 g HEPES、1.0 g葡萄糖、0.147 g CaCl2、0.23 g MgSO4、0.1 g 1000 U青霉素、0.1 g硫酸链霉素, 配制1 L)分别配置成pH为7.5、8.0、8.5、9.0和9.5的梯度, 过滤除菌, 放置4℃冰箱备用。其中CaCl2和MgSO4需要配置母液, 按照MgSO4、CaCl2的顺序依次往卵母细胞培养液格氏平衡盐溶液中滴加, 以免产生沉淀。90%的L-15培养液按照Seki等[8]描述配置。每种培养液中均加入1 μg/mL孕酮激素。
1.3 适合体外诱导的银鲫Ⅳ时相卵母细胞发育阶段的筛选
在繁殖季节, 多数银鲫卵母细胞处于Ⅳ时相,此时相的卵母细胞直径在1—1.2 mm左右。为了细分银鲫Ⅳ时相卵母细胞发育阶段, 我们首先在无菌条件下用镊子将银鲫不同个体的卵巢取出后, 分别转移至预热至23℃的GBSS和L-15卵母细胞培养液中, 接着从中分离10颗左右的卵母细胞, 用透明液(甲醇∶乙酸=3∶1)在解剖镜下检查核(生发泡)的边移情况。根据生发泡的位置将把银鲫Ⅳ时相卵母细胞分为GV0、GV1、GV2和GV3四个时期[31],同时利用本实验室已建立的生发泡剥离技术, 取对应时期卵母细胞的生发泡, 参照Zhang等[18,32]描述的方法对染色体进行DAPI染色, 并在激光共聚焦显微镜(Zeiss LSM710, 德国)下进行观察和拍照。由于来自银鲫同一个体的卵母细胞发育程度均一,因此我们可以根据上述分析结果获得具有活性的、发育一致的分别处于GV0、GV1、GV2和GV3时相的卵母细胞。接着, 利用实验室前期的银鲫卵母细胞的体外诱导方法[30]对4个时期的卵母细胞分别进行诱导培养, 并统计成熟率, 每4h统计一次。
1.4 银鲫卵母细胞体外诱导成熟条件的优化
选取处于GV1期的卵母细胞, 放置于6 mL的GBSS和L-15培养液的平皿(直径30 mm、高度0.17 mm)中进行培养, 以每毫升培养10颗卵母细胞为宜。分别配制pH为7.5、8.0、8.5、9.0和9.5五个梯度, 每种梯度都加入1 μg/mL的DHP, 23℃培养诱导卵母细胞体外成熟。在体外诱导8h后开始每隔1 h进行成熟率的统计。
1.5 体外诱导卵母细胞卵裂率和孵化率的统计
卵母细胞经体外诱导后, 选透明的卵母细胞用尖镊子剥去滤泡膜(图 1)。连续在诱导培养液中剥离50颗卵母细胞后, 参照干法授精[33]完成体外受精;待受精卵发育至二胞期, 选分裂比较均匀的卵子统计卵裂率, 并追踪至出苗期统计孵化率。诱导16h后停止每组的成熟统计和授精工作。
1.6 GV1期卵母细胞的显微注射、体外诱导成熟和人工授精
首先按照本实验室已报道的方法体外转录合成了带GFP标签的h2af1o mRNA[25,34], 接着按照每颗卵1—2 nL的剂量, 将GFP-zfh2af1o mRNA显微注射到处于GV1期的卵母细胞中。注射针尖开口小于0.5 μm[35]。处于GV1期的卵母细胞膜薄而透明,核膨大明显可见, 可以精确地注射到核的区域或附近。注射后的卵母细胞放置在pH为8.5加有1 μg/mL DHP的卵母细胞培养液GBSS中, 在23℃培养箱中体外诱导12h后, 剥离滤泡膜, 进行人工授精。其受精卵完全脱膜[35]后直接在荧光显微镜下追踪, 观察并拍照。
1.7 数据统计分析
成熟率=透明的卵母细胞数/体外诱导的总卵母细胞数×100%; 卵裂率=观察到分裂均匀二胞的胚胎/经过人工授精的总胚胎数×100%; 孵化率=孵出的鱼苗数/经过人工授精的总胚胎数×100%; 3次实验数据采用SPSS软件进行单因素方差分析, 数据间比较用Tukey’s法进行, 并利用GraphPad Prism 6作图软件绘制曲线或柱状图来显示, 取P<0.05为差异显著。
2 结果
2.1 不同发育阶段Ⅳ时相卵母细胞体外诱导成熟的比较
为了确定可以进行体外诱导成熟的银鲫卵母细胞的发育时期, 我们首先根据生发泡向受精孔迁移的位置和减数分裂前期染色体的凝集状态, 将银鲫Ⅳ时相卵母细胞分为GV0、GV1、GV2和GV3期; 接着我们将分别处于4个时期的卵母细胞按照孙敏等[30]描述的方法进行体外诱导培养, 统计卵母细胞的成熟率、卵裂率和孵化率。如图 2所示, 处于GV0期的卵母细胞, 生发泡位于卵母细胞中部或稍边移(图 2A, GV0), 减数分裂前期染色体处于未凝聚状态(图 2B, GV0); 体外诱导培养8h成熟率为零, 培养10h开始发生GVBD, 培养到12h有14.3%的卵母细胞成熟, 但进行人工授精的胚胎卵裂率较低(<10%), 当增加培养时间至16h, 成熟率可达到63.16%, 卵裂率有37.5%, 继续培养到24h, 成熟率和分裂率已有所下降, 均没有胚胎能正常孵化出膜(图 2C, GV0)。处于GV1期的银鲫卵母细胞, 生发泡开始膨大, 明显边移(图 2A, GV1), 减数分裂前期染色体开始浓缩变粗(图 2B, GV1); 体外诱导4h开始发生GVBD, 成熟率约有64.5%, 卵裂率约有30%, 但求未见可孵化的胚胎, 随着培养时间增加,成熟率和卵裂率也不断提高, 培养到8h, 开始出现有少量孵化胚胎, 其孵化率约3%, 体外诱导培养12h后有大约30.6%的胚胎可以孵化出膜, 继续培养到16h, 成熟率和分裂率也开始下降, 孵化率仅有7.8%(图 2C, GV1)。当银鲫卵母细胞发育到GV2期, 生发泡更靠近卵孔(图 2A, GV2), 减数分裂前期染色体进一步的凝聚变粗(图 2B, GV2); 体外诱导成熟时间有所缩短, 成熟率、卵裂率和孵化率都有所提高(图 2C, GV2)。处于GV3期的卵母细胞的生发泡已靠近受精孔, 核膜已融合(图 2A, GV3),减数分裂前期染色体浓缩的更粗更短(图 2B, GV3); 卵母细胞发育越靠后, 到GVBD时期所用的时间越短, 卵裂率和孵化率越高。以培养12h为例,在GV3期的卵母细胞成熟率、卵裂率、孵化率分别提高到88.5%、68.7%和42.5%(图 2C, GV3)。上述结果表明, GV1期之后的卵母细胞均可以有效进行体外诱导成熟, 并可正常受精发育, 孵化出苗; 由于GV1期在体外时间较长, 有利操作, 我们一般选GV1期作为体外诱导的最佳时期的卵母细胞。

图 1 体外诱导成熟银鲫卵母细胞在解剖镜下剥离滤泡膜的过程
2.2 最佳培养液和最佳诱导时间的确定
为了筛选适合银鲫卵母细胞体外诱导的培养液, 我们配制了pH分别为7.5、8.0、8.5、9.0和9.5的GBSS和L-15培养液, 对GV1期银鲫卵母细胞进行体外诱导, 并对诱导成熟的卵母细胞进行授精和胚胎发育状态观察。诱导13h后的结果表明, 在pH 8.5的GBSS培养液中, 银鲫GV1期卵母细胞的平均成熟率、卵裂率和孵化率分别为91.3%、74.6%和42.5%, 均高于其他pH梯度的GBSS培养液中的结果(图 3A)。在pH 9.0的L-15培养液中, 银鲫GV1期卵母细胞的平均成熟率、卵裂率和孵化率分别为89.3%、71.0%和25.3%, 均高于其他pH梯度的结果(图 3B)。对这2种不同培养液之间的比较表明, pH 8.5的GBSS培养液更适合银鲫卵母细胞体外诱导, 其诱导成熟率和卵裂率略高于pH 9.0的L-15培养液的结果, 且孵化率显著高于pH 9.0的L-15培养液的结果(P<0.05)。
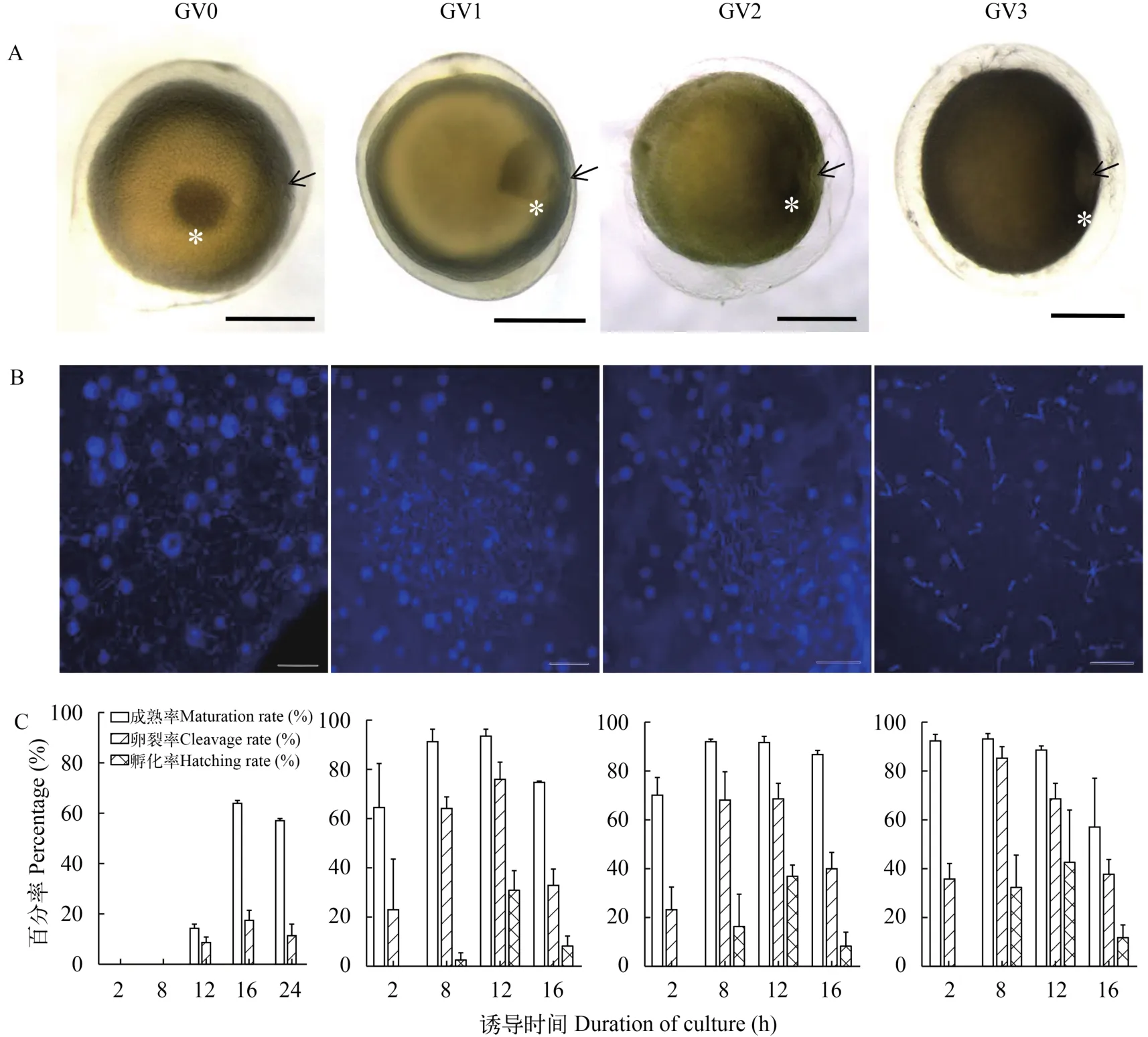
图 2 银鲫Ⅳ时相卵母细胞不同发育阶段(GV0、GV1、GV2和GV3)生发泡偏移情况(A)、减数分裂前期染色体状态(B)和其体外诱导的成熟、卵裂和孵化能力(C)Fig. 2 Germinal vesicle (GV) migration (A), DAPI-stained premeiotic chromosome spread (B) and the in vitro abilities to induce maturation, fertilization and hatching (C) of gibel carp oocytes at GV0, GV1, GV2 and GV3 stagesA. 白色星号指示生发泡, 黑色箭头指向卵孔; 比例尺=0.5 mm; B. 比例尺=20 μm。C. 横坐标为体外诱导时间A. Germinal vesicle (GV) and micropyle are indicated by white asterisks and black arrows, respectively. Scale bar=0.5 mm; B. Scale bar =20 μm; C. Abscissa denotes in vitro induction time
接着, 我们选择pH 8.5的GBSS培养液, 对银鲫GV1期卵母细胞进行体外诱导成熟, 观察并统计不同诱导时间后银鲫卵母细胞的平均成熟率、卵裂率和孵化率。如图 4所示, 在体外诱导4.5h后, 生发泡开始破裂, 卵母细胞开始透明; 诱导8h后, 超过90%的卵母细胞的生发泡都已破裂。3次重复实验结果表明, 诱导8h至16h之间的成熟率没有显著性差异, 均高达90%; 但不同诱导时间的卵裂率和孵化率差异显著, 诱导12h后卵裂率和孵化率均是最高的, 分别为81.2%和55.5%。诱导8h后的卵裂率仅有4.4%, 孵化率为0; 诱导16h后卵裂率为26.5%, 孵化率为3.4% (图 4)。以上结果表明, 银鲫GV1期卵母细胞体外诱导成熟的适宜条件是在pH 8.5的GBSS培养液中诱导12h。
2.3 体外诱导卵母细胞的显微操作及其发育过程的示踪观察
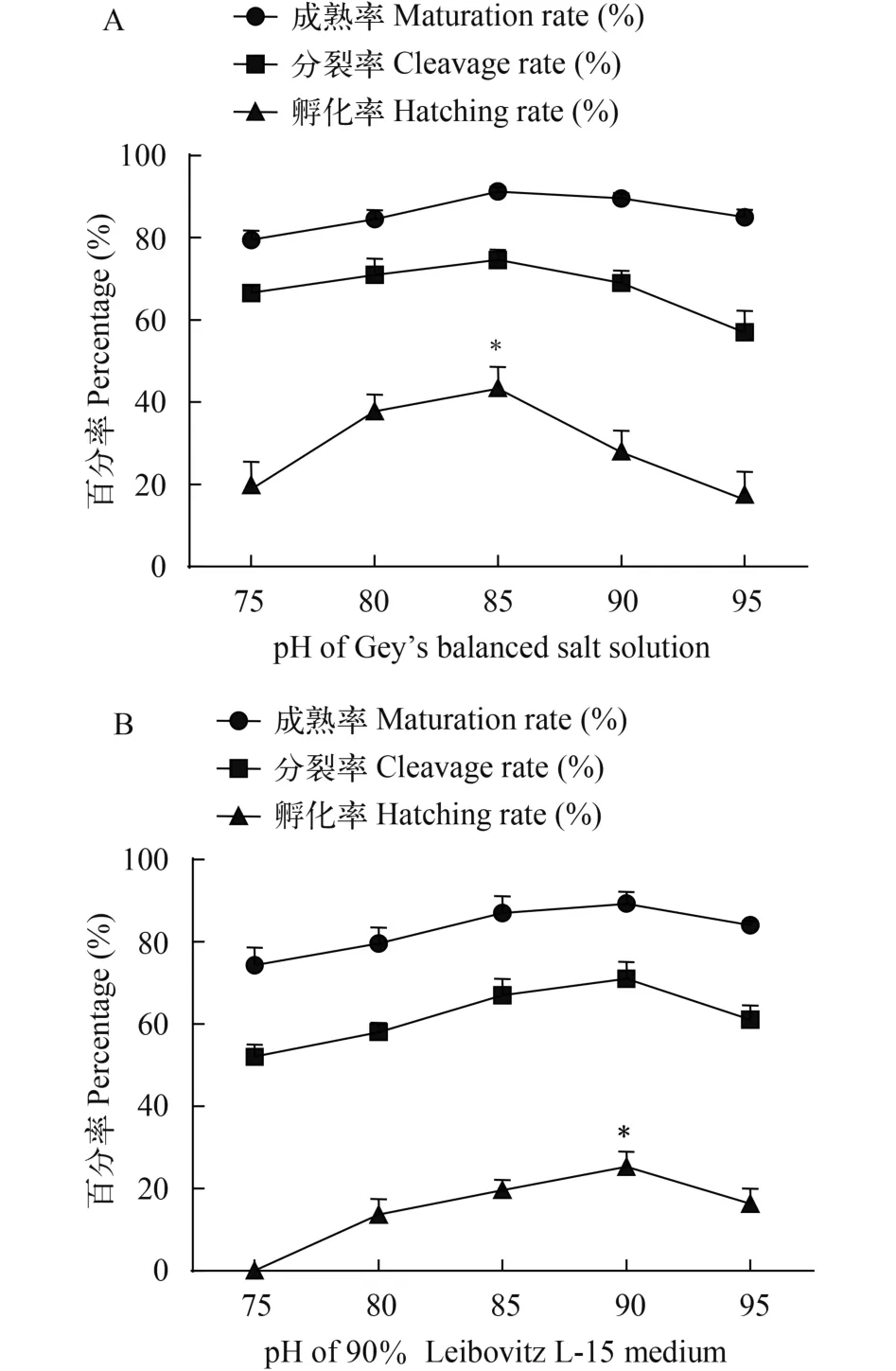
图 3 处于GV1期的银鲫卵母细胞在不同pH(pH 7.5—9.5)的GBSS培养液(A)和L-15培养液(B)中体外诱导的成熟率、卵裂率和孵化率的比较结果(*P<0.05)Fig. 3 The maturation rate (%), cleavage rate (%) and hatching rate (%) of gibel carp GV1 oocytes in vitro in GBSS cell-culture medium (A) and L-15 (B) cell-culture medium with different pH 7.5—9.0 (*P<0.05)

图 4 银鲫GV1期卵母细胞在GBSS培养液(pH 8.5)中体外诱导不同时间的成熟、分裂及孵化能力的比较Fig. 4 The ability of gibel carp GV1 oocytes to mature, fertilize, and hatch after cultured in GBSS medium (pH 8.5) for 8—16h相同颜色柱子上不同的字母表示差异显著(P<0.05)Values with different subscripts within the same color criterion were significantly different (P<0.05)
为了进一步评价银鲫卵母细胞体外诱导成熟的显微操作能力及其相关技术, 我们将体外转录合成的带GFP标签的h2af1o mRNA[23,25]注射到GV1期卵母细胞, 然后在GBSS培养液(pH 8.5, 含1 μg/mL DHP)中体外诱导成熟, 经授精直到胚胎发育, 利用其表达产物定位于染色质可示踪细胞核的特性[23,25],用其绿色荧光来示踪评价显微操作效果及其发育全过程。如图 5所示, 在显微注射后(图 5A)体外诱导2h时, 核区开始出现绿色荧光信号(图 5B); 诱导4h后, 胚泡破裂, 绿色荧光信号扩散到动物极(图 5C);诱导12h后, 剥离滤泡膜进行人工授精, 待发育至一胞期时, 绿色荧光信号开始集中于细胞核(图 5D);由于绿色荧光标示出细胞核, 发育至二胞期(图 5E)、八胞期(图 5F)、256胞期(图 5G)、以致囊胚期(图 5H)的胚胎清晰可辨。上述结果表明, 体外诱导的卵母细胞不仅可以通过荧光信号活体观察GVBD、受精、卵裂和早期胚胎发育的全过程, 而且经过显微操作后的卵母细胞, 仍可以正常被诱导减数分裂成熟以及正常受精和胚胎发育。
3 讨论
卵母细胞成熟是相当复杂的生理过程, 包括细胞核和细胞质成熟, 但在体外诱导成熟过程中, 卵母细胞的发育程度和培养条件都可能造成细胞核和细胞质发育不同步而使卵母细胞的成熟受到影响[5—8]。在适宜培养条件下, 只有具备恢复减数分裂能力的卵母细胞才能够成熟[4,5], 因此, 选择合适发育程度的卵母细胞和适宜培养条件非常重要。
目前, 关于银鲫卵母细胞体外诱导培养的报道不多。Wang等[28]报道在GBSS培养液加入0 .5 μg/mL的DHP, 24℃培养20h可以诱导66.7%的银鲫卵母细胞发生GVBD。而孙敏等[30]将分离的银鲫Ⅳ期卵母细胞在GBSS培养液(pH 7.4—7.7, 含1 μg/mL的DHP)中, 22—23℃体外培养6h后有90%的银鲫卵母细胞发生GVBD。由此可见在这些银鲫卵母细胞体外诱导成熟的报道中, 基于卵母细胞大小选择IV时相卵母细胞进行体外诱导到GVBD的时间存在较大的差异[28—30], 这可能跟所选择的IV时相卵母细胞本身发育阶段不同有关。而且, 诱导减数分裂成熟的判断是基于细胞学观察GVBD的发生[36], 并没有进行受精和孵化能力的验证[8,28—30]。为了建立可重复的适合银鲫卵母细胞显微操作和体外诱导成熟的技术, 本研究首先通过卵母细胞的GV边移程度和减数分裂前期染色体凝集状态之间的关系, 将银鲫IV时相卵母细胞进一步分为GV0、GV1、GV2和GV3四个时期。在此基础上, 对每个时期的卵母细胞分别进行体外培养, 结果表明GV1期之后的卵母细胞均可以有效进行体外诱导成熟和受精, 且发育越靠后的卵母细胞, 到GVBD时所用的时间越短, 卵裂率和孵化率越高。因此, 卵母细胞发育程度是卵母细胞体外诱导获得高成熟率、高卵裂率和高孵化率的重要条件之一[10]。该研究为银鲫卵母细胞选择上提供了依据, 增加了实验的可重复性。

图 5 GFP-zfh2af1o mRNA显微注射到GV1期卵母细胞体外诱导成熟, 受精和胚胎发育的荧光示踪
体外诱导卵母细胞减数分裂成熟后, 不仅需要通过GVBD来判断卵母细胞是否成熟[28—30], 更重要的是需要验证这些体外诱导成熟的卵母细胞是否具有受精能力和孵化出苗的能力[8]。在本实验中,通过统计卵母细胞体外诱导成熟率、卵裂率和孵化率发现, 在GBSS(pH 8.5)培养液中诱导8—16h成熟率无显著性差异, 但不同诱导时间的卵裂率和孵化率差异显著, 其中诱导12h后卵裂率和孵化率均是最高的, 表明该诱导时间是卵母细胞体外诱导核质同步成熟的最佳时间点。在该时间点之前卵母细胞虽然已经透明但未达到核质同步成熟, 诱导时间太长可能导致卵子过熟, 从而影响受精能力和孵化能力。因此, 本研究在卵母细胞体外诱导成熟的判断标准上, 不仅通过GVBD的发生来判断卵母细胞的成熟, 又进一步通过受精和孵化能力的比较建立了判断银鲫卵母细胞体外诱导核质同步成熟的时间和条件。
本研究建立了银鲫卵母细胞体外诱导成熟的适宜条件: 分离处于GV1期的卵母细胞, 对其显微注射后放置于加有1 μg/mL DHP的GBSS溶液(pH 8.5)中, 在23℃培养箱中体外诱导12h, 即可获得核质同步成熟的银鲫卵母细胞。本研究可为分析鱼类卵母细胞早期发育相关基因的功能提供技术平台。
参考文献:
[1]Gui J F. Roles of oocytes in studies on cell cycle regulation [J]. Bulletin of National Natural Science Foundation of China, 1996, 3: 173—178 [桂建芳. 卵母细胞在细胞周期调控研究中的贡献. 中国科学基金, 1996, 3: 173—178]
[2]Xu H Y, Li M Y, Gui J F, et al. Fish germ cells [J]. Science China Life Science, 2010, 42(2): 124—138 [徐红艳,李名友, 桂建芳, 等. 鱼类生殖细胞. 中国科学生命科学, 2010, 42(2): 124—138]
[3]Chen D Y. Fertilization Biology [M]. Beijing: Science Press. 2000, 316—317 [陈大元. 受精生物学. 北京: 科学出版社. 2000, 316—317]
[4]Metz C B, Monroy A. Biology of Fertilization [A]. In: Masui Y (Eds.), Meiotic arrest in animal oocytes [C]. Florida: Academic Press. 1985, 189—219
[5]Judith K, Susan S. The C. elegans Research Community [A]. In: Greenstein D, (Eds.), Control of Oocyte Meioticmaturation and Fertilization [C]. WormBook. 2005, 1—12
[6]Skoblina M N. In vitro stimulation of oocyte ovulation in teleosts by gonadotropic and steroid hormones [J]. Ontogenez, 2009, 40(4): 245—253
[7]Nagahama Y, Yamashita M. Regulation of oocyte maturation in fish[J], Development Growth & Differentiation. 2008, 50(1): 195—219
[8]Seki S, Kouya T, Tsuchiya R, et al. Development of a reliable in vitro maturation system for zebrafish oocytes [J]. Reproduction, 2008, 135(3): 285—292
[9]Abe T, Ijiri S, Adachi S, et al. Development of an in vitro culture system for producing eel larvae from immature ovarian follicles in Japanese eel Anguilla japonica [J]. Fisheries Science, 2010, 76(2): 257—265
[10]Skoblina M N, Minin A A. Hormonal induction of in vitro maturation and ovulation of loach oocytes and obtaining egg cells capable of fertilization and development [J]. Russian Journal of Developmental Biology, 2015, 46(3): 159—167
[11]Zuberi A, Naeem M, Jalali S, et al. Relative in vitro effectiveness of several gonadal steroids on oocyte maturation in freshwater teleost Barilius vagra [J]. African Journal of Biotechnology, 2011, 10(55): 11772—11777
[12]Skoblina M N. In vitro stimulation of oocyte ovulation in teleostsby gonadotropic and steroid hormones [J]. Ontogenez, 2009, 40(4): 245—253
[13]Pang Y F, Ge W. Gonadotropin and activin enhance maturational competence of oocytesin the zebrafish (Danio rerio) [J]. Biology of Reproduction, 2002, 66(2): 259—265
[14]Jiang F F, Wang Z W, Zhou L, et al. High male incidence and evolutionary implications of triploid form in northeast Asia Carassius auratus complex [J]. Molecular Phylogenetics and Evolution, 2013, 66(1): 350—359
[15]Ivan J, Gui J F. Recent invasion and low level of divergence between diploid and triploid forms of Carassius auratus complex in Croatia [J]. Genetica, 2011, 139(6): 789—804
[16]Li X Y, Zhang X J, Li Z, et al. Evolutionary history of two divergent Dmrt1 genes reveals two rounds of polyploidy origins in gibel carp [J]. Molecular Phylogenetics and Evolution, 2014, 78: 96—104
[17]Gui J F, Zhou L. Genetic basis and breeding application of clonal diversity and dual reproduction modes in polyploidy Carassius auratus gibelio [J]. Science China Life Science, 2010, 40(2): 97—103 [桂建芳, 周莉. 多倍体银鲫克隆多样性和双重生殖方式的遗传基础和育种应用.中国科学生命科学, 2010, 40(2): 97—103]
[18]Zhang J, Sun M, Zhou L, et al. Meiosis completion and various sperm responses lead to unisexual and sexual reproduction modes in one clone of ployploid Carassius gibelio [J]. Scientific Reports, 2015, 5: 10898
[19]Gui J F, Zhu Z Y. Molecular basis and genetic improvement of economically important traits in aquaculture animals (review) [J]. Chinese Science Bulletin, 2012, 57(19): 1719—1729 [桂建芳, 朱作言. 水产动物重要经济性状的分子基础及其遗传改良. 科学通报, 2012, 57(19): 1719—1729]
[20]Gui J F. Animal reproduction and physiology: from basis to application [J]. Science China Life Science, 2010, 40(2): 95—96 [桂建芳. 动物生殖与生理研究: 从基础到应用. 中国科学生命科学, 2010, 40(2): 95—96]
[21]Dong C H, Yang S T, Yang Z A, et al. A C-type lection associated and translocated with cortical granules during oocyte maturation and egg fertilization in fish [J]. Developmental Biology, 2004, 265(2): 341—354
[22]Peng J X, Xie J L, Zhou L, et al. Evolutionary conservation of dazl genomic organization and its continuous and dynamic distribution throughout germline development in gynogenetic gibel carp [J]. Journal of Experimental Zoology Part B-Molecular and Developmental Evolution, 2009, 312(2): 855—871
[23]Wu N, Yue H M, Chen B, et al. Histone H2A has a novel variant in fish oocytes [J]. Biology of Reproduction, 2009, 81(2): 275—283
[24]Mei J, Chen B, Yue H M, et al. Identification of a C1q family member associated with cortical granules and follicular cell apoptosis in Carassius auratus gibelio [J]. Molecular and Cellular Endocrinology, 2008, 289(1—2): 67—76
[25]Yue H M, Li Z, Wu N, et al. Oocyte-Specific H2A variant H2af1o is required for cell synchrony before midblastula transition in early zebrafish Embryos [J]. Biology of Reproduction, 2013, 89(4): 82
[26]Sun M, Li Z, Gui J F. Dynamic distribution of Spindlin in nucleoli, nucleoplasm and spindle from primary oocytes to mature eggs and its critical function for oocyte-to-embryo transition in gibel carp [J]. Journal of Experimental Zoology, Part A, Ecological Genetics and Physiology, 2010, 313(8): 461—473
[27]Liu W, Li S Z, Li Z, et al. Complete depletion of primor-dial germ cells in an all-female fish leads to sex-biased gene expression alteration and sterile all-male occurrence [J]. BMC Genomics, 2015, 16: 971
[28]Wang Y F, Yang Z A, Yang S T, et al. Comparative studies on the changes in cyclin synthesis and MPF activity during oocyte maturation in vitro in gynogenetic and amphimicti ccrucian carps [J]. Acta Zoologica Sinica, 2000, 46(1): 71—80 [王玉凤, 杨仲安, 杨书婷, 等. 在雌核发育和两性生殖鲫鱼体外培养的卵母细胞成熟过程中MPF周期合成中的变化和活性比较. 动物学报, 2000, 46(1): 71—80]
[29]Ding J, Jiang Y G. The preliminapy observation on inducing crcian carp carassius auratus gibello oocyte maturation in vitro [J]. Journal of Fisheries of China, 1994, 18(1): 60—71 [丁军, 蒋一珪. 银鲫卵母细胞体外诱导成熟的初步观察. 水产学报, 1994, 18(1): 60—71]
[30]Sun M, Wang L, Gui J F. Expression characterization and functional analysis of oocyte-specific splindlin in gibel carp [J]. Acta Hydrobiologica Sinica, 2012, 36(4): 593—599 [孙敏, 王兰, 桂建芳. 银鲫Spindlin的功能分析和银鲫双重生殖方式的调控机制研究. 水生生物学报, 2012, 36(4): 593—599]
[31]Lodde V, Modina S, Galbusera C, et al. Large-scale chromation remodeling in germinal vesicle bovine oocytes: interplay with gap junction functionality and developmental competence [J]. Molecular Reproduction and Development, 2007, 74(4): 740—749
[32]Lutes A A, Neaves W B, Baumann D P, et al. Sister chromosome pairing maintains heterozygosity in parthenogenetic lizards [J]. Nature, 2010, 464(7286): 283—286
[33]Gui J F, Si Y D, Zhou L. Practical Breeding Technology of Allogynogenetic Gibel Carp [M]. Beijing: Jindun Publishing House, 2003 [桂建芳, 司亚东, 周莉. 异育银鲫养殖技术. 北京: 金盾出版社. 2003]
[34]Zhong J X, Zhou L, Li Z, et al. Zebrafish Noxa promotes mitosis in early embryonic development and regulates apoptosis in subsequent embryogenesis [J]. Cell Death and Differentiation, 2014, 21(6): 1013—1024
[35]Li Z, Zhou L, Zhang J, et al. A fast and efficient microinjection method in the fertilized eggs of teleost fish with adhesive eggs [J]. Acta Hydrobiologica Sinica, 2016, 40(1): 67—82 [李志, 周莉, 张君, 等. 黏性卵鱼类受精卵一种快速高效的显微注射方法. 水生生物学报, 2016, 40(1): 67—82]
[36]Wu Q J, Gui J F. Fish Genetic Breeding Engineering [M]. Shanghai: Shanghai Scientific & Technical Publishers. 1999, 43—44 [吴清江, 桂建芳. 鱼类遗传育种工程. 上海: 上海科学技术出版社. 1999, 43—44]
DEVELOPMENT OF IN VITRO MATURATION TECHNOLOGY FOR GIBEL CARP OOCYTES
LI Zhi, WANG Yang, ZHOU Li, LI Xi-Yin, ZHANG Xiao-Juan, ZHOU Jian and GUI Jian-Fang
(State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China)
In vitro oocytes maturation is a key and efficient technology for gene and cellular micromanipulation in oocytes of fish. In this study, we used gibel carp oocytes as studying materials to develop an efficient in vitro induction maturation technology. Based on previously established germinal vesicle (GV) isolation and premeiotic chromosome preparation methods , four different stage oocytes including GV0, GV1, GV2 and GV3 were firstly distinguished by GV migration and premeiotic chromosome condensation status, and the maturation rate (%), cleavage rate (%) and hatching rate (%) were analyzed. GV1, GV2 and GV3 oocytes had the capacity for in vitro induction maturation, and GV1 oocytes were the optimal stage oocytes because they have longer time for micromanipulation. We found that the optimal induction conditions for GV1 oocytes in vitro were 12 hours at 23℃ in pH 8.5 Gey’s balanced salt solution(GBSS) with 1 μg/ml DHP (17α, 20β-dihydroxy-4-pregne-3-one), by which up to 55.5% hatching rate was reached from these stripped follicle membrane oocytes. Moreover, we injected the GFP-zfh2af1o mRNA into the GV1 oocytes, and found that the whole process of in vitro maturation, fertilization and embryo development of the micromanipulated GV1 oocytes could be tracked by the expression of GFP, and normal fertilization and embryo development could be produced from the induced mature eggs. Therefore, we established an efficient platform for studying oocyte development and gene and cellular micromanipulation in this fish.
Gibel carp; Oocyte; In vitro maturation; Germinal vesicle; Micromanipulation
Q-366
A
1000-3207(2017)05-0984-08
10.7541/2017.123
2016-07-08;
2016-11-04
中国科学院战略性先导科技专项(XDA08030201)资助 [Supported by the Strategic Priority Research Program of Sciences (XDA08030201)]
李志(1980—), 女, 河南周口人; 实验师; 主要从事鱼类发育遗传研究。E-mail: lizhi@ihb.ac.cn
桂建芳, E-mail: jfgui@ihb.ac.cn
猜你喜欢
杂志排行
水生生物学报的其它文章
- 剩余污泥资源化利用新工艺研究进展
- 草鱼野生与选育群体线粒体DNA控制区D-loop遗传变异分析
- 在患CyHV-2病的异育银鲫肠道黏膜中胆固醇、胆汁酸代谢通路基因的差异表达
- 黄颡鱼20β-羟基类固醇脱氢酶Ⅰ和Ⅱ基因特征分析和表达模式研究
- 池蝶蚌β-连环蛋白基因cDNA的克隆及表达特征分析
- MOLECULAR CLONING, CHARACTERIZATION, AND EXPRESSION ANALYSIS OF TWO ISOFORMS OF ANTI-LIPOPOLYSACCHARIDE FACTOR FROM THE ORIENTAL RIVER PRAWN, MACROBRACHIUM NIPPONENSE
