池蝶蚌β-连环蛋白基因cDNA的克隆及表达特征分析
2017-09-12闫含笑史建伍盛军庆王军花洪一江
闫含笑 史建伍 盛军庆 王军花 洪一江
(南昌大学生命科学学院, 南昌 330000)
池蝶蚌β-连环蛋白基因cDNA的克隆及表达特征分析
闫含笑 史建伍 盛军庆 王军花 洪一江
(南昌大学生命科学学院, 南昌 330000)
为了解淡水贝类性别调控与分化机制, 课题组建立了池蝶蚌(Hyriopsis schlegelii)性腺转录组, 在转录组库中, 存在β-连环蛋白(β-catenin)基因序列。实验对池蝶蚌β-catenin基因进行验证, 采用RACE技术克隆其cDNA全长, 命名为Hsβ-catenin。该序列全长4386 bp, 5′-非编码区为162 bp, 3′-非编码区为1758 bp, 开放阅读框为2466 bp, 编码821个氨基酸; 该蛋白结构域主要由12个ARM重复序列组成; 二级结构中, α-螺旋占47.75%, β-折叠占1.22%, 随机卷曲占51.04%; 三级结构中含大量α-螺旋且为右手超螺旋, 构成ARM结构域; 系统进化树分析表明, Hsβ-catenin与软体动物聚为一支, 然后与昆虫类聚为一支。实时荧光定量PCR(qRT-PCR)检测显示, Hsβ-catenin在肠中表达量最高, 其次是斧足和精巢。Hsβ-catenin基因在12月龄和36月龄表达量较高, 且在36月龄表达量最高, 表明其可能参与池蝶蚌的性别调控与分化作用。
池蝶蚌; Hsβ-catenin; 组织表达; 克隆; 序列分析; qRT-PCR
β-连环蛋白(β-catenin)是连环蛋白家族中的一个蛋白, 于1980年作为一种黏附因子被发现[1]。βcatenin有3个结构域, N末端区包括多个丝氨酸、苏氨酸残基作为多种酶的磷酸化位点; 中央区是最保守的区域, 含12—14个ARM结构域(犰狳重复结构域), 每个ARM结构域形成呈三角形排列的3个环形结构, 这些结构域因带正电荷在超螺旋结构中形成凹槽, 成为Wnt通路中许多信号分子的结合位点; C末端区含有转录激活区, 能够激活下游靶基因的转录[2]。β-catenin蛋白广泛存在于各类细胞中, 主要通过与其他分子形成复合物在不同组织结构中起作用[3]; 在细胞中主要有2个作用, 一是与细胞膜上的钙黏蛋白相互作用, 参与细胞间黏附, 二是作为Wnt信号通路中的关键信号分子调控细胞的生长、分化与凋亡[4]。依赖β-catenin的Wnt通路被称为经典Wnt通路, 多种Wnt通路上的信号分子与βcatenin结合形成破坏复合物, 细胞外分泌的Wnt配体作用于破坏复合物并使其降解, β-catenin浓度不断上升, 进而促进Wnt蛋白的表达; 而没有Wnt配体时, β-catenin不断被磷酸化, 浓度下降, Wnt通路被阻断[5]。β-catenin被发现通过Wnt通路对性别调控、癌症的转移侵袭、神经系统的发育等途径起着重要作用。
池蝶蚌(Hyriopsis schlegelii)是优质的淡水珍珠育珠蚌, 在生长过程中存在雌雄同体现象, 但成熟后性别为单性[6]; β-catenin被发现在青鳉中具有诱导卵巢发育甚至使性腺性逆转的作用[7], 我们在池蝶蚌性腺转录组中也发现有β-catenin, 是否同样对池蝶蚌的性别分化有调控作用?因此本研究对池蝶蚌β-catenin基因进行克隆, 分析其结构特征及在不同组织和不同年龄性腺中的表达量, 以为其功能分析奠定基础。
1 材料与方法
1.1 实验材料
体质健壮池蝶蚌由江西省抚州市国家级池蝶蚌良种场提供, 养于实验室水族箱中, 水温18—25℃, 每天换已曝气自来水2次。
1.2 实验方法
RNA的提取和cDNA的合成 经液氮研磨后池蝶蚌组织利用Trizol试剂盒(Invitrogen, USA)一步法提取总RNA, RNA浓度和纯度用核酸测定仪(Nanodrop 2000)测定, 并用DNaseⅠ(TaKaRa, Japan)消化处理总RNA以消除基因组DNA的残留, 最后采用1%琼脂糖凝胶电泳检测其完整性。使用Super ScriptTMⅢ Reverse Transcriptase Kit反转体系合成cDNA, 备用。
池蝶蚌β-catenin cDNA的克隆 依据本实验室已有的转录组数据设计上、下游引物, 扩增出β-catenin 基因的中间片段。50 μL PCR反应体系为: cDNA模版1 μL, Ex Taq酶0.5 μL, 10×Ex Taq buffer 5 μL, dNTP(2.5 mmol/L)5 μL, 上下游引物各1 μL, ddH2O 36.5 μL。PCR反应条件为: 94℃预变性5min; 94℃ 30s, 59℃ 30s, 72℃ 30s, 35个循环; 72℃延伸10min。设计RACE PCR的5′端引物(GSP1和GSP2)和3′端引物(GSP3和GSP4)(表 1)。用特异性引物和通用引物UPM(Long:Short=1:5)为两侧引物、cDNA为第一轮模版进行PCR扩增; 用特异性引物和通用引物NUP作为两侧引物, 将扩增产物稀释10—50倍作为模版进行第二轮PCR扩增,获得PCR产物。25 μLPCR反应体系: cDNA模版1 μL, Ex Taq酶0.3 μL, 10×Ex Taq buffer 2.5 μL, dNTP (2.5 mmol/L)1.2 μL, 上下游引物各1 μL, ddH2O 18 μL。反应条件: 94℃预变性5min; 94℃ 30s, 59℃30s, 72℃ 30s, 35个循环; 72℃延伸10min。将PCR产物经1.0%琼脂糖凝胶电泳检验后, 用琼脂糖凝胶回收试剂盒(OMEGA公司)回收、纯化, 并与pMD19-T载体连接, 转入感受态细胞E. coli DH5α中, 于LB平板(含Amp+)培养, 阳性克隆经PCR鉴定后送至上海生工生物工程技术服务有限公司测序。获得的序列经MEGA软件分析确定为Hsβ-catenin基因。利用ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)查找此cDNA序列的最大开放阅读框(ORF), 对翻译所得氨基酸序列进行一、二、三级结构预测分析, 利用MEGA软件构建分子系统树。
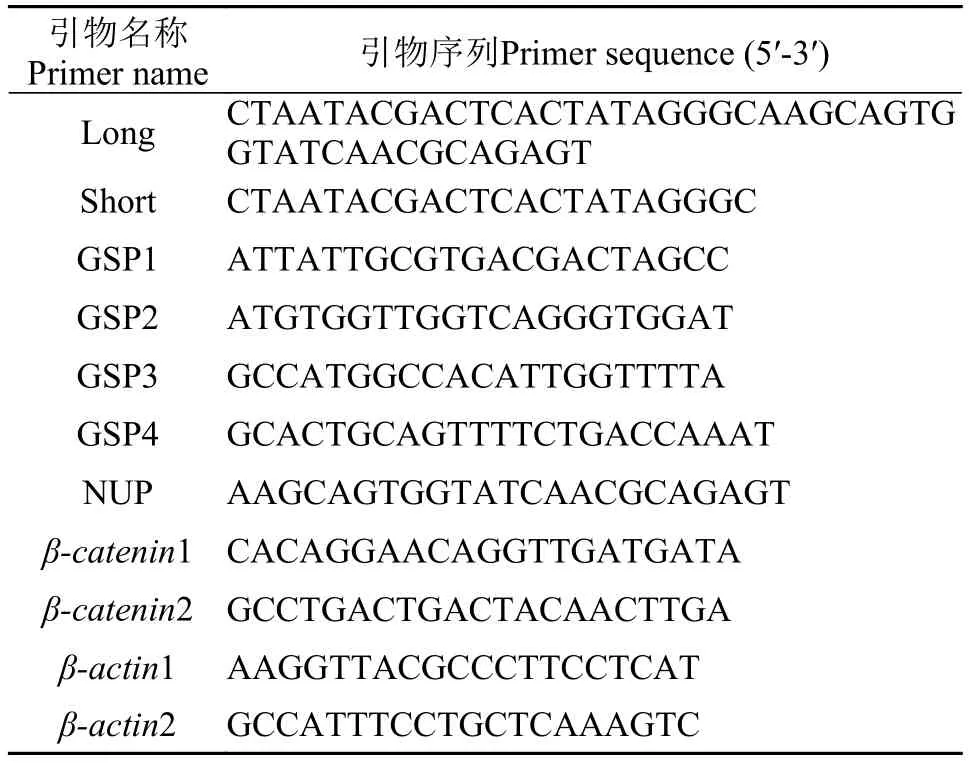
表 1 PCR相关引物序列Tab. 1 Primers used for PCR
qRT-PCR分析 采用qRT-PCR技术检测Hsβ-catenin基因的组织转录差异性及不同年龄、不同性别中性腺组织的表达差异性。根据得到的Hsβ-catenin cDNA全长序列, 设计荧光定量PCR引物(表 1)进行qRT-PCR。对于组织表达实验, 随机选取6只成熟池蝶蚌, 雌、雄各3只采取相同组织混合法分别提取池蝶蚌卵巢、精巢、心脏、外套膜、肠、肾、肝、血和斧足各组织总RNA, 通过1%琼脂糖凝胶电泳检验RNA完整性。将RNA反转为cDNA模板; 不同年龄、不同性别池蝶蚌Hsβcatenin表达实验方案: 选取1—4龄雌、雄性池蝶蚌各3只, 取各年龄雌、雄性腺, 按上述方法获得cDNA模板。根据荧光定量试剂盒(嵌合检测法, Takara)进行qRT-PCR检测。20 μL PCR反应体系为: SYBR10 μL, 上、下游引物各0.4 μL, H2O 8.2 μL。每个样品设置3个平行, 以蒸馏水代替模板作为阴性对照。反应条件为: 95℃预变性5min; 94℃ 30s, 58℃ 30s, 72℃ 30s, 40个循环; 72℃延伸10min。以上实验均重复3次, SPSS软件分析Hsβ-catenin mRNA在池蝶蚌中的表达情况, 组织表达和不同年龄性腺表达均进行单因素方差统计分析。
2 结果
2.1 池蝶蚌Hsβ-catenin 基因cDNA全长及其分析
池蝶蚌Hsβ-catenin 基因cDNA全长 将测序结果用MEGA软件处理后拼接成完整的cDNA序列, 全长4386 bp(登录号为KY126093), 其中5′端非编码区162 bp, 3′端非编码区1758 bp, ORF框2466 bp, 共编码821个氨基酸。将拼接后的cDNA序列与实验室已有的转录组序列进行比对, 二者基本相同, 证明了实验结果的准确性。
Hsβ-catenin蛋白结构域分析 通过瑞士生物信息学研究所ExPASy服务器的SMART程序(http://smart.embl-heidelberg.de/)分析池蝶蚌Hsβcatenin蛋白结构域, 可知池蝶蚌Hsβ-catenin蛋白主要由12个ARM结构域组成。ARM结构是各物种中β-catenin蛋白的中央保守区, 从而验证了实验结果的准确性。
Hsβ-catenin二级结构预测 通过PredicProtein在线软件(http://www.predictprotein.org/)对池蝶蚌Hsβ-catenin的二级结构进行预测。预测可知二级结构中α-螺旋占47.75%, 分布比较均匀且大量分布; β-折叠占1.22%, 在各处均有分布, 总量较少; 随机卷曲占51.04%, 在两端分布较多。根据蛋白表面暴露面积是否超过16%为标准对蛋白进行亲水性和疏水性预测, 亲水性蛋白含量约为49.09%, 疏水性蛋白含量约为50.91%。
Hsβ-catenin三级结构预测 通过瑞士生物信息所ExPASy服务器的SWISS-MODEL程序(http://swissmodel.expasy.org/)对池蝶蚌Hsβ-catenin的三级结构进行预测(图 1)。图中含大量α-螺旋且为右手螺旋, 每3个α-螺旋排列在一起形成1个超螺旋, 即ARM结构域, 中间区域共形成12个ARM重复区域; 图中还包括少量β-折叠及大量无规则卷曲。三级结构预测结果与二级结构一致。
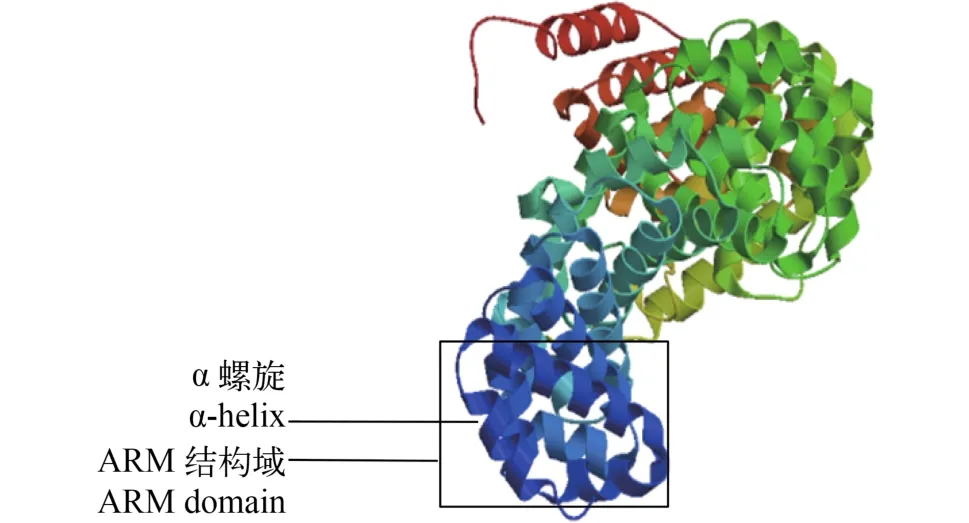
图 1 Hsβ-catenin的三级结构预测Fig. 1 The tertiary structure prediction of Hsβ-catenin
2.2 Hsβ-catenin基因的系统发育分析
在NCBI(http://www.ncbi.nlm.nih.gov/gorf/ orfig.cgi)上查找各物种β-catenin 基因的cDNA序列,利用MEGA软件分析可得到Hsβ-catenin基因的分子进化树(图 2), 由图可知, 该基因序列比较保守,同源性较高。池蝶蚌Hsβ-catenin 基因与软体动物的同源性很高, 构成一个分支, 其中与合浦珠母贝(Pinctada martensii)、栉孔扇贝(Azumapecten farreri)和太平洋牡蛎(Crassostrea gigas)同源性最高,杂斑莲花青螺(Lottia luchuana)、海蜗牛(Aplysia californica)和大西洋舟螺(Crepidula fornicata Linnaeus)次之; 与昆虫类的同源性也很高, 如毛翼虫(Chaetopterus variopedatus)、杜氏阔沙蚕(Platynereis dumerilii)和大斑蝶(Danaus plexippus); 与人类和鱼类的同源性相对较低。
2.3 池蝶蚌Hsβ-catenin组织表达分析
用荧光定量PCR技术检测池蝶蚌Hsβ-catenin在成熟个体9个组织中的表达(图 3)。由图可知, Hsβ-catenin 在各组织中均有表达, 表达量从高到低为: 肠、斧足、精巢、肝、卵巢、心脏、外套膜、肾和血, 相对Hsβ-actin表达量分别为: 8.44、4.43、3.05、2.22、1.84、1.00、0.92、0.64和0.06, 表明其在生物体各组织中具有多种生物学功能, 且在成熟池蝶蚌中精巢表达量高于卵巢, 推测Hsβ-catenin在性腺发育成熟后更多地参与其他生物学功能。

图 2 不同物种β-catenin基因分子进化树Fig. 2 The phylogenetic tree of β-catenin合浦珠母贝Pinctada martensii (AKJ32471.1);栉孔扇贝Azumapecten Farreri (AFU35436.1);太平洋牡蛎Crassostrea gigas (NP_001292224.1);池蝶蚌 Aplysia californica (NP_00119 1600.1);杂斑莲花青螺Lottia luchuana (XP_009048556.1);大西洋舟螺Crepidula fornicata Linnaeus (ADI48180.1);白氏文昌鱼Branchiostoma belcheri (BAD12593.1);意蜂Apis mellifera (NP_001172034.1);内华达古白蚁Zootermopsis nevadensis (KDR13423.1);双斑蟋Gryllus bimaculatus (BAD00045.1);大斑蝶Danaus plexippus (EHJ72882.1);嗜凤梨果蝇Drosophila ananassae (XP_001966028.1);人类Homo sapiens (CAA61107.1)
2.4 池蝶蚌Hsβ-catenin在不同年龄性腺中的表达分析
池蝶蚌在5月龄出现性腺, 12月龄雌雄可辨, 36月龄性腺成熟。检测Hsβ-catenin在不同年龄、不同性腺中的表达情况(图 4), 结果显示其在3龄(约36月龄)中的表达最高, 1龄(约12月龄)表达量次之, 2龄(约24月龄)和4龄(约48月龄)表达量最少; 在1到3龄中卵巢的表达量显著高于精巢的表达量, 而到4龄时精巢反而略高于卵巢。
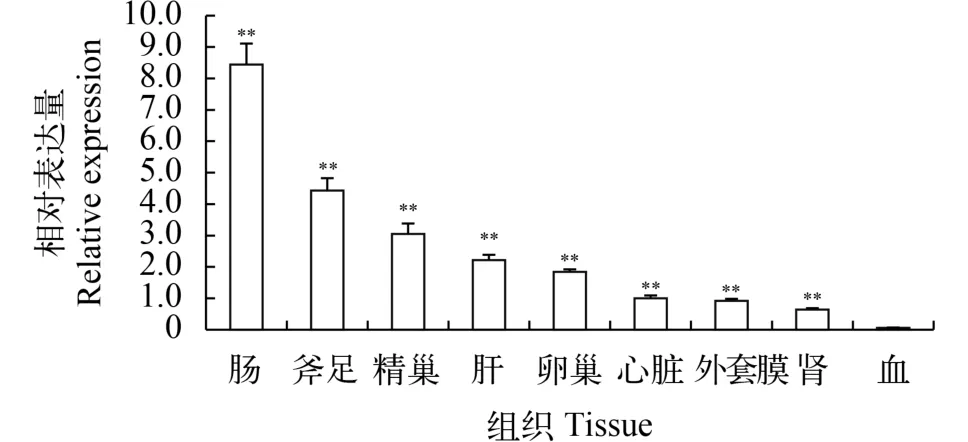
图 3 Hsβ-catenin在各组织中的表达量
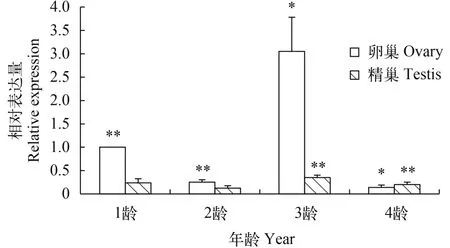
图 4 Hsβ-catenin在不同年龄、不同性腺中的表达量
3 讨论
本研究首次获得池蝶蚌Hsβ-catenin基因的cDNA全长, 并对其结构特征和蛋白功能进行预测分析。由池蝶蚌Hsβ-catenin蛋白的结构域预测可知, 其主要由12个ARM结构域组成, 序列高度保守,有典型的N末端区和C末端区, 与各种贝类甚至其他物种同源性较高, 预测结果与ARM重复序列的性质相同。ARM重复序列是约有40个氨基酸的串联重复序列, 通过在果蝇中起信号传导的作用首次被发现, 动物的ARM蛋白在细胞内信号转导和细胞骨架的调节等多种生命活动中起作用, 并参与βcatenin、腺瘤样息肉(APC)的肿瘤抑制蛋白和核运输因子importin α等蛋白的构建[8]。ARM结构高度保守, 仅有右手超螺旋结构, 普遍存在于真核细胞中, 如在拟南芥中起着细胞信号传导功能的ARM重复序列对生长发育和繁殖起着重要作用[9]。β-catenin包含3个区域, 各司其职, 第一个区域为N末端区, 含有GSK-β一致性的磷酸化位点; 第二个区域为中央区, 含有ARM重复序列, 能够与钙黏素、APC (Adenomatous polyposis coli)和TCF/LEF (T-cell Factor/Lymphoid Enhancing Factor)相互作用;第三个区域为C末端区, 含有转录激活区, 对靶基因激活是所需的[10]。我们推测在经典Wnt通路中, 池蝶蚌β-catenin蛋白ARM结构域中央区可以与APC和其他信号分子结合形成破坏复合物, N末端区的磷酸化位点可与GSK-3β作用, 使破坏复合物中的β-catenin不断被磷酸化, 无法进入细胞核中起作用; 当Wnt蛋白分泌时, GSK-3β不能磷酸化βcatenin, 从而抑制降解复合物的形成, 导致胞浆中的β-catenin不被降解并进入细胞核, 中央区与核内转录因子LEF/TCF家族成员结合, 而C末端的转录激活区促进下游靶基因表达。
在非洲爪蟾胚胎中, β-catenin出现在所有细胞中, 参与细胞间黏附功能, 特别在形态发生活跃的区域如囊胚和原肠胚的边缘区有β-catenin高水平表达; 在原基细胞基团之间也发现β-catenin高水平表达, 说明其参与生物发育过程[11]。β-catenin可以与FHL2相互作用促进小鼠肌细胞的分化[12], Wnt经典通路的激活可以诱导小鼠肾单位的分化和肾的形成[13]。在人类[14]、果蝇[15]、非洲爪蟾[11]、罗非鱼[16]等物种中也都具有的广泛表达的特点。本研究表明, 池蝶蚌β-catenin在肠、斧足、精巢、肝、卵巢、心脏、外套膜、肾和血9个组织中均有表达,而不是仅作为性别决定和性别调控基因大量出现在精巢和卵巢中, 表明其在生物体中广泛存在且可在不同组织中参与各种生理功能。根据在外套膜、斧足、肾及各细胞中的表达情况及其碱基序列的高度保守性, 我们推测, 其可能参与池蝶蚌肌细胞的分化与肾的形成, 并参与各组织内细胞间黏连等各种生理活动, 这与其他物种有功能类似; 但另一方面Hsβ-catenin在池蝶蚌各组织的表达量相对较低, 推测是由于Wnt信号通路在各组织中广泛存在。
β-catenin是一种亲卵巢、抗精巢的信号分子,对性别决定机制起着一定的作用并可导致性逆转。为了研究β-catenin是否可以阻断睾丸的发育通路, 在小鼠XY型性细胞中激活β-catenin的表达, 结果显示XY型小鼠雄性发育通路被阻断, 并造成雄性到雌性的性逆转[17]。目前一些β-catenin对性腺决定和分化作用的研究认为, 哺乳动物尚未分化的性腺的发育方向是由R-spondin 1、Wnt 4和β-catenin等信号分子介导的雌性信号通路和由Sry和Sox9等信号分子介导的雄性信号通路相互竞争决定的,性腺最终朝着竞争占优势的一方发育[16]。我们对不同性别和不同年龄池蝶蚌中Hsβ-catenin基因的表达量也进行了分析, 结果发现, 12月龄雌雄可辨时卵巢中表达量较高, 36月龄的成熟卵巢中表达量最高。由此推测, Hsβ-catenin可能在池蝶蚌雌性性别决定与分化过程中起着调控作用。另外一个有趣现象是第一次性成熟后的卵巢完成了性腺分化, Hsβ-catenin表达量反而略低于精巢, 因此我们推测其可能不再行使性腺分化调控功能。
[1]Muercheer, Wen B. New progresses of β-catenin in colon cancer [J]. Journal of North Sichuan Medical College, 2011, 26(6): 554—558 [木尔扯尔, 文彬. 结肠癌中βcatenin研究的新进展. 川北医学院学报, 2011, 26(6): 554—558]
[2]Tan Y, Jiang N, Sun X. The research progress of β-catenin in ovarian cancer and chemoresistance [J]. Maternal and Child Health Care of China, 2015, 30(21):3746—3749 [谭影, 姜宁, 孙信. β-catenin在卵巢癌及化疗耐药中的研究进展. 中国妇幼保健, 2015, 30(21): 3746—3749]
[3]Li H L. Cloning of genes Wnt4, β-catenin, Dax1, and their correlation to the gonadal development in scallop Chlamys farreri [D]. Ocean University of China. 2013 [李海龙. 栉孔扇贝(Chlamys farreri)Wnt4, β-catenin及Dax1基因的克隆及其与性腺发育相关性的研究. 中国海洋大学. 2013]
[4]He H. The research progress of β-catenin [J]. Practical Clinical Medicine, 2010, 11(10): 120—123 [何欢. βcatenin的研究进展. 实用临床医学, 2010, 11(10): 120—123]
[5]Azzolin L, Panciera T, Soligo S, et al. YAP/TAZ incorporation in the β-Catenin destruction complex orchestrates the Wnt response [J]. Cell, 2014, 158(1): 157—170
[6]Wang B H. Study on development of the gonad of Hyriopsis schlegelii [D]. Nanchang University. 2010 [王滨花. 池蝶蚌性腺发育的观察. 南昌大学. 2010]
[7]Yu X G, Wu L M, Liu G, et al. Function in the ovary differentiation of R-spondins gene from teleost fish [C]. The 2012 Symposium of Chinese Society for Oceanology and Limnology and China Ichthyology Society. 2012 [于祥国, 吴利敏, 刘刚, 等. R-spondins基因在硬骨鱼类卵巢分化中的作用研究. 中国海洋湖沼学会、中国动物学会鱼类学分会2012年学术研讨会. 2012]
[8]Hatzfeld M. The armadillo family of structural proteins [J]. International Review of Cytology, 1999, (186): 179—224
[9]Coates J. Armadillo repeat proteins: beyond the animal kingdom [J]. Trends in Cell Biology, 2003, 13(9): 463—471
[10]Akiyama T. Wnt/beta-catenin signaling [J]. Cytokine & Growth Factor Reviews, 2000, 11(4): 273—282
[11]Fagotto F, Gumbiner B M. Beta-catenin localization during Xenopus embryogenesis: accumulation at tissue and somite boundaries [J]. Development, 1994, 120(12): 3667—3679
[12]Martin B, Schneider R, Janetzky S, et al. The LIM-only protein FHL2 interacts with β-catenin and promotes differentiation of mouse myoblasts [J]. Journal of Cell Biology, 2002, 159(1): 113—122
[13]Kuure S, Popsueva A, Jakobson M, et al. Glycogen synthase kinase-3 inactivation and stabilization of beta-catenin induce nephron differentiation in isolated mouse and rat kidney mesenchymes [J]. Journal of the American Society of Nephrology, 2007, 18(4): 1130—1139
[14]Riggleman B, Wieschaus E, Schedl P. Molecular analysis of the armadillo locus: uniformly distributed transcripts and a protein with novel internal repeats are associated with a Drosophila segment polarity gene [J]. Genes & Development, 1989, 3(1): 96—113
[15]Helmbrecht K, Kispert A, Von W R, et al. Identification of a Wnt/beta-catenin signaling pathway in human thyroid cells [J]. Endocrinology, 2001, 142(12): 5261—5266
[16]Wu F R. Moleeular cloning, expression and characterization of several genes (Rspo1, β-catenin and TSP-1)involved in ovarian differentiation and development in Tilapia [D]. Southwest University. 2010 [吴风瑞. 罗非鱼卵巢分化和发育相关基因Rspo1、β-catenin和TSP-1的克隆、表达和功能鉴定. 西南大学. 2010]
[17]Maatouk D M, Dinapoli L, Alvers A, et al. Stabilization of β-catenin in XY gonads causes male-to-female sex-reversal [J]. Human Molecular Genetics, 2008, 17(19): 2949—2955
THE STRUCTURAL FEATURE AND EXPRESSION ANALISIS OF HSβ-CATENIN cDNA AND PROTEIN FROM HYRIOPSIS SCHLEGELII
YAN Han-Xiao, SHI Jian-Wu, SHENG Jun-Qing, WANG Jun-Hua and Hong Yi-Jiang
(The College of Life Science, Nanchang University, Nanchang 330000, China)
In order to explore the mechanism of sexual development of freshwater shellfish, we established a gonadal transcriptome of Hyriopsis schlegelii. Based on the transcriptome library, this study investigated the β-catenin. The fulllength cDNA was cloned by RACE PCR, which named Hsβ-catenin. The full length of Hsβ-catenin cDNA was 4386 bp that contained an open reading frame (ORF) of 2466 bp coding a protein of 821 amino acids. The protein was mainly composed of 12 ARM repeat sequences. In the secondary structure, the α-helix accounted for 47.75% and the β-folding accounted for 1.22% were predicted. The tertiary structure had many α-helixs, namely ARM domain. Hsβ-catenin gene was clustered with homologous genes from soft animal in the phylogenetic tree. Hsβ-catenin expressed highly in intestine and modestlyin foot and testis. The expression level of Hsβ-catenin was high at the age of 12-month-old (gender differentiation) and 36-month-old (gonad mature), indicated that it might be involved in sexual development.
Hyriopsis schlegelii; Hsβ-catenin; Tissue expression; Clone; Sequence analysis; qRT-PCR
Q344+1
A
1000-3207(2017)05-0972-05
10.7541/2017.121
2016-10-19;
2017-01-14
国家自然科学基金(31660337); 江西省教育厅项目(GJJ150166)资助 [Supported by the National Natural Science Foundation of China (31660337); the Fund Project of Jiangxi Provincial Education Department (GJJ150166)]
闫含笑(1993—), 女, 山东临沂人; 硕士研究生; 主要研究方向为水生生物学。E-mail: yanhanxiao1993@163.com
洪一江(1963—), 教授; 主要研究方向为水产动物细胞与遗传育种。E-mail: yjhong2008@163.com
