不同浓度乙酸钠对耐乙酸大肠杆菌DA19蛋白质组学的影响*
2017-09-08张艳军
张艳军, 赵 利
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
不同浓度乙酸钠对耐乙酸大肠杆菌DA19蛋白质组学的影响*
张艳军, 赵 利
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
对耐乙酸大肠杆菌DA19在含有不同浓度乙酸钠的氮源限制基本培养基中进行了连续培养,并利用双向凝胶电泳方法分离了稳态时菌体蛋白,再利用质谱方法对表达水平存在差异的蛋白进行了鉴定.结果表明:添加外源乙酸钠使得生物素羧基载体蛋白亚基、天冬氨酸半醛脱氢酶、巯基过氧化物酶、YgiW蛋白、外膜孔蛋白OmpC和假想蛋白等表达水平增加;而50S核糖体蛋白L9、果糖1,6-二磷酸醛缩酶、ATP合成酶α亚基和结合转移蛋白TraT表达水平减低.由此推测,生物素羧基载体蛋白亚基、天冬氨酸-β-半醛脱氢酶、巯基过氧化物酶、YgiW蛋白和外膜孔蛋白OmpC等与大肠杆菌DA19的乙酸耐受力提高相关.
大肠杆菌;乙酸;蛋白质组;双向凝胶电泳
大肠杆菌在培养过程中易产生乙酸,当其积累到一定浓度时,会抑制菌体生长并降低产物表达水平.当有乙酸存在时,大肠杆菌胞内相关基因的转录和表达会发生改变,从而引起代谢变化,增加其抗酸性,提高其细胞生存能力.Kirkpatrick等[1]利用双向电泳考察了大肠杆菌W3110在外源乙酸存在时蛋白表达情况,发现:外源乙酸引起37种蛋白表达上调,包括转运氨基酸和多肽的周质转运蛋白(ArtI,FliY,OppA和ProX)、参与代谢的酶YfiD和GatY、生长调节因子RpoS和自身诱导物合成蛋白LuxS等;同时,导致17种蛋白(包括Pta)表达下调.
提高大肠杆菌的乙酸耐受性,可以减轻乙酸对菌体生长的抑制情况,同时提高外源蛋白表达水平.例如,诱变选育的耐乙酸大肠杆菌DA19在乙酸质量浓度达到12 g/L时仍可表达外源产物人表皮生长因子.虽然传统的诱变育种方法并不是改造菌种和提高菌株乙酸耐受力的最佳选择,但是对所得耐乙酸突变株的研究有助于理解其乙酸耐受机理,为设计新的耐乙酸途径提供信息[2].而应用比较蛋白质组学技术可以准确地研究微生物在环境胁迫下产生的表达差异蛋白,从整体和动态的蛋白质水平了解微生物响应环境变化的生理机制[3].因此,本研究利用蛋白质组学技术研究了不同浓度外源乙酸钠存在下耐乙酸大肠杆菌DA19的表达差异蛋白,以期初步阐明大肠杆菌DA19对乙酸压力的应答机理,为下一步构建乙酸耐受菌株提供参考.
1 材料与方法
1.1 菌种
大肠杆菌DA19为耐乙酸突变株,由大肠杆菌DH5α诱变筛选得到.
1.2 培养基
LB培养基、M培养基、MN培养基和MNA培养基的组成参见文献[4].所有培养基均使用去离子水配制.
1.3 培养方法及条件
一级种子和二级种子培养方法及条件见文献[4].连续培养在5 L发酵罐(国强生化FMG-5L)中进行,培养方法和条件参见文献[4].当连续培养达到稳态时,离心收集菌体,用于后续实验.
1.4 差异蛋白质分离与鉴定
1.4.1 蛋白质样品制备
取出冷冻保存的稳态时的菌体,加入适量液氮并进行研磨,再加入样品裂解液,置于30 ℃恒温水浴锅中,1 h后取出,于15 000 r/min离心15 min,然后取上清液进行第2次离心.利用Bradford法测定第2次离心后上清液中的蛋白浓度,然后将其分装至1.5 mL离心管中,并置于-80 ℃冰箱中保存.
1.4.2 菌体蛋白分离
取含有300 μg蛋白的上清液,加入适量样品水化液,使得样品总体积达到450 μL,并混合均匀.取出-20 ℃冷冻保存的IPG胶条(GE Healthcare,24 cm,pH 3~10),室温下放置10 min.将制备好的蛋白样品沿聚焦槽边缘从左至右加入,然后用镊子取下IPG胶条上的保护层,胶面朝下置于样品溶液上,进行等电聚焦.将聚焦好的IPG胶条置于SDS(十二烷基硫酸钠)平衡缓冲液Ⅰ和SDS平衡缓冲液Ⅱ中分别平衡15 min后进行第2向电泳.当溴酚蓝刚好跑出凝胶时停止电泳,取出凝胶,然后进行银染.每个样品均重复3次.
1.4.3 图像分析及质谱鉴定
使用ImageScanner扫描仪扫描染色后的凝胶,并利用PDquest 8.0软件对图像进行分析.手工切取凝胶上选定的差异蛋白点,然后送至上海博苑生物科技有限公司进行质谱检测和鉴定.
2 结 果
2.1 不同浓度外源乙酸钠对大肠杆菌DA19蛋白表达的影响
大肠杆菌耐乙酸突变株DA19在不同浓度外源乙酸钠存在下的蛋白表达情况如图1所示.其中:图1(a)为MN培养基(0 g/L乙酸钠,对照组)中连续培养时菌体胞内总蛋白;图1(b)~(e)分别为3.6,4.8,7.0和9.0 g/L外源乙酸钠存在下菌体胞内总蛋白.
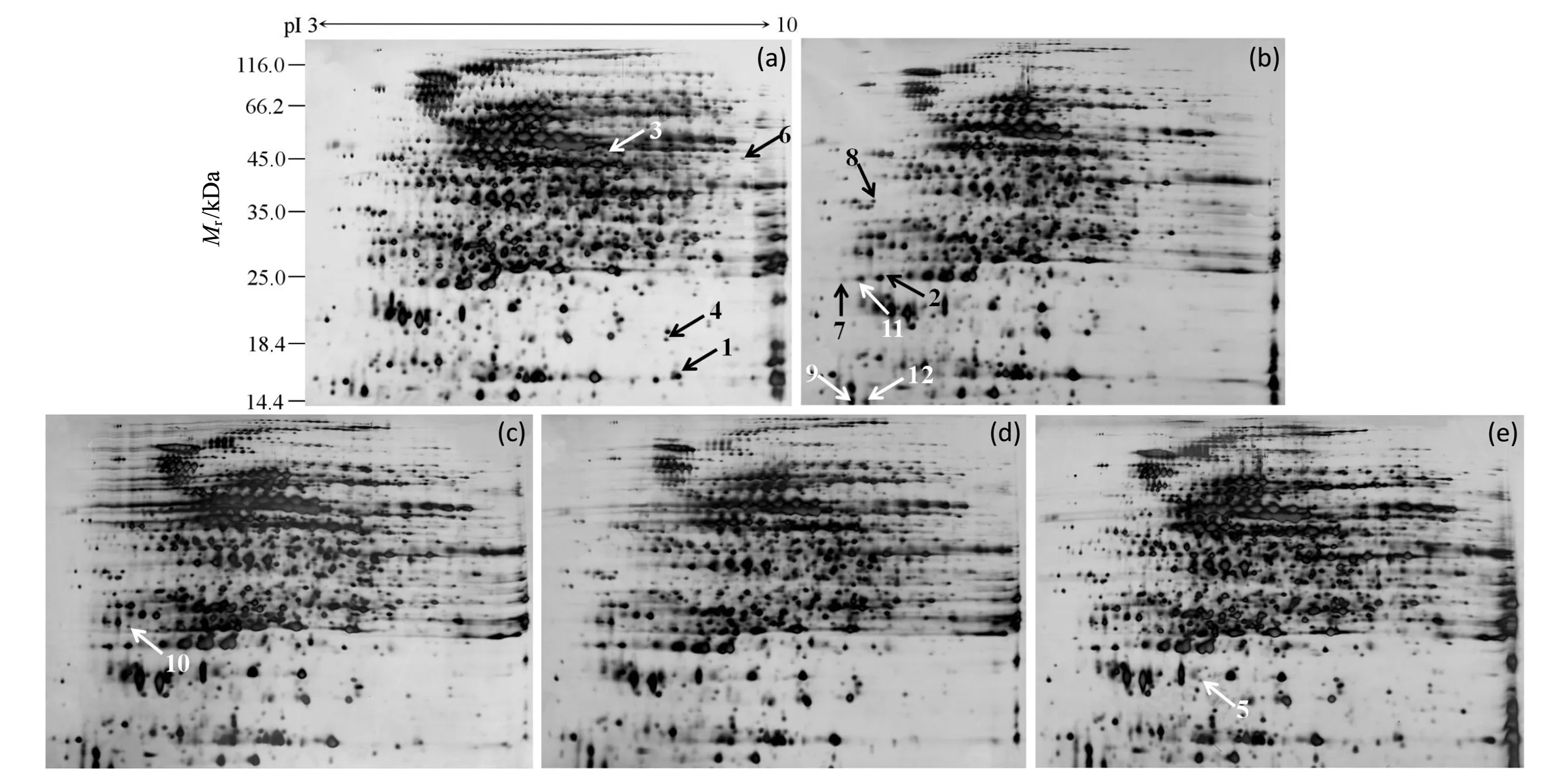
(a)0 g/L乙酸钠;(b)3.6 g/L乙酸钠;(c)4.8 g/L乙酸钠;(d)7.0 g/L乙酸钠;(e)9.0 g/L乙酸钠图1 大肠杆菌耐乙酸突变株DA19在不同浓度外源乙酸钠存在下的蛋白表达情况
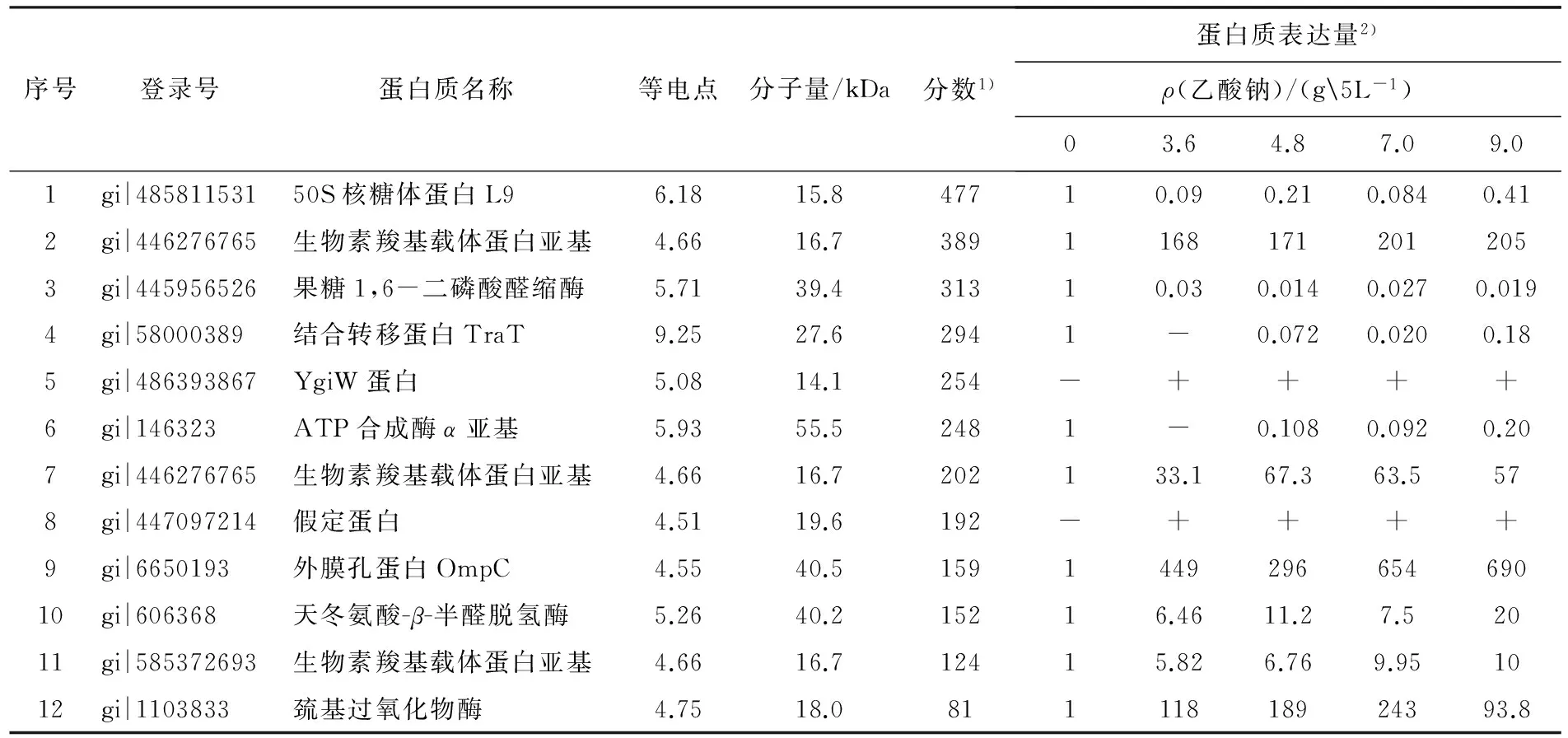
序号登录号蛋白质名称等电点分子量/kDa分数1)蛋白质表达量2)ρ(乙酸钠)/(g5L-1)03.64.87.09.01gi|48581153150S核糖体蛋白L96.1815.847710.090.210.0840.412gi|446276765生物素羧基载体蛋白亚基4.6616.738911681712012053gi|445956526果糖1,6-二磷酸醛缩酶5.7139.431310.030.0140.0270.0194gi|58000389结合转移蛋白TraT9.2527.62941-0.0720.0200.185gi|486393867YgiW蛋白5.0814.1254-++++6gi|146323ATP合成酶α亚基5.9355.52481-0.1080.0920.207gi|446276765生物素羧基载体蛋白亚基4.6616.7202133.167.363.5578gi|447097214假定蛋白4.5119.6192-++++9gi|6650193外膜孔蛋白OmpC4.5540.5159144929665469010gi|606368天冬氨酸-β-半醛脱氢酶5.2640.215216.4611.27.52011gi|585372693生物素羧基载体蛋白亚基4.6616.712415.826.769.951012gi|1103833巯基过氧化物酶4.7518.081111818924393.8
注:1)分数>46表明一致或高度同源(P<0.05).
2)蛋白质在不同浓度外源乙酸钠存在下的表达量,以MN培养基(0 g/L乙酸钠)中的蛋白表达量为参照.“-”为未检测到.
2.2 差异蛋白质的肽质量指纹谱分析
不同浓度乙酸钠存在下大肠杆菌DA19表达差异蛋白较多,因此,选取所有乙酸钠浓度下均存在差异或差异特别显著的12个蛋白进行质谱解析(鉴定结果见表1),同时将这些差异蛋白点标注在双向电泳胶片上(见图1).生物信息学分析发现:这些差异蛋白主要参与脂肪酸合成、氨基酸合成、能量代谢、应激反应及氧化还原反应等.
3 讨 论
3.1 不同浓度外源乙酸钠对大肠杆菌DA19胞内蛋白和周质蛋白的影响
培养基中乙酸通过扩散作用进入细胞内,并迅速发生解离释放出质子,使得细胞液发生酸化,从而降低胞内代谢酶的活性[2].为了应对胞液酸化问题,大肠杆菌通过谷氨酸、精氨酸和赖氨酸的脱羧基反应来减少胞内质子,从而提高胞内pH[2].本研究中添加外源乙酸钠使得天冬氨酸-β-半醛脱氢酶(aspartate semialdehyde dehydrogenase.见图1点10)表达水平增加了6.46~20倍,该酶催化天冬氨酰磷酸生成天冬氨酸-β-半醛,它是由天冬氨酸合成赖氨酸、异亮氨酸、蛋氨酸和苏氨酸生物途径的第一个分支点.由此推测,大肠杆菌DA19可能通过增加赖氨酸含量,并通过脱羧基反应来应对乙酸带来的胞液酸化问题.此外,该氨基酸合成途径中的中间代谢物二氨基庚二酸是细菌细胞壁的重要组成部分.因此,耐乙酸大肠杆菌DA19可能通过改变细胞壁组成来提高其乙酸耐受性.
乙酰辅酶A羧化酶(acetyl-CoA carboxylase)是一种生物素依赖的酶,包括生物素羧化酶亚基(biotin carboxylase)、生物素羧基载体蛋白亚基(biotin carboxyl carrier protein,BCCP)和羧基转移酶亚基(carboxyl transferase).该酶催化乙酰辅酶A生成丙二酰辅酶A,为合成脂肪酸和次生代谢产物等提供底物.乙酰辅酶A羧化酶催化的反应是脂肪酸合成途径的第一步,同时也是该途径的关键反应步骤和限速步骤[5],是碳水化合物转化成脂肪酸的重要调控位点.本研究中添加外源乙酸钠导致生物素羧基载体蛋白亚基(acetyl-CoA carboxylase biotin carboxyl carrier protein subunit.见图1点2,7和11)表达水平明显增加,从而使更多的分解代谢产物乙酰辅酶A进入脂肪酸合成途径,这可能是大肠杆菌在外源乙酸存在情况下倾向于避免自身生成乙酸[6]的一个原因,同时也可能是该菌株应对外源乙酸压力的一种防御措施.此外,脂肪酸合成途径产物还参与细胞膜的合成和维持膜结构的稳定.因此,耐乙酸大肠杆菌DA19也可能通过增加脂肪酸合成来维持细胞膜结构稳定,从而增加其对乙酸的耐受能力.
果糖1,6-二磷酸醛缩酶(fructose-bisphosphate aldolase)是大肠杆菌糖酵解途径中的一个酶,可以催化果糖1,6-二磷酸可逆地生成磷酸二羟丙酮和3-磷酸甘油醛.本研究结果显示,添加外源乙酸钠使得大肠杆菌DA19的果糖1,6-二磷酸醛缩酶(见图1点3)酶活性显著降低,表明该菌株可能通过降低EMP途径流量来减少乙酸的生产.
添加外源乙酸钠导致大肠杆菌DA19的巯基过氧化物酶(thiol peroxidase.见图1点12)表达水平显著增加,该酶是一类广泛分布于各种细菌中的抗氧化酶,对细菌的有氧生长是必不可少的.研究表明,细菌巯基过氧化物酶可以催化脂类过氧化物的还原过程,防止细胞膜被活性氧所氧化,从而起到保护细胞的作用[7].同时,与对照组相比,在添加乙酸钠情况下均检测到了YgiW蛋白(见图1点5).该蛋白是一种重要的压力响应蛋白,与H2O2、钙及酸耐受性相关,吲哚相关的酸抗性蛋白AriR和H2O2均可以诱导其表达[8].由此推测,添加外源乙酸钠可能增加了大肠杆菌DA19胞内活性氧的浓度.
50S核糖体蛋白L9(50S ribosomal protein L9)由rplI基因编码,它可以结合到23S RNA,同时该蛋白突变会使大肠杆菌K12对热敏感[9].本研究中添加外源乙酸钠使得大肠杆菌DA19的50S核糖体蛋白L9(见图1点1)表达水平显著降低,表明该蛋白表达受到乙酸的抑制.
此外,与对照组相比,在添加乙酸钠的情况下均检测到了一种假定蛋白(hypothetical protein.见图1点8),其具体的功能尚不明确,需要做进一步的研究.
3.2 不同浓度外源乙酸钠对大肠杆菌DA19膜蛋白的影响
大肠杆菌具有一系列完善的反应机制以应对各种环境压力,其中细胞膜是抵御环境、宿主免疫系统和抗生素的天然屏障.例如,醋酸菌通过改变膜成分来阻止乙酸进入细胞,从而调节其乙酸耐受性[2].外膜是革兰氏阴性菌细胞壁中的特有结构,外膜蛋白以多种结构形式镶嵌在外膜中,行使多种功能,参与各种转运系统的正常运作,在细菌的生命活动中起着重要作用[10].
本研究中,添加外源乙酸钠导致大肠杆菌DA19的外膜孔蛋白OmpC(outer membrane protein C.见图1点9)表达水平极显著增加.OmpC是一种大量存在于细胞膜上的外膜孔蛋白,该蛋白允许分子量小于600 Da的亲水性溶质或者离子通过,是物质运输进入大肠杆菌体内的一种重要的孔蛋白,参与葡萄糖和抗生素的转运[10].同时,OmpC在应对外界环境压力及乙酸耐受性方面也起着非常重要的作用.例如:添加乙酸使得大肠杆菌O157:H7胞内ompC基因表达增加2~3倍[11];当敲除ompC和ompF后,大肠杆菌的酸抗性降低[12];同时,较小的OmpC孔蛋白在不良的环境中表达升高,可降低膜渗透性[10].由此推测,耐乙酸大肠杆菌DA19通过增加OmpC孔蛋白表达量,降低膜渗透性,从而减少乙酸进入胞内.这可能是其乙酸耐受性增强的一个原因.
添加外源乙酸钠导致大肠杆菌DA19的ATP合成酶α亚基(ATP synthase alpha subunit.见图1点6)表达水平有所降低.大肠杆菌F0F1型ATP合成酶结合在膜上,在自由能转换中起着重要作用.在好氧条件下,呼吸链产生的质子动力提供能量,ADP在ATP合成酶作用下生成ATP.氧化磷酸化途径是合成ATP的主要途径,其产能效率远远高于底物水平磷酸化途径.文献[13]发现,缺乏完整的ATP合成酶的大肠杆菌在以葡萄糖为碳源的基本培养基中好氧生长时生长速率和菌体得率只有野生菌的75%和55%.本研究结果表明,大肠杆菌DA19的最大比生长速率随外源乙酸钠浓度的增加而显著降低(数据未列出).由此推测,外源乙酸钠可以降低大肠杆菌DA19的ATP合成酶的表达,进而降低ATP合成速率和合成量,从而降低菌体比生长速率.
此外,添加外源乙酸钠导致大肠杆菌DA19的结合转移蛋白TraT(conjugal transfer protein TraT.见图1点4)表达水平显著降低.该蛋白是一种菌体外膜脂蛋白,由traT基因编码,它与菌体的补体抗性和致病力关系密切,同时还可以与外膜蛋白OmpA相互结合[14].
综上所述,本研究利用双向凝胶电泳技术结合质谱和生物信息学方法,对不同浓度乙酸钠存在下耐乙酸大肠杆菌DA19的菌体总蛋白进行了研究,并分离鉴定了表达水平存在差异的蛋白,它们主要参与脂肪酸合成、氨基酸合成、能量代谢、应激反应及氧化还原反应等代谢途径,推测生物素羧基载体蛋白亚基、天冬氨酸-β-半醛脱氢酶、巯基过氧化物酶、YgiW蛋白和外膜孔蛋白OmpC等与大肠杆菌DA19的乙酸耐受力提高相关.
[1]Kirkpatrick C,Maurer L M,Oyelakin N E,et al.Acetate and formate stress:Opposite responses in the proteome ofEscherichiacoli[J].Journal of Bacteriology,2001,183(21):6466-6477.
[3]Shu Liebo,Ding Wei,Wu Jinhong,et al.Proteomic analysis of rice leaves shows the different regulations to osmotic stress and stress signals[J].Journal of Integrative Plant Biology,2010,52(11):981-995.
[4]张艳军,张萍华,周灿,等.不同浓度外源乙酸钠对耐乙酸大肠埃希菌DA19代谢和关键酶酶活的影响[J].微生物学报,2016(5):15-20.
[5]Choi-Rhee E,Cronan J E.The biotin carboxylase-biotin carboxyl carrier protein complex ofEscherichiacoliacetyl-CoA carboxylase[J].The Journal of Biological Chemistry,2003,278(33):30806-30812.
[6]Polen T,Rittmann D,Wendisch V F,et al.DNA microarray analyses of the long-term adaptive response ofEsherichiacolito acetate and propionate[J].Applied and Environmental Micorbiology,2003,69:1759-1774.
[7]Baker L M,Poole L B.Catalytic mechanism of thiol peroxidase fromEscherichiacoli.Sulfenic acid formation and overoxidation of essential CYS61[J].The Journal of Biological Chemistry,2003,278(11):9203-9211.
[8]Lee J,Hiibel S R,Reardon K F,et al.Identification of stress-related proteins inEscherichiacoliusing the pollutantcis-dichloroethylene[J].Journal of Applied Microbiology,2010,108(6):2088-2102.
[9]Isono K,Kitakawa M.Cluster of ribosomal protein genes inEscherichiacolicontaining genes for proteins S6,S18,and L9[J].PNAS,1978,75(12):6163-6167.
[10]杨君宁.大肠埃希氏菌TolC与OmpF、OmpC及其双调节系统相互关系的研究[D].广州:中山大学,2010.
[11]Arnold C N,McElhanon J,Lee A,et al.Global analysis ofEsherichiacoligene expression during the acetate-induced acid tolerance response[J].Journal of Bacteriology,2001,183:2178-2186.
[12]Bekhit A,Fukamachi T,Saito H,et al.The role of OmpC and OmpF in acidic resistance inEscherichiacoli[J].Biological & Pharmaceutical Bulletin,2011,34(3):330-334.
[13]Von Meyenburg K,Jørgensen B B,Nielsen J,et al.Promoters of the atp operon coding for the membrane bound ATP synthase ofEscherichiacolimapped by Tn10 insertion mutations[J].Molecular and General Genetics,1982,188:240-248.
[14]赖平安,王金洛,徐建国,等.鸡大肠杆菌traT基因的扩增及TraT-DIG探针制备[J].畜牧兽医学报,2004,31(3):235-240.
(责任编辑 薛 荣)
Effect of exogenous sodium acetate on proteomics of the acetate-tolerantEscherichiacoliDA19
ZHANG Yanjun, ZHAO Li
(CollegeofChemistryandLifeSciences,ZhejiangNormalUniversity,Jinhua321004,China)
The acetate-tolerantEscherichiacoliDA19 was continuously cultured in nitrogen-limited defined media without or with the different concentration of sodium acetate. The proteins of DA19 at steady-state condition were separated by two-dimensional gel electrophoresis, and the proteins differently expressed at different concentration of sodium acetate were identified by mass spectrum. The results indicated that adding exogenous sodium increased significantly the expression level of acetyl-CoA carboxylase biotin carboxyl carrier protein subunit, aspartate semialdehyde dehydrogenase, thiol peroxidase, protein YgiW, outer membrane protein OmpC and hypothetical protein. But it decreased significantly the expression level of 50S ribosomal protein L9, fructose-bisphosphate aldolase, ATP synthase alpha subunit and conjugal transfer protein TraT. Based on the results of proteomic analysis, it was suggected that the acetate-tolerantEscherichiacoliDA19 coped with the exogenous sodium acetate stress by acetyl-CoA carboxylase biotin carboxyl carrier protein subunit, aspartate semialdehyde dehydrogenase, thiol peroxidase, protein YgiW and outer membrane protein OmpC were related to the acetate-tolerant ability of DA19.
Escherichiacoli; acetic acid; proteomic analysis; two-dimensional gel electrophoresis
10.16218/j.issn.1001-5051.2017.03.010
�2016-12-20;
2017-03-13
浙江省自然科学基金资助项目(LQ12C01001);金华市科学技术研究计划项目(2014-2-042);浙江省公益技术应用研究计划项目(2015C32043)
张艳军(1979-),男,河北唐山人,讲师,博士.研究方向:发酵工程.>
Q935
A
1001-5051(2017)03-0307-05
