人类T淋巴细胞白血病1型病毒的感染复制及致病机制研究进展*
2017-09-08陈梦云宋早文方金勇徐玲玲赵铁军
陈梦云, 宋早文, 方金勇, 徐玲玲, 赵铁军
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
人类T淋巴细胞白血病1型病毒的感染复制及致病机制研究进展*
陈梦云, 宋早文, 方金勇, 徐玲玲, 赵铁军
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
主要针对人类T淋巴细胞白血病1型病毒(human T-cell leukemia virus type 1,HTLV-1)及其与成人T淋巴细胞白血病(adult T-cell leukemia,ATL)的关系,尤其是人类T淋巴细胞白血病1型病毒的感染、复制及致病机制进行了综述.HTLV-1属于逆转录病毒,它的感染可导致成人T细胞白血病.HTLV-1病毒主要通过细胞与细胞间接触进行传播,并通过促进其感染细胞的增殖增加病毒拷贝数.病毒基因的调控及宿主免疫系统共同决定了体内HTLV-1病毒的载量.病毒编码的HBZ和Tax蛋白在ATL发生过程中发挥着至关重要的作用,它们在功能上相互配合,共同调节病毒的复制,诱导感染细胞增殖及病毒传播.对于HTLV-1病毒与ATL关系的深入研究,将对认识病毒和宿主的相互作用及相关传染性疾病的防治带来新的启示.
人类T淋巴细胞白血病1型病毒;成人T淋巴细胞白血病;HBZ蛋白;Tax蛋白
人类T淋巴细胞白血病1型病毒(HTLV-1)于1980年被首次发现[1],它与人类免疫缺陷病毒(human immunodeficiency virus,HIV)一样同属于逆转录病毒家族.研究表明,HTLV-1是成人T淋巴细胞白血病(ATL)的病原因子[2].此外,该病毒还能引发慢性进行性神经系统疾病——HTLV-1相关脊髓炎/热带痉挛性瘫痪(HAM/TSP),以及HTLV-1相关葡萄膜炎、感染性皮炎等自身免疫疾病[1].全世界大约有一两千万人感染HTLV-1病毒.该病毒主要流行于日本西南部、非洲、加勒比海地区和南美洲.我国感染HTLV-1的人群集中在福建沿海和广东某些地区[3].
HTLV-1主要通过3种途径传播:母婴传播、性传播和血液传播[4].HTLV-1具有一个显著特征,即:病毒主要通过细胞与细胞接触的方式传播,且感染的细胞必须是活细胞,游离病毒颗粒几乎无感染能力.在感染HTLV-1的病人体内有成千上万的病毒克隆,该病毒不仅存在于外周血中,而且存在于淋巴结、脾、胸腺等淋巴器官中[5].与之不同,人类免疫缺陷病毒HIV既可通过细胞和细胞接触传播,又可通过游离病毒颗粒传播.
1 HTLV-1的传播
在HTLV-1主要的3种传播途径中,母乳传播被认为是HTLV-1最主要的传播方式.HTLV-1阳性母亲的子女中HTLV-1阳性率可达25%,HTLV-1阳性儿童的母亲90%为HTLV-1感染者[6].一般认为,HTLV-1通过细胞与细胞间接触的方式传播(见图1),无细胞的血浆制品不传播该病毒.检测发现,母乳和精液等体液中含有大量HTLV-1感染的细胞.有报道表明,母乳中含有T细胞,其中大部分为效应T细胞和记忆T细胞,且均表达ICAM-1和LFA1[7],上述细胞中可检测到HTLV-1病毒.这些结果表明,HTLV-1感染可能赋予感染细胞一定的表型.HTLV-1是通过何种途径使HTLV-1感染细胞转变为效应/记忆T细胞的呢?HTLV-1反义链编码的HBZ蛋白可促进效应/记忆性T细胞及调节性T细胞数量增加[8].在表达Tax的转基因小鼠中,上述细胞类型则无明显的变化.可见,由HTLV-1 HBZ蛋白赋予T细胞的免疫表型,例如效应/记忆性T细胞、调节性T细胞和粘附增强分子,这些因素对病毒在体内的传播至关重要.这也表明,ATL细胞和HTLV-1感染细胞的免疫表型由HBZ而非Tax所决定.
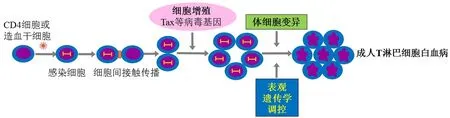
图1 HTLV-1感染及ATL发生的过程
HTLV-1是如何通过血脑屏障并侵入中枢神经系统(central nervous system,CNS)呢?最近有研究表明,HTLV-1病毒粒子主要通过转胞吞作用透过血脑屏障[9].HTLV-1病毒可感染血脑屏障中树突状细胞(dendritic cells,DC).感染HTLV-1病毒的树突状细胞可以迁移到引流淋巴结,并通过与T细胞间形成的病毒突触将病毒传递给CD4 T细胞[10].在体外,游离病毒颗粒很难感染T细胞,然而,游离病毒颗粒可以感染DC细胞.被感染的DC细胞可以传播HTLV-1病毒,这表明DC细胞是病毒在体内传播的媒介[11].粘附因子和共刺激因子的表达参与形成T细胞和树突状细胞之间的免疫突触[12].
此外,HTLV-1病毒诱导感染细胞数量的增加可提高病毒传播的几率[13-14].
2 病毒进入细胞及其在细胞间的传播
与HIV病毒不同,HTLV-1能够感染多种类型的细胞,如T淋巴细胞、B淋巴细胞、成纤维细胞和巨噬细胞等[11,15].其原因在于HTLV-1病毒的受体为细胞表面普遍表达的生物大分子[15].据报道,HTLV-1病毒的外壳蛋白可与3种细胞信号分子,如硫酸乙酰肝素蛋白多糖(HSPG)[16]、神经菌毛素1(NRP-1)[17]及葡萄糖转运蛋白1型(GLUT-1)[18]相互作用,从而进入细胞.在HTLV-1病毒进入细胞的过程中,HTLV-1病毒抗原可与这些分子形成复杂的构象.首先,HTLV-1病毒外壳与HSPG结合,然后与神经纤毛蛋白-1结合形成稳定的复合物.之后,GLUT1与该复合物互作,并最终促使病毒进入宿主细胞[19].
体外实验表明,游离的HTLV-1病毒颗粒几乎没有感染能力,而正常细胞与HTLV-1感染细胞共培养后更容易感染HTLV-1病毒[20].据文献[21]报道:细胞接触所介导的HTLV-1病毒感染效率是病毒粒子所介导感染效率的10 000倍;而对于HIV病毒,通过细胞接触介导的感染效率仅为病毒颗粒介导感染的2倍.目前普遍被接受的HTLV-1感染机制有3种:1)病毒学突触模型[22];2)生物膜模型[23];3)细胞导管模型[24].HTLV-1感染细胞与未感染细胞接触后形成突触,病毒蛋白和RNA通过细胞间突触进入靶细胞,其中膜蛋白ICAM-1和LFA-1共同参与突触的形成.HTLV-1编码的Tax蛋白促进突触的形成,且在微管的重定位中起重要的作用[25].通过上述调控方式,Tax促进病毒通过细胞与细胞间的接触性传播[21].此外,也有证据支持病毒传播的生物膜模型.HTLV-1感染的T细胞保留病毒诱导的细胞质基质成分,包括胶原蛋白、蛋白聚糖、抗病毒因子及半乳凝素-3等[23],通过细胞接触,这些病毒组件粘附其他细胞,诱导相邻细胞感染HTLV-1病毒.对于细胞导管模型,研究发现一种p8蛋白,能够增加T细胞之间的接触关联,建立T细胞网络,促进HTLV-1病毒的传播.因此,p8蛋白可诱导细胞管道,保证病毒传播,同时避免宿主的免疫监视.目前,p8蛋白也作为HTLV-1病毒治疗策略的相关靶点[24].
3 HTLV-1感染细胞的克隆性增殖
在体内,HTLV-1病毒主要感染CD4 T细胞,并通过细胞与细胞间接触及树突状细胞依赖的方式进行传播.有研究表明,HTLV-1感染细胞的早期阶段会形成一个感染细胞池[26].运用免疫缺陷小鼠模型发现:HTLV-1病毒感染细胞一周之后使用逆转录酶抑制剂泰诺福韦(TDF)或齐多夫定(AZT)处理,并不能阻止或减少HTLV-1的前病毒载量;而在HTLV-1病毒感染的同时注射TDF或AZT则能有效阻断HTLV-1病毒的感染[27].这些结果表明,HTLV-1感染细胞池在感染的早期阶段就产生了.HTLV-1感染后,机体内感染细胞的克隆化增殖占主导地位.同样,在临床实验也发现,逆转录酶抑制剂和整合酶抑制剂的联用并不能改变感染者体内HTLV-1病毒的载量[28-29].
感染的早期阶段,HTLV-1感染细胞克隆的量受宿主免疫攻击和病毒基因表达量两个因素的共同影响.HTLV-1感染细胞的克隆在早期阶段不稳定,但在感染的后期逐渐稳定[30],表明HTLV-1的感染在早期感染阶段受宿主的选择调控,而后期筛选后的细胞则会稳定存在于宿主体内.
HTLV-1为单股RNA病毒.HTLV-1进入人体淋巴细胞后就与其他逆转录病毒一样,病毒RNA经自身的逆转录酶作用逆转录为cDNA,同时这种前病毒DNA被随机整合到宿主细胞基因组DNA中.
理论上,每个感染性克隆均有不同的整合位点,可用于分析HTLV-1病毒的克隆形成能力.新一代测序技术可以显示出整合位点的分布情况,也可定量分析感染细胞中的克隆性增殖情况.研究发现,典型的HTLV-1感染个体中可能会出现成千上万个感染性克隆[31].反向PCR方法已被用于鉴定HTLV-1整合位点[32-33].此外,高通量测序技术也可用于分析HTLV-1病毒的克隆形成能力[34].研究发现,HAM/TSP患者与无症状携带者相比具有更高的病毒载量.人们通过高通量测序发现,HAM/TSP患者与无症状携带者在单一病毒感染的克隆数量上无差异,但HAM/TSP患者中被感染的克隆数较多[34].相比之下,同时感染HTLV-1和类圆线虫属或同时感染HTLV-1和皮炎(IDH)的患者中特定的病毒感染克隆数目增加[35].另外,值得注意的是,IDH患者和HTLV-1携带且感染类圆线虫属的人中,患ATL的人数相对较多,而HAM/TSP患者中ATL发生的机率并不高[36].因此,克隆丰度及细胞分裂次数增多对于ATL的发生具有重要的作用.
HTLV-1感染细胞的分裂受哪些因素调控?HBZ基因在ATL和HTLV-1感染的细胞中广泛表达,且HBZ具有促进细胞增殖的作用[37].此外,Tax基因可增强有丝分裂抗原受体信号[38-39].HBZ和Tax促进细胞增殖的机制相对比较复杂.现有研究发现,HBZ和Tax在调控与肿瘤发生相关的信号通路中具有相反的调控功能[40](见图2).例如:Tax可激活AP-1,NFAT和CREB信号通路,而HBZ则对上述信号通路具有抑制作用[41-42];另外,Tax可抑制TGF/Smad信号通路,而HBZ激活该通路[43];Tax激活经典和非经典的NF-κB信号通路[44],而HBZ选择性抑制p65介导的经典NF-κB途径;Tax除了可促进细胞增殖外,也可通过诱导p21和p27蛋白的表达,从而诱导细胞的衰老,而HBZ通过抑制p65的表达阻滞Tax介导的细胞衰老[45].除此之外,有报道表明,HBZ基因可以mRNA形式促进T细胞增殖[37].实验证实,HBZ通过形成二级茎环结构上调E2F1及其靶基因的表达,促进G1/S转换,进而促进肿瘤细胞的恶性增殖[46].该研究结果表明,HBZ可以mRNA和蛋白质2种形式参与调控白血病细胞的恶性增殖,促进成人T细胞白血病的发生.
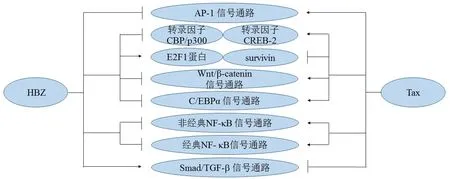
图2 HBZ与Tax在调控肿瘤相关信号通路中的作用
此外,有报道表明,HBZ通过抑制TCF1/LEF-1转录因子与DNA的结合从而抑制经典Wnt信号通路,而Tax蛋白则可激活Wnt信号通路.与之相反,HBZ能有效增强Wnt5a启动子的活性,促进其表达,进而活化非经典Wnt信号通路.在胸腺T细胞的发育过程中,Wnt经典信号通路是持续激活的;而在外周T细胞中,Wnt非经典信号通路是激活的.上述研究表明,HBZ通过调控Wnt信号通路调节外周T细胞的胞内环境,促进HTLV-1病毒的感染.
综上所述,HBZ和Tax通过复杂的相互作用共同调控着HTLV-1感染细胞的增殖.
4 病毒基因的转录调控
HTLV-1前病毒包括9 032个碱基对,具有逆转录病毒的典型结构,从HTLV-1 5′端的开放阅读框架到3′端,依次为5′LTR-gag-pro-pol-env-pX-3′LTR.HTLV-1前病毒编码调控基因(Tax和Rex)及pX区附属基因(P12,P13,P30和HBZ)共同参与调节病毒的复制和感染细胞的增殖[4].转录过程中,病毒两端的5′LTR和3′LTR作为病毒的启动子分别编码病毒的正链和负链.病毒正链编码所有的结构蛋白和病毒基因组RNA,因此,5′LTR的转录对病毒的复制和传播至关重要.Tax是HTLV-1正义链编码的一个调节病毒转录和复制的核心蛋白,Tax通过与细胞转录因子CREB的相互作用结合到病毒的启动子5′LTR上[47].5′LTR有3个21 bp的CRE重复序列,称为Tax反应元件(TRE).此外,Tax-CREB复合物还可以招募包括CREB结合蛋白CBP,P300和p300/CBP相关因子PCAF在内的组蛋白乙酰化转移酶到病毒5′LTR上,从而促进病毒蛋白的表达.除了Tax,一些细胞信号元件也可激活5′LTR.例如,通过激活T细胞受体信号可增强5′LTR启动子的活性[39,48].另有研究表明,凋亡信号也可诱导病毒转录[49].总之,HTLV-1 5′LTR的激活有助于病毒的传播,且帮助病毒逃避宿主细胞的免疫反应.
研究发现:在体内,HTLV-1病毒蛋白的复制往往被抑制[50];而经过体外培养后,HTLV-1感染细胞中包括Tax在内的病毒蛋白均快速表达[51].众所周知,宿主细胞内存在免疫监视系统,可通过监视病毒蛋白的表达从而清除被病毒感染的细胞.在HTLV-1病毒编码的病毒蛋白中,Tax是细胞杀伤T细胞(CTLs)最主要的靶蛋白[52],宿主体内存在着针对Tax蛋白的免疫反应.研究表明,在细胞体外培养条件下,如果将CD8 T细胞从外周血单个核细胞中去除,HTLV-1感染细胞中Tax的表达将上调[50].此外,病毒5′LTR的转录被抑制,表明还有其他机制也参与沉默病毒基因的转录[53].最近,研究发现HTLV-1可以通过自身编码的蛋白抑制病毒的复制.病毒蛋白P30和HBZ可通过与Tax竞争性结合CREB,进而抑制HTLV-1病毒的复制[54].同时,P30还能抑制Tax/Rex mRNA的表达[55].
除此之外,DNA甲基化和组蛋白修饰等表观遗传学修饰也参与到沉默HTLV-1基因表达的过程中.与HTLV-1不同,HIV的LTR存在较少的CpG位点,但同时存在脱氧核糖核酸酶超敏位点,这也解释了为什么HIV LTR能有效抵抗宿主的免疫沉默调控[56-57].然而,HTLV-1 LTR中存在多个CpG位点.因此,HTLV-1启动子容易被DNA甲基化,从而导致HTLV-1病毒转录受到抑制.研究发现,在HTLV-1携带者中,HTLV-1前病毒CpG位点的甲基化有升高的趋势,且随着ATL的发生,甲基化程度明显上调[58].由此可见,在ATL细胞中,Tax的表达常常因为HTLV-1 5′LTR的沉默及5′LTR的损伤而受到抑制[59-60].由于Tax蛋白是杀伤性T细胞的攻击靶点,因此,Tax的缺失可以使HTLV-1感染的白血病细胞有效逃避宿主的免疫攻击,从而实现感染细胞的无限增殖.最新研究发现,用组蛋白去乙酰化酶抑制剂丙戊酸钠(VPA)处理无症状的HTLV-1携带者和HAM/TSP病人样本后,病毒蛋白Tax和Gag蛋白的表达明显上调.这表明在病毒携带阶段,表观遗传学调控就已经参与到抑制病毒的转录过程中[61].
相较于5′LTR,3′LTR作为HTLV-1病毒负链的启动子则比较保守和稳定[62],且3′LTR中的CpG位点呈现去甲基化的状态,表明3′LTR所引起的反义链转录对HTLV-1致癌过程必不可少[58,63].研究发现,HTLV-1反义链编码HBZ基因.HBZ基因在几乎所有ATL病人样本中均持续高表达.有报道表明,在ATL中持续表达的通用转录因子SP1与HBZ及JunD可形成复合物,从而增强HBZ启动子的活性[62].这表明SP1在调控3′LTR启动子活力、维持HBZ持续表达中发挥重要的作用[64].另有研究发现,Tax可激活3′LTR启动子的活力[62].然而,Tax的这一调节机制尚不清楚.总之,3′LTR的转录调控及HBZ基因的高表达对于ATL的发生至关重要,其潜在机制及意义有待进一步深入研究.
5 宿主的免疫调节及感染细胞的增殖
HTLV-1前病毒载量主要由病毒的基因调控及宿主的免疫系统2种因素共同决定[65].如上所述,宿主对Tax具有很强的免疫反应,而对HBZ的免疫反应则较弱.研究发现,HTLV-1前病毒载量与HBZ的免疫反应密切相关.由于宿主对HBZ的免疫反应较弱,从而导致HTLV-1感染个体中具有较高的病毒载量.人们推测,HTLV-1病毒通过不断的突变及进化而降低了宿主免疫系统对HBZ的免疫反应,从而使HBZ蛋白在机体内持续稳定表达,进而通过HBZ的高表达促进感染细胞的增殖.与之相反,病毒蛋白Tax在ATL的发展进程中表达时限较短暂.虽然Tax对HTLV-1病毒的复制和病毒的传播是十分重要的,然而,由于Tax是机体免疫反应的主要靶点,因此HTLV-1病毒通过精密的调节机制抑制Tax的表达.因此,HTLV-1正是通过调控病毒蛋白的表达而与宿主免疫调节达到一定的平衡,最终由于长时间的遗传学和表观遗传学的改变而适应宿主体内的环境[5].
6 结 语
综上所述,HTLV-1病毒感染可引起成人T细胞白血病等相关疾病.HTLV-1病毒主要通过细胞与细胞接触传播.病毒蛋白HBZ和Tax通过协同调控病毒的转录和感染细胞的增殖而促进白血病的发生.HTLV-1诱导ATL发生的精确机制还有待进一步研究;而阐明HBZ和Tax的致癌功能和探索靶向HBZ和Tax的ATL治疗法,将为白血病的治疗提供新的方法和思路.
[1]Gallo R C.The discovery of the first human retrovirus:HTLV-1 and HTLV-2[J].Retrovirology,2005,2(1):17.
[2]Takatsuki K.Discovery of adult T-cell leukemia[J].Retrovirology,2005,2(1):16.
[3]Gessain A,Cassar O.Epidemiological aspects and world distribution of HTLV-1 infection[J].Frontiers in Microbiology,2012,3:388.
[4]Matsuoka M,Jeang K T.Human T-cell leukaemia virus type 1 (HTLV-1) infectivity and cellular transformation[J].Nat Rev Cancer,2007,7(4):270-280.
[5]Miyazato P,Matsuo M,Katsuya H,et al.Transcriptional and epigenetic regulatory mechanisms affecting HTLV-1 provirus[J].Viruses,2016,8(6):171.
[6]Hisada M,Maloney E M,Sawada T,et al.Virus markers associated with vertical transmission of human T lymphotropic virus type 1 in Jamaica[J].Clin Infect Dis,2002,34(12):1551-1557.
[7]Bertotto A,Gerli R,Fabietti G,et al.Human breast milk T lymphocytes display the phenotype and functional characteristics of memory T cells[J].Eur J Immunol,1990,20(8):1877-1880.
[8]Yasunaga J,Sakai T,Nosaka K,et al.Impaired production of naive T lymphocytes in human T-cell leukemia virus type I-infected individuals:Its implications in the immunodeficient state[J].Blood,2001,97(10):3177-3183.
[9]Martin-Latil S,Gnadig N F,Mallet A,et al.Transcytosis of HTLV-1 across a tight human epithelial barrier and infection of subepithelial dendritic cells[J].Blood,2012,120(3):572-580.
[10]Satou Y,Yasunaga J,Zhao T,et al.HTLV-1 bZIP factor induces T-cell lymphoma and systemic inflammation in vivo[J].PLoS Pathogens,2011,7(2):e1001274.
[11]Jones K S,Petrow-Sadowski C,Huang Y K,et al.Cell-free HTLV-1 infects dendritic cells leading to transmission and transformation of CD4(+) T cells[J].Nat Med,2008,14(4):429-436.
[12]Huppa J B,Davis M M.T-cell-antigen recognition and the immunological synapse[J].Nat Rev Immunol,2003,3(12):973-983.
[13]Makokha G N,Takahashi M,Higuchi M,et al.Human T-cell leukemia virus type 1 Tax protein interacts with and mislocalizes the PDZ domain protein MAGI-1[J].Cancer Science,2013,104(3):313-320.
[14]Campos K R,Goncalves M G,Caterino-De-Araujo A.Failures in detecting HTLV-1 and HTLV-2 in patients infected with HIV-1[J].AIDS Research and Human Retroviruses,2016,33(4):382-385.
[15]Koyanagi Y,Itoyama Y,Nakamura N,et al.In vivo infection of human T-cell leukemia virus type I in non-T cells[J].Virology,1993,196(1):25-33.
[16]Jones K S,Petrow-Sadowski C,Bertolette D C,et al.Heparan sulfate proteoglycans mediate attachment and entry of human T-cell leukemia virus type 1 virions into CD4+ T cells[J].J Virol,2005,79(20):12692-12702.
[17]Ghez D,Lepelletier Y,Lambert S,et al.Neuropilin-1 is involved in human T-cell lymphotropic virus type 1 entry[J].J Virol,2006,80(14):6844-6854.
[18]Manel N,Kim F J,Kinet S,et al.The ubiquitous glucose transporter GLUT-1 is a receptor for HTLV[J].Cell,2003,115(4):449-459.
[19]Jones K S,Lambert S,Bouttier M,et al.Molecular aspects of HTLV-1 entry:Functional domains of the HTLV-1 surface subunit (SU) and their relationships to the entry receptors[J].Viruses,2011,3(6):794-810.
[20]Derse D,Hill S A,Lloyd P A,et al.Examining human T-lymphotropic virus type 1 infection and replication by cell-free infection with recombinant virus vectors[J].J Virol,2001,75(18):8461-8468.
[21]Mazurov D,Ilinskaya A,Heidecker G,et al.Quantitative comparison of HTLV-1 and HIV-1 cell-to-cell infection with new replication dependent vectors[J].PLoS Pathogens,2010,6(2):e1000788.
[22]Igakura T,Stinchcombe J C,Goon P K,et al.Spread of HTLV-1 between lymphocytes by virus-induced polarization of the cytoskeleton[J].Science,2003,299(5613):1713-1716.
[23]Pais-Correia A M,Sachse M,Guadagnini S,et al.Biofilm-like extracellular viral assemblies mediate HTLV-1 cell-to-cell transmission at virological synapses[J].Nat Med,2010,16(1):83-89.
[24]Van Prooyen N,Gold H,Andresen V,et al.Human T-cell leukemia virus type 1 p8 protein increases cellular conduits and virus transmission[J].Proc Natl Acad Sci USA,2010,107(48):20738-20743.
[25]Nejmeddine M,Barnard A L,Tanaka Y,et al.Human T-lymphotropic virus,type 1,tax protein triggers microtubule reorientation in the virological synapse[J].J Biol Chem,2005,280(33):29653-29660.
[26]Satou Y,Matsuoka M.Molecular and cellular mechanism of leukemogenesis of ATL:Emergent evidence of a significant role for HBZ in HTLV-1-induced pathogenesis[J].Leuk Res Treatment,2012,2012:213653.
[27]Miyazato P,Yasunaga J,Taniguchi Y,et al.De novo human T-cell leukemia virus type 1 infection of human lymphocytes in NOD-SCID,common gamma-chain knockout mice[J].J Virol,2006,80(21):10683-10691.
[28]Taylor G P,Goon P,Furukawa Y,et al.Zidovudine plus lamivudine in Human T-Lymphotropic Virus type-I-associated myelopathy:A randomised trial[J].Retrovirology,2006,3(1):1-9.
[29]Trevino A,Parra P,Bar-Magen T,et al.Antiviral effect of raltegravir on HTLV-1 carriers[J].J Antimicrob Chemother,2012,67(1):218-221.
[30]Okayama A,Stuver S,Matsuoka M,et al.Role of HTLV-1 proviral DNA load and clonality in the development of adult T-cell leukemia/lymphoma in asymptomatic carriers[J].Int J Cancer,2004,110(4):621-625.
[31]Bangham C R,Cook L B,Melamed A.HTLV-1 clonality in adult T-cell leukaemia and non-malignant HTLV-1 infection[J].Semin Cancer Biol,2014,26(6):89-98.
[32]Etoh K,Tamiya S,Yamaguchi K,et al.Persistent clonal proliferation of human T-lymphotropic virus type 1-infected cells in vivo[J].Cancer Res,1997,57(21):4862-4867.
[33]Wattel E,Vartanian J P,Pannetier C,et al.Clonal expansion of human T-cell leukemia virus type I-infected cells in asymptomatic and symptomatic carriers without malignancy[J].J Virol,1995,69(5):2863-2868.
[34]Gillet N A,Malani N,Melamed A,et al.The host genomic environment of the provirus determines the abundance of HTLV-1-infected T-cell clones[J].Blood,2011,117(11):3113-3122.
[35]Gillet N A,Cook L,Laydon D J,et al.Strongyloidiasis and infective dermatitis alter human T lymphotropic virus-1 clonality in vivo[J].PLoS Pathog,2013,9(4):e1003263.
[36]Nakada K,Yamaguchi K,Furugen S,et al.Monoclonal integration of HTLV-I proviral DNA in patients with strongyloidiasis[J].Int J Cancer,1987,40(2):145-148.
[37]Satou Y,Yasunaga J,YoshidA M,et al.HTLV-I basic leucine zipper factor gene mRNA supports proliferation of adult T cell leukemia cells[J].Proc Natl Acad Sci USA,2006,103(3):720-725.
[38]Maruyama M,Shibuya H,Harada H,et al.Evidence for aberrant activation of the interleukin-2 autocrine loop by HTLV-1-encoded p40x and T3/Ti complex triggering[J].Cell,1987,48(2):343-350.
[39]Swaims A Y,Khani F,Zhang Y,et al.Immune activation induces immortalization of HTLV-1 LTR-Tax transgenic CD4+ T cells[J].Blood,2010,116(16):2994-3003.
[40]Matsuoka M,Jeang K T.Human T-cell leukemia virus type 1 (HTLV-1) and leukemic transformation:Viral infectivity,Tax,HBZ and therapy[J].Oncogene,2011,30(12):1379-1389.
[41]Sugata K,Satou Y,Yasunaga J,et al.HTLV-1 bZIP factor impairs cell-mediated immunity by suppressing production of Th1 cytokines[J].Blood,2012,119(2):434-444.
[42]Grassmann R,Aboud M,Jeang K T.Molecular mechanisms of cellular transformation by HTLV-1 Tax[J].Oncogene,2005,24(39):5976-5985.
[43]Zhao T,Satou Y,Sugata K,et al.HTLV-1 bZIP factor enhances TGF-beta signaling through p300 coactivator[J].Blood,2011,118(7):1865-1876.
[44]Sun S C,Yamaoka S.Activation of NF-kappaB by HTLV-I and implications for cell transformation[J].Oncogene,2005,24(39):5952-5964.
[45]Zhi H,Yang L,Kuo Y L,et al.NF-kappaB hyper-activation by HTLV-1 tax induces cellular senescence,but can be alleviated by the viral anti-sense protein HBZ[J].PLoS Pathog,2011,7(4):e1002025.
[46]Mitobe Y,Yasunaga J,Furuta R,et al.HTLV-1 bZIP factor RNA and protein impart distinct functions on T-cell proliferation and survival[J].Cancer Research,2015,75(19):4143-4152.
[47]Kashanchi F,Brady J N.Transcriptional and post-transcriptional gene regulation of HTLV-1[J].Oncogene,2005,24(39):5938-5951.
[48]Lin H C,Hickey M,Hsu L,et al.Activation of human T cell leukemia virus type 1 LTR promoter and cellular promoter elements by T cell receptor signaling and HTLV-1 Tax expression[J].Virology,2005,339(1):1-11.
[49]Abou-Kandil A,Chamias R,Huleihel M,et al.Role of caspase 9 in activation of HTLV-1 LTR expression by DNA damaging agents[J].Cell Cycle,2011,10(19):3337-3345.
[50]Hanon E,Hall S,Taylor G P,et al.Abundant tax protein expression in CD4+ T cells infected with human T-cell lymphotropic virus type I (HTLV-I) is prevented by cytotoxic T lymphocytes[J].Blood,2000,95(4):1386-1392.
[51]Umadome H,Uchiyama T,Hori T,et al.Close association between interleukin 2 receptor mRNA expression and human T cell leukemia/lymphoma virus type I viral RNA expression in short-term cultured leukemic cells from adult T cell leukemia patients[J].J Clin Invest,1988,81(1):52-61.
[52]Kannagi M,Harada S,Maruyama I,et al.Predominant recognition of human T cell leukemia virus type I (HTLV-I) pX gene products by human CD8+ cytotoxic T cells directed against HTLV-I-infected cells[J].Int Immunol,1991,3(8):761-767.
[53]Furuta R A,SugiurA K,Kawakita S,et al.Mouse model for the equilibration interaction between the host immune system and human T-cell leukemia virus type 1 gene expression[J].J Virol,2002,76(6):2703-2713.
[54]Yasunaga J,Matsuoka M.Leukaemogenic mechanism of human T-cell leukaemia virus type I[J].Rev Med Virol,2007,17(5):301-311.
[55]Nicot C,Dundr M,Johnson J M,et al.HTLV-1-encoded p30II is a post-transcriptional negative regulator of viral replication[J].Nat Med,2004,10(2):197-201.
[56]Pion M,Jordan A,Biancotto A,et al.Transcriptional suppression of in vitro-integrated human immunodeficiency virus type 1 does not correlate with proviral DNA methylation[J].J Virol,2003,77(7):4025-4032.
[57]Verdin E.DNase I-hypersensitive sites are associated with both long terminal repeats and with the intragenic enhancer of integrated human immunodeficiency virus type 1[J].J Virol,1991,65(12):6790-6799.
[58]Taniguchi Y,Nosaka K,Yasunaga J,et al.Silencing of human T-cell leukemia virus type I gene transcription by epigenetic mechanisms[J].Retrovirology,2005,2(1):1-16.
[59]Fan J,Ma G,Nosaka K,et al.APOBEC3G generates nonsense mutations in human T-cell leukemia virus type 1 proviral genomes in vivo[J].J Virol,2010,84(14):7278-7287.
[60]Takeda S,Maeda M,Morikawa S,et al.Genetic and epigenetic inactivation of tax gene in adult T-cell leukemia cells[J].Int J Cancer,2004,109(4):559-567.
[61]Belrose G,Gross A,Olindo S,et al.Effects of valproate on Tax and HBZ expression in HTLV-1 and HAM/TSP T lymphocytes[J].Blood,2011,118(9):2483-2491.
[62]Yoshida M,Satou Y,Yasunaga J,et al.Transcriptional control of spliced and unspliced human T-cell leukemia virus type 1 bZIP factor (HBZ) gene[J].J Virol,2008,82(19):9359-9368.
[63]Miyazaki M,Yasunaga J,Taniguchi Y,et al.Preferential selection of human T-cell leukemia virus type 1 provirus lacking the 5′ long terminal repeat during oncogenesis[J].J Virol,2007,81(11):5714-5723.
[64]Saito M,Matsuzaki T,Satou Y,et al.In vivo expression of the HBZ gene of HTLV-1 correlates with proviral load,inflammatory markers and disease severity in HTLV-1 associated myelopathy/tropical spastic paraparesis (HAM/TSP)[J].Retrovirology,2009,6:19.
[65]Bangham C R,Meekings K,Toulza F,et al.The immune control of HTLV-1 infection:Selection forces and dynamics[J].Front Biosci (Landmark Ed),2009,14:2889-2903.
(责任编辑 薛 荣)
Research progress in human T-cell leukemia virus type 1 and its mechanisms of oncogenesis
CHEN Mengyun, SONG Zaowen, FANG Jinyong, XU Lingling, ZHAO Tiejun
(CollegeofChemistryandLifeSciences,ZhejiangNormalUniversity,Jinhua321004,China)
It was summarized the relationship between human T-cell leukemia virus type 1 (HTLV-1) and adult T-cell leukemia (ATL), especially HTLV-1 infection, replication and its mechanisms of oncogenesis. HTLV-1 was a retrovirus that could cause ATL. HTLV-1 transmited mainly by cell-to-cell contact, and it increased copy number of the virus through promoting the proliferation of infected cells. Regulation of viral genes and the host immune system cooperatively determined viral load of HTLV-1. In the developments of ATL, HTLV-1 encoded HBZ and Tax proteins synergistically regulated viral replication and promoted the proliferation of infected cells. Efforts on the researches of HTLV-1 and ATL would give new insights into virus-host interactions and therapy of related diseases.
human T-cell leukemia virus type 1 (HTLV-1); adult T-cell leukemia (ATL); HBZ; Tax
10.16218/j.issn.1001-5051.2017.03.013
�2016-10-25;
2017-02-21
国家自然科学基金资助项目(31470262);浙江省科技厅公益技术应用研究计划项目(2015C33149)
陈梦云(1991-),女,安徽宿州人,硕士研究生.研究方向:分子细胞生物学.
赵铁军.E-mail: tjzhao@zjnu.cn>
R373.9;Q291
A
1001-5051(2017)03-0324-07
