胞内分枝杆菌及偶发分枝杆菌对小鼠巨噬细胞凋亡的影响
2019-05-20张丽娇赵彤彤梁云霞王春芳王春凤钱爱东
张丽娇,赵彤彤,梁云霞,王春芳,王春凤,钱爱东
(1. 长春师范大学生命科学学院,吉林长春130032 ; 2. 吉林农业大学动物科学学院,吉林长春130000)
目前非结核分枝杆菌(Nontuberculous Mycobacterium,NTM)感染及其致病性越来越受到重视,有报道证实,新金色分枝杆菌可引发肺部感染,嗜血分枝杆菌引发眼内炎、泪囊炎和颈面部淋巴结炎等等[1-5]。分枝杆菌感染机体后,第一步感染巨噬细胞,通过与宿主细胞的斗争最终存活下来,并且增殖[6]。但关于NTM与巨噬细胞的相互作用方面研究尚少,本试验主要观察由吉林农业大学免疫与微生物实验室分离鉴定出来的胞内分枝杆菌、偶发分枝杆菌对巨噬细胞系RAW264.7凋亡率及TNF-α及IL-10表达的影响,并且观察了这2株菌在小鼠巨噬细胞中的吞噬及增殖情况。对进一步明确NTM与宿主巨噬细胞的作用机制以及NTM疾病的发病机理、制定治疗措施具有重要意义。
1 材料与方法
1.1 材料 1株胞内分枝杆菌,1株偶发分枝杆菌均由吉林农业大学免疫与微生物实验室分离鉴定;C57BL/6小鼠,雌性,6周龄,北京华阜康生物科技股份有限公司; RPMI1640培养基、胎牛血清,Hyclone公司;7H9 培养基,BD公司;Triton X-100,北京索莱宝科技有限公司;荧光素双醋酸酯(FDA),Sigma公司;AnnexinV/PI 细胞凋亡检测试剂盒,BD公司;TNF-α、IL-10的ELISA检测试剂盒,R&D公司。
1.2 方法
1.2.1 胞内分枝杆菌及偶发分枝杆菌在小鼠巨噬细胞中的吞噬及增殖 按常规方法制备小鼠骨髓巨噬细胞[7],接种至24孔板( 5×105个/孔)。分成胞内分枝杆菌组、偶发分枝杆菌组及空白对照组,菌体( 5×106个/孔)与巨噬细胞作用2 h 后,清洗,加入 RPMI1640 培养基(含阿米卡星 20 μg/mL),在感染后的 1、3、5、7 d,以 PBS (含0.1% Triton X-100) 裂解细胞,收集菌体。7H9 培养基培养菌体,检测胞内分枝杆菌及偶发分枝杆菌在细胞中的增殖数量,计算吞噬率,吞噬率=被吞噬的菌数/细胞总数[8-9]。另外,感染1 d时收集的菌体,用FDA(0.5 μg/mL)染色,倒置荧光显微镜下观察。
1.2.2 胞内分枝杆菌及偶发分枝杆菌对巨噬细胞系RAW264.7凋亡率的影响 RAW264.7细胞(5×105个/孔)放在12孔培养板中,分成胞内分枝杆菌组、偶发分枝杆菌组及空白对照组,培养24 h后在每孔加细菌5×106个。4 h后,用PBS洗去没有被吞噬的菌体,加入培养基,其中含阿米卡星(20 μg/mL),之后使用AnnexinV/PI 细胞凋亡检测试剂盒,流式细胞仪检测不同时间(0 h、4 h、12 h、24 h、48 h)各组细胞凋亡率。
1.2.3 胞内分枝杆菌及偶发分枝杆菌对RAW264.7 细胞TNF-α、IL-10表达的影响 按照说明书用ELISA法检测RAW264.7细胞感染后各组不同时间点(0 h、4 h、12 h、24 h、48 h)培养上清中TNF-α及IL-10的表达,最后用酶标仪于450 nm波长处检测OD值。
1.2.4 数据分析 作图及数据分析用Graphpad Prism 5.0软件。组间差异用t检验。
2 结果
2.1 胞内分枝杆菌及偶发分枝杆菌在小鼠巨噬细胞中的吞噬及增殖 感染第1天,2株NTM都被小鼠骨髓巨噬细胞所吞噬,胞内分枝杆菌的吞噬率高于偶发分枝杆菌(表1)。在倒置荧光显微镜下同样观察到2株NTM被巨噬细胞吞噬(见中插彩版图1)。

图1 NTM在小鼠骨髓巨噬细胞中的吞噬情况
a: 胞内分枝杆菌 ; b: 偶发分枝杆菌
2株菌感染3、5、7 d后增殖明显,胞内分枝杆菌在巨噬细胞中增殖速度比偶发分枝杆菌快(P<0.01)(图2)。
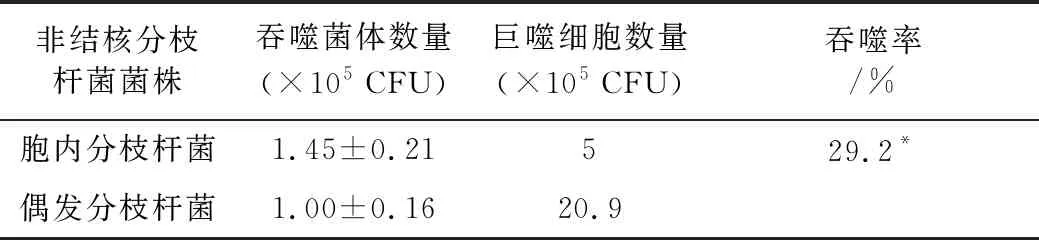
表1 非结核分枝杆菌感染小鼠骨髓巨噬细胞的吞噬率
与偶发分枝杆菌组比较, *P<0.05
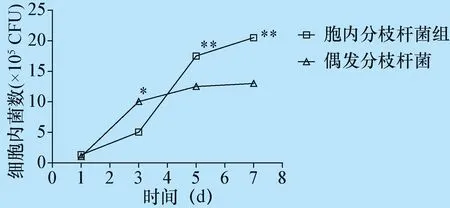
图2 NTM在小鼠骨髓巨噬细胞中的增殖情况
2.2 胞内分枝杆菌及偶发分枝杆菌对巨噬细胞系RAW264.7凋亡率的影响 如图3所示,感染0 h,胞内分枝杆菌组、偶发分枝杆菌组及空白对照组差异不显著。随着时间延长,各感染组凋亡率开始升高,与空白对照组差异极显著(P<0.001),其中偶发分枝杆菌组凋亡率升高最明显,其次是胞内分枝杆菌组。凋亡率的高低可能与菌体毒力有关。
2.3 胞内分枝杆菌及偶发分枝杆菌对RAW264.7 细胞TNF-α、IL-10表达的影响 收集RAW264.7细胞上清液ELISA法检测TNF-α、IL-10表达的变化,在 4 h、12 h,胞内分枝杆菌组及偶发分枝杆菌组TNF-α的表达值与空白对照组相比都较高,差异显著(P<0.05),并且胞内分枝杆菌组TNF-α的表达量高于偶发分枝杆菌组,差异显著(P<0.05);但在24 h、48 h,2个试验组TNF-α表达值下降明显,与对照组差异不显著(P>0.05)(图4)。在4 h、12 h,胞内分枝杆菌组及偶发分枝杆菌组IL-10的表达值与空白对照组相比都较高,差异显著(P<0.05),并且下降不明显,保持高表达,并且胞内分枝杆菌组IL-10的表达量高于偶发分枝杆菌组,差异显著(P<0.05)(图5)。

图3 NTM对巨噬细胞凋亡率的影响
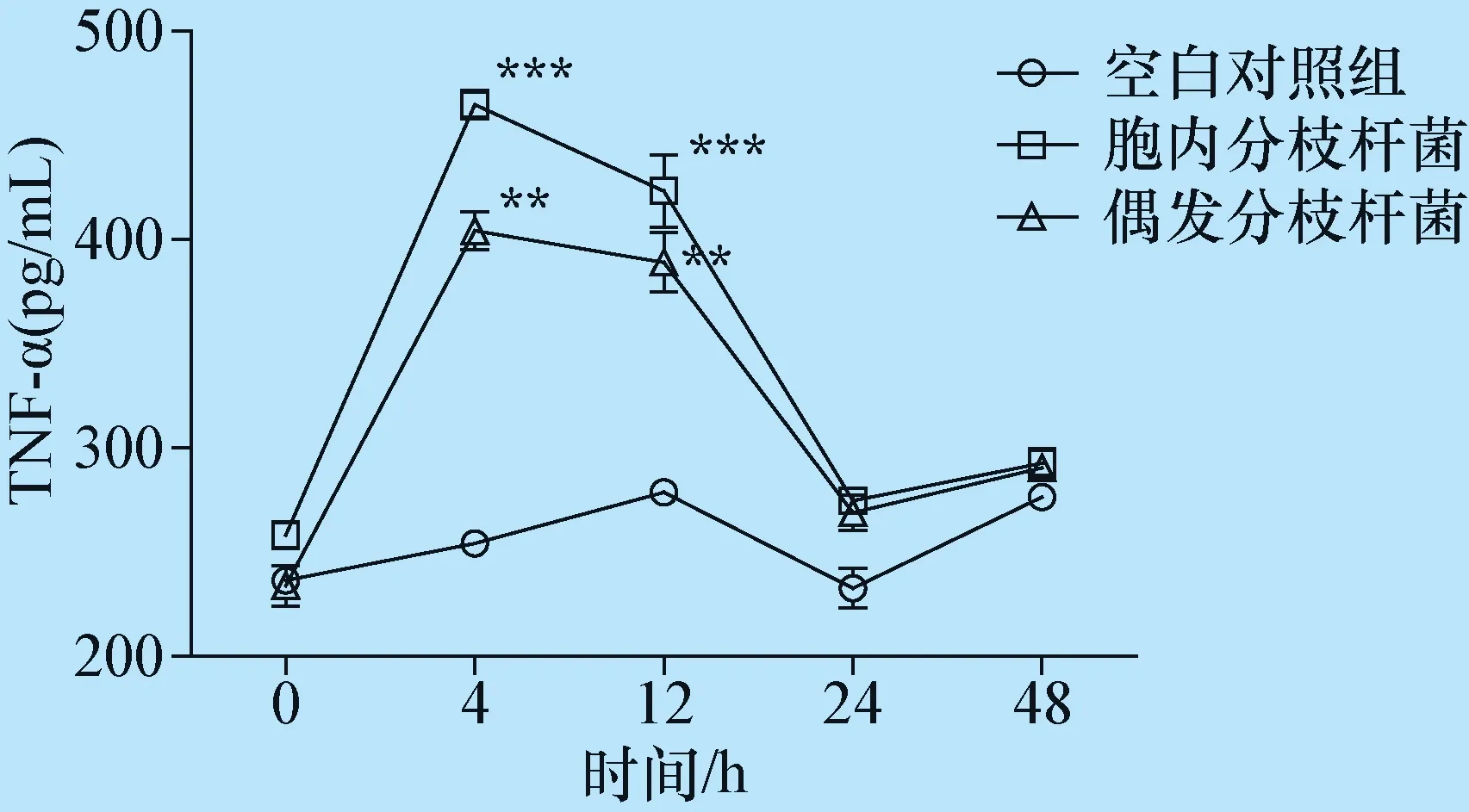
图4 NTM对RAW264.7细胞TNF-α表达的影响
与空白对照组比较, *P<0.05, **P<0.01,***P<0.001
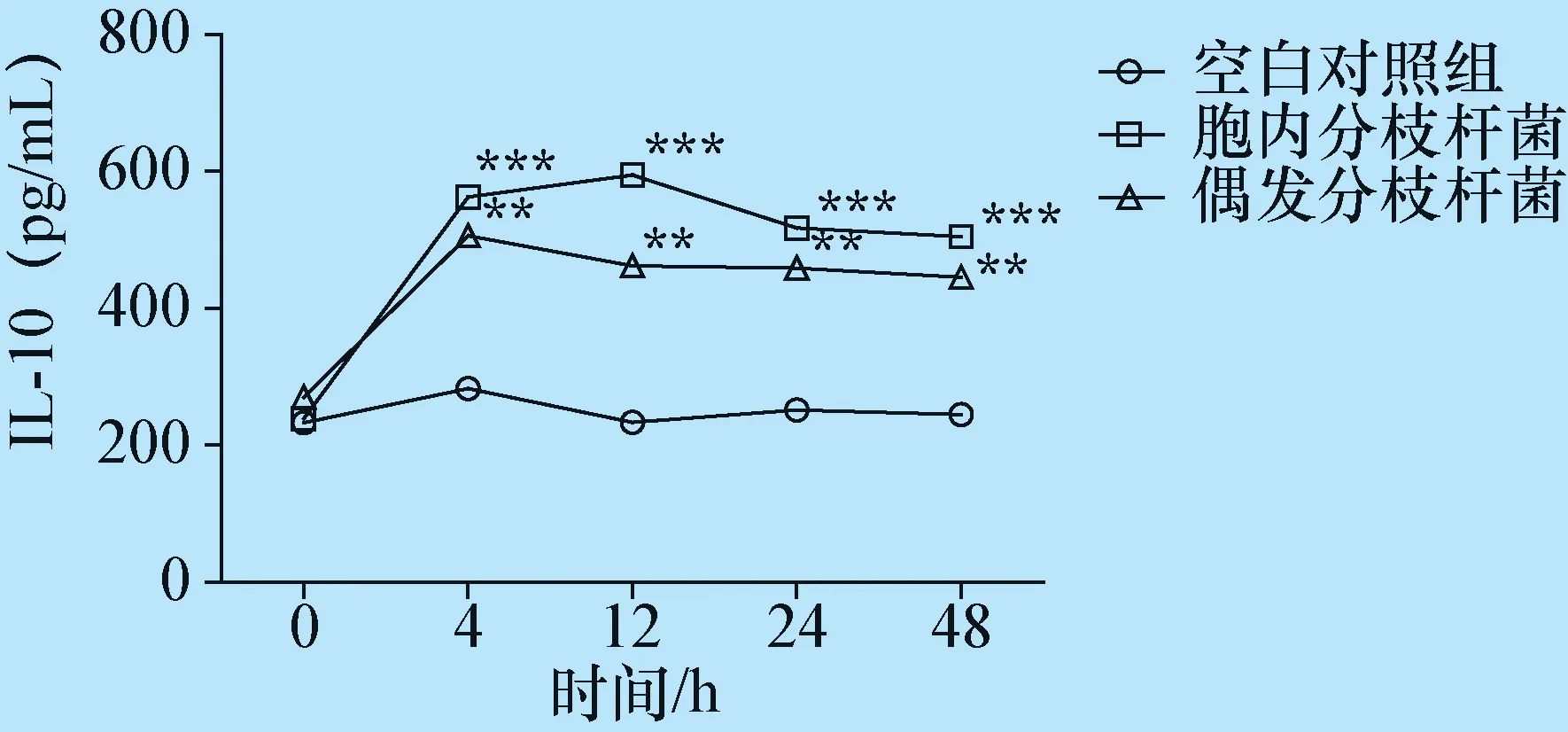
图5 NTM对RAW264.7细胞IL-10表达的影响
与空白对照组比较, *P<0.05 ,**P<0.01 ,***P<0.001
3 讨论
有研究证明,结核分枝杆菌强毒株在巨噬细胞中的存活及繁殖能力要高于弱毒株[10]。因此,分枝杆菌在巨噬细胞中的生存状态及数量可以作为评价菌株毒力高低的一个重要指标;有研究发现,腹腔巨噬细胞对强毒株H37Ra的吞噬率高于灭活菌H37Rv[9],说明巨噬细胞对分枝杆菌的吞噬率也是验证菌体毒力及易感性的一个重要标准。
为了探究非结核分枝杆菌感染巨噬细胞后的增殖情况,我们观察了小鼠骨髓巨噬细胞吞噬胞内分枝杆菌、偶发分枝杆菌的情况,并且在1、3、5、7 d检测NTM在巨噬细胞中的数量。结果发现,不同菌体感染后的增殖情况各有不同,可能与其毒力有关,在感染过程中2株菌都被吞噬并在细胞中增殖,胞内分枝杆菌相比于偶发分枝杆菌吞噬数量及增殖都更为显著。我们推测胞内分枝杆菌毒力及易感性均高于偶发分枝杆菌。
巨噬细胞通过凋亡来抑制菌体的感染是一种常见的方式,有相关研究表明,不同的菌体感染巨噬细胞后引起的凋亡率不同[11-13]。这可能与菌体的毒力相关,但菌体种类繁多,我们还需要深入研究相关机制。因此,我们用胞内分枝杆菌和偶发分枝杆菌感染RAW264.7巨噬细胞。结果显示,胞内分枝杆菌和偶发分枝杆菌都引起了巨噬细胞的凋亡。胞内分枝杆菌组凋亡率高于偶发分枝杆菌组。更进一步说明凋亡率和毒力的关系,推测是由于胞内分枝杆菌的毒力更强所以引起的凋亡率反而更低。
分枝杆菌感染巨噬细胞后,会引起很多细胞因子的分泌,TNF-α属于炎性细胞因子,促进保护性免疫[14]。而IL-10属于抑制性细胞因子,阻碍细胞免疫[15]。我们分析了这2个重要的细胞因子在胞内分枝杆菌和偶发分枝杆菌感染巨噬细胞过程中的变化。结果显示,在感染初期,胞内分枝杆菌和偶发分枝杆菌都引起了这2种细胞因子的高表达,显著高于空白对照组,但后期,TNF-α的表达量开始下降,而IL-10持续高表达。IL-10持续高表达有可能是炎性因子TNF-α表达下降的原因。并且胞内分枝杆菌在整个过程中细胞因子的表达量都较高,这也可能与毒力相关。
目前关于NTM与巨噬细胞相互作用的机制的研究还不够深入,本试验为NTM与宿主巨噬细胞调控作用的机制研究奠定基础。
