碳源饥饿对癌细胞和正常细胞增殖的影响*
2017-09-08苏佳佳邵邻相
苏佳佳, 曾 杰, 邵邻相
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
碳源饥饿对癌细胞和正常细胞增殖的影响*
苏佳佳, 曾 杰, 邵邻相
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
研究了共培养条件下碳源饥饿对癌细胞和正常细胞形态、生长和凋亡的影响.采用细胞体外共培养的方法,实验分4组:对照组(25 mmol/L葡萄糖)及5,1和0 mmol/L葡萄糖组,分别处理共培养条件下的HeLa癌细胞和人脐带正常细胞,在倒置显微镜下观察细胞的形态与生长,吖啶橙/溴乙锭(AO/EB)双重荧光染色检测凋亡细胞的形态及数量.结果表明:对照组HeLa癌细胞和人脐带正常细胞都分布均匀,贴壁性好,形态饱满,多呈规则的梭形或多角形,折光性好,AO/EB双染绿色荧光分布均匀;实验组糖浓度越低,细胞存活时间越短,细胞收缩变圆并逐渐凋亡,AO/EB双染细胞由绿色荧光逐渐变为橙黄色荧光;相同糖浓度条件下人脐带正常细胞比HeLa癌细胞存活时间更长.说明碳源饥饿使癌细胞先于正常细胞死亡.
碳源饥饿;HeLa癌细胞;人脐带正常细胞;增殖;凋亡
细胞的生长需要充足的营养物质.Warburg[1]发现,肝癌细胞比正常细胞的糖酵解代谢途径活跃,甚至在氧气充足的条件下,肿瘤细胞仍需大量摄取葡萄糖并优先进行糖酵解,从而为癌细胞的快速生长和侵袭转移提供能量.Hanahan等[2]认为,肿瘤细胞利用有氧糖酵解的特殊糖代谢方式,与正常细胞竞争能量时占据优势地位.与氧化磷酸化途径相比,糖酵解途径的产能效率低,肿瘤细胞需从细胞外环境摄取的葡萄糖的量大约是正常细胞的10多倍[3-4].当体内糖源耗尽后,正常细胞将转向消耗脂肪和酮体,但肿瘤细胞不能利用脂肪酸或酮体.基于此特点,可以通过最大限度地限制葡萄糖供应而降低癌细胞的增殖[5-7].
本实验室前期工作已表明,碳源饥饿能够显著抑制HeLa癌细胞的增殖[8-9].为了比较碳源饥饿对HeLa癌细胞和人脐带正常细胞生长的影响,本实验通过低糖处理共培养下的HeLa癌细胞和人脐带正常细胞,比较了HeLa癌细胞和人脐带正常细胞的生长增殖情况,为碳源饥饿用于癌症治疗提供科学依据.
1 材料与方法
1.1 主要试剂与仪器
HeLa癌细胞株购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所(SICB);脐带取自浙江省金华市中心医院.高糖DMEM培养基、胰蛋白酶购自美国Gibco公司;胎牛血清购自兰州百灵生物技术有限公司;无糖DMEM培养基、葡萄糖、青霉素、链霉素购自Sigma公司.细胞培养板购自NEST公司;其他常规试剂均购自金华市医药公司.TS-100型倒置显微镜、荧光显微镜购自日本尼康公司;3111型CO2细胞培养箱购自美国热电公司.
1.2 原代脐带细胞分离与培养
将收集的细胞用完全培养基重悬,然后接种至培养瓶进行细胞培养.用含冷磷酸盐缓冲液的蓝盖瓶从医院收取脐带,冰盒 4 ℃下带回实验室,在无菌工作台将脐带在蓝盖瓶中清洗一遍,用镊子夹出,放入已装好磷酸盐缓冲液的10 cm培养皿中清洗后转入第2个培养皿中,清洗,挤出脐带中的血液,切除脐带一端2 cm或2 cm以上包括动脉夹痕迹处,转入第3个皿中,用刀将脐带交叉切成1~2 mm3左右的小块,用弯头镊子将组织移入离心管内,用磷酸盐缓冲液重悬清洗组织块,使组织块沉降,去除上清液.如此重复2次以上.将1 mm3及更小的组织块转入1号细胞培养瓶内,2 mm3及更小的组织块转入2号细胞培养瓶内,比2 mm3大一点的组织块转入3号细胞培养瓶内,其他组织块转入4号细胞培养瓶内,4个瓶内均加入足量浓度的2.5%胰蛋白酶,比例不低于20 mL∶1 g.将1~3号培养瓶放入培养箱中,每5 min摇晃一次或用移液管进行吹打,使组织块充分消化.1号瓶在30 min后收集细胞悬液,再加入胰蛋白酶消化,30 min后再次收集细胞悬液,直至组织块完全消化.2号瓶在1 h后收集细胞悬液,再加入胰蛋白酶消化,1 h后再次收集细胞悬液,直至组织块完全消化.3号瓶在1.5 h后收集细胞悬液,再加入胰蛋白酶消化,1.5 h后再次收集细胞悬液,直至组织块完全消化.4号瓶放入4 ℃冰箱中过夜,然后放入培养箱中,每5 min摇晃一次,30 min后收集细胞悬液.将各培养瓶内收集的细胞悬液反复吹打后加入完全培养基终止消化,然后1 200 r/min离心5 min后收集细胞.
1.3 HeLa癌细胞培养
HeLa癌细胞接种于含10%胎牛血清、100 μg/mL青霉素和100 μg/mL链霉素的DMEM培养基中,放置在37 ℃、体积分数为5%CO2培养箱中培养,待细胞长到80%~90%融合时用0.1%胰酶消化传代.
1.4 脐带细胞与HeLa癌细胞共培养
取脐带细胞以密度为5×104/mL接种于含有圆形玻片的12孔板中,取HeLa癌细胞以密度为5×104/mL接种于含有方形玻片的12孔板中,待12 h细胞贴壁后,将方形玻片和圆形玻片转移至6孔板的同一孔中,实验分为4组:对照组、5 mmol/L 葡萄糖组、1 mmol/L葡萄糖组和0 mmol/L 葡萄糖组,在6孔板中加入含不同浓度糖的DMEM培养基,共培养HeLa癌细胞和人脐带正常细胞24,48,72 h后,倒置显微镜下观察细胞形态,拍照,然后吖啶橙/溴乙锭(AO/EB)双重荧光染色观察细胞核染色质的分布.
1.5 AO/EB双重荧光染色
碳源饥饿分别处理24,48和72 h后取出细胞玻片,磷酸盐缓冲液清洗3次.临用前将吖啶橙(5 μg/mL)溶液和溴乙锭(5 μg/mL)溶液等体积混合.在玻片上滴加AO/EB混合液进行染色,荧光显微镜观察,拍照.
2 结 果
2.1 碳源饥饿对共培养24 h人脐带正常细胞与HeLa癌细胞形态及凋亡的影响
共培养条件下对照组细胞分布均匀,贴壁性好,形态饱满,多呈规则的梭形或多角形,折光性好(见图1中1和5);AO/EB双染细胞呈黄绿色荧光(见图2中1和5).5 mmol/L葡萄糖组细胞密度减小,形态正常,分布均匀,贴壁性良好(见图1中2和6);AO/EB双染细胞呈黄绿色荧光(见图2中2和6).1 mmol/L葡萄糖组细胞密度减小,细胞形态正常,贴壁性良好(见图1中3和7);AO/EB双染人脐带正常细胞呈黄绿色荧光,HeLa癌细胞大多数呈黄绿色、少量呈橙红色荧光(见图2中3和7).0 mmol/L葡萄糖组人脐带正常细胞培养部分生长状况良好、贴壁性良好、细胞密度降低,而HeLa癌细胞大部分收缩变圆,仅有极少量存活且细胞形态逐渐呈变圆趋势(见图1中4和8);AO/EB双染人脐带正常细胞呈黄绿色荧光,HeLa癌细胞呈橙黄色荧光(见图2中4和8).
2.2 碳源饥饿对共培养48 h人脐带正常细胞与HeLa癌细胞形态及凋亡的影响
共培养条件下对照组细胞密度增大,细胞分布均匀,贴壁性好,形态饱满,多呈规则的梭形或多角形,折光性好(见图1中9和13);AO/EB双染人脐带正常细胞大部分呈黄绿色荧光,但有极少数呈橙黄色荧光,而HeLa癌细胞呈黄绿色荧光(见图2中9和13).5 mmol/L葡萄糖组细胞密度较培养24 h的增大,人脐带正常细胞大部分贴壁性好、形态饱满、折光性好,HeLa癌细胞部分开始收缩变圆逐渐凋亡(见图1中10和14);AO/EB双染人脐带正常细胞和HeLa癌细胞都有部分呈橙黄色荧光,部分人脐带正常细胞呈黄绿色荧光、HeLa癌细胞呈亮绿色荧光(见图2中10和14).1 mmol/L葡萄糖组人脐带正常细胞部分形态饱满、贴壁性良好、呈规则梭形或多角形,少量细胞开始收缩变圆逐渐凋亡,而HeLa癌细胞几乎全部收缩变圆逐渐凋亡(见图1中11和15);AO/EB双染人脐带正常细胞约1/2呈黄绿色荧光、1/2呈橙黄色荧光,HeLa癌细胞呈橙黄色荧光(见图2中11和15).0 mmol/L葡萄糖组人脐带正常细胞仍有部分存活,但细胞轮廓发生改变,呈三角形或瘦长形,而HeLa癌细胞全部收缩变圆逐渐凋亡(见图1中12和16);AO/EB双染人脐带正常细胞仍有极少数细胞呈黄绿色荧光,HeLa癌细胞全部呈橙黄色荧光(见图2中12和16).

图1 倒置显微镜观察HeLa癌细胞与人脐带正常细胞形态(Bar=50 μm)
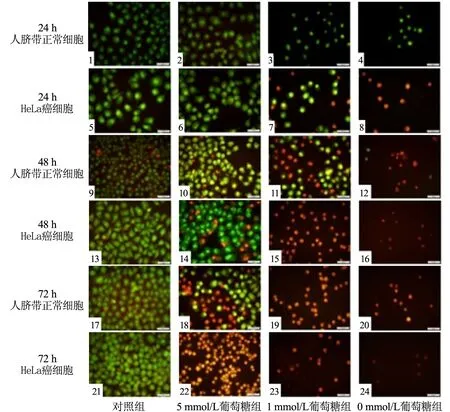
图2 AO/EB双重荧光染色检测HeLa癌细胞与人脐带正常细胞凋亡细胞形态及数量(Bar=50 μm)
2.3 碳源饥饿对共培养72 h人脐带正常细胞与HeLa癌细胞形态及凋亡的影响
共培养条件下对照组细胞密度增大,细胞分布均匀,贴壁性好,形态饱满,多呈规则的梭形或多角形,折光性好(见图1中17和21);AO/EB双染人脐带正常细胞大部分呈黄绿色荧光,但有极少数呈橙黄色荧光,而HeLa癌细胞呈黄绿色荧光(见图2中17和21).5 mmol/L葡萄糖组人脐带正常细胞大部分贴壁性好、形态饱满、折光性好,仅有极少量细胞收缩变圆逐渐凋亡,而HeLa癌细胞几乎全部收缩变圆逐渐凋亡(见图1中18和22);AO/EB双染人脐带正常细胞约1/2呈黄绿色荧光、1/2呈橙黄色荧光,HeLa癌细胞呈橙黄色荧光(见图2中18和22).1 mmol/L葡萄糖组人脐带正常细胞大部分收缩变圆逐渐凋亡,仍有少数细胞存活但轮廓发生改变、折光性减弱,而HeLa癌细胞全部收缩变圆逐渐凋亡(见图1中19和23);AO/EB双染人脐带正常细胞、HeLa癌细胞全部呈橙黄色荧光(见图2中19和23).0 mmol/L 葡萄糖组人脐带正常细胞与HeLa癌细胞全部收缩变圆逐渐凋亡,人脐带正常细胞密度大于HeLa癌细胞(见图1中20和24);AO/EB双染人脐带正常细胞、HeLa癌细胞全部呈橙黄色荧光(见图2中20和24).
3 讨 论
葡萄糖作为真核生物的主要能源物质和新陈代谢的中间产物,对生物体的生长发育具有重要的作用.癌细胞的基本特征之一是细胞能量代谢异常,新陈代谢异常,葡萄糖的摄取和利用速度增加,胞外乳酸堆积增多,因此,肿瘤细胞需要大量表达GLUTs以满足葡萄糖的超量摄入,糖酵解代谢增强,这一现象使得GLUT1和GLUT3成为潜在的具有诊断价值的肿瘤细胞标志物[10].糖酵解代谢途径为肿瘤细胞的生长提供了充足的三磷酸腺苷(ATP),而充足的ATP又促进了肿瘤细胞的增殖与转移.与氧化磷酸化途径相比,糖酵解途径的产能效率低,肿瘤细胞为了生成足够的ATP,需要从细胞外环境中摄取的葡萄糖的量大约是正常细胞的10倍[3-4,11].因此,剥夺葡萄糖的癌症治疗方法受到人们的关注.碳源饥饿是指通过降低培养基中的葡萄糖浓度而对细胞进行饥饿处理.目前,国内外关于碳源饥饿的研究较少.Foster等[12]用0,0.5和25 mmol/L葡萄糖浓度条件处理多种肿瘤细胞120 h,结果表明:0 mmol/L葡萄糖浓度处理组所有肿瘤细胞的生长均受到抑制;0.5 mmol/L葡萄糖浓度处理可以抑制多种肿瘤细胞的生长.文献[13]运用长时间连续流动维持低糖培养基的培养装置对体外肿瘤细胞株进行培养,对低糖敏感的细胞系由于葡萄糖限制从而产生复杂的mtDNA基因突变或葡萄糖利用障碍,导致肿瘤生长发生异常.文献[14]研究表明,依赖葡萄糖作为主要能量来源的癌细胞,由于线粒体氧化磷酸化途径异常,癌细胞在低葡萄糖条件下培养生长受到抑制.闫珊[15]研究发现,缺糖能降低HeLa癌细胞的生存率,并通过调节Bcl-2蛋白家族,诱导HeLa癌细胞发生凋亡.文献[16]在葡萄糖饥饿的前提下,运用碱(如碳酸氢钠)去除肿瘤内的氢离子,破坏乳酸根与氢离子的协同作用,从而有效杀死葡萄糖饥饿的肿瘤细胞.
本实验结果表明:共培养条件下,葡萄糖浓度为5 mmol/L时,HeLa癌细胞48 h部分凋亡,72 h几乎全部凋亡,人脐带正常细胞72 h时仍生长状况良好;葡萄糖浓度为1 mmol/L时,HeLa癌细胞48 h几乎全部凋亡,人脐带正常细胞48 h出现部分凋亡,72 h时几乎全部凋亡;葡萄糖浓度为0 mmol/L时,HeLa癌细胞24 h几乎全部收缩变圆逐渐凋亡,人脐带正常细胞48 h仍存活,72 h几乎全部收缩变圆逐渐凋亡.由于HeLa癌细胞摄取葡萄糖的量显著高于人脐带正常细胞,葡萄糖浓度降低,HeLa癌细胞因葡萄糖供应减少而导致其增殖受到抑制.碳源饥饿可使癌细胞先于正常细胞死亡,这为碳源饥饿抗肿瘤治疗提供了理论依据.
[1]Warburg O.On the origin of cancer cells[J].Science,1956,123(3191):309-314.
[2]Hanahan D,Weinberg R A.The hallmarks of cancer[J].Cell,2000,100(1):57-70.
[3]Kallinowski F,Vaupel P,Runkel S,et al.Glucose uptake,lactate release,ketone body turnover,metabolic micromilieu,and pH distributions in human breast cancer xenografts in nude rats[J].Cancer Res,1988,48(1):7264-7272.
[4]Sauer L A,Stayman J W 3rd,Dauchy R T.Amino acid,glucose,and lactic acid utilization in vivo by rat tumors[J].Cancer Research,1982,42(10):4090-4097.
[5]Martinez-Outschoorn U E,Pestell R G,Howell A,et al.Energy transfer in "parasitic" cancer metabolism:Mitochondria are the powerhouse and Achilles′ heel of tumor cells[J].Cell Cycle,2011,10(24):4208-4216.
[6]Bost F,Sahra I B,Le Marchand-Brustel Y,et al.Metformin and cancer therapy[J].Curr Opin Oncol,2012,24(1):103-108.
[7]高海涛,邵邻相,孙桂菊.饮食限制对学习记忆和抗肿瘤作用的研究进展[J].浙江师范大学学报:自然科学版,2014,37(1):99-107.
[8]陈佳.碳源饥饿对HeLa细胞凋亡的影响[D].金华:浙江师范大学,2016.
[9]陈佳,邵邻相,麻艳芳,等.佛手叶挥发油诱导HeLa细胞凋亡与坏死[J].浙江师范大学学报:自然科学版,2016,39(2):215-218.
[10]Deng Dong,Sun Pengcheng,Yan Chuangye,et al.Molecular basis of ligand recognition and transport by glucose transporters[J].Nature,2015,526(7573):391-396.
[11]Gullino P M,Grantham F H,Courtney A H.Glucose consumption by transplanted tumors in vivo[J].Cancer Research,1967,27(6):1031-1040.
[12]Foster R,Griffin S,Grooby S,et al.Multiple metabolic alterations exist in mutant PI3K cancers,but only glucose is essential as a nutrient source[J].PLoS One,2012,7(9):e45061.
[13]Birsoy K,Possemato R,Lorbeer F K,et al.Metabolic determinants of cancer cell sensitivity to glucose limitation and biguanides[J].Nature,2014,508(7494):108-112.
[14]Song I S,Han Jin,Hong K L.Metformin as an anticancer drug:A Commentary on the metabolic determinants of cancer cell sensitivity to glucose limitation and biguanides[J].Journal of Diabetes Investigation,2015,6(5):516-518.
[15]闫珊.缺糖增加Bcl-2抑制剂S1诱导人宫颈癌细胞凋亡敏感性的实验研究[D].长春:吉林大学,2014.
[16]Chao Ming,Wu Hao,Jin Kai,et al.A nonrandomized cohort and a randomized study of local control of large hepatocarcinoma by targeting intratumoral lactic acidosis[J].Elife,2016,2(5):e15691.
(责任编辑 薛 荣)
Effects of glucose deprivation of HeLa cells and human umbilical cord cells
SU Jiajia, ZENG Jie, SHAO Linxiang
(CollegeofChemistryandLifeSciences,ZhejiangNormalUniversity,Jinhua321004,China)
To investigate the influence of different glucose concentration medium on the morphology, growth and apoptosis of HeLa cell which were directly co-cultured with human umbilical cord cells. A control group and three experimental groups(5 mmol/L, 1 mmol/L, 0 mmol/L) were designed.After co-cultured for 24, 48, 72 h, cells were observed and took pictures under the inverted microscope and stained with AO/EB were observed under fluoroscope. The results under the inverted microscope: cells population of control group were sufficient, presented irregular and adherent growth, cone-shaped or polygonal cell body, its boundary was clear and obvious halo, and highly refractive. It was found that the numbers of cells increased gradually with the increment of glucose concentration. Cells stained with AO/EB were seen dark green or emit green. In the experimental group, the lower the glucose concentration was, the shorter the cell survival time was. Cells stained with AO/EB were gradually changed from green to orange yellow fluorescence. The same glucose concentration in human umbilical cord cells survived longer than HeLa cells. Therefore, the effect of carbon starvation on HeLa cell proliferation inhibition and induced apoptosis was more obvious than that of human umbilical cord cells. HeLa cells were more dependent on glucose than human umbilical cord cells.
glucose deprivation; HeLa cells; human umbilical cord cells; proliferation; apoptosis
10.16218/j.issn.1001-5051.2017.03.014
�2016-11-09;
2017-02-21
苏佳佳(1992-),女,山东滨州人,硕士研究生.研究方向:细胞生物学.
邵邻相.E-mail: shaolinxiang@zjnu.edu.cn>
Q291
A
1001-5051(2017)03-0331-05
