跨物种筛选黄毛鼠的微卫星分子标记*
2017-09-08韩金巧谭江东王艳妮张新玉黄相相
韩金巧, 谭江东, 王艳妮, 任 鹏,张新玉, 龚 堃, 黄相相, 周 晓
(浙江师范大学 生态研究所,浙江 金华 321004)
跨物种筛选黄毛鼠的微卫星分子标记*
韩金巧, 谭江东, 王艳妮, 任 鹏,张新玉, 龚 堃, 黄相相, 周 晓
(浙江师范大学 生态研究所,浙江 金华 321004)
利用微卫星引物侧翼序列具有保守性的特点进行了跨物种筛选黄毛鼠微卫星引物的研究.选取60对大鼠、小鼠已知的微卫星位点引物,对黄毛鼠的基因组DNA进行了PCR扩增,通过琼脂糖凝胶电泳、聚丙烯酰氨凝胶电泳及基因扫描技术筛选了适合黄毛鼠的多态性位点引物.研究结果显示,60对微卫星位点引物中,17对引物能够稳定扩增,其中8对引物的多态信息含量(PIC)均大于0.5,为高度多态性引物.研究筛选到的微卫星位点可为后期黄毛鼠的种群遗传学研究提供参考.
黄毛鼠;微卫星标记;跨物种扩增;多态性
黄毛鼠(Rattuslosea)隶属于啮齿目(Rodentia)鼠科(Muridae)大鼠属(Rattus),是我国华南地区水稻生产区重要的害鼠之一,是钩端螺旋体、立克次体等多种病原体的储存者和传播者[1],主要分布于长江以南及湖北、安徽等地区[2].目前,有关黄毛鼠生长发育[3]、年龄鉴定[4]、生态习性[5-6]、种群数量变动[7]、种群空间格局[8]及危害防治[9]等方面已有较多的研究,但利用分子生物学技术进行遗传分析的研究报道较少.
微卫星DNA标记是一种分子遗传标记技术,具有共显性遗传、多态信息含量高、检测快速方便、重复性好等特点,被广泛地应用于遗传图谱构建、遗传多样性分析、遗传疾病诊断和遗传育种等方面[10-12].目前,大鼠(Rattusnorvegicus)[13]、小鼠(Musmusculus)[14]、社鼠(Niviventerconfucianus)[15]、大仓鼠(Cricetulustriton)[16]、黑线仓鼠(Cricetulusbarabensis)[17]和长爪沙鼠(Merionesunguiculatus)[18]等啮齿动物的微卫星引物已通过开发或筛选而获得,但适合黄毛鼠的微卫星引物尚未见报道.由于黄毛鼠、大鼠及小鼠都属于鼠科动物,存在一定的亲缘关系,所以,本研究采用跨物种扩增的方法,从大鼠、小鼠的微卫星引物中筛选适合黄毛鼠的多态性引物,为进一步进行黄毛鼠遗传结构与遗传多样性分析奠定基础.
1 材料与方法
1.1 样本采集
分别于2013年6月和9月,采用夹捕法,在浙江省舟山群岛的大摘箬山、刺山、小猫岛、小盘峙岛、大猫岛、六横岛、桃花岛及小摘箬山8个岛屿上捕捉到黄毛鼠171只,其中雄性56只、雌性115只.取适量的黄毛鼠肌肉组织,放入95%乙醇溶液中固定保存,带回实验室,置于-70 ℃冰箱中待处理.
1.2 组织DNA提取
取95%乙醇溶液固定保存的黄毛鼠肌肉样品,用双蒸水清洗样品表面3次,用滤纸吸干表面水分.剪取肌肉组织150~200 mg,采用经典的酚氯仿抽提法提取肌肉组织的DNA.用1%琼脂糖凝胶电泳检测DNA提取结果.
1.3 微卫星位点选取
参照黄毛鼠的近缘种大鼠、小鼠等的微卫星位点,选取位于大鼠和小鼠不同染色体上的60个微卫星位点[13-15,18].微卫星引物全部由生工生物工程(上海)股份有限公司合成,用TE(Tris-EDTA)缓冲液将引物稀释至10 μmol/L,根据实验需要取出适量,其余放入-20 ℃冰箱中保存.
1.4 PCR扩增
1.4.1 反应体系
PCR反应体系为25 μL,其中:10×PCR buffer 2.5 μL;Mg2+溶液分为1.0,1.5和2.0 μL(25 mmol/L)3个梯度进行筛选;dNTP 1.5 μL(2.5 mmol/L);上游和下游引物各0.5 μL(10 μmol/L);样品DNA溶液1.0 μL;rTag DNA聚合酶溶液0.2 μL(5 U/μL);双蒸水定容至25 μL.
1.4.2 反应程序
PCR反应在BIO-RAD公司的MyCycleTM梯度PCR扩增仪上进行.第1阶段:预变性95 ℃,5 min;第2阶段40个循环:变性95 ℃ 30 s,退火50~60 ℃(不同引物退火温度不同) 35 s,延伸72 ℃ 35 s;第3阶段:延伸72 ℃,7 min.
1.5 引物筛选
1.5.1 退火温度及Mg2+浓度的确定
退火温度及Mg2+浓度对于微卫星引物扩增的影响较大.Mg2+浓度分为1.0,1.5,2.0 mmol/L 3个梯度;利用BIO-RAD公司的MyCycleTM梯度PCR扩增仪,设置温度范围为50~60 ℃,仪器自动生成8个温度梯度:50.0,50.9,52.3,54.0,56.3,58.1,59.3和60.0 ℃,随机抽取一个经电泳检测条带较清晰的样本DNA进行PCR扩增,PCR产物用加有Gold View Ⅰ型核酸染料的1.5%琼脂糖凝胶、120 V电压电泳40 min,判断引物能否扩增及对应的最适退火温度和Mg2+浓度.
1.5.2 引物的筛选
每个岛上随机抽取6个样本,利用能扩增的引物,采用筛选的退火温度及Mg2+浓度,对8个岛上的48个样本DNA进行PCR扩增,将PCR产物用1.5%琼脂糖凝胶电泳检测,判断引物能否进行稳定扩增.
将能够稳定扩增的微卫星引物的PCR产物,利用BIO-RAD生产的DcodeTMUniversal Mutation Detection System进行6%变性聚丙烯酰胺凝胶电泳,150 V电压预电泳40 min,点样后250 V电压电泳4 h,电泳结束后用10%冰醋酸溶液固定20 min,0.1%AgNO3溶液染色30 min,30 s快速水洗,显色液(0.2 g碳酸钠,10 g氢氧化钠,1 mL甲醛,500 mL蒸馏水)显色5 min,至条带清晰时用10%冰醋酸溶液终止显色,最后用Bio-Rad Gel DocTMXR+凝胶成像系统进行观察.若条带的泳动距离一致,则说明该位点是单态位点;若泳动距离有差异,则表明该位点为多态性位点.
将初步筛选出的多态性引物的5′端分别用FAM,TAMRA和HEX进行荧光标记,对48个样本DNA进行PCR扩增,扩增产物委托生工生物工程(上海)股份有限公司进行短串联重复序列(short tandem repeats,STR)基因扫描,扫描结果采用GeneMapper ID v3.2软件判读,获得扩增片段的长度.用CERVUS 3.0[19]统计各微卫星位点的等位基因数,并计算多态信息含量(PIC),进一步验证引物的多态性.计算公式为
其中,Pi,Pj分别为第i和第j个等位基因的频率.
2 结果与分析
2.1 DNA提取
利用本实验室改善的酚-氯仿抽提法提取黄毛鼠肌肉组织的DNA.提取的DNA样品用100 μLTE缓冲液溶解稀释,取3 μL用1.0%琼脂糖凝胶电泳检测.部分DNA的电泳结果见图1.
2.2 退火温度及Mg2+浓度确定

图1 部分组织样本DNA提取的电泳检测结果
综合考虑条带的明亮、实验成本及条带的特异性等,最终选定每对引物最适合的Mg2+浓度及退火温度.图2为引物TNF的琼脂糖凝胶电泳图.不同引物的最适Mg2+浓度和退火温度见表1.
2.3 微卫星引物扩增和筛选
经PCR反应体系优化,60对引物中,17对引物能够稳定扩增,其位点名称、引物序列、扩增条件及所在染色体见表1.其中,8对引物杂合且多态性较好,平均等位基因数为9.625(7~12),平均多态信息含量为0.811(0.696~0.871)(见表2).部分引物PCR扩增产物的聚丙烯酰胺凝胶电泳结果见图3和图4;图5为引物IGHE的STR扫描图.

1~8:Mg2+浓度为1.0 mmol/L,退火温度依次降低;9~16:Mg2+浓度为1.5 mmol/L,退火温度依次降低;17~24:Mg2+浓度为2.0 mmol/L,退火温度依次降低;M:DM 2000图2 引物TNF的琼脂糖凝胶电泳结果

序号座位引物序列(5'—3')退火温度/℃c(Mg2+)/(mmol·L-1)所在染色体1TNFAGGAAATGGGTTTCAGTTCCCAGGATTCTGTGGCAATCTG60.01.5202FGGCAGCAACGACAAAAATGTCCATCTCCCCAACTGTCAAATG60.02.023APOC3GATTTGAAGCGATTGTCCATGTCTAGCTGCCCACAGGAG59.32.084CATCTTATGTTACCTCACAGCCT-GGGGGTGGGCCATCTTTATAATC52.32.03
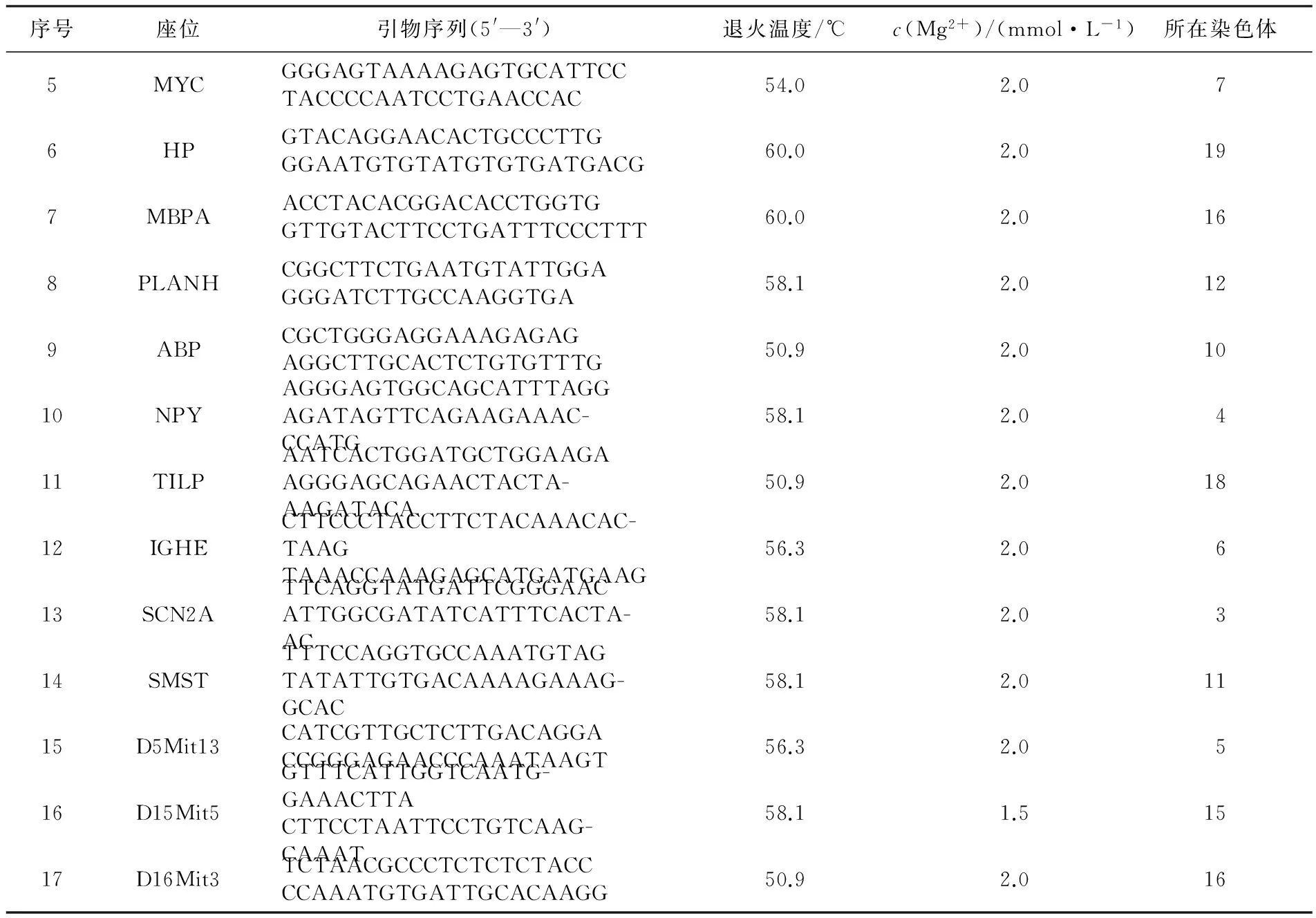
续表1

表2 黄毛鼠的多态性微卫星位点

1~15:PCR产物的编号;M:20 bp DNA Ladder marker图3 引物MYC的聚丙烯酰胺凝胶电泳图

1~13:PCR产物的编号;M:20 bp DNA Ladder marker图4 引物IGHE的聚丙烯酰胺凝胶电泳图

图5 引物IGHE的STR扫描图
3 讨 论
PCR反应体系的建立和优化是引物筛选的基础.影响PCR反应的主要因素有Mg2+浓度、dNTP浓度、引物浓度及rTaq酶浓度等,退火温度也会对扩增条带产生显著的影响.本研究对每对引物的退火温度及Mg2+浓度进行了优化,结果显示,本实验筛选的多态性引物退火温度在50.9~60.0 ℃间不等,部分引物的退火温度范围较宽,而个别引物只能在特定的退火温度下才能扩增出条带.Mg2+浓度主要集中为1.5和2.0 mmol/L.综合考虑条带的明亮、实验成本及条带的特异性等,最终选定每对引物最适合的Mg2+浓度及退火温度.PCR反应体系及反应条件的优化是PCR反应顺利进行的前提.聚丙烯酰胺凝胶电泳(PAGE)具有分辨率高、不易扩散、热稳定、易于观察和灵敏度高等优点,已被广泛应用于核酸与蛋白质的分离,特别是在SSR,AFLP,SNP等分子标记研究中具有极其重要的作用.虽然PAGE技术操作步骤繁琐复杂、费时费工,但不失为初步筛选多态性引物的较节约成本的有效方法.STR基因扫描技术相比聚丙烯酰胺电泳技术的结果更加准确客观,可以检测到微小片段的差异,得到更准确的等位基因数,以进一步检验微卫星引物的多态性[20].
自从1991年Moore等[21]发现了哺乳动物基因组中的微卫星侧翼保守序列后,对于相同属、科、目的不同物种的跨种扩增筛选微卫星位点的方法得到了证实.吴云良等[22]利用16对家猫微卫星引物和4对苏门答腊虎微卫星引物,筛选出15对具有高度多态性的微卫星引物,并有效地检测了东北虎的遗传多样性及亲缘关系;孙波等[15]利用大鼠和小鼠的微卫星引物对社鼠的基因组DNA进行了扩增,扩增的同源率达到30%;包文斌等[23]利用29对鸡的微卫星标记对孔雀基因组DNA进行了跨种扩增,发现14对引物能扩增出稳定的特异性条带,且7对引物具有较丰富的多态性,并成功利用筛选的微卫星标记对蓝孔雀和绿孔雀群体间和群体内的遗传多样性进行了分析.本研究选取60对大鼠和小鼠已知的微卫星位点引物,对黄毛鼠的基因组DNA进行了扩增,研究结果显示,60对微卫星位点引物中,17对引物能够稳定扩增,其中8对引物的多态信息含量(PIC)大于0.5,为高度多态性引物,能够客观地分析黄毛鼠种群的遗传变异情况.由此可见,微卫星跨种扩增的方法简单、操作方便,是一种有效快速的方法,对于种群遗传学的研究具有一定指导意义.
[1]谢福才.划分黄毛鼠种群年龄指标的分析比较[J].兽类学报,1994,14(4):306-308.
[2]秦姣.卡麦角林对黄毛鼠的不育效果及其作用机理[D].北京:中国农业大学,2015.
[3]黄铁华,王耀培,秦耀亮.防治稻田黄毛鼠和板齿鼠的试验[J].植物保护学报,1984,11(3):205-209.
[4]郭志南,苏成豪,陈国伟,等.黄毛鼠种群年龄划分的研究[J].中华卫生杀虫药械,2014,20(4):332-335.
[5]鲍毅新,丁平,诸葛阳,等.舟山岛黄毛鼠种群生态研究[J].浙江师大学报:自然科学版,1997,20(2):60-65.
[6]刘全生,冯志勇,龚鹏博,等.高纤维食物对黄毛鼠摄食和消化的影响[J].兽类学报,2010,30(3):291-296.
[7]洪朝长,袁高林,郑本栋.黄毛鼠的种群动态研究及数量预测的意见[J].兽类学报,1989,9(2):137-145.
[8]黄秀清,冯志勇,颜世祥,等.黄毛鼠种群空间格局的研究[J].广东农业科学,2004(4):46-48.
[9]黄秀清,冯志勇,颜世祥,等.黄毛鼠综合防治对策及技术研究[J].广东农业科学,2002(1):40-42.
[10]段辛乐,乔宪凤,彭雄,等.我国禾谷缢管蚜微卫星位点扩增稳定性及遗传多样性[J].植物保护学报,2015,42(3):297-303.
[11]吴则东,倪洪涛,王茂芊,等.适合于甜菜品种鉴定的ISSR核心引物的筛选[J].中国农学通报,2015,31(17):48-52.
[12]闵金金,张加勇,郑荣泉,等.跨种扩增筛选大鳄龟微卫星标记及遗传多样性分析[J].动物学杂志,2013,48(6):926-932.
[13]Serikawa T,Kuramoto T,Hilbert P,et al.Rat gene mapping using PCR-analyzed microsatellites[J].Genetics,1992,131(3):701-721.
[14]Jacob H J,Brown D M,Bunker R K,et al.A genetic linkage map of the laboratory rat,Rattusnorvegicus[J].Nature Genetics,1995,9(1):63-69.
[15]孙波,鲍毅新,张龙龙,等.大鼠及小鼠微卫星引物在社鼠中的跨种扩增[J].动物学杂志,2009,44(6):145-150.
[16]郭俣.大仓鼠高变异微卫星座位的筛选及应用[D].曲阜:曲阜师范大学,2005.
[17]李传海.黑线仓鼠(Cricetulusbarabensis)微卫星引物的筛选及应用[D].曲阜:曲阜师范大学,2006.
[18]赵太云,路静,王钜,等.大、小鼠微卫星引物对长爪沙鼠的扩增[J].中国比较医学杂志,2006,16(2):114-117.
[19]Kalinowski S T,Taper M L,Marshall T C.Revising how the computer program CERVUS accommodates genotyping error increases success in paternity assignment[J].Molecular Ecology,2010,16(7):1099-1106.
[20]张媛,李晓飞,李振宇,等.滇西亚种树鼩微卫星分子标记的筛选[J].中国比较医学杂志,2015,25(6):36-41.
[21]Moore S S,Sergeant L L,King T J,et al.The conservation of dinucleotide microsatellites among mammalian genomes allows the use of heterologous PCR primer pairs in closely related species[J].Genomics,1991,10(3):654-660.
[22]吴云良,包文斌,张红霞,等.微卫星技术分析东北虎遗传多样性及亲缘关系[J].扬州大学学报:农业与生命科学版,2011,32(1):87-91.
[23]包文斌,陈国宏,束婧婷,等.孔雀微卫星引物筛选及其遗传多样性分析[J].遗传,2006,28(10):1242-1246.
(责任编辑 薛 荣)
Cross-species amplication of microsatellite loci inRattuslosea
HAN Jinqiao, TAN Jiangdong, WANG Yanni, REN Peng,ZHANG Xinyu, GONG Kun, HUANG Xiangxiang, ZHOU Xiao
(InstituteofEcology,ZhejiangNormalUniversity,Jinhua321004,China)
Based on the conservatism of microsatellite flanking sequences, cross-species amplication of microsatellite loci was an effective method. 60 microsatellite markers of rat (Rattusnorvegicus) and mouse (Musmusculus) were screened forRattusloseathrough PCR amplification, polyacrylamide gel electrophoresis and gene scanning technique. The results showed that 17 microsatellite loci could be amplified stably and 8 of them were highly polymorphic, and the polymorphism information content (PIC) was more than 0.5. These microsatellite loci would provide a reference for the later research on the population genetics ofRattuslosea.
Rattuslosea; microsatellite loci; cross-species amplication; polymorphism
10.16218/j.issn.1001-5051.2017.03.011
�2016-03-01;
2017-12-21
国家自然科学基金资助项目(31200323)
韩金巧(1990-),女,山西汾阳人,硕士研究生.研究方向:生物多样性保护.
王艳妮.E-mail: wangyn@zjnu.cn>
Q959.837
A
1001-5051(2017)03-0312-06
