玄参多糖对2型糖尿病大鼠降糖作用的研究
2017-08-30赵洪伟张宁李自辉董婉茹刘树民
赵洪伟,张宁,李自辉,董婉茹,刘树民*
(1.黑龙江省高等院校中药药性理论创新团队,黑龙江 哈尔滨 150040;2.黑龙江中医药大学,黑龙江 哈尔滨 150040;3.黑龙江中医药大学药物安全性评价中心,黑龙江 哈尔滨 150040)
玄参多糖对2型糖尿病大鼠降糖作用的研究
赵洪伟1,2,张宁1,2,李自辉1,2,董婉茹1,3,刘树民1,3*
(1.黑龙江省高等院校中药药性理论创新团队,黑龙江 哈尔滨 150040;2.黑龙江中医药大学,黑龙江 哈尔滨 150040;3.黑龙江中医药大学药物安全性评价中心,黑龙江 哈尔滨 150040)
目的:探讨玄参多糖对2型糖尿病模型大鼠的降糖作用。方法:观察腹腔注射链脲菌素(STZ)加高脂高糖饲料法诱导建立的糖尿病模型大鼠的生存状态,并记录其体质量与饮食饮水量的变化;监测大鼠空腹血糖及糖耐量变化,并对其糖化血红蛋白、C-肽、血脂(TG、TC、LDL-C、HDL-C)及胰岛素分泌量进行测定,以此对玄参多糖降糖作用进行综合性研究及评价。结果:玄参多糖中、高剂量可显著改善STZ与高脂高糖饲料所致2型糖尿病大鼠糖代谢及脂代谢功能(P<0.05或P<0.01),提高机体的抗氧化能力并促进胰岛素的分泌量(P<0.05),显著性降低模型大鼠的血糖(P<0.05)。结论:玄参多糖对2型糖尿病模型大鼠有降糖作用,且高剂量组降糖效果略强于中剂量组。
玄参多糖;血糖;胰岛素;2型糖尿病
玄参为玄参科(Scrophulariaceae)玄参属多年生草本植物玄参(ScrophularianingpoeusisHemsl.)干燥块根,始载《神农本草经》,味甘、苦、咸;性微寒,归肺、胃、肾经。2015版《中国药典》中记载玄参具有凉血滋阴,泻火解毒的作用。临床主要用于热邪入血分营分,阴伤烦渴,津亏舌绛等证的治疗,现代临床研究表明其具有抗菌抗炎、抗肿瘤、保肝、解热镇痛、改善微循环及毛细管通透性等作用[1-2]。目前认为玄参主要的化学成分为环烯醚萜类、苯丙素类、黄酮类及芳香糖类等[3]。近些年来已有大量关于中药多糖组分对于机体血糖与血脂具有调节作用的报导,有研究表明玄参多糖具有一定的抗疲劳和抗氧化的作用,但鲜有关于其降血糖功能和机理的研究[4-5]。本研究通过对链脲菌素(STZ)加高脂高糖饲料诱导建立的糖尿病模型大鼠多项指标的综合评价,初步揭示玄参多糖降血糖的作用机制,为今后的开发及应用提供理论依据。
1 材料
1.1 试验药物
玄参饮片购自黑龙江省药材公司(批号20120623012),经黑龙江中医药大学中药资源与开发教研室王振月教授鉴定为玄参科植物玄参(ScrophularianingpoensisHemsl.)的干燥根。将适量玄参粉碎后,分别用10倍和8倍量的蒸馏水恒温加热进行提取(水煎煮法),两煎液均冷凝回流1.5 h,合并药液,过滤,减压浓缩,得到棕褐色,甜腻芳香气味,略带苦味的水煎液,提取得到的玄参水煎液经过冻干得到干粉,加水溶解,加入85%乙醇(10倍量体积),不断搅动,静置12 h(此过程反复3~4次),收集沉淀部分,冻干,作为玄参多糖组分待研究。提取后计算其产率为2.18%[6]。
1.2 动物
SD大鼠60只,SPF级,雄性,体质量(140±20)g,由黑龙江中医药大学动物实验中心提供,许可证编号:SCXK(黑)2013-004。适应性喂养3 d后进行实验,所有实验小鼠的使用和喂养严格遵照动物保护协会所规定的有关条款。
1.3 试剂
链脲佐菌素(STZ,Sigma公司);柠檬酸(天津市百世化工有限公司);柠檬酸钠(湖北金铭洲化学技术有限公司);链脲佐菌素STZ配制液:用时将A(柠檬酸2.1 g加入双蒸水100 mL中)、B(柠檬酸钠2.94 g加入双蒸水100 mL中)液按1∶1.32比例混合,调节pH值4.2后,与STZ混合配制浓度1%溶液;罗氏全活力型血糖试纸(罗氏诊断产品有限公司);大鼠糖化血红蛋白酶联免疫检测试剂盒、大鼠胰岛素酶联免疫检测试剂盒、大鼠C-肽酶联免疫检测试剂盒(北京诚林生物科技有限公司);甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)测定试剂盒(中生北控生物科技有限公司);超氧化物歧化酶测定试剂盒、丙二醛测定试剂盒(南京建成生物工程研究所);高脂高糖饲料成分:猪油15%,蔗糖20%,蛋黄5%,基础饲料(北京澳协力饲料有限公司)60%,由哈尔滨玉英饲料厂加工制成。
1.4 仪器
UVmini-1240紫外-可见分光光度计(岛津国际贸易上海有限公司);HHS型数显恒温水浴锅(上海博迅实业有限公司医疗设备厂);Accu-Chek Ative 血糖仪(罗氏诊断产品有限公司);魅力2000全自动生化分析仪(美国MD公司);超低温冰箱(赛默飞世尔科技中国有限公司);pH计(上海雷磁仪器厂);AL204电子天平(梅特勒-托利多仪器上海有限公司);YP10001电子称(上海佑科仪器有限公司);Anthos2010酶标仪(奥地利安图斯公司);KDC-160HR台式高速冷冻离心机(科大创新股份有限公司中佳分公司);MS3 digital蜗旋仪(德国IKA公司);微量移液器(赛默飞世尔科技中国有限公司)。
2 方法
2.1 动物造模与分组给药
SD大鼠60只随机抽取10只作为正常对照组,采用基础饲料喂养;其余 50只作为造模组,采用高脂高糖饲料喂养。4周后,所有大鼠禁食12 h,造模组大鼠按照 30 mg/kg的剂量一次性腹腔注射STZ(冰浴操作,10 min内注射完毕),正常对照组按照同等剂量腹腔注射柠檬酸-柠檬酸钠缓冲液。注射 STZ 72 h后,禁食12 h,罗氏血糖仪检测针刺尾静脉取出血样的血糖含量。记录造模大鼠空腹血糖≥7.0 mmo1/L,灌胃2 g/kg葡萄糖溶液2 h后血糖≥12 mmol/L认为2型糖尿病模型成功。将成模大鼠随机分为模型组、玄参多糖高、中、低剂量组及阳性药组。其中空白对照组和模型组灌胃给予10 ml/(kg·d)蒸馏水;玄参多糖高、中、低剂量组给药剂量按玄参人体临床用药上限的4、2、1倍量折算后给予实验小鼠,即0.16 g/kg、0.08 g/kg、0.04 g/kg;阳性药组按照0.15 g/kg的剂量给予盐酸二甲双胍水溶液;各组大鼠均在每日9:00~10:00按照10 ml/kg(体质量)灌胃给予相应的试剂,连续6周,每日1次。
2.2 大鼠生存状态的监测
记录各组大鼠体质量、日均饮食饮水量,同时监测各组大鼠的日常生存状态。
2.3 大鼠口服糖耐量的测定(OGTT)
末次给药前一天进行FBG、OGTT、AUC的测定,各组大鼠禁食不禁水10 h,给药2 h后针刺尾静脉取血,用罗氏血糖仪检测FBG同时灌胃2 g/kg(体质量)葡萄糖溶液,于30 min、60 min、120 min同上方法取血检测血糖值,并按照公式计算AUC值。
AUC=0.5×空腹血糖+30 min血糖+1.5×60 min血糖+120 min血糖
2.4 大鼠血清及肝脏生化指标的测定
末次给药前10 h禁食不禁水,给药2 h后称重,20%乌拉坦麻醉,腹主动脉取血,取血后室温静置15 min,4℃ 4 000 r/min离心10 min,取上清液于-80℃低温保存,用Elisa法测定血清中胰岛素分泌量(FINS)、C-肽及糖化血红蛋白(GHb)的含量。取同一肝小叶上1.00 g肝组织加9倍量冷生理盐水于冰水浴上手动匀浆制备10%肝组织匀浆,4℃ 3 500 r/min离心10 min,取上清用Elisa法测定肝脏组织中丙二醛(MDA)和超氧化物歧化酶(SOD)的含量。
2.5 统计学处理
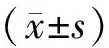
3 结果
3.1 玄参多糖对2型糖尿病大鼠生存状态及体质量的影响
正常对照组大鼠精神饱满,体形健壮,毛色光亮,反应正常;与正常对照组大鼠相比,模型组大鼠身体消瘦,精神萎靡且嗜睡,皮毛稀疏干燥无光泽,尿液伴有腐败性臭味,同时出现鼠尾大面积溃烂、足肿胀等糖尿病并发症症状。经给药治疗,玄参多糖高剂量组与阳性药组治疗效果较好,总体状态与空白对照组大鼠无差异,其他各给药组也有不同程度改善,结果见表1,图1、2。

表1 玄参多糖对2型糖尿病大鼠体质量的影响
注:与正常对照组比较,▲P<0.05,▲▲P<0.01,▲▲▲P<0.001;与模型组比较,★P<0.05,★★P<0.01。

图1 玄参多糖对2型糖尿病大鼠饮食量的影响
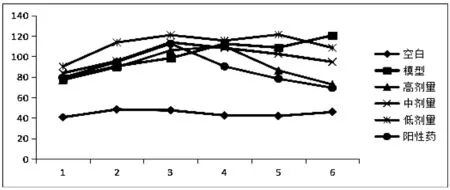
图2 玄参多糖对2型糖尿病大鼠饮水量的影响
3.2 玄参多糖对2型糖尿病大鼠OGTT和AUC的影响
与正常对照组相比,模型组大鼠0 min、30 min、60 min、120 min血糖及AUC值均极显著性升高(P<0.01),且120 min时血糖水平仍保持在很高的水平,糖耐量严重受损。与模型组相比,除多糖低剂量组外,其余各组均能在不同时段显著性或极显著性降低血糖(P<0.05或P<0.01);多糖高剂量组与阳性药组AUC出现极显著性降低(P<0.01),多糖中剂量组AUC能显著性降低(P<0.05),结果见表2。
3.3 玄参多糖对2型糖尿病大鼠血脂的影响
与正常对照组相比,模型组大鼠TG、TC、LDL-C的水平极显著性升高(P<0.001),HDL-C的水平极显著性下降(P<0.01)。与模型组相比,多糖高剂量组四项指标具有显著性回调作用(P<0.05);阳性药组四项指标具有极显著性回调作用(P<0.01);多糖中剂量组能降低LDL-C的水平(P<0.05),升高HDL-C的水平(P<0.05),结果见表3。
3.4 玄参多糖对2型糖尿病大鼠SOD和MDA的影响
与正常对照组相比,模型组大鼠肝脏中SOD水平极显著性降低(P<0.01),MDA水平极显著性升高(P<0.01)。与模型组相比,多糖中、高剂量组SOD水平显著性升高(P<0.05),高剂量组MDA水平极显著性下降(P<0.01)。中剂量组MDA水平显著性下降(P<0.05);阳性药组SOD水平极显著性升高(P<0.01),MDA水平极显著性下降(P<0.01),结果见表4。

表2 玄参多糖对2型糖尿病大鼠OGCT和AUC的影响
注:与正常对照组比较,▲P<0.05,▲▲P<0.01,▲▲▲P<0.001;与模型组比较,★P<0.05,★★P<0.01。

表3 玄参多糖对2型糖尿病大鼠血脂影响
注:与正常对照组比较,▲P<0.05,▲▲P<0.01,▲▲▲P<0.001;与模型组比较,★P<0.05,★★P<0.01。
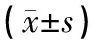
表4 玄参多糖对2型糖尿病大鼠SOD和MDA的影响
注:与正常对照组比较,▲P<0.05,▲▲P<0.01;与模型组比较,★P<0.05,★★P<0.01。
3.5 玄参多糖对2型糖尿病大鼠INS、C-肽、GHb的影响
与正常对照组相比,模型组INS、C-肽水平极显著性下降(P<0.01),GHb水平极显著性升高(P<0.01)。与模型组相比,中剂量组INS、C-肽水平显著性升高(P<0.05);高剂量组INS水平显著性升高(P<0.05),C-肽水平极显著性升高(P<0.01),GHb水平极显著性下降(P<0.01);阳性药组INS、C-肽水平极显著性升高(P<0.01),GHb水平极显著性下降(P<0.01),结果见表5。

表5 玄参多糖对2型糖尿病大鼠INS、C-肽、GHb的影响
注:与正常对照组比较,▲P<0.05,▲▲P<0.01;与模型组比较,★P<0.05,★★P<0.01。
4 讨论
2型糖尿病是目前全世界最严重的以高血糖为主要特征,是一种代谢性的慢性非传染性的疾病。本研究应用当前广泛诱导2型糖尿病的化学诱导剂STZ进行造模。STZ是链霉素菌与被烷基化硝亚基部分的糖分子组成的毒性物质,机制主要表现为选择性破坏β细胞上转运蛋白的转录,激活自身免疫应答和巨噬细胞抗原发生改变,导致胰岛β细胞结构的破坏及细胞的损伤[7-10]。本实验结果表明,模型大鼠血糖值明显升高,并伴有多饮、多食、多尿、体质量减轻等“三多一少”症状,抗氧化能力及胰岛素分泌量降低,脂代谢和糖代谢功能明显减退,说明2型糖尿病模型造模成功。
糖代谢通常是作为糖尿病研究最重要的方面之一,OGTT联合FBS是目前临床上最直接的糖尿病诊断方法,其中也包含对红细胞与血糖在血液中相互结合的产物HbA1c和经酶变后与胰岛素等量释放入血的C-肽含量的监测;同时糖代谢紊乱亦会影响机体脂代谢的功能,经常会引起血液中总胆固醇、甘油三酯、低密度脂蛋白水平升高和高密度脂蛋白水平降低的现象发生,减缓胰脏组织对胰岛细胞的分泌及胰岛细胞对葡萄糖的摄取与利用,也降低了外周细胞对胰岛细胞敏感性的调控,这也是引起糖尿病并发症的主要原因之一[11-12]。本实验结果表明,玄参多糖高剂量组能极显著性提高大鼠总胆固醇、甘油三酯、低密度脂蛋白的含量,降低高密度脂蛋白的含量,促进胰岛素分泌量及升高C-肽水平,其药效接近于阳性药二甲双胍,说明玄参多糖对糖代谢与脂代谢能起到全面回调的功能。
经研究发现,糖尿病不仅能导致机体糖代谢和脂代谢的紊乱,抗氧化能力也会随之减弱。机体的抗氧化能力主要与自由基酶SOD的清除氧自由基作用和脂质过氧化物MDA生物膜的表达作用有关,MDA升高会导致血管病变的发生,而SOD的降低引起机体自由基的紊乱,进一步会出现免疫功能的异常[13-14]。实验结果表明,玄参多糖中、高剂量组能显著性改善模型大鼠SOD和MDA的水平,说明玄参多糖不仅能治疗糖尿病的症状,还能提高机体的抗氧化能力。
糖尿病在中医学上应属“消渴”范畴,“消渴”一词首见于《黄帝内经》[15]。中医名家认为,消渴症的病因多以热毒为主,常见于热火郁结,伤阴耗津等症状;临床用药也多以清热解毒与凉血滋阴药为主[16]。本实验结果表明,玄参多糖高剂量对2型糖尿病大鼠有极显著性的降糖作用,与玄参清热凉血代表药的药效相符;但玄参多糖中剂量组对模型大鼠糖代谢、脂代谢及抗氧化能力也有一定的调节作用;从量效关系来看,说明玄参多糖中剂量(0.04 g/kg)可能是最低有效剂量,随着剂量的增加,机体的降糖效果越发明显。由于中药存在多药性多靶点的特性,是一个复杂的系统,很难反应药物的整体作用规律[17-18]。众所周知,一般药物在一定的范围内药效随着剂量增大而增强,但超出一定范围后,药效很可能会降低甚至消失,甚至产生毒副作用。玄参多糖随着给药剂量的提高,是否符合能上述规律,有待于进一步的研究。
[1] 国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2015:117-118
[2] 杜晓煌,方勇飞,李莉.玄参主要成分生物活性研究进展[J].中国药房,2015,26(15):2158-2160
[3] 王晴,韩文杰,张旗,等.玄参抗内毒素性急性肺损伤活性的谱效关系研究[J].中医药信息,2017,34(3):9-13.
[4] 黄才国,魏善建,刘军华.玄参中环烯醚epibueropyridinium A对醛糖还原酶的抑制作用[J].第二军医大学学报,2006,27(7):760-762.
[5] 王梅芳,竺天青.中药及其复方制剂治疗2型糖尿病的研究概况[J].中成药,2001,23(4):281.
[6] 白宇.玄参的药味药理学初步研究[D].哈尔滨:黑龙江中医药大学,2014.
[7] Tautsui H,Kinugawa S,Matsushina S,et al.Oxidative stress in cardiac and skeletal muscal dysfunction associated with diabetes mellitus[J].Chin Biochem Natr,2011,48(1):68-69.
[8] 宓文佳,陈素红,吕圭源,等.铁皮石斛根提取物对2型糖尿病模型小鼠降糖作用的研究[J].中药药理与临床,2015,31(1):125-129.
[9] 鞠霖杰,温小花,舒娈.红景天苷对胰岛β细胞保护作用研究及机制探讨[J].南京中医药大学学报,2016,32(5):456-460.
[10] 陈金铭,赵丽薇,庄鹏宇,等.银杏种子中胰蛋白酶抑制剂对2型糖尿病大鼠细胞与体液免疫的影响[J].中医药学报,2015,43(4):40-42.
[11] 杨勇,容蓉,蒋春红.山茱萸不同极性提取物降糖作用的研究[J].辽宁中医杂志,2011,38(1):171-172.
[12] 张文萍,吴敏.苦味中药降糖效应及机理研究[J].辽宁中医药大学学报,2013,15(6):93-95.
[13] 龙少华,李晓丹,徐新颖,等.海带面对糖尿病模型大鼠降糖作用的影响[J].中国中医药信息,2011,18(6):40-42.
[14] 李道中,彭代银,徐先祥,等.菟丝子多糖降糖作用机制研究[J].中华中医药学刊,2008,26(12):2717-2718.
[15] 苏静,周少英,阚敏宸,等.山楂叶总黄酮对2型糖尿病大鼠肾脏组织保护作用的研究[J].中医药信息,2017,34(2):22-27.
[16] 洪金妮,杨金霞,王学美.清热解毒中药降糖作用及机制研究进展[J].中草药,2015,46(19):2656-2660.
[17] 张莹莹,关璐,周妍妍,等.御唐丸对2型糖尿病大鼠氧化应激的影响[J].中医药学报,2016,44(5):55-57.
[18] 王亚威,王鑑威.养阴健脾汤对胰岛素抵抗的2型糖尿病患者的影响[J].中医药学报,2016,44(2):87-88.
TheEffectofPolysaccharidesfromRadixScrophulariaeonType2DiabetesRats
ZHAOHong-wei1,2,ZHANGNing1,2,LIZi-hui1,2,DONGWan-ru1,3,LIUShu-min1,3*
(1.TCMMedicinalTheoryInnovationTeamofHeilongjiangHigherEducationalInstitutions,Harbin150040,China; 2.HeilongjiangUniversityofChineseMedicine,Harbin150040,China; 3.DrugSafetyEvaluationCenter,HeilongjiangUniversityofChineseMedicine,Harbin150040,China)
Objective:To study the effect of polysaccharides fromRadixScrophulariaein reducing blood sugar of type 2 diabetes rats. Methods:The diabetes model was established by injecting streptozotoin(STZ) combined with fat diet. The changes of weight, intake of diet and water, and living status indexes were observed; fasting blood sugar and sugar tolerance were monitored; indexes of glycosylated hemoglobin, C-peptides, blood fat, and insulin were measured. On this basis, the effect of polysaccharides fromRadixScrophulariaewas elvaluted. Results:Medium-dose and high-dose Polysaccharides fromRadixScrophulariaesignificantly improved the metabolisms of sugar and fat(P<0.01 orP<0.05), and they enhanced the antioxidant activity(P<0.05)and increased insulin(P<0.05), also they significantly reduced blood sugar(P<0.05). Conclusion:Polysaccharides fromRadixScrophulariaecan reduce blood sugar of type 2 diabetes rats. The high-dose group was slightly better than the medium-dose group.
Polysaccharides fromRadixScrophulariae; Blood sugar; Insulin; Type 2 diabetes
国家重点基础研究发展计划“973”计划(No.2013CB531804)
赵洪伟(1992-),女,黑龙江中医药大学2015级临床药学专业硕士研究生,主要研究方向:中药性味理论。
刘树民*(1963-),男,教授,博士研究生导师,主要研究方向:中药临床药效物质基础及中药药性理论。
2016-10-18
修回日期:2016-11-10
R285.5
:A
:1002-2406(2017)05-0008-05
