花旗泽仁对胰岛素抵抗大鼠肝脏CaSR mRNA、蛋白表达及AKT活性的影响
2017-08-30刘笑男李璐赵聪郑义阚玉娜刘萍葛鹏玲
刘笑男,李璐,赵聪,郑义,阚玉娜,刘萍,葛鹏玲*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.牡丹江医学院,黑龙江 牡丹江 157000; 3.牡丹江医学院附属江旗医院,黑龙江 牡丹江 157011; 4.中国人民解放军军事经济学院门诊部,湖北 武汉 430000)
实验研究
花旗泽仁对胰岛素抵抗大鼠肝脏CaSR mRNA、蛋白表达及AKT活性的影响
刘笑男1,李璐2,赵聪3,郑义4,阚玉娜1,刘萍1,葛鹏玲1*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.牡丹江医学院,黑龙江 牡丹江 157000; 3.牡丹江医学院附属江旗医院,黑龙江 牡丹江 157011; 4.中国人民解放军军事经济学院门诊部,湖北 武汉 430000)
目的:观察花旗泽仁对胰岛素抵抗(IR)大鼠肝脏组织中钙敏感受体(CaSR) mRNA、蛋白表达及蛋白激酶B(AKT)活性的影响,探讨花旗泽仁改善2型糖尿病胰岛素抵抗的作用机制。方法:雄性Wistar大鼠用复合脂肪乳连续灌胃4周配合小剂量注射链脲佐菌素的方法复制2型糖尿病胰岛素抵抗模型,将大鼠随机分为花旗泽仁组、阳性对照组、模型对照组、空白对照组。检测空腹血糖(FBG)及空腹血清胰岛素(FINS),并计算胰岛素敏感指数(ISI);采用qRT-PCR、Western blot技术检测CaSR mRNA、CaSR蛋白、磷酸化AKT(Ser473和Thr308)蛋白表达水平。结果:与空白对照组比较,模型对照组组大鼠FBG及FINS水平明显增高,ISI显著降低;与模型对照组相比,花旗泽仁组和阳性对照组大鼠FBG和FINS水平明显降低,ISI明显升高;与空白对照组比较,模型对照组大鼠肝脏组织中CaSR mRNA表达水平明显降低;与模型对照组相比,花旗泽仁组和阳性对照组大鼠肝脏组织中CaSR mRNA表达水平显著增高;与空白对照组比较,模型组大鼠肝脏组织中CaSR蛋白、磷酸化AKT(Ser473和Thr308)蛋白表达量均显著降低;与模型对照组相比,花旗泽仁组和阳性对照组大鼠肝脏组织中CaSR 蛋白、磷酸化AKT(Ser473和Thr308)蛋白表达量均明显增加。结论:花旗泽仁可能通过调节CaSR基因及蛋白表达,改善2型糖尿病胰岛素抵抗。
2型糖尿病;胰岛素抵抗;钙敏感受体;AKT;花旗泽仁
2型糖尿病(Type 2 diabetes mellitus,T2DM)是一种与肥胖有关的慢性内分泌和代谢性异常疾病。目前认为胰岛素抵抗是2型糖尿病重要的发病基础。胰岛素抵抗(insulin resistance, IR)是指机体靶器官或组织对胰岛素生物效应的敏感性降低或丧失,即胰岛素促进葡萄糖摄取和利用的效率下降,机体代偿性分泌过多胰岛素产生高胰岛素血症,以维持血糖的稳定[1]。胰岛素抵抗及其次生代谢障碍是一种常见的导致冠心病和糖尿病的重要因素[2-4]。
目前,临床治疗T2DM的西药多为胰岛素增敏剂,长久使用存在很多不良反应。中医药重视整体调节及辨证论治,且中药治疗具有多通路,多靶点、毒副作用少等特点[5-6]。花旗泽仁是临床用于治疗脾虚湿盛,湿热内蕴型糖尿病的经验方。本课题组前期研究表明,花旗泽仁可以通过提高胰岛素敏感性,调节TNF-α水平和瘦素水平来改善2型糖尿病胰岛素抵抗[7-11],同时能降低血清总胆固醇,甘油三酯和游离脂肪酸水平[12]。本实验拟通过观察花旗泽仁对大鼠肝脏组织中CaSR mRNA、CaSR蛋白表达及AKT活性的影响来探讨花旗泽仁治疗2型糖尿病胰岛素抵抗的作用机制。
1 材料与方法
1.1 实验动物
雄性Wistar大鼠50只,SPF级,体质量180 g~220 g,由黑龙江中医药大学实验动物中心提供,动物许可证号:SCXK(鲁-2009-0007)。造模前,实验动物适应性喂养7天,明暗交替周期为12 h,自由摄食和饮水,室内温度约为(25±5)℃,湿度约为(60±10)%。
1.2 药品与试剂
花旗泽仁复方(黑龙江中医药大学附属第一医院中药局提供);链脲佐菌素(Streptozocin,STZ)、丙硫氧嘧啶、RNase-free water(Sigma公司);胆固醇(上海山浦化工有限公司);果糖(上海兰季科技有限公司);蔗糖、柠檬酸、柠檬酸钠、葡萄糖、无水乙醇、丙烯酰胺、10%过硫酸铵、甲醇、10%十二烷基硫酸钠(天津天力化学试剂有限公司);谷氨酸钠(广东翁江化学试剂有限公司);Tween80(天津大茂化工试剂有限公司);丙二醇(天津富宁精细化工有限公司);诺和灵R生物合成人胰岛素(丹麦诺和诺德公司);马来酸罗格列酮(葛兰素史克公司);Ins放射免疫试剂盒(北方生物技术研究所);Trizol Reagen(Invitrogen公司);焦炭酸二乙酯(DEPC)(Amresco公司);AccuPower RocketScript RT PreMix、AccuPower GreenStar qPCR PreMix(Bioneer公司);氯仿、异丙醇(天津致远化学试剂有限公司);Tris-HCl,pH 6.8、Tris-HCl,pH 8.8(北京诺博莱德公司);N,N,N',N'-四甲基二乙胺(TEMED)(上海海曲化工有限公司);蛋白裂解液、4×蛋白上样缓冲液、ECL化学发光试剂盒(Solarbio公司);蛋白预染Marker(Fermentas公司);AKT一抗、T308一抗、S473一抗(兔、CST公司);CaSR一抗(小鼠)、β-actin(兔)(abcam公司);二抗(中杉金桥公司);Tween20(湖北兴银河化工有限公司);5%脱脂奶粉(伊利公司)。
1.3 仪器
分析天平(Sartorius公司);酶标仪(BIO-TEX Instruments INC公司);罗康全活力型血糖监测仪(德国罗氏公司);放射免疫计数器(西安核仪器厂);梯度单头PCR仪 Bio-RadS1000、Real-time PCR仪Bio-Rad CFX96、电泳仪、Universal Hood 2型Bio-RAD凝胶成像系统、转膜仪(美国伯乐公司);紫外分光光度计(岛津公司);离心机(Thermo公司)。
1.4 胰岛素抵抗大鼠模型制备
将Wistar大鼠按照随机原则分为模型对照组(40只)和空白对照组(10只),模型对照组灌胃脂肪乳10 ml/(kg·d),连续灌胃20天后,禁食12 h,正常给水,腹腔注射链脲佐菌素(Streptozocin,STZ)40 mg/(kg·d),接连注射2天,每次腹腔注射STZ 15 min后,给大鼠腹腔注射胰岛素0.4 U,并于2.5 h和5 h后分别灌胃给予25%葡萄糖10 ml/kg。最后一次注射STZ 72 h后,空腹血糖值≥16.7 mmol/L,且胰岛素敏感指数(Insulin Sensitivity Index,ISI)与空白对照组比较具有显著差异的大鼠作为胰岛素抵抗模型大鼠。
1.5 分组及给药
取36只造模成功大鼠按随机原则分成三组:模型对照组(10只)、花旗泽仁组(10只)和阳性对照组(10只)。花旗泽仁组按4.5 g/kg灌胃给药;阳性对照组按0.4 mg/kg灌胃给药;空白对照组和模型对照组分别给予同等剂量的蒸馏水,共灌胃28天。
1.6 指标及检测
4周后,大鼠腹腔注射戊巴比妥(30 mg/kg)进行麻醉,腹主动脉采血,血液静置30 min后,4℃ 3 000 rpm离心15 min,吸取上清液,-80℃保存待测。随后迅速打开腹腔取出肝脏组织约100 mg剪碎置于液氮中迅速冷冻,2 h后转移至-80℃冰箱保存,待测。用qRT-PCR和Western blot技术检测钙敏感受体(CaSR)mRNA、蛋白、磷酸化AKT(Ser473和Thr308)蛋白表达水平。
1.6.1 一般指标
观察大鼠行为表现、体质量。
1.6.2 空腹血糖(FBG)检测方法
用毛细玻璃管法尾尖取血后,滴于血糖试纸上,应用血糖仪测试空腹血糖(FBG)。
1.6.3 空腹胰岛素(FINS)检测方法
眼底取血约1.0 ml置于1.5 ml EP管中,按照酶联免疫法(ELISA)测空腹胰岛素,按试剂盒说明书进行实验。
1.6.4 计算胰岛素敏感指数(ISI)
采用李光伟法[13]计算ISI。
ISI =ln[1/(FBG×FINS)]
1.6.5 肝脏组织中CaSR mRNA的表达
取50 mg样本在研钵中加入液氮快速研磨成为细小颗粒,并将研磨好的样本转移入冰浴中的l.5 ml EP管中,参照TRIZOL(Invitrogen)提取RNA的方法提取总RNA[14];然后进行反转录和扩增,并测定总RNA的完整性,计算RNA的浓度和纯度。
反应体系:2×Greenstar Master Mix 12.5 μl+cDNA样本2.0 μl+引物F-primer:TTCTTTGAACCTGGACGACGAGT 1.0 μl +引物R-primer:GCGAGGAAGGATTTGTAC 1.0 μl + DEPC 8.5 μl ;反应条件:95℃预变性10 min、95℃变性10 s、47℃退火30 s、47℃延伸30 s、40个循环。
1.6.6 蛋白印迹法(Western blot)检测各组织钙敏感受体(CaSR)蛋白表达量及Akt活性
将肝脏组织研至粉末状,每20 mg中加入150~250 μl组织裂解液,静置于冰上反应30 min;然后12 000 rpm离心10 min;取出上清液,加入蛋白上样缓冲液,煮沸5 min,使其热变性,-20°C保存备用。热变性后的样品,即可进行电泳(分离胶配制浓度10%,浓缩胶配制浓度5%)。电泳后,转移至硝酸纤维素(PVDF)膜上(恒流转膜90 min左右)。转膜后,将膜取出,朝向胶的方向为正面,在左上角做标记,并放入5%脱脂牛奶封闭液中,37℃平缓摇动1 h。封闭结束后,用TBST洗膜,放置摇床上,室温摇动10 min,重复3次。洗完膜后,将一抗用TBST稀释比例为1:1 000,将膜放入一抗中4℃过夜,第二日,用TBST洗膜3次,每次10 min。将二抗用TBST稀释比例为1∶5 000,将PVDF膜放入二抗中,室温孵育1 h,用TBST洗涤3次,每次10 min。配制比例是1:1的ECL发光液,混匀后滴加到PVDF膜正面上,确保ECL发光液反应2~3 min后置于凝胶成像系统中曝光,尽快拍照。
1.7 统计学处理
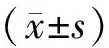
2 实验结果
2.1 一般指标结果
空白对照组大鼠皮毛平整、色泽光亮、活动迅速;模型对照组大鼠毛发暗淡无光、动作缓慢、精神萎靡不振;模型对照组大鼠与空白对照组大鼠对比,其摄食量、饮水量、尿量都明显增加,体质量下降;花旗泽仁组及阳性对照组大鼠与模型对照组比较,毛发有色泽、精神好转、活动增多,在摄食量、饮水量和尿量方面有所减少,体质量上升。
2.2 花旗泽仁对大鼠体质量、FBG、FINS及ISI的影响
如表1、图1所示,与空白对照组比较,模型对照组大鼠体质量减少,具有显著差异(P<0.01);与模型对照组比较,花旗泽仁组及阳性对照组大鼠体质量升高,但不具有显著差异(P>0.05)。如表1、图1、2、3、4所示,与空白对照组比较,模型对照组大鼠血糖(FBG)和胰岛素(FINS)水平明显升高,胰岛素敏感指数(ISI)显著降低(P<0.001);与模型对照组比较,花旗泽仁组和阳性对照组的空腹血糖(FBG)和空腹胰岛素(FINS)水平明显下降,胰岛素敏感指数(ISI)显著升高(P<0.001)。
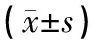
表1 花旗泽仁对大鼠体质量、FBG、FINS、ISI的影响
注:与空白对照组比较,△△△P<0.001,△△P<0.01,△P<0.05;与模型对照组比较,***P<0.001,**P<0.01,*P<0.05。

图1 花旗泽仁对IR大鼠体质量的影响
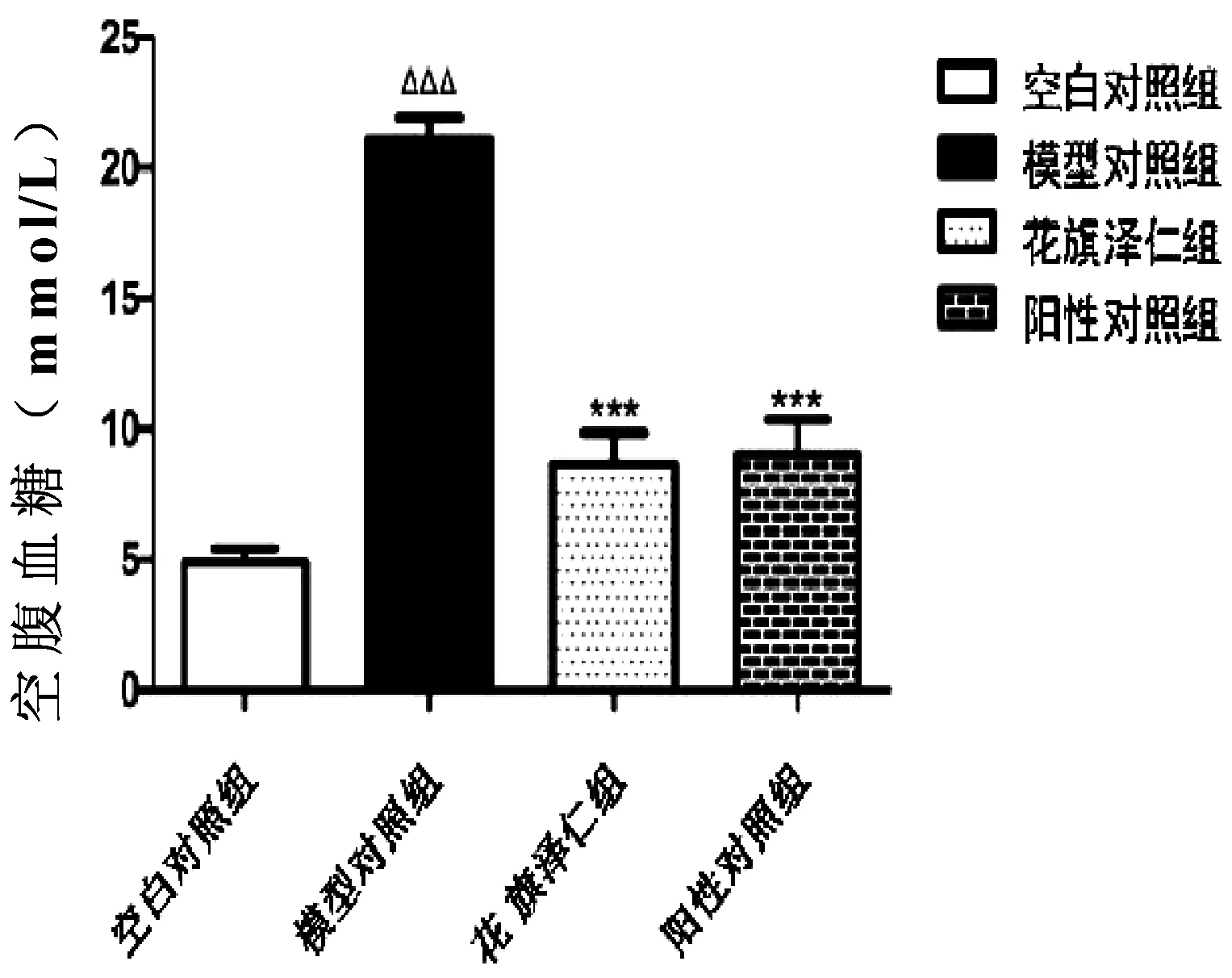
图2 花旗泽仁对IR大鼠空腹血糖的影响

图3 花旗泽仁对IR大鼠空腹胰岛素的影响

图4 花旗泽仁对IR大鼠胰岛素敏感指数的影响
2.3 花旗泽仁对IR大鼠肝脏组织中CaSR mRNA表达水平的影响
如表2、图5所示,在肝组织中,与空白对照组比较,模型组CaSR mRNA表达水平下调(P<0.001);与模型对照组比较,花旗泽仁组、阳性对照组大鼠肝脏中CaSR mRNA的表达水平显著上调(P<0.05,P<0.01)。

表2 各组大鼠肝脏组织上CaSR mRNA表达水平的比较
注:与空白对照组比较,△△△P<0.001;与模型对照组比较,**P<0.01,*P<0.05。
2.4 花旗泽仁对胰岛素抵抗(IR)大鼠肝脏组织中钙敏感受体(CaSR) 蛋白表达的影响
如表3、图6所示,与空白对照组比较,模型对照组大鼠肝脏组织中CaSR蛋白表达显著下降(P<0.01);与模型对照组比较,花旗泽仁组、阳性对照组大鼠肝脏中CaSR蛋白表达水平明显升高(P<0.05)。
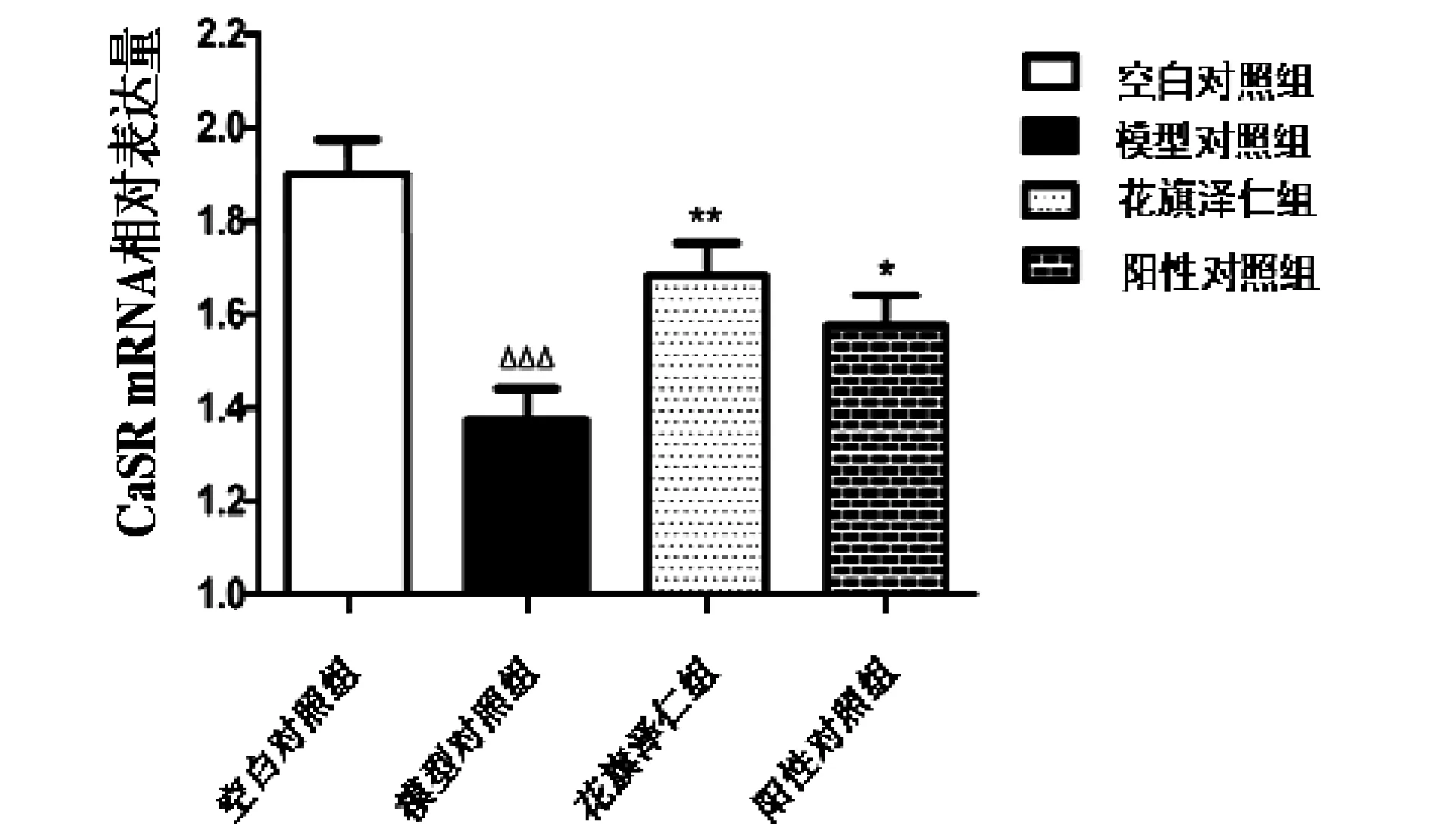
图5 花旗泽仁对IR大鼠肝脏组织中CaSR mRNA表达水平的影响
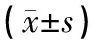
表3 各组大鼠在肝脏组织中CaSR蛋白表达水平的比较
注:与空白对照组比较,△△P<0.01;与模型对照组比较,*P<0.05。

图6 花旗泽仁对IR大鼠肝脏组织中CaSR 蛋白表达水平的影响注:A:Western blot检测结果;B:蛋白灰度值。

图7 花旗泽仁对IR大鼠肝脏组织中磷酸化Akt蛋白表达水平的影响 注:A:Western blot检测结果;B:蛋白灰度值。
2.5 花旗泽仁对胰岛素抵抗(IR)大鼠肝脏组织中蛋白激酶B(AKT)活性的影响
如表4、图7所示,与空白组比较,模型对照组大鼠肝脏组织中磷酸化AKT(Ser473和Thr308)蛋白含量显著下降(P<0.05,P<0.01);与模型对照组比较,花旗泽仁组、阳性对照组大鼠磷酸化AKT(Ser473和Thr308)蛋白表达水平明显升高(P<0.05,P<0.01)。

表4 各组大鼠肝脏组织中磷酸化AKT蛋白水平的比较
注:与空白对照组比较,△△△P<0.001;与模型对照组比较,**P<0.01,*P<0.05。
3 讨论
研究证实,肝脏中含有大量胰岛素受体,能结合胰岛素,在调节葡萄糖代谢上发挥重要作用,是胰岛素敏感组织,并且肝细胞中葡萄糖的吸收和利用出现障碍可能导致胰岛素抵抗[15-16]。
磷脂酰肌醇3-激酶(PI3K)蛋白家族是胰岛素信号传导的重要途径,根据其不同的作用底物可分为三种亚型:I型、Ⅱ型、Ⅲ型,其中I型又分成IA和IB亚型。PI3K的IA亚型和IB亚型都能被G 蛋白偶联受体激活,使其在细胞的生长、分化、凋亡及葡萄糖的转运等多种生物过程中发挥重要作用。丝/苏氨酸激酶(ser- ine threonine kinase, AKT) 位于PI3K这一信号传导通路的中心环节,其主要作用是负责该通路中生物信息的传导,AKT分为三种亚型:AKT1、AKT2、AKT3,其中AKT2主要分布在胰岛素敏感组织中,若AKT2传导信号受抑制则干扰胰岛素信号传导。PI3K/AKT信号通路与胰岛素抵抗的发生发展关系密切,激活PI3K信号通路,可激活绑定在磷脂酰肌醇-3,4,5-三磷酸上的丝氨酸或苏氨酸(S473,T308)两个主要磷酸化位点,从而激活AKT使其发挥作用[17]。
在本研究中,通过模型对照组和空白对照组比较,发现模型对照组的CaSR的mRNA和蛋白表达量降低,且PI3K/AKT活性被抑制,文献表明,钙敏感受体拮抗剂可抑制Akt的活性,钙敏感受体激动剂能增强Akt活性[18],提示CaSR和PI3K/AKT之间密切相关。
本实验中,与模型对照组比较,花旗泽仁组的CaSR mRNA、CaSR蛋白表达量显著升高,且随着花旗泽仁组胰岛素敏感指数的增加,Ser473和Thr308蛋白表达量也随之增加。我们推测花旗泽仁可能通过激活PI3K/AKT信号通路上AKT的Ser473和Thr308磷酸位点,影响PI3K通路改善2型糖尿病胰岛素抵抗。且此作用可能是通过影响CaSR mRNA、CaSR蛋白表达量实现的。花旗泽仁可能通过调节CaSR,激活PI3K/AKT信号通路缓解胰岛素抵抗。本项研究的主要的目的是探究改善胰岛素抵抗的新靶点,CaSR的发现为我们治疗2型糖尿病胰岛素抵抗拓展了新方向。
[1] Panzer C,Lauer MS,Brieke A,et al.Association of fasting plasma glucose with heart rate recovery in healthy adults: a population-based study[J]. Diabetes, 2002,51(3):803-807.
[2] Danaei G, Finucane MM, Lu Y,et al.National, regional, and global trends in fasting plasma glucose and diabetes prevalence since 1980: systematic analysis of health examination surveys and epidemiological studies with 370 country-years and 2.7 million participants[J].Lancet, 2011,378(9785): 31-40.
[3] Wild S,Roglic G,Green A,et al.Global prevalence of diabetes: estimates for the year 2000 and projections for 2030[J].Diabetes Care, 2004,27(5):1047-1053.
[4] 马育轩,于国强,张洪财,等.针刺配合黄连温胆汤加减对代谢综合征大鼠胰岛素抵抗及脂肪细胞因子的影响[J].中医药信息,2017,34(2):71-74.
[5] 张莹莹,关璐,周妍妍,等.御唐丸对2型糖尿病大鼠氧化应激的影响[J].中医药学报,2016,44(5):55-57.
[6] 王亚威,王鑑威.养阴健脾汤对胰岛素抵抗的2型糖尿病患者的影响[J].中医药学报,2016,44(2):87-88.
[7] Pengling Ge,Ping Liu,Yuxuan Ma,et al.Influence of HQZR on the Insulin Sensitivity in Insulin Resistance Rats[J].Information on Traditional Chinese Medicine,2012(6):99-101.
[8] Pengling Ge,Dongwei Han,Ji Li.Influence of HQZR on the Adipocytokines in Insulin Resistance RatsⅡ[J].Acta Chinese Medicine and Pharmacology,2012(5):32-33.
[9] 葛鹏玲,张宇驰,韩东卫,等.花旗泽仁对胰岛素抵抗大鼠胸主动脉血管张力、血清一氧化氮含量以及骨骼肌胰岛素受体mRNA 基因表达的影响[J].中医药信息,2016,33(6):23-27.
[10] 葛鹏玲,温薇,李冀,等.花旗泽仁对胰岛素抵抗大鼠脂肪因子的影响Ⅰ[J].中医药学报,2012,40(6):29-30.
[11] 葛鹏玲,韩东卫,李冀.花旗泽仁对胰岛素抵抗大鼠脂肪因子的影响Ⅱ[J].中医药学报,2012,40(5):32-33.
[12] Pengling Ge,Qingyun Li,et al.Influence of HQZR on the Lipid Metabolism in Insulin Resistance Rats[J].Information on Traditional Chinese Medicine,2012(5):87-89.
[13] 李光伟,潘孝仁,Stephen L,等.检测人群胰岛素敏感性的一项新指数[J].中华内科杂志,1993,32(10):656-660.
[14] Singh G, Kumar S, Singh P, et al. A quick method to isolate RNA from wheat and other carbohydrate-rich seeds[J].Plant Molecular Biology Reporter,2003,21(1):93.
[15] Fluck CE,Slotboom J,Nuoffer JM,et al.Normal hepatic glycogen storage after fasting and feeding in children and adolescents with type 1 diabetes[J].Pediatr Diabetes,2003,4(2):70-76.
[16] El-Serag HB,Tran T,Everhart JE,et al.Diabetes increases the risk ofchronic liver disease and hepatocellular carcinoma[J].Gastroenterology,2004,126(2):460-468.
[17] Montagnani M,Ravichandran L,Chen H,et al.Insulin receptor substrate-1 and phosphoinositide-dependent kinase-1 are required for insulin-stimulated production of nitric oxide in endothelial cells[J].Mol Endocrinol,2002,16(8):1931-1942.
[18] Li HX, Kong FJ, Bai SZ, et al.Involvement of calcium-sensing receptor in oxLDL-induced MMP-2 production in vascular smooth muscle cells via PI3K/Akt pathway[J].Mol Cell Biochem,2012,362(1-2):115-122.
InfluenceofHuaqizerenontheExpressionsofProteinCaSR,CaSRmRNA,andProteinAKTintheLiverTissueofT2DMRatswithIR
LIUXiao-nan1,LIlu2,ZHAOCong3,ZHENGYi4,KANYu-Na1,LIUPing1,GEPeng-Ling*
(1.HeilongjiangUniversityofChineseMedicine,Harbin150040,China;2.MudanjiangMedicalCollege,Mudanjiang157000;3.RedFlagHospitalAffiliatedMudanjiangMedicalCollege,Mudanjiang157011;4.ChinesePeople’sLiberationArmyMilitaryEconomicsInstituteout-patientDepartment,Wuhan430000,China)
Objective:To observe the influence of Huaqizeren(HQZR) on the expressions of protein CaSR(calcium-sensing receptor), CaSR mRNA, Protein AKT (Kinase B) of the liver tissues in rats with insulin resistance(IR), in order to explore the mechanism of HQZR improving T2DM (Type 2 Diabetes Mellitus) with IR. Methods:The IR model was established with compound fat emulsion diet for four weeks and small-dose STZ injection in male Wistar rats. The rats were randomly divided into the normal control group, the model group, the HQZR group, and the positive control group. FBG(Fasting blood glucose) and FINS(fasting insulin) were tested and ISI (insulin sensitivity index) was calculated. The expressions of CaSR mRNA, protein CaSR and phosphorylated AKT(Ser473 and Thr308) were detected with qRT-PCR and Western blot techniques. Results:In terms of the levels of FBG, FINS, and ISI, FBG and FIN were significantly increased with decreased ISI in the model group, compared to the normal control group after medication; FBG and FINS were significantly decreased with increased ISI in both the HQZR group and the positive control group compared to the normal group. In terms of the expression of CaSR mRNA, it was significantly decreased in the model group compared to the normal control group; it was significantly increased after the treatment in both the HQZR group and the positive control group. In terms of protein expressions of CaSR and phosphorylated AKT, they were decreased after modeling, whereas they were significantly increased after medication both in the HQZR group and in the positive control group. Conclusion:HQZR may improve IR by regulating CaSR mRNA, protein CaSR and AKT.
Type 2 diabetes mellitus(T2DM); Insulin resistance(IR); Calcium-sensing receptor (CaSR); AKT; Huaqizeren(HQZR)
国家科技重大专项(No.2012ZX09103201-018);国家自然科学基金项目(No.81273650);黑龙江省自然科学基金项目(No.LC2011C03);黑龙江中医药大学“优秀创新人才支持计划” (No. 2012RCD19);黑龙江省博士后科研启动基金项目(No.LBH-Q15136);哈尔滨市科技创新人才研究专项资金项目(No.2016RAXXJ100);黑龙江中医药大学科研基金项目(No.201515)
刘笑男(1991-),女,黑龙江中医药大学2014级药理学专业硕士研究生。
葛鹏玲*(1974-),女,医学博士,教授,博士研究生导师,主要研究方向:中医药治疗2型糖尿病的现代药理学研究。
2016-05-10
修回日期:2016-06-04
R285.5
:A
:1002-2406(2017)05-0028-06
