布渣叶总黄酮大孔吸附树脂纯化工艺研究
2017-08-30李智勇孙冬梅王洛临
李智勇,孙冬梅*,王洛临
(1.广东省中医药工程技术研究院,广东 广州 510095;2.广东省中医药研究开发重点实验室,广东 广州 510095)
布渣叶总黄酮大孔吸附树脂纯化工艺研究
李智勇1,2,孙冬梅1,2*,王洛临1,2
(1.广东省中医药工程技术研究院,广东 广州 510095;2.广东省中医药研究开发重点实验室,广东 广州 510095)
目的:确定布渣叶总黄酮(total flavonoids inMicrocospaniculataL.,TFMP)的大孔吸附树脂纯化工艺参数。方法:采用单因素试验法筛选适宜的大孔树脂;并对其纯化工艺条件进行优化。结果:D101分离TFMP的工艺条件为上柱药液浓度为0.15 g/mL,上柱流速0.5 BV/h,上样体积8.5 BV,树脂柱径高比为1∶8,以5 BV水洗脱,洗脱溶剂为80%的乙醇,洗脱流速1 BV/h,洗脱体积3.75 BV,大孔树脂可重复利用5次,TFMP纯化后含量达84.09%,精制度达220.03%。结论: D101可以用于富集,纯化TFMP。
布渣叶总黄酮;大孔吸附树脂;纯化工艺
布渣叶为椴树科植物破布叶(MicrocospaniculataL.)的叶,具有消食化滞,清热利湿等功效,主要含有黄酮、生物碱、三萜、挥发油等化合物。前期研究发现,布渣叶提取物能显著降低高脂血症小鼠模型血清中总胆固醇(TC)和甘油三酯(TG)的含有量,其中黄酮类化合物为其主要有效成分。本研究在前期布渣叶总黄酮提取研究的基础上[1],采用大孔树脂进行纯化工艺研究,为其有关制剂提供物质基础。
1 仪器与试药
紫外分光光度计UV PC-2550(岛津);Sartorius BP 211D电子分析天平;Agilent 6890-5973N GC-MS气质联用仪;Agilent 7694E顶空进样器;大孔吸附树脂:D101(天津市海光化工有限公司),AB-8(南开大学化工厂),HPD100、HPD300、HPD400、HPD450(河北沧州宝恩化工有限公司)。
布渣叶药材购于广州养和医药有限公司,经广东省中医药工程技术研究院孙冬梅主任中药师鉴定为正品;TFMP提取物(自制);芦丁对照品(080-9303,中国药品生物制品检定所);药用乙醇(广宁县顺宁葡萄糖药业有限公司);盐酸,氢氧化钠,亚硝酸钠,硝酸铝均为分析纯。
2 方法与结果
2.1 TFMP的UV测定
2.1.1 对照品溶液的配制
精密称取在120℃干燥至恒重的芦丁对照品20.5 mg置100 mL容量瓶中,加70%乙醇至刻度,摇匀,制成每1 mL含0.205 mg芦丁的对照品溶液。
2.1.2 供试品溶液的配制
取布渣叶提取物(约相当于2.5 g布渣叶),精密称定,置具塞三角瓶中,精密加入70%乙醇50 mL,密塞,称定重量,超声处理(功率200 W,频率40 KHz)1 h,放冷,再称定重量,用70%乙醇补足减失的重量,摇匀,滤过,取滤液,即得[2]。
2.1.3 方法学考察
精密吸取对照品溶液0,0.5,1.0,2.0,3.0,4.0和5.0 mL,分别置25 mL容量瓶中,加水至6 mL,加5%亚硝酸钠溶液1 mL,摇匀,放置6 min,加10%硝酸铝溶液1 mL,摇匀,放置6 min,加氢氧化钠试液5 mL,再加水至刻度,摇匀,放置15 min;以相应试剂为空白,测定500 nm处吸光度[2],以吸光度(A)为纵坐标,浓度为横坐标(C),绘制标准曲线,得回归方程A=0.011 49 C-0.009 64(r=0.999 63),表明线性良好。取同一供试品溶液,在显色后5,10,15,20,25,30 min测定,结果显示经过20 min后吸光度明显下降,因此控制测定时间在显色后20 min以内。
2.1.4 测定法
精密量取供试品溶液0.2 mL,置25 mL容量瓶中,照“2.1.3”项下的方法,自“加水至6 mL”起,依法测定吸光度,从标准曲线上读取浓度,计算总黄酮含量。经测定,本实验用布渣叶中总黄酮含量为6.81%。
2.2 TFMP的大孔吸附树脂纯化工艺研究
2.2.1 布渣叶提取液的制备
取布渣叶500 g,照优选的提取工艺提取,回收乙醇,浓缩至无醇味,加入一倍量的蒸馏水,搅匀,静置过夜,滤过,沉淀物用水洗涤2次,洗涤液与滤液合并,置1 000 mL容量瓶中,加水至刻度,摇匀,即得。依法测定吸光度并计算总黄酮的得率为6.29%。
2.2.2 大孔吸附树脂的选择[3]
称取已预处理[4]的HPD100、HPD300、HPD400、HPD450、AB-8、D101等大孔吸附树脂各3 g,置100 mL具塞三角瓶中,加入30 mL布渣叶提取液,摇床振摇12 h,过滤,大孔吸附树脂以30 mL水洗涤,合并水洗液和滤液,转移至100 mL容量瓶中,加水至刻度,摇匀,备用;树脂转移至100 mL具塞三角瓶中,加入乙醇25 mL,超声处理(功率200 W,频率40 KHz)15 min,取出,放置3 h,过滤,继续加乙醇洗涤至洗出液呈无色,合并滤液和洗涤液,转移至100 mL量瓶中,加乙醇至刻度,摇匀,备用;分别测定吸光度,计算比吸附量,比洗脱量和解吸附率,结果如表1。

表1 不同大孔吸附树脂对TFMP的吸附考察
注:比吸附量=(上样量-残余量)/树脂重量;比洗脱量= 醇洗脱量/树脂重量;解吸附率(%)=醇洗脱量/吸附量×100%。
结果可知,除HPD450的比吸附量和比洗脱量相对较低外,其余均无显著差异,但从解吸附率来看,D101型的解吸附率优于其他各型号,确定选用D101。
2.3 吸附条件优化
2.3.1 上样液pH值对D101总黄酮吸附率的影响[5]
取布渣叶提取液(pH值为3.4),加入稀HCl试液或稀NaOH试液,调节使pH值分别为2、4、6、8,吸取原液和各pH值溶液各20 mL,置入已称取2 g D101的三角瓶中,轻轻振摇,并放置过夜,过滤,D101以30 mL水洗涤,合并,转移至50 mL容量瓶中,加水至刻度,摇匀,依法测定吸光度,计算总黄酮吸附率[计算公式:吸附率(%)=(上样量-残余量)/上样量×100%]。结果上样药液pH值2、3.4、4、6、8时TFMP吸附率分别为93.86%、92.19%、87.56%、88.4%、91.38%,考虑到生产的方便性和实际操作性,选用原液(pH值3.4)上样。
2.3.2 上样浓度对D101总黄酮吸附率的影响[6]
取布渣叶提取液,分别加水稀释成每毫升含总黄酮10.76、7.17、4.30、2.69 mg的溶液,以0.5 BV/h的速度通过D101树脂柱,收集流出液,转移至50 mL量瓶中,加水至刻度,摇匀,依法测定吸光度,结果 计算得总黄酮吸附率分别为91.67%、90.05%、92.98%、96.83%,考虑上样浓度过低明显增加上样时间,选择上样浓度10.76 g/L(约每毫升含0.15 g生药)。
2.3.3 上样流速对D101总黄酮吸附率的影响
取布渣叶提取液(每毫升含0.15 g生药),分别以0.5、1、2、3 BV/h的流速通过D101树脂柱,分别收集流出液,转移至50 mL容量瓶中,加水至刻度,摇匀,依法测定吸光度,计算得总黄酮吸附率分别为89.02%、82.23%、79.72%、67.75%,故选择上样流速为0.5 BV/h。
2.3.4 树脂柱径高比对D101纯化TFMP的影响
称取D1015份,湿法装于不同的玻璃柱中,使径高比分别为1∶6、1∶7、1∶8、1∶9、1∶10,各取6 BV的布渣叶提取液(0.15 g/mL),以0.5 BV/h的速度通过树脂柱,收集残余液;取蒸馏水以1 BV/h的速度洗脱至无色,收集水洗液;再以80%乙醇洗至无色,收集醇洗液;残余液,水洗液和醇洗液,分别浓缩至适量,转移至100 mL容量瓶中,加水至刻度,摇匀,依法测定吸光度,并计算吸附残余率,水洗损失率,总黄酮得率及其总和,结果如表2,选择径高比为1∶8。
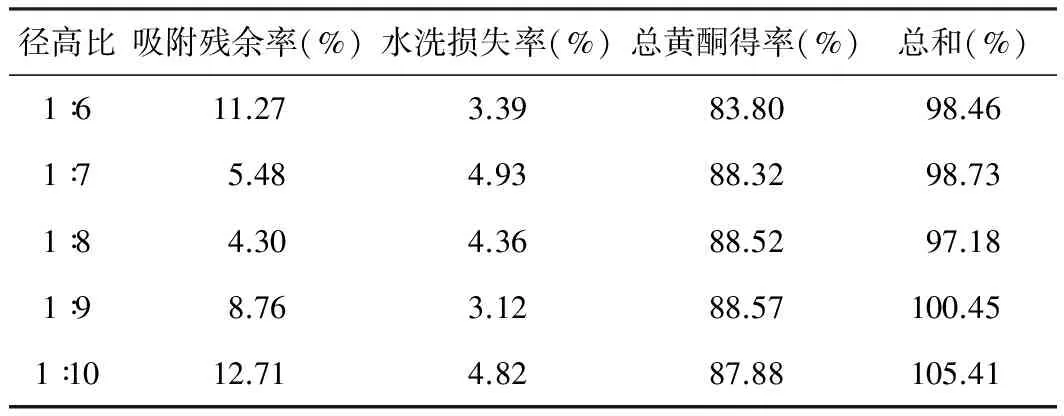
表2 树脂柱径高比对D101纯化TFMP的影响
注:吸附残余率(%)=吸附残余量/上样量×100%; 水洗损失率(%)=水洗损失量/上样量×100%;总黄酮得率(%)=醇洗脱量/上样量×100%;总和(%)=吸附残余率+水洗损失率+总黄酮得率。
2.3.5 吸附泄漏曲线的考察
取布渣叶提取液,以0.5 BV/h的流速通过D101树脂柱(柱体积约20 mL),分段收集流出液,每份10 mL,依法测定吸光度,计算总黄酮浓度,并绘制泄漏曲线图(如图1)。结果显示,在上样体积180 mL处流出液总黄酮浓度达到47.71 mg/L,约相当于170 mL处流出液浓度25.65 mg/L的2倍,确定上样溶液的体积为170 mL,约为8.5 BV。
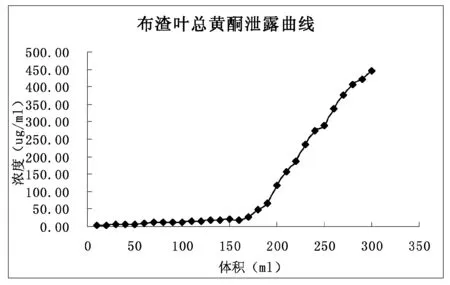
图1 TFMP泄露曲线
2.4 洗脱条件优选
2.4.1 不同浓度醇溶液对总黄酮静态解吸附的影响
称取D1016份,每份3 g,分别置于100 mL具塞的三角瓶中,加入布渣叶提取30 mL,时时振摇,放置过夜,使充分吸附,滤过,D101水洗至无色,抽干,分别加入对应浓度为40%、50%、60%、70%、80%、90%的乙醇各20 mL,摇床振摇6 h后,滤过,并以相同浓度的乙醇分别洗涤,合并洗涤液和滤液,转移至50 mL容量瓶中,加乙醇至刻度,摇匀。依法测定吸光度,计算。结果总黄酮得率分别为50.18%,63.88%,74.5%,75.57%,82.64%,76.57%。故选用80%乙醇作为洗脱溶剂。
2.4.2 洗脱速度对总黄酮得率的影响
取布渣叶提取液4份,分别以0.5 BV/h通过D101树脂柱,分别用8倍量80%乙醇分别以0.5、1.0、2.0、3.0 BV/h流速洗脱,收集洗脱液,依法测定吸光度,计算得总黄酮得率分别为86.49%、83.59%、76.01%、69.65%,表明随着洗脱流速加大,总黄酮得率呈下降趋势,兼顾生产效率和生产实际可操作性,选择洗脱速度为1 BV/h。
2.4.3 洗脱体积的选择[7]
取布渣叶提取液,以0.5 BV/h的流速通过D101树脂柱,再用80%乙醇以1 BV/h的流速洗脱,分段收集洗脱液,每份5 mL,依法测定吸光度,计算洗脱液中的总黄酮含量和洗脱体积,并绘制洗脱曲线,结果如图2。由洗脱曲线可知,当洗脱体积达到45 mL时洗脱液中总黄酮的含量趋近于洗脱平衡,因此可确定洗脱体积为45 mL(约3.75 BV)。

图2 TFMP洗脱曲线
2.5 D101再生重复使用次数考察[7]
根据确定的D101吸附条件,重复多次吸附与解吸附,每次解吸附后用95%乙醇和蒸馏水依次进行洗脱再生,再进行下一次试验。分别收集各次80%乙醇洗脱液,依法测定吸光度,计算总黄酮得率。
总黄酮得率(%)=醇洗脱量/上样量×100%

表3 D101不同再生重复使用次数总黄酮得率(n=2)
结果如表3所示,新D101的总黄酮得率与重复再生1,2,3,4,5次的总黄酮得率差别不大,在重复使用6次后,总黄酮得率明显下降,不利于总黄酮的富集。因此D101重复利用5次可以保证吸附效果。
2.6 验证试验
按照确定的纯化工艺进行3次验证试验(投药量分别为1 kg、5 kg、20 kg),结果显示,TFMP纯化前总黄酮的平均得率为药材的4.10%,总黄酮平均含量为38.22%,RSD为0.04%(n=3),纯化后的平均含量为84.09%,RSD为2.16%(n=3),精制度达220.03%[精制度(%)=纯化后总黄酮含量/纯化前总黄酮含量×100%]。说明该纯化工艺稳定,可靠。
3 小结与结论
本研究基于将布渣叶总黄酮提取物用于医药用途,因此在提取、纯化、分离工艺中选择溶剂时尽量避开易燃易爆、毒性较强的有机溶媒,而选用药用乙醇等作为溶剂,以便利于后续纯化和药品生产。并在前期提取的研究基础上,采用单因素考察法对TFMP的大孔树脂纯化工艺参数进行了筛选,确定了其纯化工艺,结果显示其精制度达220.03%,说明采用D101可以较好地富集,纯化布渣叶总黄酮,从而为其进一步制剂奠定基础。
[1] 谭志灿.广东道地药材布渣叶质量评价及调血脂物质基础研究[D].广州:广州中医药大学,2012:66-69.
[2] 潘天玲,李坤平,贲永光,等.正交试验法优化布渣叶总黄酮提取工艺的研究[J].广东药学院学报,2008,24(5):454-456.
[3] 葛亮,豆浩然,张晋,等.天山雪莲黄酮类成分大孔树脂纯化工艺优选[J].中国实验方剂学杂志,2014,20(7):1-3.
[4] 贾存勤,李阳春,屠鹏飞,等.D-101型大孔吸附树脂预处理方法的研究[J].中草药,2006,37(2):193-196.
[5] 王桂玲,房建强,赵雪梅,等.拳参总黄酮的纯化研究[J].医药导报,2011,30(2):190-193.
[6] 张华潭,郑文丽,魏艳婷,等.大孔树脂纯化黄蜀葵花总黄酮的工艺优选[J].中国实验方剂学杂志,2015,21(1):28-31.
[7] 张崇禧,郑友兰,张春红,等.大孔树脂吸附人参总皂苷工艺及再生使用的研究[J].中国药学杂志,2003,38(9):23-26.
PurificationProcessofTotalFlavonoidsinMicrocosPaniculatawithMacroporousAdsorptionResin
LIZhi-yong1,2,SUNDong-mei1,2*,WANGLuo-lin1,2
(1.GuangdongProvinceEngineeringTechnologyResearchInstituteofT.C.M.,Guangzhou510095,China; 2.GuangdongProvincialKeyLaboratoryofR&DinT.C.M.,Guangzhou510095,China)
Objective: To determine the parameters of purification process of total flavonoids inMicrocospaniculataL.(TFMP)with macroporous resin. Methods: Single factor test was used to choose the suitable macroporous. Optimize the purification process conditions. Results: D101isolated TFMP process conditions on the concentration was 0.15 g/mL; the flow rate was 0.5 BV/h; the sample volume was 8.5 BV; resin column diameter to height ratio was 1∶8; with 5BV water washed; 3.75 BV ethanol 80% with flow rate 1 BV/h, microporous resin could be reused for 5 times; the purification of TFMP reached 84.09%, up to 220.03% of refining. Conclusion: D101can be used to enrich and purify TFMP.
Total flavonoids inMicrocospaniculataL.; Macroporous adsorption resin; Purification process
广东省科技计划项目重大科技专项项目(No.2012A080202016)
李智勇(1977-),男,博士,主任中药师,主要研究方向:中药制剂及质量标准研究。
孙冬梅*(1969-),女,教授,博士研究生导师,主任中药师,主要研究方向:中药质量评价研究。
2016-09-01
修回日期:2016-09-15
R284
:A
:1002-2406(2017)05-0024-04
