糖酵解抑制剂对红曲霉乙醇发酵的影响
2017-06-19李晨阳赵靖沈艳华赵树欣
李晨阳,赵靖,沈艳华,赵树欣
(天津科技大学,工业发酵微生物教育部重点实验室,天津,300457)
糖酵解抑制剂对红曲霉乙醇发酵的影响
李晨阳,赵靖,沈艳华,赵树欣
(天津科技大学,工业发酵微生物教育部重点实验室,天津,300457)
经研究发现,红曲霉能以葡萄糖为底物合成乙醇。糖酵解抑制剂氟化钠在一定程度上抑制菌体生长及乙醇、高级醇的合成。可以推测出红曲霉的生长代谢及乙醇合成与糖酵解(EMP)途径有关。当EMP途径严重受阻时红曲霉将无法进行丙酮酸和乙醇的合成。
红曲霉;乙醇;高级醇;糖酵解抑制剂;丙酮酸
红曲是中国传统发酵制品,在我国多地都有生产。红曲有多种用途,如酿酒、食品着色、酿制腐乳等等。其中采用红曲酿酒历史悠久,如浙江金华寿生酒、福建红曲酒等都是国家非物质文化遗产。酿酒红曲是将红曲种曲接种到籼稻上,经制曲培养形成的具有糖化力和发酵力的一种酒曲,其中包含有红曲霉、酿酒酵母和细菌等微生物[1]。一般认为在酿酒红曲中,红曲霉主要起糖化作用,酿酒酵母主要起发酵产酒的作用。酒精发酵是指酵母菌在厌氧条件下通过糖酵解途径,将葡萄糖降解为丙酮酸,然后在丙酮酸脱羧酶的作用下,将丙酮酸脱羧形成乙醛,乙醛再在乙醇脱氢酶的作用下生成乙醇的过程[2]。本课题组之前的研究中,发现红曲霉中的某些种(如安卡红曲霉、红色红曲霉、紫色红曲霉)具有较高的乙醇生产能力,某些条件下可以达到与酿酒酵母相同的发酵水平[3]。但是培养基及培养方式的不同对其发酵结果有着显著影响。与酿酒酵母相比,红曲霉能产生糖化酶,具有同时糖化、发酵产酒的潜力[4],且在发酵过程中可以产生一些有功能的次级代谢产物。如Monacolin k[5],麦角固醇[6],色素[7],γ-氨基丁酸[8]等等,具有很好的开发前景。
为了了解红曲霉的乙醇代谢途径,本研究以从金华红曲米中分离得到的红曲霉为发酵菌株,研究其以葡萄糖为碳源进行乙醇发酵的特性及代谢途径,并分析糖酵解抑制剂对红曲霉乙醇发酵的影响,以期推测出红曲霉乙醇发酵的代谢途径,为更好地开发红曲霉的工业应用提供基础。
1 材料与方法
1.1 试剂
高温α-淀粉酶:诺维信公司,活力为20 000 U/g(最佳液化条件为温度90 ℃,α-淀粉酶添加量为12 U/g,液化时间为1 h);糖化酶:河北胜利酶制剂有限公司,活力为80 000 U/g(最佳糖化条件为温度55 ℃,糖化时间1 h)。
1.2 菌株
从金华红曲米中分离得到的红曲霉,经鉴定为红色红曲霉(Monascusruber)。
1.3 培养基
麦芽汁斜面培养基[13]。
种子培养基:5%大米粉,121 ℃灭菌20 min。
发酵培养基:葡萄糖150 g/L,蛋白胨10 g/L,K2HPO40.5 g/L,MgSO4·7H2O 0.5 g/L,NaCl 0.5 g/L,FeSO40.03 g/L,115 ℃灭菌30 min。
大米糖化液:大米粉与水1∶3混合,搅拌均匀,加热进行淀粉糊化、液化。液化条件为α-淀粉酶添加量为12 U/g(大米),液化温度为90 ℃,之后在55 ℃下糖化1 h,过滤取清液,加热灭酶,装瓶115 ℃灭菌30 min,得到糖度为13 °Brix的培养基。
1.4 菌种分离及鉴定方法
菌种分离方法:稀释涂布法。
菌种鉴定方法:分子生物学鉴定。
1.5 培养方法
1.5.1 斜面菌种培养
在35 ℃的恒温箱中培养7 d,作为实验用种子。
1.5.2 摇瓶种子培养
接种孢子悬液,30 ℃,150 r/min的旋转式摇床中培养48 h。
1.5.3 红曲霉培养方法
种子液10%(v/v)的接种量,30 ℃,150 r/min的旋转式摇床中培养24 h。之后30 ℃下静止发酵5 d。
1.6 分析检测方法
乙醇和高级醇检测方法:气相色谱法[9-10]。
还原糖测定方法:斐林试剂法。
菌体量的测定:干重法。
发酵失重的测定:每隔12 h测定1次发酵失重,记录结果。
丙酮酸的检测[11]:高效液相色谱法。
糖利用率计算:

酒精发酵效率计算:
2 结果与分析
2.1 红曲霉的鉴定
从金华红曲中分离得到1株红曲霉,将其命名为MonascusruberMR9,采用分子生物学鉴定方法对其进行鉴定。图1为红曲霉MR9的PCR产物电泳图。
对PCR产物进行测序,并将测序结果在NCBI数据库进行同源性比对,绘制红曲霉MR9的系统发育树如图2。
图1 红曲霉的PCR产物Fig.1 PCR products ofMonascus ruber MR9

图2 红曲霉的系统发育树Fig.2 Phylogenetic tree of Monascus ruber MR9
经鉴定,从金华红曲中分离得到的红曲霉MR9为红色红曲霉(Monascusruber)。
2.2 红曲霉的乙醇发酵
按照1.5.3的方法进行发酵,得到以下结果。从表1可以看出红曲霉具有乙醇生成能力。

表1 红曲霉在两种培养基中产乙醇的比较
从图3的发酵曲线可以确定,发酵过程中伴随有气体生成。
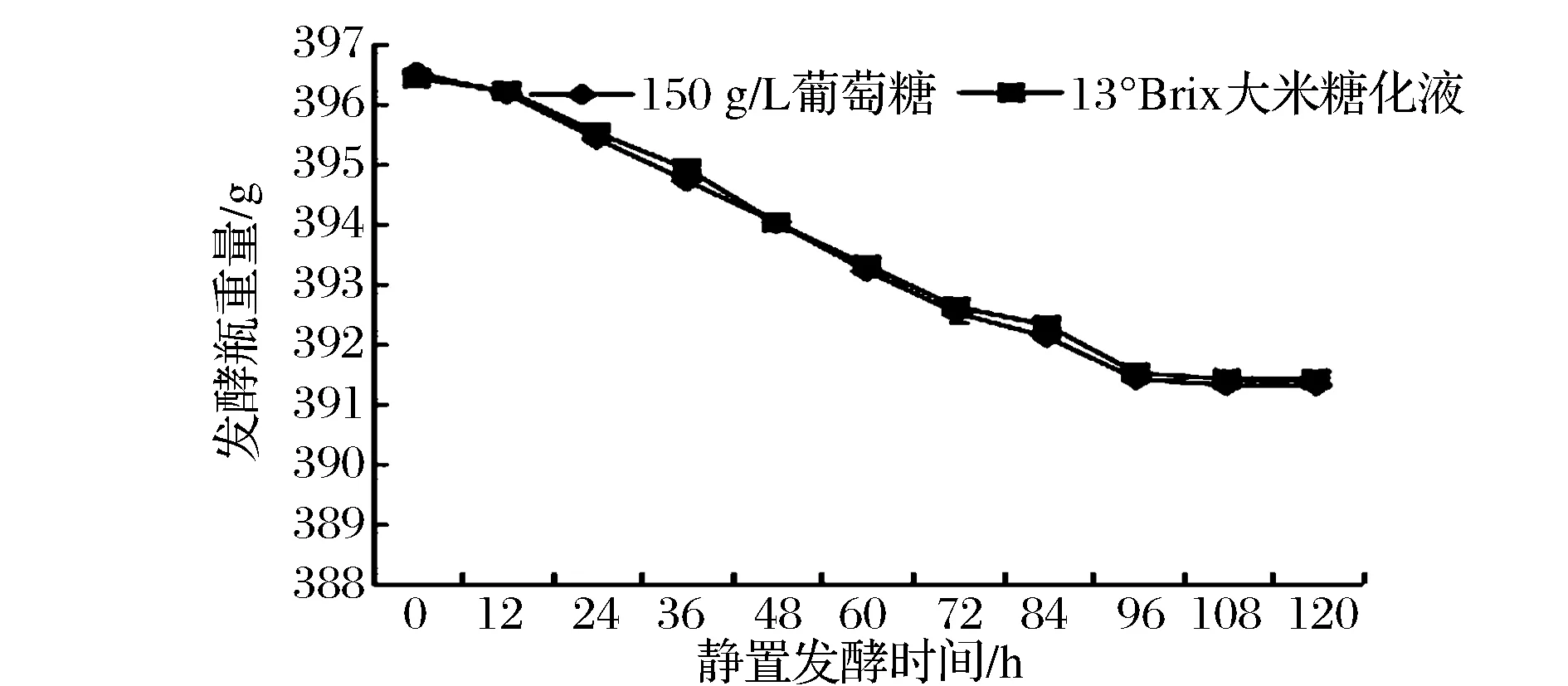
图3 红曲霉在两种培养基中发酵失重的变化Fig.3 Weigh loss during ethanol fermentation by Monascus ruber MR9 from two kinds of medium
从表2可知,红曲霉的乙醇发酵与酿酒酵母相似。在糖酵解过程中生成丙酮酸,进而合成氨基酸。通过氨基酸的分解代谢途径会转化为相应的高级醇。因此,在乙醇生成的同时也有高级醇生成。
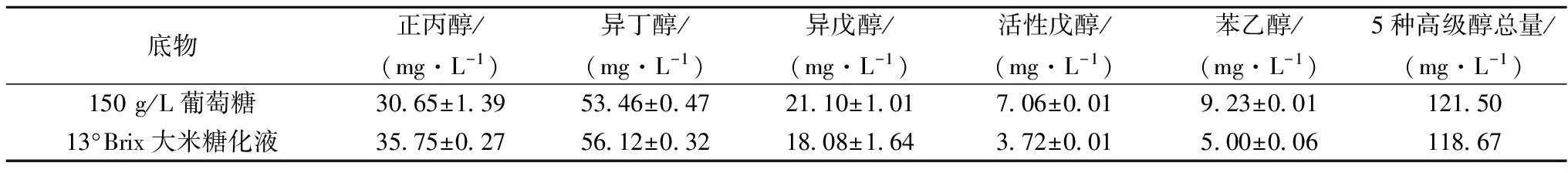
表2 红曲霉在两种培养基中产高级醇的比较
2.3 氟化钠对红曲霉乙醇发酵的影响
2.3.1 氟化钠添加量对红曲霉乙醇发酵的影响
氟化钠是一种常见的糖酵解抑制剂,对糖酵解途径中的丙酮酸激酶具有较强的抑制效果。在丙酮酸激酶的催化作用下,磷酸烯醇式丙酮酸的磷酰基团转移到ADP上,转变为ATP形式的自由能,同时磷酸烯醇式丙酮酸转化为丙酮酸,这一步反应不可逆。因
此,丙酮酸激酶是整个糖酵解途径的限速酶。实验通过添加氟化钠来抑制红曲霉的乙醇发酵,测定糖酵解产物丙酮酸的质量浓度,分析红曲霉的糖酵解途径对乙醇合成的作用。
从表3可知,添加氟化钠的实验组中,实际乙醇产量均低于对照组。随着添加的氟化钠的浓度增加,乙醇产量逐渐降低,糖利用率逐渐降低,酒精发酵效率逐渐降低。这说明,添加氟化钠对红曲霉乙醇发酵起到了抑制作用。且添加的浓度越大,抑制作用越明显。表明氟化钠对于糖酵解途径中丙酮酸激酶的抑制作用,严重地阻碍了EMP途径的代谢通路,抑制了乙醇的合成,从而间接证明了红曲霉的乙醇代谢也是经过了该途径。

表3 氟化钠添加量对红曲霉乙醇产量的影响
从表4可知,添加氟化钠的实验组中,高级醇产量均低于对照组。随着添加的氟化钠的浓度的增加,高级醇产量逐渐降低。当氟化钠终浓度大于0.01 g/L时,5种高级醇的总量出现了明显的降低。
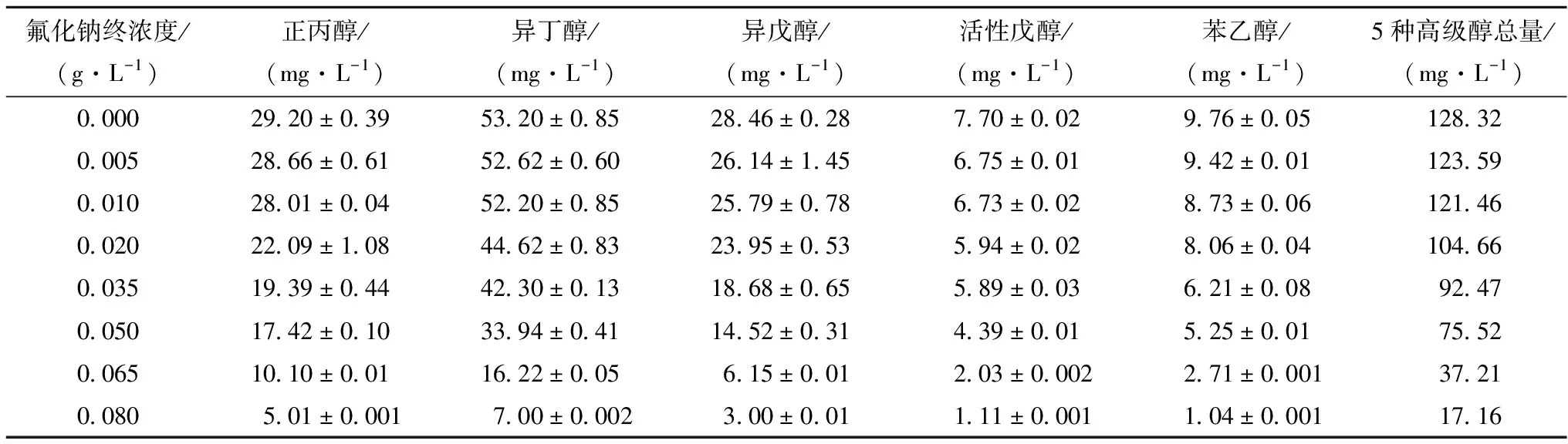
表4 氟化钠添加量对红曲霉高级醇产量的影响
从图4可知,氟化钠的添加对代谢中间产物丙酮酸的合成有明显的抑制作用。由于丙酮酸激酶控制着EMP途径最终转化丙酮酸的关键性反应。添加了氟化钠后,丙酮酸浓度下降,合成的氨基酸含量下降,进而合成的高级醇含量下降。当丙酮酸的合成受到抑制时,红曲霉的自身生长并未全部受到抑制,这说明仍有少量丙酮酸进入到了TCA循环,并完成彻底的分解,提供能量。因此并未严重影响红曲霉菌体生长。

图4 添加氟化钠对红曲霉的丙酮酸浓度和菌体干重的影响Fig.4 Effect of sodium fluoride on pyruvate concentration and dry weight of myceliaof Monascus ruber MR9
2.3.2 分阶段添加氟化钠对红曲霉乙醇发酵的影响
从表5、表6可知,在红曲霉发酵的不同阶段添加氟化钠,对乙醇和高级醇的产量具有明显不同的影响。在前期添加,会对红曲霉的乙醇和高级醇产量产生较强的抑制作用,导致乙醇和5种高级醇产量远低于对照组。而在后期添加时,其对乙醇和高级醇合成的抑制作用就会逐渐减弱。在静置发酵第4天时加入氟化钠,实验组中乙醇和高级醇的产量几乎与对照组一样。说明此时发酵已经完成,此时添加抑制剂,对最终乙醇产量不会产生太大影响。

表5 不同时间添加氟化钠对红曲霉乙醇、丙酮酸产量的影响
表注:ck:不添加氟化钠,对照组;a:在接种子液时添加;b:好氧培养1天时添加;c:静置发酵1天时添加;d:静置发酵2天时添加;e:静置发酵3天时添加;f:静置发酵4天时添加。

表6 不同时间添加氟化钠对红曲霉高级醇产量的影响
表注:ck:不添加氟化钠,对照组;a:在接种子液时添加;b:好氧培养1天时添加;c:静置发酵1天时添加;d:静置发酵2天时添加;e:静置发酵3天时添加;f:静置发酵4天时添加。
由于加入了氟化钠,造成糖酵解过程受阻,产生的能量减少,进而TCA循环受到影响,草酰乙酸产量下降,生成正丙醇的前体物质——苏氨酸产量减少,因此正丙醇产量下降。丙酮酸产量下降,因此缬氨酸、亮氨酸、异亮氨酸合成减少,导致异丁醇、异戊醇、活性戊醇产量下降。磷酸烯醇式丙酮酸产量下降,苯丙氨酸的合成减少,苯乙醇产量下降[12]。
本实验结果表明发酵前期对红曲霉的乙醇合成尤为重要。如果此时添加氟化钠,会导致糖酵解过程受阻,无法合成丙酮酸,进而会对乙醇合成产生严重影响。
3 结论
糖酵解抑制剂氟化钠会在一定程度上影响红曲霉的菌体生长及乙醇、高级醇的合成。由此可推测红曲霉的乙醇合成与EMP途径相关。当EMP途径严重受阻时,红曲霉将无法进行丙酮酸和乙醇的合成。通过分阶段添加糖酵解抑制剂测定乙醇产量时发现,发酵初期对于红曲霉的乙醇合成与菌体生长尤为重要。同时,在其他研究中发现,以火龙果汁、葡萄汁作为底物进行发酵时,红曲霉发酵液酒度可达到7%~9%(v/v),与酿酒酵母发酵水平相当。可在今后研究中进一步挖掘红曲霉产乙醇的潜能。
[1] 左楠楠.红曲黄酒酿造关键技术的研究[D].金华:浙江师范大学,2013:31.
[2] 刘兴艳.低pH对酿酒酵母酒精发酵的影响及酵母应答酸胁迫机制初探[D].北京:中国农业大学,2015:11.
[3] 赵树欣,赵华.红曲霉酒精发酵性能的初步研究[J].酿酒科技,1997(1):13-15.
[4] AJDARI Z,EBRAHIMPOUR A,MANAN M A,et al.Nutritional requirements for the improvement of growth and sporulation of several strains of monascus purpureus on solid state cultivation[J].Biomed Research International,2011,2011(1):10-11.
[5] 张庆庆,杨超,汤文晶,等.超声提取红曲霉发酵液中的Monacolin K[J].食品与发酵工业,2014,40(4):216-220.
[6] 谭艾娟,宁玮霁,刘爱英,等.红曲霉产麦角固醇液体发酵条件优化[J].食品科学, 2008,29(9):434-436.
[7] 陈章娥,杨成龙,吴小平,等.红曲霉种间产色能力比对与高产色素菌株的筛选[J].食品与发酵工业,2014, 40(5):55-59.
[8] CHUANG C Y,SHI Y C,YOU H P, et al.Antidepressant effect of GABA-rich Monascus-fermented product on forced swimming rat model[J].Journal of Agricultural & Food Chemistry,2011,59(7):3 032-3 033.
[9] YVETTE N,EGMONT R R.Investigating the coffee flavour in South African Pinotage wine using novel offline olfactometry and comprehensive gas chromatography with time of flight mass spectrometry[J].Journal of Chromatography A,2013,1 271(1):176-180.
[10] SIARHEI V C,ANTON N K,NIKITA V K,et al.Direct determination of volatile compounds in spirit drinks by gas chromatography[J]. Journal of Agricultural and Food Chemistry,2013,61(12):2 950-2 956.
[11] MIYATA R,YONEHARA T.Breeding of high-pyruvate-producing Torulopsis glabrata, and amino acid auxotroph ic mutants[J].Journal of Bioscience & Bioengineering,2000,90(2):137-141.
[12] 王镜岩,朱圣庚,徐长法.生物化学(下册)[M].3版.北京:高等教育出版社,2002:340-359.
[13] 范雨锁.麦芽汁和玉米汁酵母培养物对瘤胃发酵作用的比较研究[D].哈尔滨:东北农业大学,2007.
Effects of the glycolytic inhibitor on ethanol fermentation byMonascus
LI Chen-yang, ZHAO Jing, SHEN Yan-hua, ZHAO Shu-xin
(Tianjin University of Science and Technology, The Ministry of Education Key Laboratory of Industrial Fermentation Microorganisms,Tianjin 300457,China)
Hongqu is a Chinese traditional fermented product in many regions. Hongqu has been used for brewing rice wines which have a long history and some of them belong to China’s intangible cultural heritage, such as Zhejiang jinhua rice wine, Fujian rice wine, and so on. The traditional Hongqu used for brewing rice wines mainly containsMonascus,Saccharomycescerevisiae, and other bacteria. Early researches indicated thatMonascuscould synthesize ethanol. In this study, the ethanol metabolic pathway involved inMonascuswas studied. Results indicated thatMonascuscould synthesize ethanol with glucose as substrate. Sodium fluoride (Glycolytic inhibitor) inhibited the production of biomass, ethanol, and higher alcohols during the ethanol fermentation byMonascusat a certain level. It could predicate that the growth and ethanol fermentation byMonascuswere based on the glycolytic pathway. When Embden-Meyerhof-Parnas pathway was seriously inhibited,Monascuscould not synthesize pyruvic acid and ethanol.
Monascus; ethanol; higher alcohols; glycolytic inhibitor; pyruvate
10.13995/j.cnki.11-1802/ts.201704009
硕士研究生。
2016-11-01,改回日期:2016-11-25
