高转化人参皂苷菌株筛选鉴定及发酵培养基优化
2017-06-19方磊陈红余晓斌
方磊,陈红,余晓斌
(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
高转化人参皂苷菌株筛选鉴定及发酵培养基优化
方磊,陈红,余晓斌
(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
用含七叶苷柠檬酸铁的平板筛选产β-葡萄糖苷酶的菌株;再用对硝基苯酚-β-葡萄糖苷(pNPG)为底物测定β-葡萄糖苷酶酶活,筛选出6株酶活较高的菌株。利用筛选的菌株以人参皂苷Rb1为底物进行发酵转化,通过薄层色谱(thinlayer chromatograph, TLC)和高效液相色谱法(high performance liquid chromatography, HPLC)检测转化产物的种类和含量,确定转化率最高的菌株。该菌株β-葡萄糖苷酶酶活为0.803 U/mL,人参皂苷Rd转化率为97.234 2%。对其进行形态学、18S rDNA基因序列进行分析,经鉴定该菌株是Saccharomycopsisfibuligera。对发酵培养基进行优化,优化结果是:碳源为乳糖,氮源为玉米粉,金属离子为Ca2+。最后对诱导剂进行优化,发现诱导剂对转化率没有显著影响,但是芦丁能够诱导人参皂苷Rd向CK的转化。
人参皂苷;β-葡萄糖苷酶;酵母菌;鉴定;优化
人参(ginseng),广泛应用于中药、保健品中,其有效成分是人参多糖、人参挥发油、氨基酸和人参皂苷[1],主要有效成分是人参皂苷[2]。目前已有180多种人参皂苷被发现,50多种人参皂苷被分离[3]。人参皂苷分3类,分别是原二醇型人参皂苷、原三醇型人参皂苷和齐墩果酸型人参皂苷,其中二醇型人参皂苷Rb1占总皂苷含量的20%以上[4]。由于肠道菌的作用人参皂苷在体内被转化为含侧链糖基少的人参皂苷,而侧链糖基少的人参皂苷才能被人体肠道细胞吸收[5]。人参皂苷转化方法主要有酸碱法,酶法和微生物法,酸碱法具有效率低,对环境有害等缺点[6-7];酶法具有造价成本高,工艺复杂等缺点[8];微生物法反应要求低,成本低,有利于工业化应用[9]。目前,对人参皂苷研究主要集中在酶转化法和微生物法方向上[10],但筛选1株转化率高的无害菌株,依然是研究的热点和难点。本课题主要是以农村腌菜汁和大曲为样品及实验室原有的益生菌菌种,进行高转化人参皂苷Rb1无害菌株的筛选并对人参皂苷发酵培养基优化进行研究。
1 材料与方法
1.1 材料
1.1.1 样品来源
取自不同地区不同种类的腌菜和腌菜汁和大曲。
1.1.2 主要实验试剂
柠檬酸铁、正丁醇、乙腈:色谱纯、甲醇:色谱纯、七叶苷购自Sigma公司;人参皂苷Rb1、Rd、CK等标准品购自上海源叶生物技术公司;真菌DNA提取试剂盒、Taq酶、溶菌酶、胶回收试剂盒购自天根生物科技公司;硅胶板购自德国马克公司。
1.1.3 筛选培养基
含3 g/L七叶苷、0.2 g/L柠檬酸铁的MRS培养基和YPD培养基。
1.1.4 发酵培养基
MRS培养基或糖度为5°P的麦汁培养基。
1.2 主要的仪器设备
超级恒温水浴锅HH-501,常州翔天实验仪器厂;旋转蒸发仪RE-52AA,上海亚荣生化仪器厂;SB-25-12-DT超声波清洗机,宁波新芝生物科技股份有限公司;可见分光光度计721N,上海精科有限公司;安捷伦1260高效液相色谱仪,美国安捷伦公司。
1.3 方法
1.3.1 筛选产β-葡萄糖苷酶的菌株
取各种泡菜挤出1 mL浸出液和1 g大曲分别加入含9 mL无菌生理盐水的试管里,逐级稀释,分别吸取稀释度为10-1~10-6的菌悬液200 μL,涂布于筛选培养基,30 ℃培养2 d。观察菌落的生长状况和培养基颜色变化。若菌落周围变黑,则说明该菌能产生β-葡萄糖苷酶,产酶菌株纯化保藏。筛选实验室原有益生菌菌株,保藏显黑菌株。
1.3.2 β-葡萄糖苷酶的酶活测定
1.3.2.1 标准曲线的绘制
称取对硝基苯酚13.9 mg溶于100 mL的蒸馏水里,分别吸取0.1、0.2、0.3、0.4、0.5、0.6 mL于10 mL的容量瓶中,用1 mol/L Na2CO3溶液定容后混匀,以蒸馏水为对照,于400 nm处测定吸光值并绘制标准曲线。标准方程:Y=16.68X+0.022 2,相关系数R2=0.999 8。
1.3.2.2 酶活性的测定
采用pNPG(p-nitrophenyl-β-D-glucopyranoside)法测定β-葡萄糖苷酶的酶活[11]。将培养5 d的细胞培养液置于灭菌的EP管中,于8 000 g,4 ℃离心10 min,收集上清液。取上清液100 μL,加入200 μL的5 mmol/LpNPG(溶于pH 5.0柠檬酸钠-磷酸氢二钠缓存液中,P-C缓冲液)混匀,50 ℃反应30 min,立即加入2 mL的1 mol/L Na2CO3终止反应,于400 nm下测定吸光值。酶活定义:每分钟释放1 μmol/L的对硝基苯酚所需要的酶量。酶活计算公式为:
(1)
式中:C,对硝基苯酚浓度,mmol/L;V,反应体系的体积,mL;N,稀释倍数;t,反应时间,min;v,取上清液的体积,mL。
1.3.3 筛选高转化人参皂苷Rb1的菌株
将1.3.1筛选菌株接种于40 mL 的种子培养基中,30 ℃、180 r/min培养12 h,转接发酵培养基,30 ℃、180 r/min培养24 h,加入20 mg过滤除菌的人参皂苷Rb1,发酵96 h。然后,用水饱和的正丁醇萃取发酵液3次,每次加入水饱和正丁醇后先静置12 h,再用超声萃取1 h,再用分液漏斗分离,取上层的正丁醇,减压蒸干,甲醇复溶,过滤待测。
1.3.4 转化产物的检测
1)薄层色谱法(thinlayer chromatograph,TLC)半定性测定人参皂苷[12]。用微孔进样器吸取5 μL的1.3.2中制备的待测样品,在活化好的硅胶板上划线、点样,展开,挥干溶剂,喷洒上10%的硫酸乙醇溶液,在105 ℃的烘箱中加热5 min显色。根据样品迁移率和颜色的深浅初步判断人参皂苷的浓度和种类。
2)高效液相色谱法定量测定人参皂苷。配置浓度分别是0.25、0.5、1、1.5、2 mg/mL的人参皂苷Rd的标准品溶液,绘制标准曲线,得到标准方程:峰面积=1 868.818 02×Amt+34.972 551,RES=2.628%,相关系数R2=0.998 48。色谱设备与条件:GP-C18色谱柱(4.6 mm×250 mm,5 μm);柱温30 ℃;进样量15 μL;流速1 mL/min;流动相水(A)-乙腈(B);梯度洗脱:0~30 min 30%B,30~45 min 55%B,45~60 min 70%B;检测波长203 nm。人参皂苷Rd的生物转化率计算公式:
(2)
Rb1的摩尔质量为1 108.6;Rd的摩尔质量为946.6。
1.3.5 高转化率的菌种鉴定
18S rDNA序列分析使用溶菌酶,破壁并提取DNA。以ITS1、ITS4为引物进行PCR扩增,扩增反应体系ExTaq(5 U/μL)0.25 μL,buffer 5 μL,dNTP mixture 各2.5 μL,ITS1 1 μL,ITS4 1 μL,加入ddH2O至50 μL。RCR条件:95 ℃预变性5 min;95 ℃变性1 min,54.2 ℃退火30 s,72 ℃延伸90 s,30次循环;修复延伸,72 ℃ 5 min。PCR扩增产物送上海生工生物有限公司测序。把测取序列在NCBI数据库中进行比对,构建系统进化树。
1.3.6 发酵培养基的优化
以糖度为5°P的麦汁液体培养基为基本培养基,加入蔗糖、麦芽糖、乳糖、葡萄糖、可溶性淀粉等碳源,添加量分别为5、10、15 g/L;加入(NH4)2SO4、NH4Cl、黄豆粉、玉米浆、胰蛋白胨、酵母粉等氮源,添加量分别为质量浓度5、10、15 g/L;加入Cu2+、Mn2+、K+、Ca2+、Fe3+、Zn2+、Mg2+、Na+等金属离子,添加量分别为1、1.5、2 g/L;测定人参皂苷Rd的产量。在麦汁液体培养基中加入吐温-20、吐温-80、曲拉通、芦丁等,添加量分别为0.5、1、1.5 g/L,测定人参皂苷Rd的产量。人参皂苷Rb1底物添加量为1.25 mg/mL。以糖度为5°P的麦汁培养基直接发酵测得人参皂苷Rd的产量是0.549 317 5 mg/mL。
2 结果与讨论
2.1 产β-葡萄糖苷酶的菌株筛选
微生物转化人参皂苷依靠的是一种或者多种酶,研究发现β-葡萄糖苷酶是其中的关键酶。β-葡萄糖苷酶酶活高的菌株,人参皂苷的转化率一般较高;酶活低的菌株,人参皂苷转化率较低。筛选出72株有黑色圈的菌株,并测定这72株菌株的β-葡萄糖苷酶的酶活,图1显示其中6株酶活较高的菌株。并对这6株菌种进行转化人参皂苷Rb1的研究。对这6株分别命名为ZB0302、ZB0304、ZB0305、ZB0307、ZB0316、ZB0317。

图1 筛选出的菌株β-葡萄糖苷酶酶活Fig.1 Enzyme activity of β-glucosidase in strains screened
2.2 高转化人参皂苷Rb1菌株的筛选
2.2.1 TLC薄层色谱法分析产物
薄层色谱是一种准确高效的鉴定产物的方法,可用于快速鉴定转化菌株的产物。将2.1筛选的菌株进行转化人参皂苷Rb1实验,结果如图2所示。

2-菌株ZB0302;3-菌株ZB0304;4-菌株ZB0305;5-菌株ZB0307;6-Rd标准品;16-菌株ZB0316;17-菌株ZB0317;CK-人参皂苷Compound K标准品图2 菌株对人参皂苷Rb1转化的TLC法分析结果Fig.2 TLC analysis of bioconversion of ginsenosides Rb1 by strains screened
菌株ZB0302、菌株ZB0304、菌株ZB0305和菌株ZB0307能够将发酵液中底物人参皂苷Rb1化为人参皂苷Rd,菌株ZB0316和ZB0317能够将发酵液中底物人参皂苷Rb1转化为人参皂苷Compound K等其他皂苷。
2.2.2 HPLC高效液相色谱法分析产物
以β-葡萄糖苷酶较高6株菌转化底物人参皂苷Rb1,测定发酵液中产物人参皂苷Rd的含量。结果如图3所示,菌株ZB0304的人参皂苷转化率最大,为97.234 2%。选取ZB0304菌株继续研究。

图3 菌株对人参皂苷Rb1的生物转化率Fig.3 Bioconversion ratio of ginsenoside Rb1 by strains screened
2.3 菌种鉴定
2.3.1 形态学观察
如图4所示,菌株ZB0304,菌落表面不光滑,边缘不齐,边缘有锯齿状,中间较厚边缘较薄。经过镜检,初步判断为酵母菌。

图4 人参皂苷Rd转化率最高的菌株ZB0304Fig.4 Strain ZB0304 with the highest bioconversion ratio of ginsenoside Rd
2.3.2 菌株18S rDNA序列分析
通过18S rDNA序列分析菌株,经过上海生工测序获取了一个大小为630bp左右的序列。将这个序列放入GenBank数据库中进行同源性比对,选取同源性较高的菌株构建系统进化树,见图5。该菌株和Saccharomycopsisfibuligera2232最相似,达到92%,结合显微镜观察和菌落形态大小,得出结论:该菌株属于Saccharomycopsisfibuligera。

图5 菌株ZB0304的进化图Fig.5 Phylogenetic tree strain ZB0304
2.4 发酵培养基的优化
2.4.1 碳源对菌株转化人参皂苷的影响
碳源对菌株转化人参皂苷Rd和β-葡萄糖苷酶酶活的影响结果如图6所示。在不同种类的碳源下,对酶活和转化产量的影响是不同的,同时,相同碳源不同添加量,对酶活和转化产量的影响也是不同的。在基本培养基中加入碳源,都会增加Rd的产量,其中添加量为15 g/L的乳糖促使该菌株产酶活性和人参皂苷Rd的产量最大。因此选取乳糖为碳源进行后续的实验。乳糖可能会促进菌株产β-葡萄糖苷酶[13],进而使人参皂苷Rd的产量提高。

图6 不同碳源对人参皂苷Rd产量和β-葡萄糖苷酶酶活的影响Fig.6 Effect of different carbon sources on the production of ginsenoside Rd and β-glucosidase enzyme activity
2.4.2 氮源对菌株转化人参皂苷的影响
氮源对菌株产β-葡萄糖苷酶和对人参皂苷Rd的产量影响结果如图7所示,不同种类的氮源和不同浓度的氮源对菌株产酶和人参皂苷Rd的产量不同。有机氮源对人参皂苷Rd的产量有促进作用,其中,添加量为15 g/L玉米浆对β-葡萄糖苷酶和人参皂苷Rd产量的促进作用最大。因此,选取玉米浆为氮源进行后续研究。玉米浆促进产酶和提高产量,可能是因为其含有大量的维生素和其他微量元素。
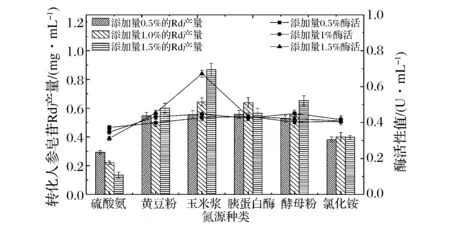
图7 不同氮源对人参皂苷Rd产量和β-葡萄糖苷酶酶活的影响Fig.7 Effect of different nitrogen source on the production of ginsenoside Rd and β-glucosidase enzyme activity
2.4.3 金属离子对菌株转化人参皂苷的影响
金属离子对菌株产酶和转化人参皂苷Rd的影响结果如图8所示,不同金属离子和不同添加量对产酶和人参皂苷Rd产量的影响均不同。其中,Cu2+抑制菌株产酶,而添加量为15 g/L的Ca2+对菌株产酶和人参皂苷Rd的产量有促进作用且促进作用最大。因此,在发酵液中添加适量的Ca2+会促进产酶和人参皂苷Rd的转化。

图8 不同金属离子对人参皂苷Rd产量和β-葡萄糖苷酶酶活的影响Fig.8 Effect of different metal ion on the production of ginsenoside Rd and β-glucosidase enzyme activity
2.4.4 诱导剂对菌株转化人参皂苷的影响
诱导剂吐温-20、吐温-80、曲拉通对人参皂苷转化情况和酶活性没有显著的影响,但是不同添加量的芦丁对人参皂苷的转化产物的影响很大,如图9所示,在芦丁添加量为0.1 mg的时候,CK(Compound K)的含量明显多,它能促使人参皂苷Rd向人参皂苷CK的转化,提高人参皂苷CK的产量。因此,发酵液中添加适量的芦丁可作后续研究。
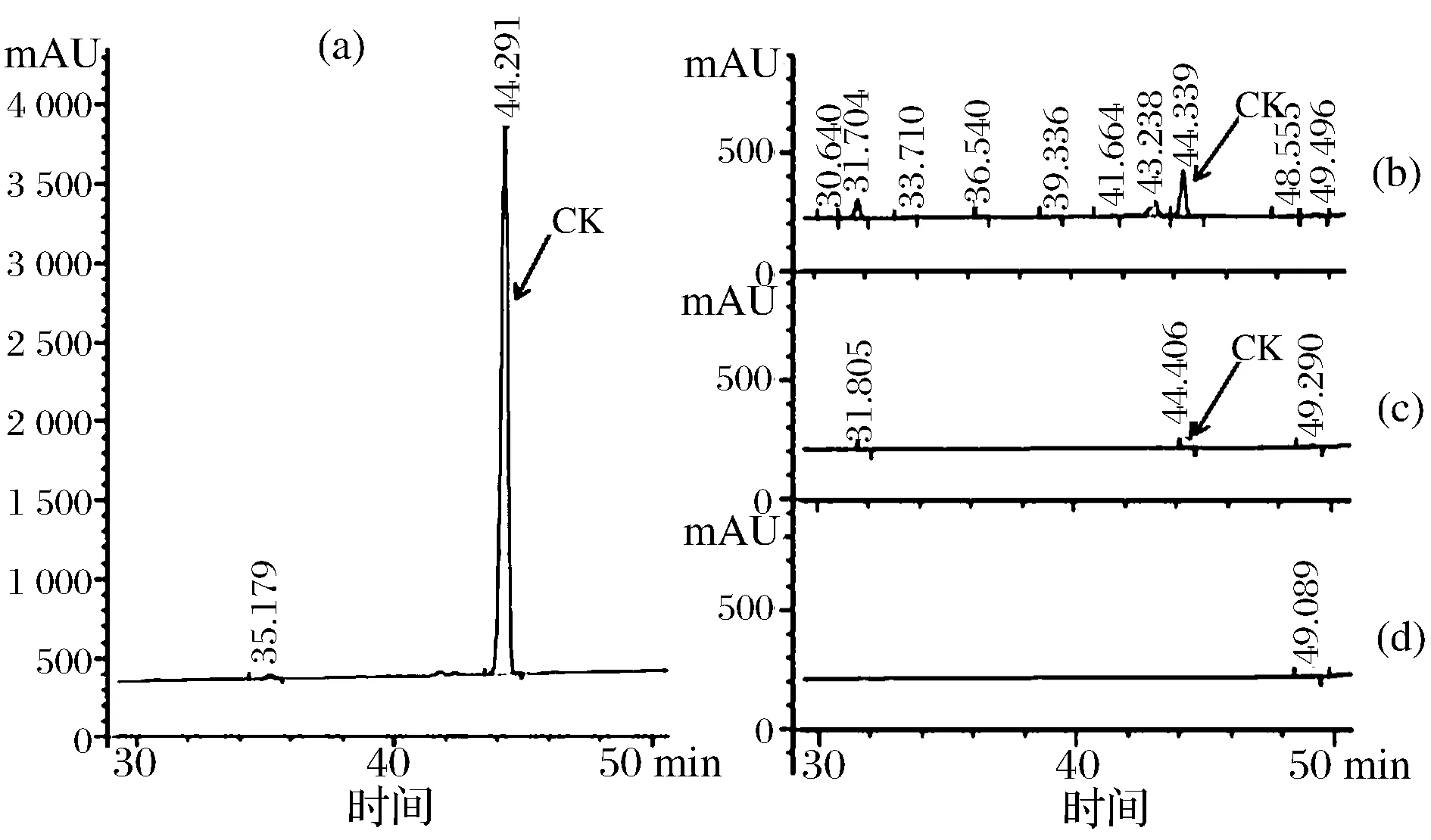
(a)人参皂苷CK标准品的HPLC图谱;(b)芦丁添加量为0.1mg的HPLC图谱;(c)芦丁添加量为0.05mg的HPLC图谱,(d)芦丁添加量为0.025mg的HPLC图谱图9 HPLC法分析芦丁对人参皂苷CK的影响Fig.9 Effect of rutinon ginsenoside CK by HPLC
3 结语
通过含七叶苷柠檬酸铁的平板显色筛选出72株产β-葡萄糖苷酶菌株,测定酶活,选酶活较高的6株菌株,进行人参皂苷Rb1的转化研究,最终确定1株转化率较高的菌株ZB0304,经过形态学观察和18S rDNA基因序列分析,鉴定为Saccharomycopsisfibuligera。发酵培养基的优化实验,以乳糖为碳源,玉米粉为氮源,Ca2+作为金属离子添加到发酵培养基中,会促进人参皂苷Rd的产量和β-葡萄糖苷酶酶活的提高。诱导剂芦丁能够促进人参皂苷Rd进一步转化为其他皂苷。
[1]BAQUEMA,MOHSH,LEEEJ,etal.Productionofbiomassandusefulcompoundsfromadventitiousrootsofhigh-valueaddedmedicinalplantsusingbioreactor[J].BiotechnologyAdvances,2012,30(6):1 255-1 267.
[2]HANS,KIMJS,JUNGBK,etal.EffectsofginsenosideonpacemakerpotentialsofculturedinterstitialcellsofCajalclustersfromthesmallintestineofmice[J].MoleculerCells,2012,33(3):243-249.
[3]CHENGLQ,NAJR,BANGMH,etal.ConversionofmajorginsenosideRb1to20(S)-ginsenosideRg3byMicrobacteriumsp.GS514[J].Phytochemistry,2008,69(1):218-224.
[4] 万会达,李丹,张钰,等.β-半乳糖苷酶选择性催化人参皂苷Rg3水解制备Rh2初探[J].食品与发酵工业,2015,41(8):54-58.
[5] AKAO T,KANAOKA M,KOBASHI K.Appearance of compound K, a major metabolite of ginsenoside Rb1 by intestinal bacteria,in rat plasma after oral administration-measurement of compound K by enzyme immunoassay[J].Biological & Pharmaceutical Bulletin,1998,21(3):245-249.
[6] KEUM Y S,PARK K K,LEE J M,et al.Antioxidant and anti-tumor promoting activities of the methanol extract of heat-processed ginseng[J].Cancer Letters, 2000,150(1):41-48.
[7] ZHAO X,WANG J,JIE L,et al.Highly selective biotransformation of ginsenoside Rb1 to Rd by the phytopathogenic fungusCladosporiumfulvum(syn. Fulvia fulva)[J].Journal of Industrial Microbiology,2009,36(5):721-726.
[8] 赵方允,陈自弘,虞泓,等.微生物转化人参皂苷研究进展[J].中国医药生物技术,2010,5(3):115-120.
[9] HAN B H,PARK M H,HAN Y N,et al.Degradation of ginseng saponins under mild acidic conditions[J].Planta Medica,1982,44(3):146-149.
[10] CHENG L Q,KIM M K,LEE J W,et al.Conversion of Major Ginsenoside Rb1 to Ginsenoside F2 by Caulobacter leidyia[J].Biotechnology Letters,2006, 28(14):1 121-1 127.
[11] ROSI I,VINELLA M,DOMIZIO P.Characterization of β-glucosidase activity in yeasts of oenological origin[J].Journal of applied microbiology,1994,77(5): 519-527.
[12] UPADHYAYA J,KIM M J,KIM Y H,et al.Enzymatic formation of compound-K from ginsenoside Rb1 by enzyme preparation from cultured mycelia ofArmillariamellea[J].Journal of Ginseng Research,2016,40(2):105-112.
[13] 华承伟,于江傲,李兰,等.拟青霉FLH30_葡萄糖苷酶动力学—激活抑制及其转糖苷[J].食品科技,2016,16(5):130-135.
Isolation of high-conversion ginsenoside strain and optimization of fermentation medium
FANG Lei ,CHEN Hong, YU Xiao-bin
(The Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, JiangnanUniversity, Wuxi 214122,China)
Strains producing β-glucosidase were isolated by solid medium containing esculin and ferric. Then six strains having high β-glucosidase activity were selected withp-nitropheny l-β-D-glucopyranoside as substrate. Strain having high ginsenoside bioconversion was finally chosen with Rb1 as substrate and converted products were determined by TLC and HPLC. β-glucosidase activity of this strain was 0.803 U/mL and ginsenoside Rd conversation rate was 97.234 2%. The selected strain was identified asSaccharomycopsisfibuligerabased on the morphology and nucleotide sequence analysis of the 18S rDNA. Fermentation medium was optimized to contain lactose as carbon source and corn flour as nitrogen source, and Ca2+as metal ion. Finally inducer was optimized to promote the ginsenoside bioconversion. Results indicated that inducer had little impact on the bioconversion but rutin, a kind of inducer, could promote the bioconversion of Rd to CK. The selected strain with high ginsenoside bioconversion had good potential application.
ginsenoside; β-glucosidase; yeast; identification; optimation
10.13995/j.cnki.11-1802/ts.201704023
硕士研究生(余晓斌教授为通讯作者,E-mail:xbyu@jiangnan.edu.cn)。
江苏省普通高校研究生科研创新计划项目(SJLX15_0546)
2016-10-08,改回日期:2016-11-29
