“低甲醇浓度- 高溶解氧浓度”策略诱导毕赤酵母高效表达HSA-GCSFm及其转录组学机理分析
2017-04-26涂庭勇贾禄强孙佼文陈珊珊史仲平
涂庭勇,贾禄强,孙佼文,陈珊珊,史仲平
(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
“低甲醇浓度- 高溶解氧浓度”策略诱导毕赤酵母高效表达HSA-GCSFm及其转录组学机理分析
涂庭勇,贾禄强,孙佼文,陈珊珊,史仲平*
(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
甲醇/山梨醇共混诱导毕赤酵母(Mut+,GS115)表达人血清白蛋白-人粒细胞集落刺激因子突变体融合蛋白(HSA-GCSFm)的过程中,甲醇消耗与O2消耗相互偶联,难以将甲醇浓度和溶解氧浓度(DO)同时维持在高水平。该文研究探讨了“低甲醇浓度-高DO”和“高甲醇浓度-低DO”诱导策略下HSA-GCSFm的表达性能。结果表明,“低甲醇浓度-高DO”诱导策略策略下的HSA-GCSFm浓度达到587.5 mg/L,而“高甲醇浓度-低DO”诱导策略下的HSA-GCSFm浓度仅达到106 mg/L。利用转录组学技术分析上述2种诱导策略引起HSA-GCSFm表达水平差异的分子机制,结果表明:“低甲醇浓度-高DO”条件下甲醇代谢途径、TCA循环和过氧化物酶体相关的部分基因上调,而与蛋白水解作用相关的部分基因下调,表明该条件下甲醇和山梨醇的代谢活性更高,细胞抗高DO冲击的能力更强,错误折叠的蛋白减少。
毕赤酵母;甲醇浓度;溶解氧浓度;转录组学分析
甲醇营养型毕赤酵母(MethylotrophicPichiapastoris)表达系统是1980年代初开发和研制的一种新型蛋白表达系统。由于毕赤酵母表达系统具有细胞容易达到高密度、产物表达效率高、产物可分泌到胞外、外源基因遗传稳定等许多优点,近年来已成为极受青睐、应用广泛的外源蛋白表达系统[1]。一般而言,根据毕赤酵母利用甲醇的能力不同,可以将其分为甲醇利用快型(methanol utilization positive,Mut+)和甲醇利用慢型(methanol utilization slow,MutS)。Mut+型毕赤酵母的代表菌株为GS115;MutS型毕赤酵母的代表菌株为KM71。人粒细胞集落刺激因子是(human granulocyte colony stimulating factor,hG-CSF)特异的作用于粒系祖细胞,促进其向中性细胞增殖、分化及维持功能、存活所必需的糖蛋白造血生长因子[2]。BAHRAMI等成功地实现了hG-CSF在毕赤酵母系统中的表达,且产量达到320 mg/L[3]。然而,hG-CSF由于分子量较小而易被肾小球过滤,导致其在人体内半衰期短,使用效果不佳。目前,人们已利用人血清白蛋白(human serum albumin, HSA) 融合技术成功地融合了大量的多肽/蛋白类药物并显著地延长了其半衰期[4]。为了延长hG-CSF在人体内的半衰期,本研究室的合作者将G-CSF突变体(GCSFm)与HSA进行基因融合并在毕赤酵母GS115中成功表达。融合蛋白HSA-GCSFm兼具HSA抗原性及G-CSF活性,且突变型融合蛋白活性高出野生型融合蛋白数倍,具有良好的应用前景[5]。
为了提高HSA-GCSFm在毕赤酵母系统中的表达水平,需要对其发酵条件进行优化。毕赤酵母表达外源蛋白的过程主要分为甘油初始培养期、甘油流加培养期和甲醇诱导培养期,其中甲醇诱导期是表达蛋白最为关键的时期。本研究室的合作者在前期研究中已经证明,在甲醇诱导阶段添加辅助碳源山梨醇能够提高HSA-GCSFm在毕赤酵母GS115中的表达量[6]。在毕赤酵母表达外源蛋白的诱导阶段,甲醇浓度和溶解氧浓度(dissolved oxygen, DO)是影响外源蛋白表达的2个重要因素。对于毕赤酵母GS115而言,其诱导过程中甲醇能够被快速消耗,且O2消耗与甲醇利用相互偶联。因此,难以同时将甲醇浓度和DO控制在较高的水平,只能满足其中之一。因此,本研究将在合作者前期研究[7]的基础之上,考察采用甲醇/山梨醇共混诱导策略时,“高甲醇浓度-低DO”和“低甲醇浓度-高DO”2种条件下HSA-GCSFm的表达性能,并利用转录组学分析的方法进一步解析导致上述2种条件下发酵性能差异的分子机制。
1 材料与方法
1.1 材料
1.1.1 菌株
重组毕赤酵母(Pichiapastoris)GS115(pPIC9K-HSA-GCSFm),由江南大学药学院分子药理学实验室提供。表达载体为pPIC9k蛋白信号肽为α交配因子信号肽,外源基因为HSA-GCSFm。
1.1.2 培养基
种子培养基(g/L):酵母粉10,葡萄糖20,蛋白胨20。发酵罐初始培养基(g/L):甘油20 mL/L,K2SO41,MgSO41,CaSO40.1,(NH4)2SO45,PTM110 mL/L,H3PO42%(v/v),pH 6.0。甘油流加培养基(g/L):甘油500 mL/L,(NH4)2SO40.5,MgSO40.03,PTM110 mL/L, KH2PO40.5,pH 6.0。诱导流加培养基(g/L):甲醇500 mL/L,(NH4)2SO40.5,MgSO40.03,PTM110 mL/L, KH2PO40.5,pH 5.5。山梨醇流加培养基(g/L):山梨醇 500。
1.2 培养方法
1.2.1 种子培养
在装有50 mL种子培养基的500 mL三角瓶中接入从YPD平板上挑取的单菌落,30 ℃、220 r/min的条件下摇瓶培养24 h,作为发酵的种子液。
1.2.2 5 L发酵罐分批补料培养毕赤酵母表达HSA-GCSFm
分批补料培养在5 L发酵罐(百仑生物科技公司)内进行,装液量3 L,接种量10%,通风比为1.5 vvm。初始甘油耗尽后开始补加甘油流加培养基,利用前期研究中构建的改良型DO-stat策略控制甘油流加,当DO基线过低时改为通纯氧,当菌体质量浓度达到100 g-DCW/L时停止流加甘油。经过1~2 h的饥饿培养,甘油以及其他可以充当碳源的中间代谢物全部耗尽后,添加甲醇诱导HSA-GCSFm的表达。因此本研究中,采用2种不同的甲醇/山梨醇共混流加诱导策略:(1)诱导策略Ⅰ(低甲醇浓度-高DO):将DO设定为10%,按照下列公式修正甲醇流加速率:F=F*+Kc×(DO-DOset)。其中F表示甲醇流加速率(F≥ 0);F*代表基准甲醇流加速率,本次实验验中F*=0.7 mL/min;控制参数Kc在实验中设定为0.05。(2)诱导策略Ⅱ(高甲醇浓度-低DO):利用甲醇电极在线检测甲醇浓度,并采用ON-OFF控制的方式将甲醇浓度维持在5~10 g/L,同时按2∶1的质量比流加山梨醇。在整个诱导期内,均采用空气供氧,通风比为1.5 vvm,搅拌速率保持不变,并将2个电子天平通过RS232通讯接口连接至工业控制计算机,通过自编的监控程序在线记录甲醇和山梨醇的流加速率。
1.3 检测方法
1.3.1 乙醇和甲醇浓度测定
商用的膜渗透型甲醇电极(上海苏泊公司,FC2002)可以对乙醇和甲醇这一类的挥发性小分子有机物产生响应,其响应电压与有机物浓度存在二次曲线型的数量关系。利用不同浓度的甲醇和乙醇标准溶液,分别拟合出描述电极输出电压与乙醇/甲醇浓度之间数量关系的标准曲线。在细胞培阶段和诱导阶段,根据电极的输出电压,分别利用各自的标准曲线计算得到乙醇和甲醇的浓度。
1.3.2 菌浓测定
测量方法与参考文献[8]相同。
1.3.3 HSA-GCSFm浓度测定
SDS-PAGE蛋白电泳。使用5%的浓缩胶和8%的分离胶定性检测。利用尿微量蛋白检测试剂盒测定样品中HSA的含量,根据公式C(HSA-GCSFm)=1.30×C(HSA)来计算融合蛋白的浓度(g/L),其中1.30代表HSA与HSA-GCSFm的相对分子质量之比。
1.3.4 总蛋白浓度测定
采用考马斯亮蓝法测定发酵液中的总蛋白浓度,操作步骤与参考文献[9]相同。
1.3.5 乙醇和甲醇浓度的离线测定
乙醇和甲醇浓度使用气相色谱仪测定,色谱条件与参考文献[10]相同。
1.3.6 山梨醇的检测方法
采用高效液相色谱法测定。检测之前,发酵上清液样过0.22 μm 膜处理。色谱条件如下:氨基柱(Agilent);示差折光检测器 (RID);检测器温度 30 ℃;柱温 30 ℃;流动相 70% 乙腈和 30% 超纯水;流速 1 mL/min;进样量 20 μL。
1.3.7 O2利用速率,CO2释放速率的计算
利用尾气分析仪(LKM2000A,韩国LOKAS公司)在线检测发酵尾气中的CO2和O2的分压,按文献[11]中的公式进行计算O2利用速率(oxygen uptake rate OUR),CO2释放速率(carbon dioxide rate CER),并借助RS232通信接口将数据传输记录于工业控制计算机中。
1.3.8 甲醇及山梨醇代谢关键酶比酶活测定
醇氧化酶(alcohol oxidase,AOX),甲醛脱氢酶(formaldehyde dehydrogenase,FLD),甲酸脱氢酶(formate dehydrogenase,FDH),异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)以及α-酮戊二酸脱氢酶(α-ketogluarate dehydrogenase complex, α-KD)比酶活按文献[12]报道方法测定。
1.3.9 不同诱导条件下产HSA-GCSFm的转录组学分析
诱导HSA-GCSFm表达36 h后,分别取10 mL诱导策略Ⅰ和诱导策略Ⅱ条件下的发酵液。委托北京诺禾致源生物信息科技有限公司提取胞内RNA,并采用RNA-seq法进行转录组分析。分析两种发酵策略下基因的差异表达情况,并对差异表达基因进行KEGG功能富集分析。
2 结果与讨论
2.1 不同诱导策略下的发酵性能
前期研究表明,将DO控制在10%~15%时,Mut+型毕赤酵母细胞能够高效表达猪圆环病毒Cap蛋白[13]。因此,在本研究中,将10%~15%的DO水平定为“高DO”。对于本研究中使用的Mut+型毕赤酵母菌株,在甲醇供应充足条件下醇氧化酶被大幅度激活,细胞耗氧剧烈,导致DO始终处于0%。想要将DO控制在10%~15%的高水平,必须要限制细胞对甲醇的消耗速率。通过调节甲醇流加速率将DO控制在10%~15 %(高DO)时,甲醇浓度必然处于极低的水平(1 g/L以下),此时的甲醇浓度被认为是“低甲醇浓度”。DAMASCENO等人发现,将甲醇浓度控制在5 g/L时,可以获得最高的目的蛋白产量(A33scFv)[14];DING等人发现,将甲醇浓度控制在5 g/L以上时,甲醇供应充足,毕赤酵母细胞能够高效表达猪α干扰素[15]。在本研究中,将高于5 g/L的甲醇浓度界定为“高甲醇浓度”。将甲醇浓度控制在5 g/L以上时,DO自然处于接近0%的水平,此时的DO水平被认定为“低DO”。
利用诱导策略Ⅰ实现上述的“高DO-低甲醇浓度”诱导条件,将DO设定在10%,甲醇浓度自然;利用诱导策略Ⅱ实现上述的“低DO-高甲醇浓度”诱导条件,将甲醇浓度设定在5 g/L,DO自然。实际的控制性能如图1所示,在诱导策略Ⅰ下,DO在绝大多数时间内都被维持在10%~15%,而甲醇浓度则始终被维持在1 g/L以下。与此相反,在诱导策略Ⅱ中,DO始终维持在0%,而甲醇浓度则始终被维持在5~8 g/L。图2a是2种诱导策略下发酵液样品SDS-PAGE检测结果,从中可以看出,诱导策略Ⅰ条件下的HSA-GCSFm表达水平明显高于诱导条件Ⅱ下的相应值。直接测定各时间点发酵液样品中的HSA-GCSFm浓度,也得到相同的结论。如图2b所示,采用诱导策略Ⅰ时,诱导60 h后HSA-GCSFm的浓度达到587.5 mg/L;采用诱导策略Ⅱ时,诱导60 h后HSA-GCSFm的浓度仅达到106 mg/L。
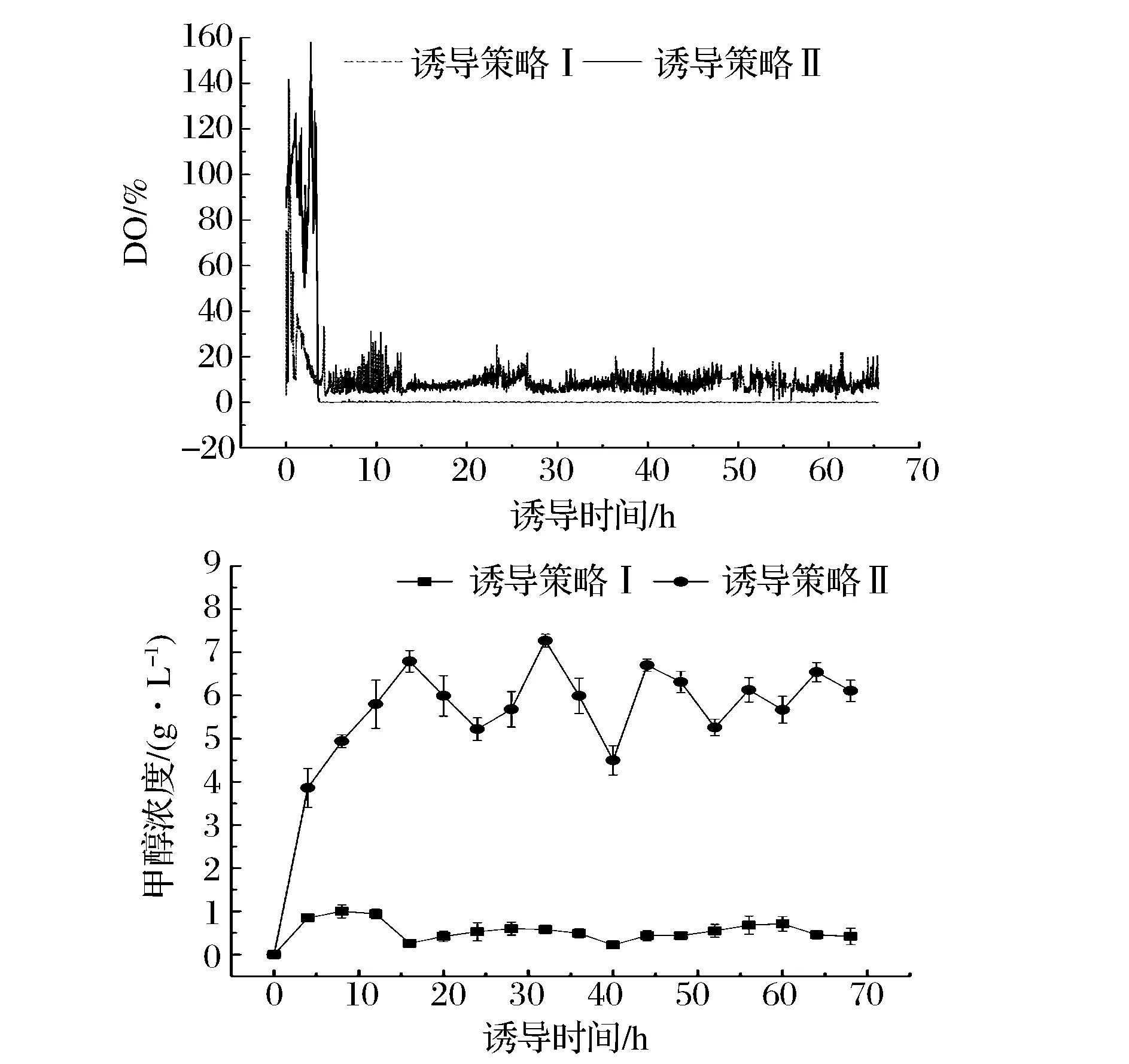
图1 不同诱导策略下的DO及甲醇浓度变化Fig.1 Variations of DO and methanol concentration in different induction strategies诱导策略Ⅰ:低甲醇浓度-高DO;诱导策略Ⅱ:高甲醇浓度-低DO

图2 不同诱导策略下的HSA-GCSFm表达水平Fig.2 The expression level of HSA-GCSFm in different induction strategies诱导策略Ⅰ:低甲醇浓度-高DO;诱导策略Ⅱ:高甲醇浓度-低DO
2.2 不同诱导策下的呼吸特性
OUR和CER是发酵过程中重要的在线状态参数,可以直接反应菌体的呼吸代谢状况。图3比较了诱导策略Ⅰ和诱导策略下的OUR和CER。从中可以看出,采用诱导策略Ⅰ的批次其OUR和CER在诱导期内分别维持在50 mmol/(L·h)和40 mmol/(L·h);采用诱导策略Ⅱ的批次其OUR和CER在诱导期内分别维持在90 mmol/(L·h)和60 mmol/(L·h)。在诱导策略Ⅱ的调节下,甲醇浓度能够被维持在5~8 g/L,从而保证甲醇的充足供应,甲醇代谢活性被大幅度提高,这就导致该条件下的OUR和CER均明显高于采用诱导策略Ⅰ的批次。在采用诱导策略Ⅱ的批次中,HSA-GCSFm表达水平较低。由此可以看出,高代谢呼吸活性并不一定能够促进HSA-GCSFm的高效表达。

图3 不同诱导策略下细胞CER和OUR变化Fig.3 Variations of CER and OUR in different feeding strategies诱导策略Ⅰ:低甲醇浓度-高DO;诱导策略Ⅱ:高甲醇浓度-低DO
2.3 不同诱导策略下的碳代谢关键酶活性
如图4所示,AOX是甲醇代谢途径中最关键的酶,它催化甲醇代谢过程中的第一步反应,将甲醇氧化为甲醛。AOX的活性则直接决定细胞对甲醇的利用速率,从而影响发酵产蛋白的速率。不同的诱导策略在诱导期的细胞干重基本相同,AOX的比活性实际体现了不同诱导条件下细胞代谢甲醇的能力。由图5a可知,诱导策略Ⅰ下的AOX比活性活性比采用诱导策略Ⅱ的批次提高了一倍多。这表明在高DO环境下毕赤酵母细胞具有更强的代谢甲醇的能力。但在诱导策略Ⅰ条件下,由于甲醇供应收到限制,实际的甲醇消耗速率仍然低于采用诱导策略Ⅱ的批次,如图5b所示。
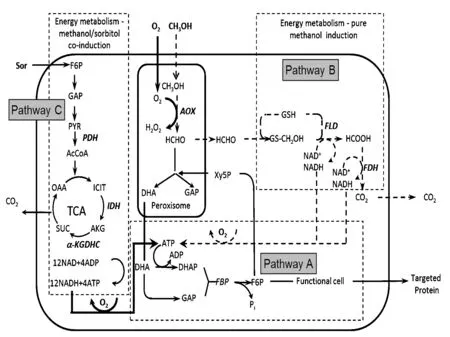
图4 毕赤酵母胞内碳代谢路径Fig.4 Carbon metabolism pathways in Pichia pastoris
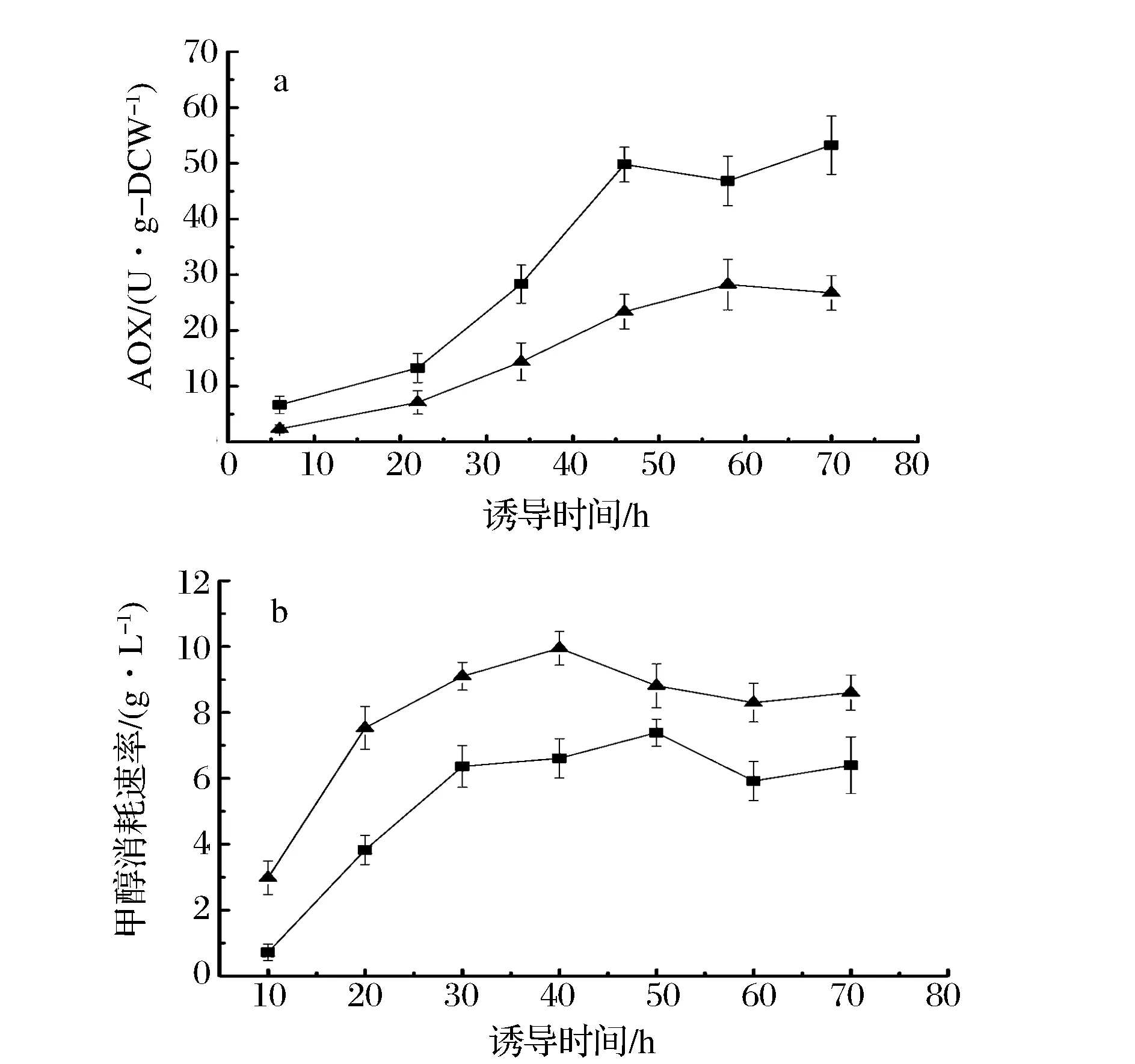
:诱导策略Ⅰ(低甲醇浓度-高DO);:诱导策略Ⅱ(高甲醇浓度-低DO)图5 不同诱导策略下的AOX比酶活和甲醇消耗速率Fig.5 Specific activities of AOX and methanol consumption rate in different induction strategies
FLD和FDH是甲醇异化途径(Pathway B)中的关键酶,分别催化甲醛氧化为甲酸和甲酸完全氧化为CO2的反应。由图6a和图6b可知,诱导策略Ⅰ条件下的FLD和FDH比酶活均明显高于诱导策略Ⅱ。因此,在采用诱导策略Ⅰ时毕赤酵母细胞能够快速分解甲醛和甲酸,减轻了甲醛和甲酸对细胞的毒害作用。如图4所示,辅助碳源山梨醇的代谢是通过糖酵解途径和TCA途径(Pathway C)完成的,α-KD和IDH是TCA途径中的关键酶。由图6c和6d可知,诱导策略Ⅰ条件下的α-KD和IDH比酶活均明显高于诱导策略Ⅱ。因此,诱导策略Ⅰ能够提高毕赤酵母细胞代谢山梨醇的效率,为蛋白合成途径提供更多的能量,促进HSA-GCSFm的高效表达。
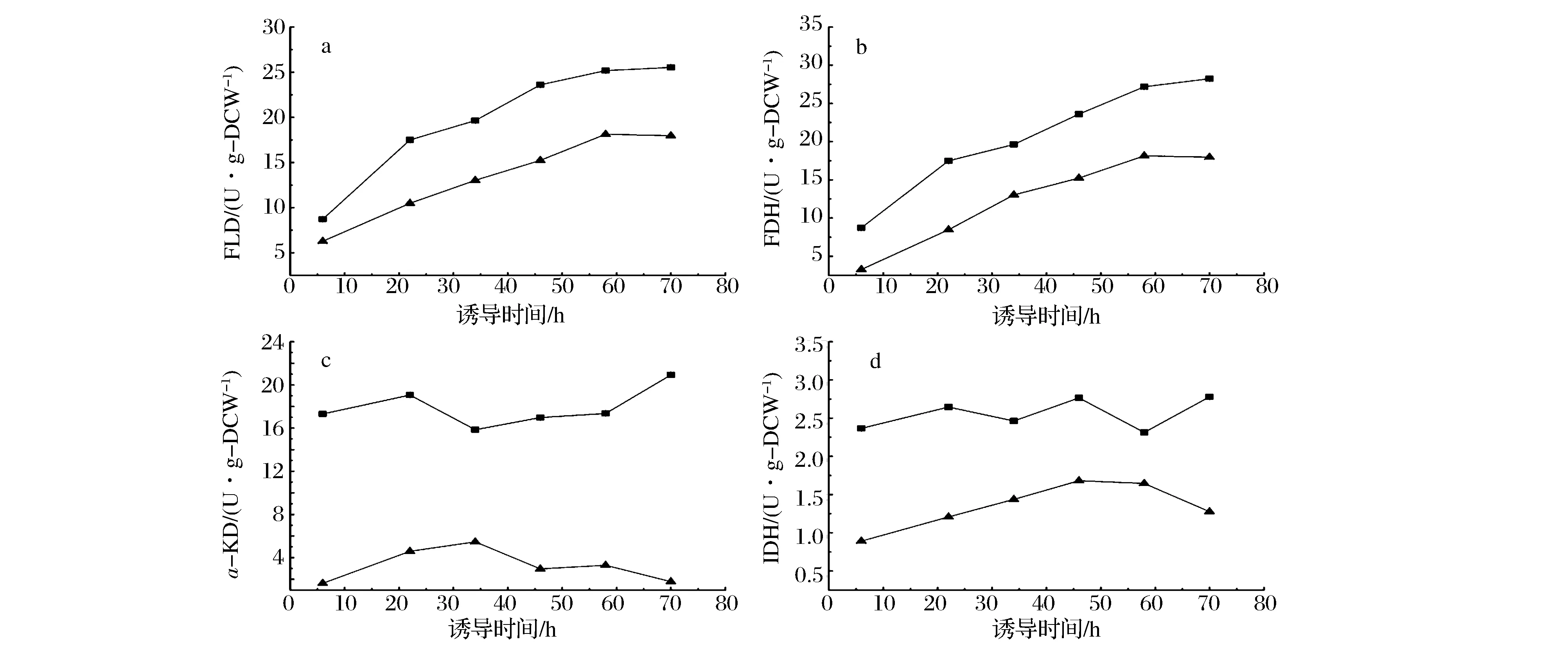
:诱导策略Ⅰ(低甲醇浓度-高DO);:诱导策略Ⅱ(高甲醇浓度-低DO)图6 不同诱导策略关键酶的比酶活Fig.6 Specific activities of the key enzyme using different feeding strategies
2.4 不同诱导策略下基因的差异表达
2.4.1 差异表达基因的筛选
利用RNA-seq技术分析获得诱导策略Ⅰ(高DO-低甲醇浓度)和诱导策略Ⅱ(低DO-高甲醇浓度)条件下、诱导中期(36 h)的细胞样本各基因的转录水平数据。以Foldchange≥1.5和qvalue≤0.05为条件,筛选不同诱导条件下的差异表达基因。根据筛选结果,差异化表达的基因共有514个,其中上调表达的基因数为278个,下调表达的基因数为236个。
2.4.2 差异表达基因的 GO功能富集分析
Gene Ontology(GO)是一个国际标准化的基因功能分类体系,通过GO功能显著性富集分析能确定差异表达基因行使的生物学功能[16]。因此,本研究对不同诱导策略下的差异表达基因进行GO功能富集分析,结果表明(表1):差异表达基因主要集中于水解酶活性、氧化还原等分子功能和羧酸代谢过程、细胞呼吸等细胞过程。
2.4.3 差异表达基因的KEGG Pathway代谢途径分析
在生物体内,不同基因相互协调行使其生物学功能,通过途径显著性富集能确定差异表达基因参与的最主要生化代谢途径和信号转导途径。KEGG(Kyoto Encyclopedia of Genes and Genomes)是系统分析基因功能、基因组信息的数据库,它有助于研究者把基因及表达信息作为一个整体网络进行研究[17]。因此,对不同诱导条件下的差异表达基因进行KEGG信号通路分析,符合P≤0.05则被定义为显著性差异富集的信号代谢通路,结果如表2所示:TCA循环、甲醇代谢、氨基酸合成、氮代谢等途径相关的基因都有不同程度的上调或下调,表明不同诱导策略可以引起毕赤酵母细胞代谢途径的变化。这些代谢通路改变对研究不同甲醇浓度及DO影响毕赤酵母表达HSA-GCSFm的分子机制具有重要意义。

表1 差异表达基因的GO功能富集分析
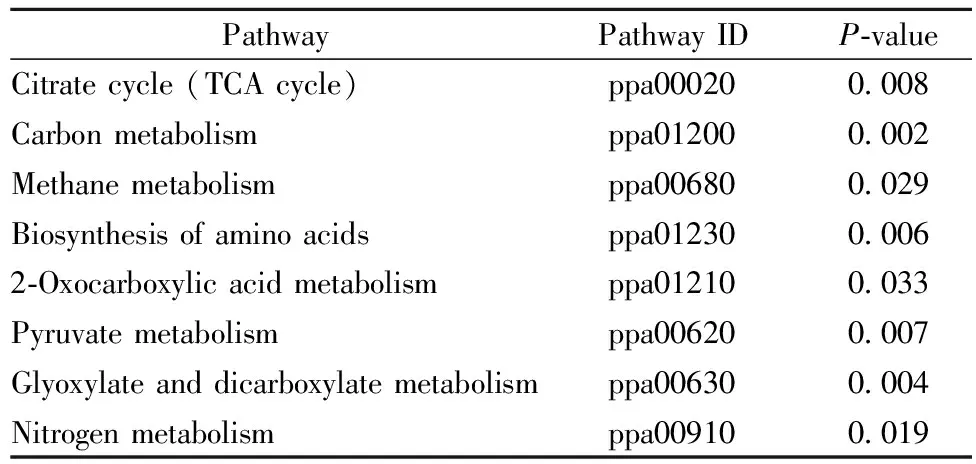
表2 差异表达基因的KEGG Pathway 功能集分析
2.5 不同诱导策略影响HSA-GCSFm表达的转录组学机理
2.5.1 与甲醇相关代谢基因转录水平变化
甲醇是蛋白表达过程的诱导剂和主要碳源,因此首先比较不同诱导策略下甲醇代谢相关基因的表达水平。如图7所示,在诱导策略Ⅰ条件下,ALOX1基因转录水平明显上调。ALOX1基因编码醇氧化酶,其转录水平上调会引起醇氧化酶活性的提高(图5a)。FDH是编码甲酸脱氢酶的基因,在诱导策略Ⅰ条件下明显上调, FDH酶具有更高的活性(图6b),使得酵母细胞更易分解甲醇代谢产生的有毒中间产物甲酸。MTHR2编码四氢叶酸还原酶,四氢叶酸是一碳单位的携带者,MTHR2基因在诱导策略Ⅰ条件下的上调表明细胞的甲醇代谢能力得到大幅提升。ACS1和SERB分别编码乙酰辅酶A合成酶B和磷酸丝氨酸磷酸酶,也与甲醇代谢密切相关。由此可见,诱导策略Ⅰ能够提高诸多甲醇代谢相关酶的表达水平,进而显著激活甲醇代谢通路。
:诱导策略Ⅰ(低甲醇浓度-高DO);□:诱导策略Ⅱ(高甲醇浓度-低DO)图7 与甲醇代谢相关基因转录水平变化Fig.7 Transcriptional analysis of genes relate to methanol metabolism
2.5.2 与TCA代谢路径转录水平
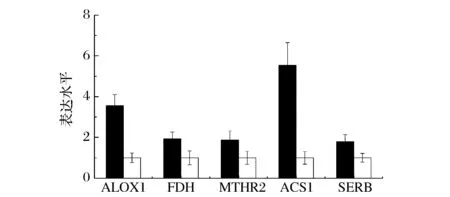
辅助碳源山梨醇被摄入酵母细胞后,通过TCA循环完成其代谢过程。TCA循环中所产生的中间物代谢可以作为其他代谢途径的前体,如氧化磷酸化,氨基酸合成,脂肪酸以及其它生物大分子的合成。山梨醇的添加,能够明显缓解甲醇的供能压力,并为HSA-GCSFm的合成提供充足的碳源。转录组学分析发现,在诱导策略Ⅰ条件下,有部分TCA循环中的关键酶基因显著上调(图8)。柠檬酸合酶由CIS基因编码,是TCA循环中最关键的限速酶,对TCA循环的整体活性有调节作用。CIS基因的上调可以提高TCA循环的整体代谢活性。IDH2基因编码编码异柠檬酸脱氢酶; KDL基因编码催化α-酮戊二酸生成琥珀酰CoA的复合酶系;MDHC基因编码苹果酸脱氢酶。IDH2,KDH和MDHC在诱导策略Ⅰ条件下均有不同程度的上调。由此可知,采用诱导策略Ⅰ时,细胞代谢山梨醇的能力更强,能够为蛋白合成提供更加充足的能量和碳源。
:诱导策略Ⅰ(低甲醇浓度-高DO);□:诱导策略Ⅱ(高甲醇浓度-低DO)图8 与TCA循环相关基因转录水平变化Fig.8 Transcriptional analysis of genes relate to tricarboxylic acid cycle
2.5.3 与蛋白酶体代谢途径基因转录水平
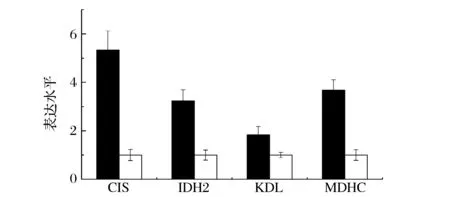
蛋白酶体由2个19S调节蛋白和1个20S核心蛋白组成。Rpn11是19S的蛋白PA700中Lid的成员,Rpn11是调节蛋白的关键亚基,能够直接影响调节蛋白的活性[18]。Rpn2、Rpn13、Rpt3分别参与编码26S蛋白酶的调节亚基N2、N13、T3。PSB3和PSB5分别编码20S核心蛋白的β3和β5亚基。上述基因编码的蛋白主要参与ATP依赖的蛋白水解,其在诱导策略Ⅰ条件下均明显下调(图9)。这说明在采用诱导策略Ⅰ进行发酵时,细胞内的蛋白酶含量减少,错误折叠的蛋白数减少,蛋白合成效率提高。
:诱导策略Ⅰ(低甲醇浓度-高DO);□:诱导策略Ⅱ(高甲醇浓度-低DO)图9 与蛋白酶体代谢基因转录变化Fig.9 Transcriptional analysis of genes relate to proteasome
2.5.4 与过氧化物酶体代谢转录水平
过氧化物酶体在O2代谢起到十分重要的作用,它能够调节O2浓度,降低O2对细胞造成的伤害[19]。一旦溶氧上升,细胞内过氧化物酶体氧化应激反应上调,用于缓解高浓度氧给细胞带来的毒害作用。PXMP4编码过氧化物酶体上的膜蛋白酶4,主要参与蛋白转运和催化功能。SODM编码超氧化物歧化酶(SOD),SOD能够催化体内的O2-发生歧化反应,从而将其清除。PMP20基因的编码产物则属于抗氧化蛋白超家族,主要起到还原过氧化物的作用。SPS19和LCF1的编码产物则主要编码参与不饱和脂肪酸的氧化。CACM编码肉毒碱-O-乙酰基转移酶,它也是参与清除过氧化物的酶类之一。如图10所示,上述与O2代谢相关的基因在诱导策略Ⅰ下均有不同程度的上调。这是由于诱导策略Ⅰ下的DO水平明显高于诱导策略Ⅱ,大量O2通过自由扩散进入胞内,引起O2-等有毒副产物的生产。而细胞本身则通过上调上述基因,合成相关酶,降解O2代谢中的有毒副产物,保证细胞生理活动的正常进行。
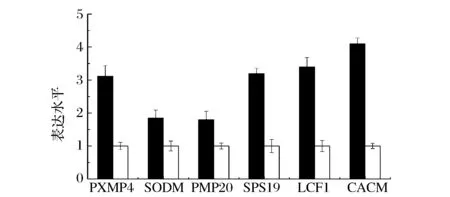
:诱导策略Ⅰ(低甲醇浓度-高DO);□:诱导策略Ⅱ(高甲醇浓度-低DO)图10 与过氧化物酶体相关基因转录变化Fig.10 Transcriptional analysis of genes relate to peroxisome
3 结论
本研究在甲醇/山梨醇共混诱导条件下,对比了“低甲醇浓度-高DO”和“高甲醇浓度-低DO”2种诱导策略。结果表明,“低甲醇浓度-高DO”条件更有利于HSA-GCSFm的高效表达。利用转录组学分析技术揭示产生上述现象的分子机制,结果发现:“低甲醇浓度-高DO”条件下甲醇代谢途径、TCA循环和过氧化物酶体相关的部分基因发生不同程度的上调,而与蛋白水解相关的部分基因则发生了不同程度的下调。这说明“低甲醇浓度-高DO”条件下甲醇和山梨醇代谢的活性更高,细胞抗高DO冲击的能力更强,错误折叠的蛋白减少,蛋白合成效率更高。
[1] MACAULEY-PATRICK S, FAZENDA M L, MCNEIL B, et al. Heterologous protein production using thePichiapastorisexpression system [J]. Yeast, 2005, 22(4): 249-270.
[2] ZSEBO K M, COHEN A M, MURDOCK D C, et al. Recombinant human granulocyte colony stimulating factor: molecular and biological characterization [J]. Immunobiology, 1986, 172(3-5): 175-184.
[3] BAHRAMI A, SHOJAOSADATI S A, KHALILZADEH R, et al. Two-stage glycerol feeding for enhancement of recombinant hG-CSF production in a fed-batch culture ofPichiapastoris[J]. Biotechnology Letters, 2008, 30(6): 1 081-1 085.
[4] DARRELL S, JASON C, LESLIE R E. Albumin as a versatile platform for drug half-life extension [J]. Biochimica Et Biophysica Acta, 2013, 1830(12): 5 526-5 534.
[5] 朱书峰. 计算机辅助HSA-hGCSF融合蛋白的分子改造 [D]. 无锡; 江南大学, 2008.
[6] 李清亮, 周月涵, 丁健,等. 毕赤酵母GS115表达HSA-GCSF~m的诱导工艺研究 [J]. 工业微生物, 2016, 02): 8-13.
[7] 李清亮. 毕赤酵母表达HSA-GCSFm融合蛋白的发酵与纯化研究 [D]. 无锡:江南大学, 2015.
[8] BLAKE M S, JOHNSTON K H, RUSSELL-JONES G J, et al. A rapid, sensitive method for detection of alkaline phosphatase-conjugated anti-antibody on Western blots [J]. Analytical Biochemistry, 1984, 136(1): 175-179.
[9] JIN Hu, ZHENG Zhi-yong, GAO Min-jie, et al. Effective induction of phytase inPichiapastorisfed-batch culture using an ANN pattern recognition model-based on-line adaptive control strategy [J]. Biochemical Engineering Journal, 2007, 37(1): 26-33.
[10] WANG Zhi-hao, WANG Yun, ZHANG Dong-xu, et al. Enhancement of cell viability and alkaline polygalacturonate lyase production by sorbitol co-feeding with methanol inPichiapastorisfermentation [J]. Bioresource technology, 2010, 101(4): 1 318-1 323.
[11] GAO Min-jie, ZHAN Xiao-bei, ZHENG Zhi-yong, et al. Enhancing pIFN-alpha production and process stability in fed-batch culture ofPichiapastorisby controlling the methanol concentration and monitoring the responses of OUR/DO levels [J]. Applied Biochemistry and Biotechnology, 2013, 171(5): 1 262-1 275.
[12] GAO Min-jie, DONG Shi-juan, YU Rui-song, et al. Improvement of ATP regeneration efficiency and operation stability in porcine interferon-α production byPichiapastorisunder lower induction temperature [J]. Korean Journal of Chemical Engineering, 2011, 28(6): 1 412-1 419.
[13] DING Jian, ZHANG Chun-ling, GAO Min-jie, et al. Enhanced porcine circovirus Cap protein production byPichiapastoriswith a fuzzy logic DO control based methanol/sorbitol co-feeding induction strategy [J]. Journal of Biotechnology, 2014, 177(1)35-44.
[14] DAMASCENO L M, PLA I, CHANG H J, et al. An optimized fermentation process for high-level production of a single-chain Fv antibody fragment inPichiapastoris” [J]. Protein Expression and Purification, 2004, 37(1): 18-26.
[15] DING Jian, GAO Minjie, HOU Guoli, et al. Stabilizing porcine interferon-α production byPichiapastoriswith an ethanol on-line measurement based DO-Stat glycerol feeding strategy [J]. Journal of Chemical Technology and Biotechnology, 2014, 89(12): 1 948-1 953.
[16] YOUNG M D, WAKEFIELD M J, SMYTH G K, et al. Gene ontology analysis for RNA-seq: accounting for selection bias [J]. Genome Biology, 2010, 11(2): 1-12.
[17] MAO X, CAI T, OLYARCHUK J G, et al. Automated genome annotation and pathway identification using the KEGG Orthology (KO) as a controlled vocabulary [J]. Bioinformatics, 2005, 21(19): 3 787-3 793.
[18] LUO Honglin, WONG J, WONG B. Protein degradation systems in viral myocarditis leading to dilated cardiomyopathy [J]. Cardiovascular Research, 2010, 85(2): 347-356.
[19] MARKS V D, HO S S D, GK V D M, et al. Dynamics of the yeast transcriptome during wine fermentation reveals a novel fermentation stress response [J]. Fems Yeast Research, 2008, 8(1): 35-52.
Enhanced HSA-GCSFmproduction byPichiapastorisunder “low methanol concentration-high dissolved oxygen” induction strategy and its transcriptome analysis
TU Ting-yong, JIA Lu-qiang, SUN Jiao-wen, CHEN Shan-shan, SHI Zhong-ping*
(Key Laboratory of Industrial Biotechnology of Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, China)
In the process of producing HSA-GCSFmwith methanol/sorbitol co-induction byPichiapastoris, the consumptions of methanol and O2couple with each other, making it difficult to maintain methanol concentration and dissolved oxygen (DO) at high level simultaneously. In this study, induction strategies of “high methanol concentration-low DO” and “low methanol concentration-high DO” were adopted, and the performances of HSA-GCSFmproduction were investigated. As a result, the titer of HSA-GCSFmunder “high methanol concentration-low DO” and “low methanol concentration-high DO” strategies were 587.5 mg/L and 106 mg/L, respectively. The molecular mechanism of the two induction strategies causing different HSA-GCSFmexpression level was revealed by transcriptome analysis. Under the “low methanol concentration-high DO” strategy, the partial genes correlated with methanol metabolic pathway, TCA cycle and peroxisome were up-regulated, while the partial genes involved in proteolysis were down-regulated. That indicated the higher metabolic activities of methanol and sorbitol, the enhanced resistance to the shock of high DO and reduced protein misfolding.
Pichiapastoris; methanol concentration; dissolved oxygen; transcriptome analysis
10.13995/j.cnki.11-1802/ts.201703001
硕士研究生(史仲平教授为通讯作者,E-mail:jnbioprocess@163.com)。
国家自然科学基金(21606106);江苏省自然科学基金(BK20150127)
2016-09-05,改回日期:2016-11-23
