泡菜中生物转化共轭脂肪酸的植物乳杆菌
2017-04-26杨波王奥纪东张灏陈永泉陈海琴陈卫
杨波,王奥纪东,张灏,陈永泉,陈海琴,陈卫
(江南大学 食品学院,江苏 无锡,214122)
泡菜中生物转化共轭脂肪酸的植物乳杆菌
杨波,王奥纪东,张灏,陈永泉,陈海琴*,陈卫
(江南大学 食品学院,江苏 无锡,214122)
共轭脂肪酸是指一类含共轭双键的多不饱和脂肪酸的总称,包括共轭亚油酸(conjugated linoleic acid ,CLA),共轭亚麻酸(conjugated linolenic acid,CLNA)和共轭十八碳四烯酸(conjugated stearidonic acid ,CSA)。CLA和CLNA分别是由亚油酸和亚麻酸衍生所得的多种位置与几何异构体的总称,具有多种生理功能,如抗癌、抗动脉粥样硬化、提高机体免疫力和减肥等,已成为功能性脂质的研究热点。采用GC-MS(gas chromatography-mass spectrometry)法分析了筛选自泡菜的22株植物乳杆菌转化共轭脂肪酸的能力。结果显示,CCFM47和CCFM232两株菌具有极高的共轭亚油酸和共轭亚麻酸转化能力,其中亚油酸的转化率均超过30%,发酵液中CLA总浓度分别达到0.166 4 mg/mL和0.151 4 mg/mL,而对α-亚麻酸的转化率高达60%,发酵液中CLNA总浓度分别达到0.196 4 mg/mL和0.172 1 mg/mL。
共轭亚油酸;共轭亚麻酸;气相色谱质谱联用检测;植物乳杆菌;转化率
共轭脂肪酸因其对人体健康的有益作用,一直是功能脂质领域的研究重点[1]。共轭亚油酸(conjugated linoleic acid,CLA)是一类含有共轭双键的十八碳二烯酸的总称,是亚油酸(linoleic acid,LA)的几何和位置异构体[2]。CLA主要存在于乳制品及反刍动物的肉中[1,3],已被确认是一种癌症抑制剂、抗氧化剂、胆固醇抑制剂、动脉粥样硬化抑制剂及促生长因子。在共轭亚油酸的异构体中,c9,t11-CLA和t10,c12-CLA被公认为最具生物活性的异构体[4-5]。共轭亚麻酸(conjugated linolenic acid,CLNA)是3个共轭双键的十八碳三烯酸的几何和位置异构体的总称。相比于CLA,CLNA天然存在于特定的植物种籽中[1],如桐籽油、石榴籽油、梓树种籽油中,CLNA占到总脂肪酸含量的40%~80%[6]。一些研究表明,用α-亚麻酸或种子植物油制备的CLNA碱性异构化混合物具有一些生理功能,包括抗肿瘤、抗炎、减肥以抗糖尿病等活性[7-8]。
由于这两种共轭脂肪酸在人们日常饮食中的摄取量相对较少,因此如何利用其他来源增加共轭脂肪酸的摄取量,以满足人类健康的要求是亟待研究的[8]。此前一些研究表明在特殊的培养基、脱脂乳或全脂乳中,许多双歧杆菌、乳杆菌、乳球菌和链球菌可分别利用LA、LNA为底物产生CLA和CLNA。如植物乳杆菌AKU1009a可将亚油酸、α-亚麻酸、γ-亚麻酸转化成相应的共轭脂肪酸[9],而双歧杆菌、乳杆菌、丙酸杆菌等也可利用亚麻酸产生CLNA,其中一些菌可将80%甚至90%的底物转化为CLNA[10]。
泡菜中富含丰富的乳酸菌,特别是植物乳杆菌,本团队先前研究结果表明一批源自泡菜的植物乳杆菌普遍具有良好的转化共轭脂肪酸的潜力[13]。在前期建立的分析方法的基础上,本研究对一批筛选自泡菜的植物乳杆菌进行了共轭脂肪酸转化能力的评估,从而获得高效生物转化共轭脂肪酸的优良菌株。
1 材料与方法
1.1 菌株
所使用的菌株筛选自泡菜,由江南大学食品生物技术中心菌种库保存(CCFM)。
1.2 主要试剂与仪器
MRS液体培养基:蛋白胨(10 g),牛肉膏(10 g),葡萄糖(20 g),乙酸钠(5 g),酵母提取物(5 g),柠檬酸二胺(2 g),K2HPO4(2 g),MgSO47H2O(0.1g),MnSO4H2O(0.05 g),水(1 L),pH6.5。MRS固体培养基:1 L MRS液体培养基中加入15 g琼脂。
主要仪器:DG250 厌氧工作站,英国Don Whitley Scientific;GCMS-QP2010 Ultra SYSTEM气质联用仪,岛津;ND100-2氮吹仪,四川汇巨仪器设备有限公司;GENIUS 3漩涡振荡混合器,IKA;ST40R型冷冻离心机,Thermo Scientific。
1.3 菌株活化与培养
将植物乳杆菌划线于MRS固体培养基上,厌氧,37 ℃培养48 h,挑取单菌落接种至MRS液体培养基中,厌氧,37 ℃培养48 h,连续转接活化3代。
将活化好的菌液按照2%(v/v)接种量分别接种至含LNA(0.3 mg/mL,含2% Tween-20)和含LA(0.5 mg/mL)的10 mL MRS液体培养基中,厌氧,37 ℃培养72 h。
1.4 脂肪酸提取
将培养后的菌液移至离心管中,5 000 r/min,离心5 min;取2份3 mL发酵液至干净离心管中。向发酵液中添加十七烷酸(C17∶0)作为内标至终浓度为0.202 5 mg/mL,后添加2 mL异丙醇,充分振荡30 s;再添加3 mL正己烷,充分振荡30 s;5 000 r/min,离心3 min,吸收正己烷层至干净提脂瓶,氮气吹干[11]。
1.5 脂肪酸甲酯化
向氮气吹干后的样品加入400 μL甲醇,充分振荡混匀,后添加适量重氮甲烷进行直接甲酯化,氮气吹干后用1 mL正己烷回溶,并转移至1.5 mL EP管中,12 000 r/min离心2 min,吸取洁净上清液800 μL至气相瓶,待进行GC-MS检测[12]。
靠窗一张大书案,上面很乱,堆着宣纸。砚台里的墨还很新鲜,墨迹沿着斜放在上面的毛笔已经延伸到了书案上,墨色从书案上的一张宣纸上浸出来一团。宣纸上是一幅未完成的女人肖像画。夏冰用枪轻轻将画纸摊平,画上的女人是雪萤。
1.6 GC-MS检测
脂肪酸甲酯采用气质联用色谱仪进行检测[13]。岛津气相色谱仪(GC 2010 plus),气相柱Rtx-wax(30 m × 0.25 mm × 0.25 μm),质谱仪(岛津Ultra QP2010)。程序升温条件:初始170 ℃,保持3min,以10 ℃/min的速率升温至190 ℃,保持3 min,后以5 ℃/min升温至220 ℃,保持1min,以2 ℃/min升温至230 ℃,保持18 min。采用分流进样,进样量1 μL,分流比10∶1,氦气为载气。进样器温度和检测器温度均为240 ℃。离子源220 ℃,强度为70 eV。根据文献中共轭亚油酸和共轭亚麻酸的质谱碎片进行定性,以十七烷酸为内标,采用内标法对脂肪酸进行定量[11,13-14]。
2 结果与讨论
2.1 植物乳杆菌转化共轭亚油酸的能力分析
游离脂肪酸对细菌具有一定的毒害或抑制作用,COAKLEY等人[11]发现某些菌株会受亚油酸的抑制,对于短双歧杆菌的最小抑制浓度为0.2~1.5 mg/mL。而本实验所分析菌株在含有亚油酸的培养基中生长良好,并未出现COAKLEY等人发现的有些菌株受游离脂肪酸抑制而不生长的情况。
所有植物乳酸菌在含有LA的培养基中培养72 h后,分别对其的发酵液中的脂肪酸进行了GC-MS检测,与空白对照相比,培养基中实际亚油酸的浓度为0.46 mg/mL,且本实验中GC-MS检测仅检出了CLA1(c9,t11-CLA)和CLA2(t9,t11-CLA)2个峰(图1),其他异构体在本实验条件下未检测到,故对植物乳酸菌发酵液中的c9,t11-CLA和t9,t11-CLA的含量以及转化率进行了计算,结果见表1。若c9,t11-CLA和t9,t11-CLA两种脂肪酸的转化率之和超过10%,则初步认为该菌株可产共轭亚油酸,当转化率达到30%及以上时可认为其是高产菌株[15]。
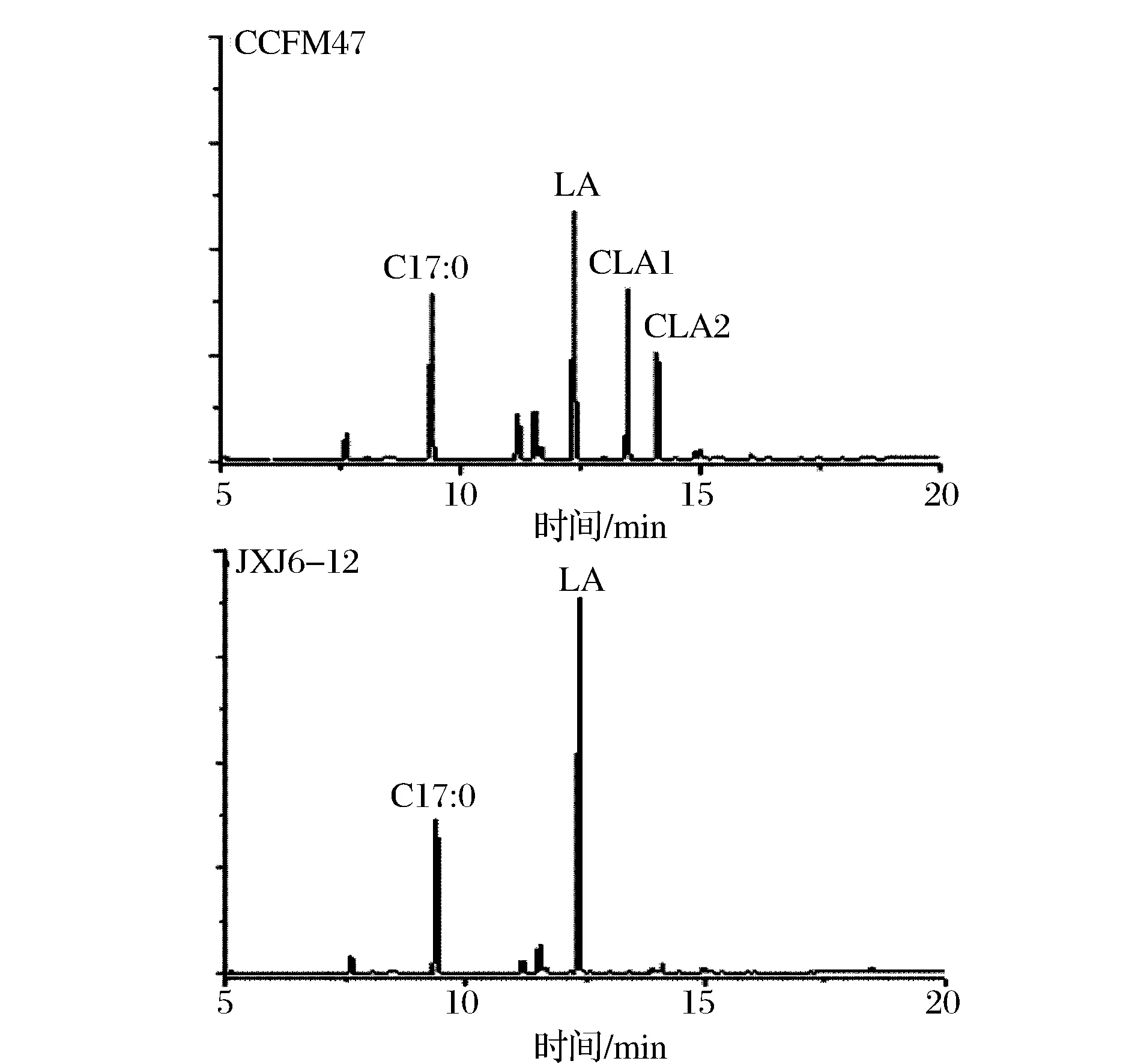
图1 CCFM47和JXJ6-12在含有亚油酸的培养基中生长后发酵液脂肪酸组成Fig.1 Fatty acid profiles of the supernatant from CCFM47 and JXJ6-12 cultured in the medium with linoleic acid
生物转化CLA的能力有较显著的菌株差异性,同一种属不同菌株生物转化CLA的性状也有较大的差异,本实验的结果也表明了该性状的菌株特异性。根据c9,t11-CLA和t9,t11-CLA两种共轭亚油酸异构体的转化率之和可认定RS44-1(9.67%)、CCFM47(37.18%)、CCFM184(13.61%)、CCFM185(11.84%)和CCFM232(33.87%)具有转化共轭亚油酸的能力,而其余17株植物乳杆菌均不具备转化共轭亚油酸的能力。CCFM47、CCFM232可将30%以上的亚油酸转化为CLA,为高产CLA的菌株,这2株菌所产异构体c9,t11-CLA和t9,t11-CLA的比例接近1∶1。
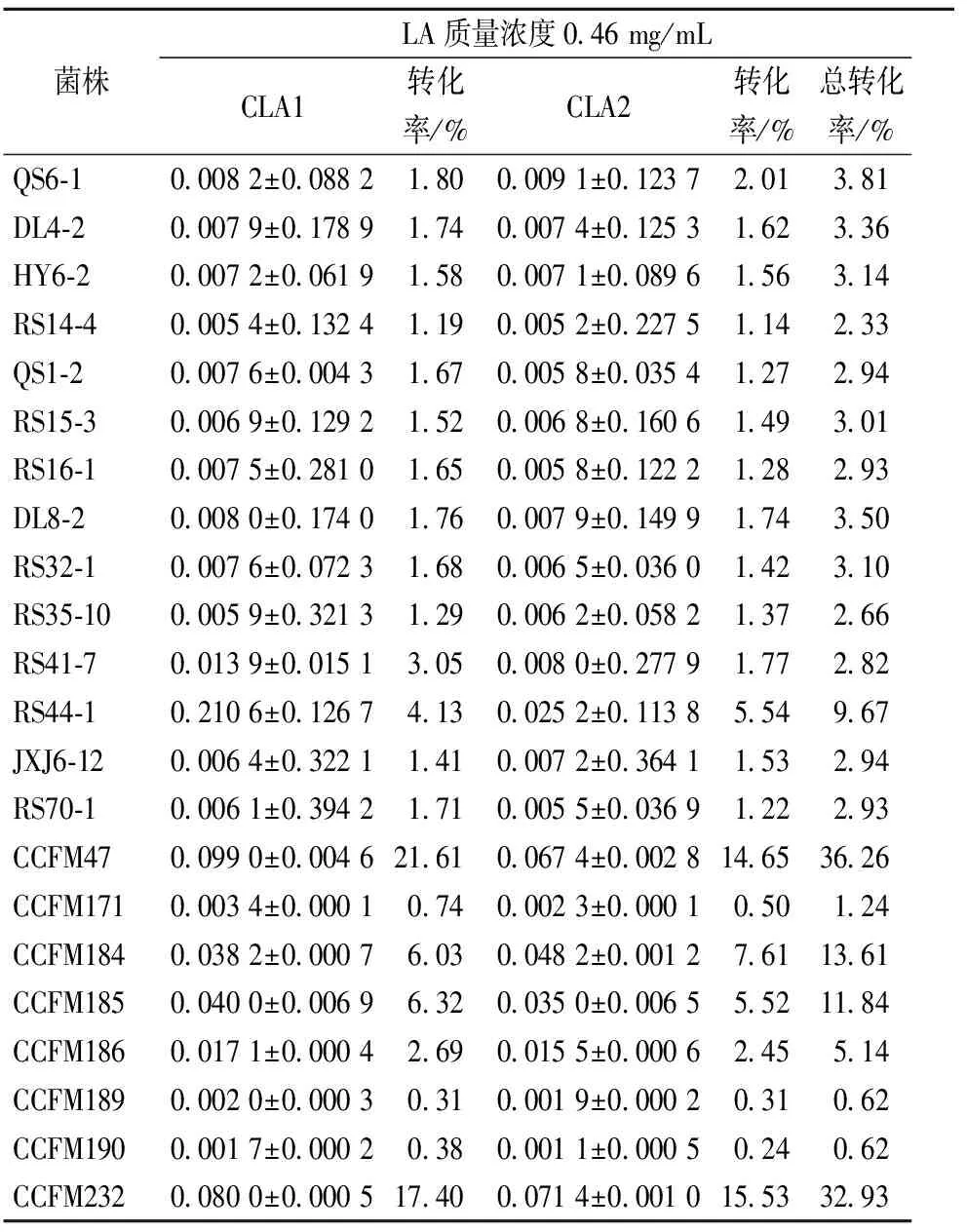
表1 在含LA的培养基中培养后发酵液的脂肪酸组成
注:CLA1:c9,t11-CLA;CLA2:t9,t11-CLA;N.D.:未检出。
2.2 植物乳杆菌转化共轭亚麻酸的能力分析
本实验所分析的菌株在含有游离亚麻酸的培养基中生长良好。根据内标的浓度与峰面积计算出只添加LNA的空白对照中LNA的实际浓度为0.25 mg/mL,并以此作为计算共轭亚麻酸转化率时的底物浓度。所有菌株在含有LNA培养基中培养72 h后,分别对其发酵液中的脂肪酸进行GC-MS检测,根据GC-MS碎片及文献报道[8,14]得出,本实验中乳酸菌所产CLNA仅有3种异构体(图2),其他异构体在本实验条件下未检出。对CLNA1、CLNA2、CLNA3三种脂肪酸的含量以及转化率进行计算,结果见表2。

图2 CCFM47和JXJ6-12在含有亚麻酸的培养基中生长后发酵液脂肪酸组成Fig.2 Fatty acid profiles of the supernatant from CCFM47 and JXJ6-12 cultured in the medium with linolenic acid
根据CLNA1、CLNA2、CLNA3三种共轭亚麻酸异构体的浓度之和可发现总转化率达到或超过10%仅有CCFM47、CCFM184、CCFM185、CCFM186和CCFM232五株菌,而其余所有17株菌均不具备转化共轭亚麻酸的能力。
CCFM47、CCFM232这2株菌对亚麻酸的转化率均超过了60%,分别高达77.67%和68.82%[8],是典型的高产菌株。进一步分析这2株菌所产CLNA的异构体可以发现, CLNA1和CLNA2占绝对主体,这2种异构体浓度之和分别达到0.187 4 mg/mL和0.164 6 mg/mL,占总CLNA的96.4%和95.6%。其中CLNA1为c9,t11,c15-CLNA,CLNA2为t9,t11,c15-CLNA,而CLNA3是之前文献中从未报道过的,系本研究中首次发现,但其具体共轭双键位置以及双键的顺反结构等待后续进一步研究确认。
综合表1和表2可知,该批菌株转化共轭亚油酸与转化共轭亚麻酸的性状基本一致,即可转化共轭亚油酸的植物乳杆菌同样具有转化共轭亚麻酸的能力,高产共轭亚油酸的菌株也是高产共轭亚麻酸的菌株,且共轭亚麻酸的转化率更高,这与先前的文献报道也基本一致[8,14]。
3 结论
在前期基础上[13, 15],本研究通过GC-MS检测法成功从22株菌株中筛选出较高产共轭亚油酸和共轭亚麻酸的菌株。CCFM47、CCFM232可分别将30%以上的亚油酸转化为共轭亚油酸,所得共轭亚油酸为c9,t11-CLA和t9,t11-CLA。此外,这2株菌可将60%以上的亚麻酸转化为c9,t11,c15-CLNA和t9,t11,c15-CLNA,以及痕量的CLNA3,前2种异构体可达总CLNA的95%以上。鉴于共轭脂肪酸对健康的益处以及益生菌对人体健康的改善调节作用,高效转化共轭脂肪酸的益生菌具有很大的研究价值和市场潜力。

表2 在含LNA的培养基中培养后乳酸菌发酵液的脂肪酸组成
注:CLNA1:c9,t11,c15-CLNA;CLNA2:t9,t11,c15-CLNA;N.D.:未检出。
[1] YASUI Y,HOSOKAWA M,SAHARA T,et al.Bitter gourd seed fatty acid rich in 9c, 11t, 13t-conjugated linolenic acid induces apoptosis and up-regulates the GADD45,P53 and PPAR gamma in human colon cancer Caco-2 cells[J].Prostaglandins Leukotrienes and Essential Fatty Acids,2005,73(2):113-119.
[2] BELURY M A.Dietary conjugated linoleic acid in health:physiological effects and mechanisms of action[J].Annual Review of Nutrition,2002,22(1):505-531.
[3] KOHNO H,SUZUKI R,YASUI Y,et al.Pomegranate seed oil rich in conjugated linolenic acid suppresses chemically induced colon carcinogenesis in rats[J].Cancer Science, 2004, 95(6):481-486.
[4] LEE S O,HONG G W,OH D K.Bioconversion of linoleic acid into conjugated linoleic acid by immobilizedLactobacillusreuteri[J]. Biotechnology Progress,2003,19(3):1 081-1 084.
[5] IRMAK S,DUNFORD N T,GILLILAND S E,et al.Biocatalysis of linoleic acid to conjugated linoleic acid[J].Lipids,2006, 41(8):771-776.
[6] YANG L,LEUNG K Y,CAO Y,et al.α-linolenic acid but not conjugated linolenic acid is hypocholesterolaemic in hamsters[J]. British Journal of Nutrition,2005,93(4):433-438.
[7] ARAO K,WANG Y M,INOUE N,et al.Dietary effect of pomegranate seed oil rich in 9cis, 11trans, 13cisconjugated linolenic acid on lipid metabolism in obese,hyperlipidemic OLETF rats[J].Lipids in Health and Disease,2004,3(1):24.
[8] GORISSEN L,RAES K,WECKX S,et al.Production of conjugated linoleic acid and conjugated linolenic acid isomers byBifidobacteriumspecies[J].Applied Microbiology and Biotechnology,2010,87(6):2 257-2 266.
[9] TAKEUCHI M,KISHINO S,HIRATA A,et al.Characterization of the linoleic acid Δ9 hydratase catalyzing the first step of polyunsaturated fatty acid saturation metabolism inLactobacillusplantarumAKU 1009a[J].Journal of Bioscience and Bioengineering,2014,119(6):636-641.
[10] HENNESSY A A, ROSS R P, DEVERY R, et al. The health promoting properties of the conjugated isomers of α-linolenic acid [J]. Lipids, 2011, 46(2):105-119.
[11] COAKLEY M,ROSS R P,NORDGREN M,et al.Conjugated linoleic acid biosynthesis by human-derivedBifidobacteriumspecies[J].Journal of Applied Microbiology,2003,94(1):138-145.
[12] ROACH J A G,MOSSOBA M M,YURAWECZ M P,et al.Chromatographic separation and identification of conjugated linoleic acid isomers[J]. Analytica Chimica Acta, 2002, 465(465):207-226.
[13] YANG B,CHEN H,GU Z,et al.Synthesis of conjugated linoleic acid by the linoleate isomerase complex in food-derived lactobacilli [J].Journal of Applied Microbiology,2014,117: 430-439.
[14] HENNESSY A,BARRETT E,ROSS R P,et al.The production of conjugated α-linolenic, γ-linolenic and stearidonic acids by strains ofBifidobacteriaandPropionibacteria[J].Lipids,2012,47:313-327.
[15] 杨波.乳酸菌生物转化共轭亚油酸的研究[D].无锡:江南大学,2014.
Conjugated fatty acids production byLactobacillusplantarumfrom Paocai
YANG Bo, WANG Ao-ji-dong, ZHANG Hao, CHEN Yong-quan,CHEN Hai-qin*, CHEN Wei
(School of Food Science and Technology, Jiangnan University, Wuxi 214122,China)
Conjugated fatty acids refers to a group of positional and geometric isomers of polyunsaturated fatty acids, including conjugated linoleic acid (CLA), conjugated linolenic acid (CLNA) and conjugated stearidonic acid (CSA). CLA and CLNA were derived from linoleic acid and linolenic acid, respectively, with a variety of healthy-associated functions, such as anti-cancer, anti-atherosclerotic, immunity improvement and anti-obese, which have become a hot research topic in functional lipids. In this paper, twenty-two ofLactobacillusplantarumisolated from Paocai were analyzed for conjugated fatty acids production via GC-MS. The results indicated that CCFM47 and CCFM232 had high conversion capability of both CLA and CLNA. Further analysis showed that the two strain convert over 30% linoleic acid to CLA, total CLA in the supernatant fluid reached 0.1664 mg/mL and 0.1514 mg/mL. Additionally, the two strains could convert over 60% of α-linolenic acid to CLNA, with total CLNA 0.1964 mg/mL and 0.1721 mg/mL in the supernatant fluid, respectively.
conjugated linoleic acid; conjugated linolenic acid; gas chromatography-mass spectrometry;Lactobacillusplantarum; conversion ratio
10.13995/j.cnki.11-1802/ts.201703006
博士,助理研究员(陈海琴教授为通讯作者,E-mail:haiqinchen@jiangnan.edu.cn)。
国家自然科学基金(31571810);江苏省自然科学基金青年基金(BK20150141)
2016-10-20,改回日期:2016-11-03
