群体感应AHLs对温和气单胞菌体外致腐因子分泌的影响
2017-04-26李婷婷崔方超马艳励建荣
李婷婷,崔方超,马艳,励建荣*
1(大连民族大学 生命科学学院,辽宁 大连,116600) 2(渤海大学 食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州,121013)
群体感应AHLs对温和气单胞菌体外致腐因子分泌的影响
李婷婷1,崔方超2,马艳2,励建荣2*
1(大连民族大学 生命科学学院,辽宁 大连,116600) 2(渤海大学 食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州,121013)
以大菱鲆腐败菌温和气单胞菌(Aeromonassobria,AS7)为研究对象,研究了不同处理方式(营养基质、共生培养和添加不同种类的AHLs)对温和气单胞菌的致腐因子(嗜铁素、胞外蛋白酶、生物被膜)产生情况的影响,结果表明,菌株AS7嗜铁素的分泌受到培养基质的影响,在脱脂牛奶等天然基质中可以大量分泌嗜铁素,而市售的合成培养基中不能分泌嗜铁素;AHLs的添加对嗜铁素的产生量有影响,其中,C8-HSL影响显著,随添加的增加,嗜铁素分泌量呈现正相关(P<0.05),而C6-HSL影响不显著(P>0.05);共生条件下,温和气单胞菌对荧光假单胞菌和腐败希瓦氏菌嗜铁素的分泌有明显促进作用;AHLs的添加可以促进温和气单胞菌胞外蛋白酶和生物被膜的产量,且呈现正相关(P<0.05),说明AHLs对温和气单胞菌产生胞外蛋白酶、嗜铁素和生物被膜具有调控作用。
温和气单胞菌;嗜铁素;胞外蛋白酶;生物被膜;群体感应
引起水产品腐败变质的主要原因包括酶、微生物及脂肪氧化等作用,新鲜水产品富含营养物质和水分,肌肉组织脆弱,可溶性蛋白质和游离氨基酸含量高,pH值接近中性,研究表明约30%的捕获鱼类是由于微生物单独因素导致损失的[1]。腐败菌通过分泌大量的胞外蛋白酶(蛋白水解酶、脂肪水解酶等)将组织结构中蛋白质、脂肪等营养物质分解成小分子的醛类、酮类、胺类等,导致鱼类质地、风味和气味改变,同时还分泌胞外多糖等其他代谢产物在鱼肉表面形成黏液或产生有色物质,最终导致鱼体腐败[2]。
AHLs信号分子作为大多数革兰氏阴性菌信息交流的媒介调控着细菌某些特定表型的表达,如生物被膜的形成、嗜铁素的分泌、胞外蛋白酶的合成及分泌、芽孢的产生、细菌的运动性等。WHAN[3]等研究发现,巴氏消毒奶腐败变质是由假单胞菌的生长引起的,假单胞菌的群体感应系统可以调控蛋白水解酶的活性,从而导致了巴氏消毒奶的腐败变质。綦国红[4]等在鱼源假单胞菌产生的AHLs信号分子对腐败特性的影响研究中发现,其细菌腐败特性的表达是通过群体感应现象来调控的,AiiA蛋白水解酶对假单胞菌的AHLs分子进行降解可使其腐败特性表达的水平下降,从而说明水产品的腐败与AHLs是密切相关的。CHRISTENSEN[5]等研究发现,群体感应系统调控导致冷藏鲑鱼腐败变质的变形斑沙雷菌(Serratiaproteamaculans)B5a 蛋白水解酶的活性。BAGGE-RAVN[6]等、Gubjörnsdóttir[7]等在鱼制品加工厂及对虾生长环境中发现了假单胞菌(Pseudomonasspp.)信号分子能够调控生物被膜的产生。STINTZI[8]等报道了铜绿假单胞菌(Pseudomonasaeruginosa)通过群体感应信号分子调控嗜铁素的分泌。因此,腐败菌可通过AHLs介导的QS体系调控细菌特定腐败基因的表达,从而在食品的腐败过程中发挥作用。
大菱鲆低温冷藏货架期终点优势腐败菌是腐败希瓦氏菌和假单胞菌,同时,不管在腐败中期还是货架期终点都有一定比例的气单胞菌存在,且气单胞菌属具有很强的信号分子分泌能力。所以本实验利用产AHLs的腐败菌(温和气单胞菌),通过添加不同的外源信号分子标准品(C6-HSL、C8-HSL)和利用天然(牛奶)与人工合成(合成培养基)的培养基质研究温和气单胞菌群体感应系统对其生物被膜、胞外蛋白酶和嗜铁素产生的影响,从而确定大菱鲆4 ℃冷藏过程中QS信号分子与腐败菌致腐因子之间的关系。
1 材料与方法
1.1 材料、菌株和培养条件
温和气单胞菌AS7、荧光假单胞菌PF14(Pseudomonasfluorescens, PF14)和腐败希瓦氏菌SP25(Shewanellaputrefaciens, SP25),从市售大菱鲆中分离,本实验室保存。温和气单胞菌用TSB液体培养基活化,其他菌株均在28 ℃、LB 液体培养基活化,摇床培养,连续活化两代。
1.2 仪器与设备
信号分子标准品C6-HSL、C8-HSL,购于Sigma 公司;铬天青S (Chrome azurol Sulphonate)、十六烷基三甲基溴化铵(Hexadecyltrimethylammonium bromide HDTMA)、PIPEs,购自国药集团化学试剂有限公司;琼脂粉、TSB、LB培养基、营养琼脂,北京陆桥生物技术有限公司;酸水解酪蛋白溶液,上海沪峰化工有限公司;脱脂奶粉,购自生工生物工程(上海)有限公司,其他常规试剂均为分析纯。
HZQ-X300C型恒温振荡器,BPS-100CA恒温恒湿培养箱,上海一恒科技有限公司;MS105UD电子分析天平,瑞士梅特勒-托利多有限公司;Purifier Logic生物安全柜,美国LABCONCO公司;MLS-3020高压蒸汽灭菌,日本三洋公司;Imark酶标仪,美国BIO-RAD;Biofuge Stratos冷冻高速离心机,美国THERMO公司;UV-2700紫外可见分光光度计,日本岛津公司。
1.3 方法
1.3.1 嗜铁素检测
利用CASAD嗜铁素平板法可检测总的嗜铁素,不受嗜铁素形态的限制,根据文献[9],制作CASAD嗜铁素检测平板,制作过程如下:
1)溶液 A:将 0.06 g的 CAS溶于50 mL 去离子水中,再加入10 mL 1 mmol/L 的FeCl3溶液(含有10 mmol/L 的 HCl);
2)溶液 B:将0.07 g的 HDTMA溶于 40 mL去离子水中;
3)溶液 C:将A溶液沿着烧杯的壁缓缓加入到B溶液中,轻轻晃动,使得溶液A与溶液B混合均匀,即得到溶液 C:CAS蓝色检测液。121 ℃,15 min灭菌。
先配制好1 mmol/L 的CaCl2溶液、1 mmol/L的MgSO4·7H2O溶液、10%的酸水解酪蛋白溶液(121 ℃,15 min 单独灭菌);再分别取 0.2 mL 的CaCl2溶液、0.2 mL 的MgSO4·7H2O 溶液、6 mL的 10%的酸水解酪蛋白溶液,加入生物缓冲液 Pipes(sigma),调至pH6.8~7.0。去离子水定容到 100 mL。加入 2 g 琼脂粉,121 ℃,15 min 灭菌。当以上的固体培养基灭菌后,温度降低到 60 ℃时,以 5 mL CAS 蓝色检测液每100 mL CAS培养基的量沿着三角瓶壁加入,混合均匀。注意不要产生气泡,影响平板检测实验。然后按照每皿15 mL倾注于培养皿(直径 90 mm)中。每孔加入菌液200 μL,空白培养基为阴性对照,每组3个平行,培养24 h。
1.3.2 蛋白酶活性检测
牛奶平板制作参考VIJAYARAGHAVAN[10]的方法:在普通肉汤蛋白胨固体培养基中添加终质量分数为1.5%的牛奶。15%的脱脂乳粉用水溶解后应单独灭菌(115 ℃,0.06 MPa,30 min),铺平板前再与营养琼脂混合。10 mL 15%脱脂乳粉(单独灭菌),加到90 mL的营养琼脂中,混匀,倒入底层铺有琼脂的平板中,打孔器打孔后加入无菌上清液150 μL,每组3次平行,培养24 h。无菌上清液制作方法为:将AS7菌株接种至不同培养基中,然后于30 ℃,180 r/min培养24 h后,将培养好的菌液在10 000 r/min、离心15 min,弃菌体,留上清液,上清液加入培养基之前用0.22 μm无菌滤膜过滤除菌。
1.3.3 生物被膜能力测定
1.3.3.1 酶标仪法定量生物被膜
[11]的方法,将过夜活化的菌悬液与培养基按1∶100体积混匀后,加入到无菌的标准96孔板中,每组4平行,以无菌的培养基为空白对照,在28 ℃下静置培养。每次取出测定时,先弃去培养液,用无菌蒸馏水250 μL/孔清洗3 次,60 ℃或无菌风干燥固定30 min,随后用0.1%结晶紫溶液200 μL/孔染色30 min后弃去染液,用无菌蒸馏水250 μL/孔清洗3 次,60 ℃干燥后,于200 μL/孔的95%乙醇溶解5 min,酶标仪法测定OD595值,每个处理4个重复,分别按不同时间(12、24、36、48、96 h)培养。
1.3.3.2 扫描电镜观察生物被膜
从培养皿中取出生物被膜载体,用无菌水冲洗干净后,无菌风吹干,将载体放入4 ℃预冷的2.5%戊二醛中浸泡4 h,取出后依次在50%、70%、80%、90%和100%的乙醇中浸泡30 min,再经醋酸异戊酯置换2次,自然干燥后喷金处理,用扫描电镜镜检[12]。
1.3.4 数据处理和分析
采用SPSS 13.0 进行重复测量方差分析,Origin 8.0绘图。
2 结果与分析
2.1 嗜铁素分析
嗜铁素(Siderophore),又名铁载体蛋白,是一类由微生物在低铁条件下合成的相对分子质量小的、能特异地螯合Fe3+的一种螯合因子[13],嗜铁素主要是通过对铁离子的竞争影响其他细菌的生长。菌株产生的嗜铁素络合环境中铁离子,使其他微生物得不到足够的铁营养,生长发育受到抑制,从而使菌株能够维持自己的菌体密度。利用CASAD检测平板法,培养基中因含有CAS、十六烷基三甲铵(HDTMA)及Fe3+的三元复合物而呈现蓝色。嗜铁素会夺取蓝色平板中的铁离子,形成橙色晕圈。
不同培养方式处理的菌液在CAS检测平板生长情况如图1所示,各个受试菌株(AS7、PF14和SP25)在市售的合成培养基(LB、TSB)中几乎不能产生嗜铁素,而在脱脂牛奶等天然基质中可以明显检测到橙色圈,可能的原因是合成培养基中缺少合成嗜铁素所必须的微量元素,GRAM[14]等研究发现,希瓦氏菌(Shewanellaputrefuciens)嗜铁素的分泌受到培养基成分的影响,只有在鱼的提取物中培养时才能分泌嗜铁素,在合成的基础培养基中培养时不分泌嗜铁素。綦国红[4]等研究发现食源性假单胞菌在牛奶基质中培养时能够大量产生嗜铁素,而在基础培养基中生长时未检测到嗜铁素。这与我们的研究结果相一致。
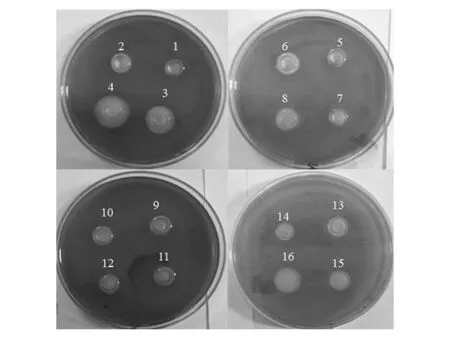
图1 不同处理下AS7嗜铁素的分泌量Fig.1 The siderophore secretion of strain AS7 under different processing
在脱脂牛奶培养基中共生情况下嗜铁素的分泌情况见图1。结果表明,温和气单胞菌对荧光假单胞菌和腐败希瓦氏菌的嗜铁素的分泌具有促进作用,对荧光假单胞菌的促进作用尤为显著,可能是因为在共生培养的过程中,温和气单胞菌分泌大量的信号分子到培养环境中,荧光假单胞菌和腐败希瓦氏菌具有LuxR型受体蛋白,可以结合并利用其信号分子调控自身嗜铁素的分泌,我们前期研究结果显示,荧光假单胞菌嗜铁素的分泌受到群体感应系统的调控[15]。
为进一步研究群体感应与温和气单胞菌的关系,添加了不同浓度的C6-HSL和C8-HSL标准品,结果见图2。添加C6-HSL对菌株AS7嗜铁素的分泌并没有促进作用,而C8-HSL对菌株AS7嗜铁素的分泌有显著影响,随着添加浓度升高,晕圈直径明显变化,呈现正相关,本实验前期研究发现C8-HSL为该菌主要信号分子,温和气单胞菌通过分泌C8-HSL来调控嗜铁素的分泌,STINTZI[8]等报道了铜绿假单胞菌通过群体感应调控嗜铁素的产生量。
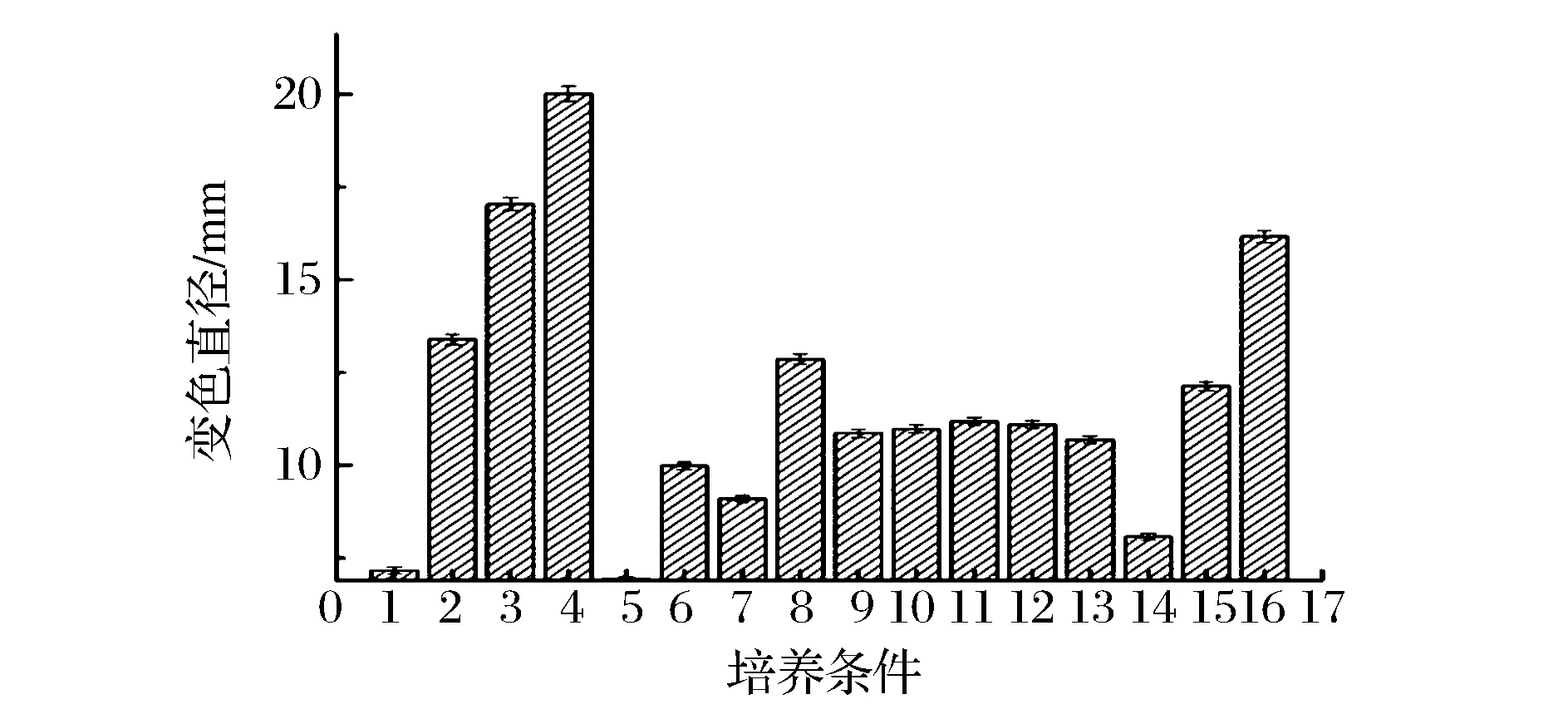
1-AS7+TSB;2-AS7+牛奶;3-AS7+SP25;4-AS7+PF14;5-PF14+LB;6-PF14+牛奶;7-SP25+LB;8-SP25+牛奶;9-AS7+50 μL C6-HSL;10-AS7+25 μL C6-HSL;11-AS7+75 μL C6-HSL;12-AS7+100 μL C6-HSL;13-AS7+50 μL C8-HSL;14-AS7+25 μL C8-HSL;15-AS7+75 μL C8-HSL;16-AS7+100 μL C8-HSL图2 不同处理下AS7嗜铁素的分泌量Fig.2 The siderophore secretion of strain AS7 under different processing
2.2 蛋白酶分析
水产品属于高蛋白类食品,其蛋白质、游离氨基酸的含量较高,因此,只有蛋白水解酶丰富的腐败微生物才能在其中大量繁殖,通过分泌大量的蛋白水解酶水解其中的蛋白质,导致水产品失去原有的风味和气味,最终腐败变性,甚至产生有毒有害物质[2]。綦国红[4]利用aiiA水解酶对食源性假单胞菌产生的AHLs分子进行降解时发现,其蛋白酶活性减弱,表明该菌胞外蛋白酶的产生受群体感应调控。HeNTZER[16]等研究发现铜绿假单胞菌胞外蛋白酶的分泌受到群体感应调控,通过添加C-30和C-56的群体感应抑制剂发现该菌胞外蛋白酶分泌量明显降低。
因此,为了确定AHLs是否也影响温和气单胞菌胞外蛋白酶的分泌,通过添加外源信号分子标准品并利用脱脂牛奶平板法检测来初步评价其胞外蛋白酶分泌量与AHLs的关系,为进一步阐释群体感应与腐败菌致腐能力提供依据。结果如图3和图4所示,温和气单胞菌能够分泌胞外蛋白酶,且随着C8-HSL信号分子标准品添加量的增加呈现正相关,蛋白水解圈有明显增加,说明AHLs可以促进温和气单胞菌胞外蛋白酶的分泌。

图3 不同处理下AS7胞外蛋白酶的分泌量Fig.3 The extracellular protease of strain AS7 under different processing
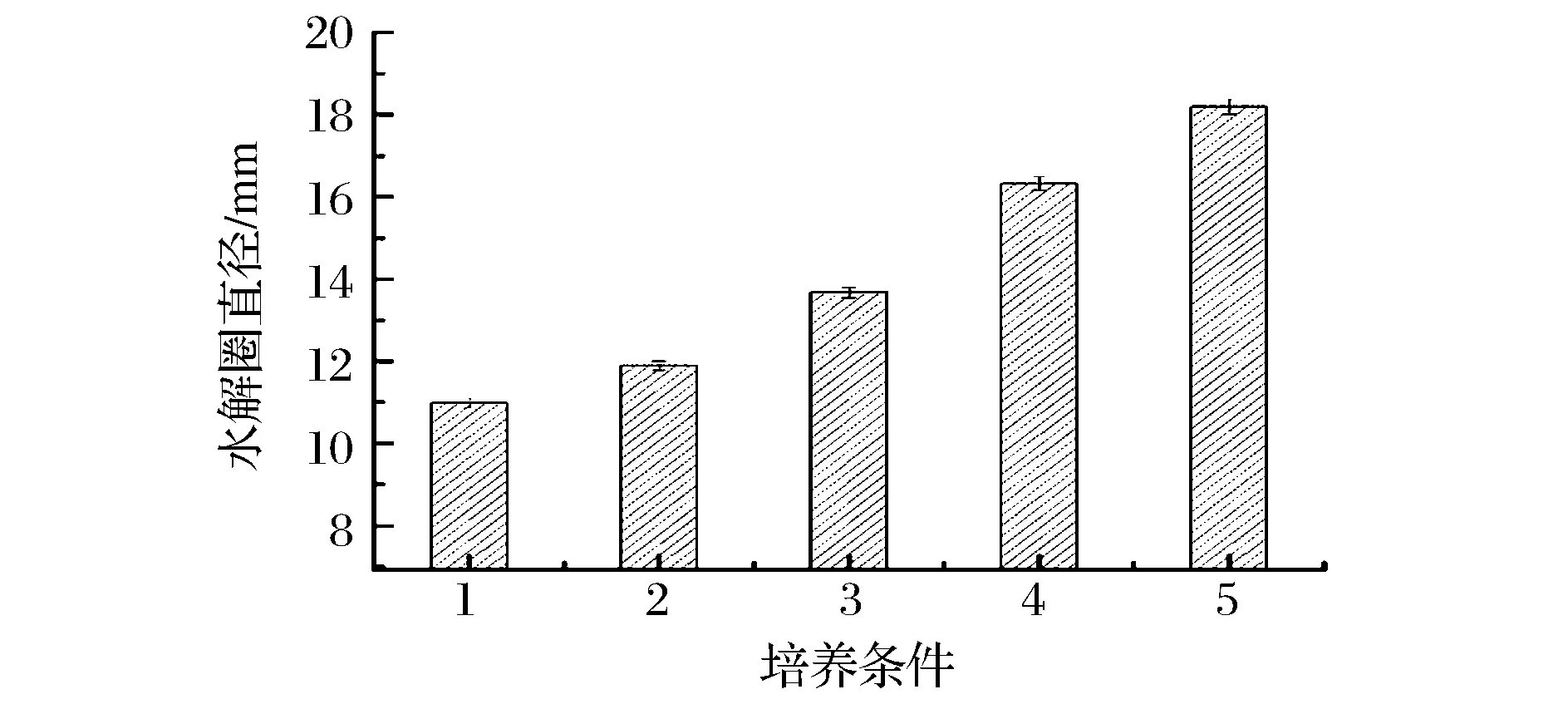
1-AS7 ;2-AS7+25μL C8-HSL ;3-AS7+50μL C8-HSL;4-AS7+75μL C8-HSL;5-AS7+100μL C8-HSL图4 不同处理下AS7胞外蛋白酶的分泌量Fig.4 The extracellular protease of strain AS7 under different processing
2.3 生物被膜分析
2.3.1 AHLs对温和气单胞菌生物被膜产生量的影响
生物被膜是微生物为适应胁迫环境、形成有利于生存的特殊生长状态。是由自身分泌胞外黏质物(如多糖基质、纤维蛋白、脂质蛋白等)包裹的,具有高度组织化的多细胞群体结构[17]。大量研究发现,细菌的群体感应系统可以调控其生物膜的形成[18],KJELLEBERG[19]等表明AHLs 调控细菌黏附、游动、生物被膜的形成。FAZLI[20]等发现群体感应系统可以调控洋葱伯克霍尔德菌(Burkholderiacepacia)生物被膜的形成;LEE[21]等研究霍氏弧菌的生物被膜形成时也发现相似结论。本实验通过添加外源信号分子标准品对温和气单胞菌生物被膜与群体感应的关系进行了研究。结果如图5所示,随着培养时间的延长,生物被膜形成量呈现先增加后降低的趋势,0~24 h生物被膜产生量非常少,细菌以浮游态存在于培养基中,24~36 h是形成期,36 h后进入稳定期,96 h后开始衰老,但生物被膜衰老的比较慢,基本维持不变,细菌的黏附是其形成生物被膜的前提条件。一旦细菌黏附到接触表面,黏附的细菌便会汲取周围的营养进行生长繁殖,进而形成生物被膜。在一定范围,较高的菌体浓度会促进细菌在接触面的黏附,而较多黏附的细菌会促进生物被膜的形成[22]。添加外源信号分子标准品,生物被膜的产生量明显增加,且随着添加量的增大呈现正相关,但在培养后期,高浓度的信号分子添加量会使得生物被膜衰老迅速,NILSSON[23]等认为由AHLs 介导的细菌QS 系统在细菌生物被膜形成、附着、固定过程起着关键性作用。因此,QS系统对温和气单胞菌生物被膜的形成具有调控作用。
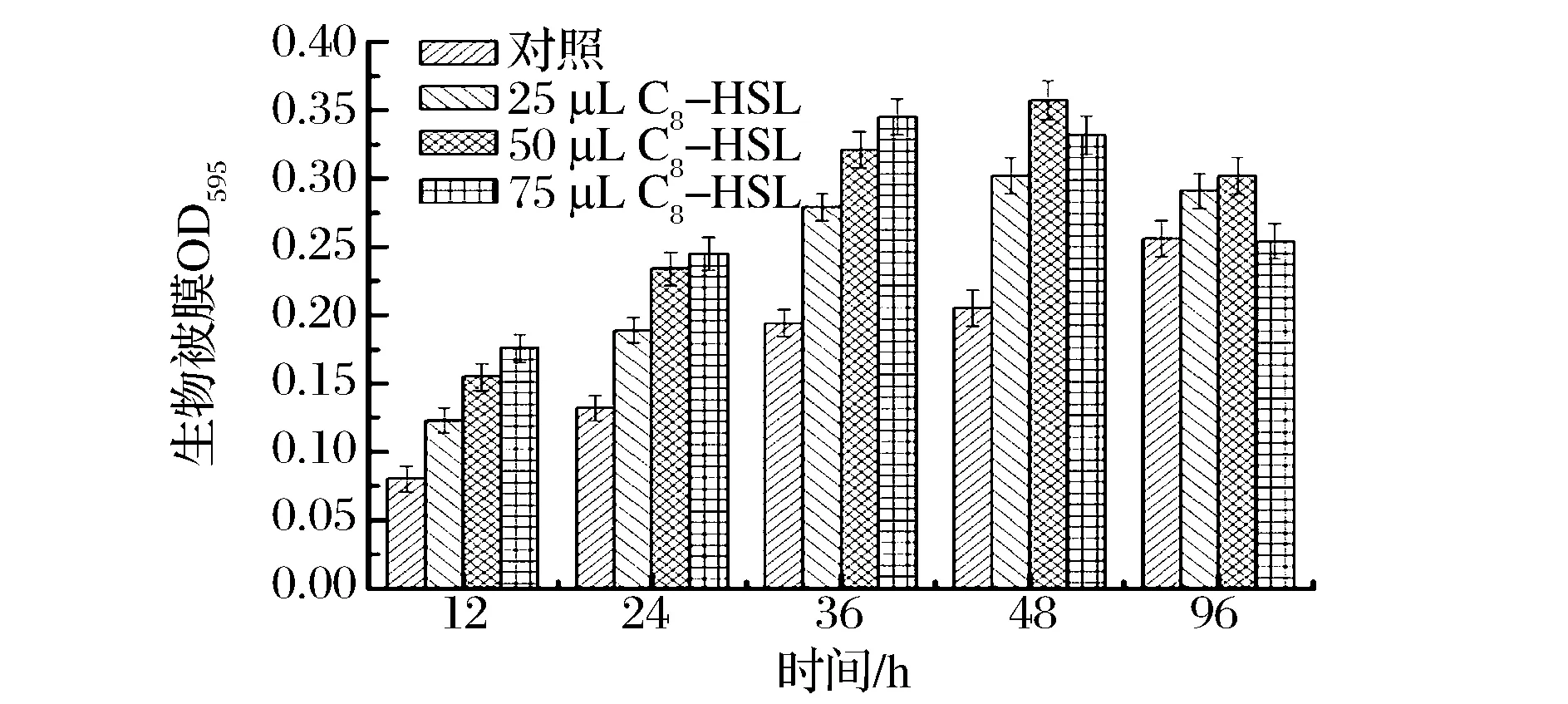
图5 不同时间生物被膜产生量与AHLs关系Fig.5 The relationship between AHLs and biofilm at different culture time
2.3.2 生物被膜扫描电镜观察
如图6所示,温和气单胞菌在不同培养时间其生物被膜形成过程,在12 h菌体开始聚集黏附,是生物被膜的初始形成阶段,12~24 h后菌体黏附逐渐增多,细菌间开始出现粘结,细菌鞭毛和菌毛会分泌大量黏性的胞外多聚糖,并与其他胞外基质将细菌包裹起来,36 h后细菌生物被膜基本处于稳定状态,36~48 h为温和气单胞菌生物被膜的成熟稳定期;而添加不同浓度的外源信号分子标准品培养48 h时,结果如图7所示,添加AHLs明显增加温和气单胞菌生物被膜的形成速度和产生量,在添加75 μL的C8-HSL能够形成致密的生物被膜,温和气单胞菌生物被膜的形成与添加AHLs浓度呈现正相关,说明群体感应能够调控温和气单胞菌生物被膜的形成。ZHANG[24]等通过添加玫瑰花茶多酚提取物为抑制剂,抑制了铜绿假单胞菌群体感应,从而抑制其生物被膜的形成。
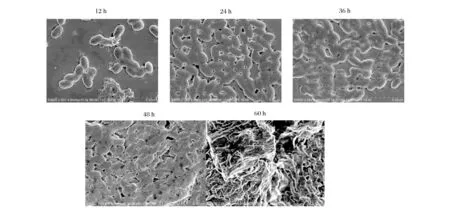
图6 不同培养时间下AS7生物被膜形态 (×10.0 K)Fig.6 Biofilm morphology of AS7 at different culture time (×10.0K)

图7 不同浓度AHLs对生物被膜的影响 (×10.0 K)Fig.7 Influence of biofilm by the AHLs concentration (×10.0K)
3 结论
温和气单胞菌是水产品中常见的一种腐败菌,通过研究营养基质、共生培养和添加不同种类AHLs对其体外致腐因子(嗜铁素、胞外蛋白酶及生物被膜)的影响可知,其嗜铁素的分泌受到培养基质的影响,在脱脂牛奶等天然基质中可以大量分泌嗜铁素,在市售的合成培养基中不能分泌嗜铁素,其原因可能是缺乏合成必要的微量元素。共生条件下,温和气单胞菌对荧光假单胞菌和腐败希瓦氏菌嗜铁素的分泌有明显促进作用,温和气单胞菌信号分子分泌量大,分泌到共生环境中被其他菌株所利用,调控特定生物表现型。AHLs的添加对嗜铁素的产生量有影响,其中,C8-HSL影响显著,随添加的增加,嗜铁素分泌量呈现正相关,而C6-HSL影响不显著。同时,AHLs的添加也可以促进温和气单胞菌胞外蛋白酶和生物被膜的产量,且呈现正相关,说明AHLs对温和气单胞菌产生胞外蛋白酶和生物被膜具有调控作用。扫描电镜观察生物被膜组织结构,也与该实验结果相一致。
参考文献
[1] AMOS B,SECTOR F,EINARSSON H,et al.Analysis of quality deterioration at critical steps/points in fish handling in Uganda and Iceland and suggestions for improvement[D].Uganda,United Nations University,2007.
[2] LAMBROPOULOU K A,DROSINOS E H,NYCHAS G J E.The effect of glucose supplementation on the spoilage microflora and chemical composition of minced beef stored aerobically or under a modified atmosphere at 4 C[J].International journal of Food Microbiology,1996,30(3):281-291.
[3] WHAN L,DUNSTALL G,ROWE M.A study of the growth kinetics of twoPseudomonadsfrompasteurizedmilk and the possible role of quorum sensing[J].Milchwissenschaft,2000,55(7):371-373.
[4] 綦国红,董明盛,陈晓红,等.鱼源假单胞菌群体感应信号分子与腐败特性相关关系的研究[J].中国农业科学,2007,40(7):1 486-1 491.
[5] CHRISTENSEN A B,KATHRIN R,LEO E,et al.Quorum-sensing-directed protein expression inSerratiaProteamaculansB5a[J]. Microbiology,2003,149(2):471-483.
[6] BAGGE-RAVN D,NG Y,HJELM M,et al.The microbial ecology of processing equipment in different fish industries—analysis of the microflora during processing and following cleaning and disinfection[J].International Journal of Food Microbiology,2003,87(3): 239-250.
[8] STINTZI A,EVANS K,MEYER J,et al.Quorum-sensing and siderophore biosynthesis inPseudomonasaeruginosa: lasRllasI mutants exhibit reduced pyoverdine biosynthesis[J].FEMS Microbiology Letters,1998,166(2):341-345.
[9] SHIN S H,LIM Y,LEE S E,et al.CAS agar diffusion assay for the measurement of siderophores in biological fluids[J].Journal of Microbiological Methods,2001,44(1):89-95.
[10] VIJAYARAGHAVAN P,VINCENT S G P.A simple method for the detection of protease activity on agar plates using bromocresolgreen dye[J].Journal of Biochemical Technology,2013,4(3):628-630.
[11] RODE T M,LANGSRUD S,HOLCK A,et al.Different patterns of biofilm formation inStaphylococcusaureusunder food-related stress conditions[J].International Fournal of Food Microbiology,2007,116(3):372-383.
[12] JAHID I K,HAN N R,SREY S,et al.Competitive interactions inside mixed-culture biofilms ofSalmonellaTyphimuriumand cultivable indigenous microorganisms on lettuce enhance microbial resistance of their sessile cells to ultraviolet C (uv-c) irradiation[J].Taiwan Journal of Democracy,2014,10(7):1 415-1 421.
[13] CHA J Y,LEE J S,Oh J I,et al.Functional analysis of the role of fur in the virulence ofPseudomonassyringaepv. tabaci 11528: fur controls expression of genes involved in quorum-sensing[J].Biochemical and Biophysical Research Communications,2008,366(2): 281-287.
[14] GRAM L.The influence of substrate on siderophore production by fish spoilage bacteria[J].Journal of Microbiological Methods, 1996,25(3):199-205.
[15] 崔方超, 李婷婷, 刘明爽, 等. 大菱鲆荧光假单胞菌的群体感应现象及不同碳源培养下的腐败特性研究[J]. 现代食品科技, 2015,31(12): 49-55.
[16] HENTZER M,WU H,ANDERSEN J B,et al.Attenuation ofPseudomonasaeruginosavirulence by quorum sensing inhibitors[J]. The EMBO journal,2003,22(15):3 803-3 815.
[17] MA L,WANG J,WANG S,et al.Synthesis of multiplePseudomonasaeruginosabiofilm matrix exopolysaccharides is posttranscriptionally regulated[J].Environmental Microbiology,2012,14(8):1 995-2 005.
[19] KJELLEBERG S,MOLIN S.Is there a role for quorum sensing signals in bacterial biofilms?[J].Current Opinion in Microbiology, 2002,5(3):254-258.
[20] FAZLI M,ALMBLAD H,RYBTKE M L,et al.Regulation of biofilm formation inPseudomonasandBurkholderiaspecies[J]. Environmental Microbiology, 2014, 16(7):1 961-1 981.
[21] LEE K J,KIM J A,HWANG W,et al.Role of capsular polysaccharide (CPS) in biofilm formation and regulation of CPS production by quorum-sensing inVibriovulnificus[J].Molecular Microbiology,2013,90(4):841-857.
[22] JOHNSON L R.Microcolony and biofilm formation as a survival strategy for bacteria[J].Journal of Theoretical Biology,2008,251(1): 24-34.
[23] NILSSON R E,TOM R,BOWMAN J P.Variability in biofilm production byListeriaMonocytogenescorrelatedto strain origin and growth conditions[J].International Journal of Food Microbiology,2011,150(1):14-24.
[24] ZHANG J,RUI X,WANG L,et al.Polyphenolic extract from rosa rugosa tea inhibits bacterial quorum sensing and biofilm formation[J].Food Control,2014,42(2):125-131.
Influence of quorum sensing AHLs on spoilage factor secretion ofAeromonassobria
LI Ting-ting1, CUI Fang-chao2, MA Yan2, LI Jian-rong2*
1 (College of Life Science, Dalian Minzu University, Dalian 116600, China) 2 (College of Food Science and Technology, Bohai University,National & Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural and Aquatic Products, Dalian 121013, China)
AeromonassobriaAS7 separated from spoilage turbot were used as test strain. The relationship between different treatment (the nutrition of substrate, symbiotic cultivation and adding different kind of AHLs) and the spoilage factors (siderophore, protase and biofilm) were further studied. The results showed that the secretion of siderophore was affected by medium quality, that could be secret at natural substrate such as skim milk, while could not be produced at synthetic medium. Addition of AHLs had a significant influence on the production of siderophore, wherein C8-HSL was affected significantly and the production of siderophore presented positive correlation with the increase AHLs (P<0.05), while effect on C6-HSL was not significant (P>0.05). The production of siderophore of Pseudomonas fluorescens and Shewanella putrefaciens was obvious promoted when symbiotic cultivation with AS7. Adding AHLs could also promote the production of protase and biofilm, and present the positive correlation (P<0.05), which demonstrated that the AHLs could regulate the production of extracellular protease, siderophore and biofilm in AS7.
Aeromonassobria; siderophore; protase; biofilm; quorum sensing
10.13995/j.cnki.11-1802/ts.201703010
博士(励建荣教授为通讯作者,E-mail:lijr6491@163.com)。
国家自然科学基金(31301572,31471639);中国博士后科学基金(2014M552302)
2016-09-18,改回日期:2016-11-05
