伊马替尼治疗晚期及高危胃肠道间质瘤的临床疗效与安全性分析
2017-03-23杨弘鑫张波沈朝勇王黔王海斌严芝强陈家驹
杨弘鑫,张波,沈朝勇,王黔,王海斌,严芝强,陈家驹
(1. 贵州医科大学附属医院 胃肠外科,贵州 贵阳 550004;2. 四川大学华西临床医学院 胃肠外科,四川 成都 610041)
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是最常见的间叶源性肿瘤[1]。手术切除是最主要的治疗手段,但GIST术后极易复发转移,而且对放化疗不敏感,在靶向药物伊马替尼出现之前,国外文献报道不可切除/转移患者的中位生存期仅为10~20个月,但随着甲磺酸伊马替尼的出现,其能阻断引起GIST发生的特异酪氨酸激酶受体(c-Kit)及血小板源性生长因子受体(PDGFR-α),从而抑制酪氨酸激酶的磷酸化,阻断下游的信号传导,抑制GIST生长,从而改善不可切除/转移患者的预后,中位生存期能延长至近3倍[2-3]。此外,国内外文献[4-5]报道伊马替尼作为术后辅助治疗效果同样显著。
考虑到种族、体质等因素,其客观疗效、治疗时限、毒副反应等问题,国内患者是否也与国外文献一致,有待进一步观察研究。为此,本研究回顾性分析2011年1月—2016年6月四川大学华西医院胃肠外科及贵州医科大学附属医院胃肠外科经治的173例晚期或术后高危GIST患者,分别对比服用伊马替尼与未服药的预后差异,并评估服用伊马替尼的相关毒副作用,以期评价伊马替尼在中国GIST患者中的疗效及安全性。
1 资料与方法
1.1 患者选择
GIST患者纳入标准:⑴ 年龄≥18岁;⑵ 病理、免疫组化检查或基因检测证实为GIST;⑶ 不可切除/转移患者:至少有一个病灶可以用腹部增强CT评估其大小及密度(术后辅助治疗患者:术后根据NIH推荐的危险度分级[6]评估,确认为高危险度且未发现远处转移的患者);⑷ 根据美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG),体能评分≤2分。排除标准:⑴ 年龄<18岁、孕妇、哺乳期妇女;⑵ 有其它系统重大疾病的患者;⑶ 依从性较差的患者。
1.2 研究方法
初始剂量均按400 mg/d剂量口服,建议不可切除/转移患者连续服药直至病情进展或出现不可耐受的毒副反应;高危患者建议服用3年。定期评估患者的一般情况、血液学检查、临床疗效及毒副反应等情况;并每3~6个月行腹部增强CT了解疾病情况。而未服药的患者每3~6个月电话随访了解情况。
晚期患者病灶按Choi标准[7],即根据肿瘤直径及密度进行客观近期疗效评价,分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。根据客观近期疗效进行剂量调整:患者病情进展或辅助治疗患者治疗期间出现复发转移时,将剂量增至600 mg/d或换用二线药物舒尼替尼。
毒副作用根据抗癌药物常见毒副反应分级标准(2.0)[8]。
1.3 统计学处理
本研究最后一次随访时间截至2016年11月30日。晚期患者的终点指标是总生存期(overall survival,OS),即从患者确诊到死亡或最后一次随访的时间。高危患者术后辅助治疗终点指标设定为无复发生存期(recurrence free survival,RFS),即从完整切除术后至复发转移或最后一次随访时间。数据统计使用SPSS18.0分析:计量资料用均数±标准差(±s)表示;计数资料用方差分析;OS及术后RFS用Kaplan-Meier生存分析(比较因子采用Log-rank进行差异检验);生存回归分析用Cox生存回归,P<0.05为差异有统计学意义。
2 结 果
2.1 患者基本特征
总共173例患者入选,其中73例晚期患者;100例高危患者。晚期GIST患者73例:45例服用伊马替尼(服药组),28例未服用伊马替尼(未服药组)。73例晚期患者GIST具体临床病理资料见表1。100例高危GIST患者中,25例服药1年(服药1年组),21例服药2年(服药2年组),5例服药3年(服药3年组),49例未服药(未服药组)。100例高危GIST患者具体的临床病理资料见表2。
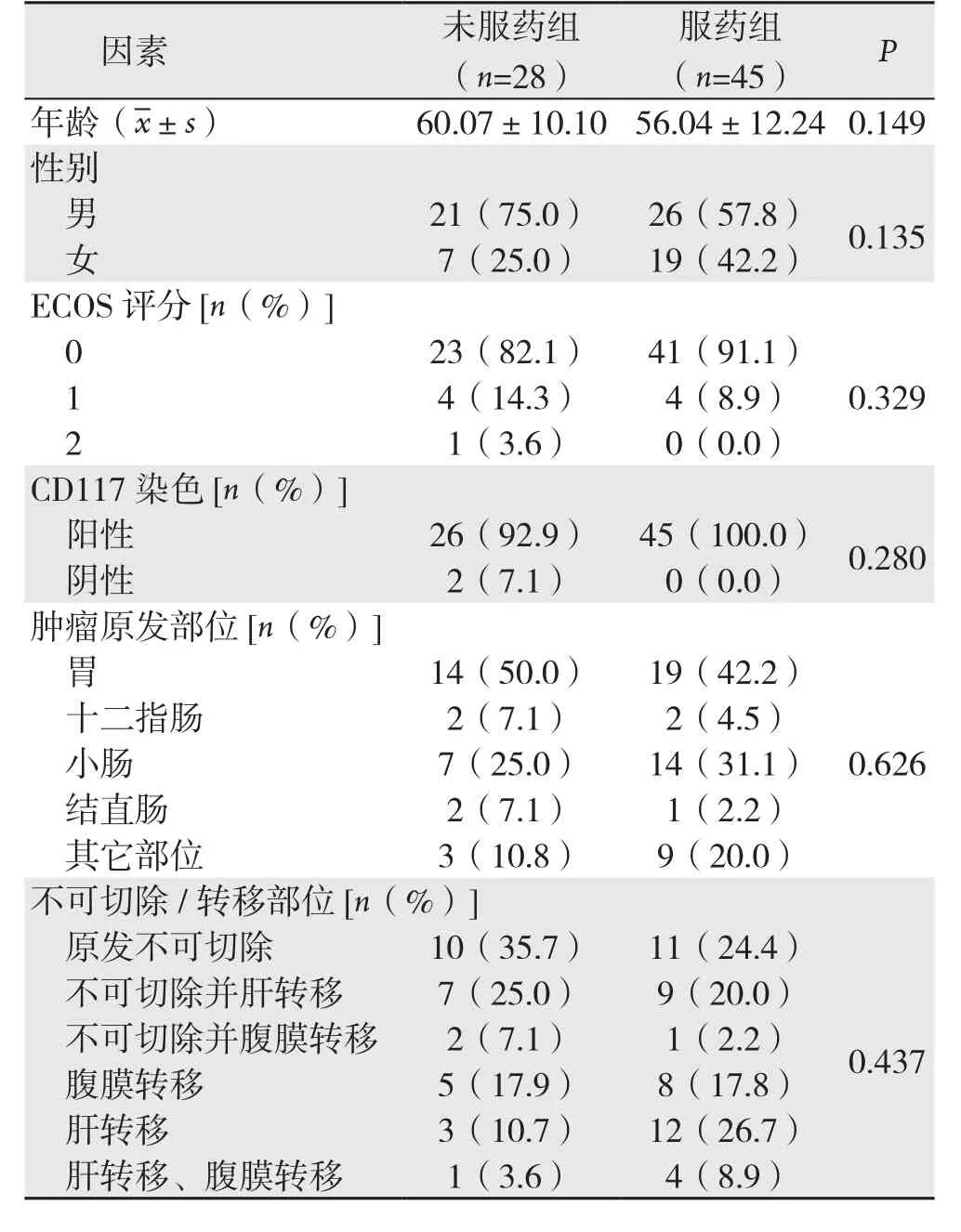
表1 73例晚期GIST患者基本资料Table 1 General data of the 73 patients with advanced GIST

表2 100例高危GIST患者基本资料Table 2 General data of the 100 patients with high-risk GIST
2.2 临床疗效
2.2.1 晚期患者 平均随访31(6~66)个月,截止最后随访时间,服用伊马替尼患者4例死亡,未服药患者19例死亡。Cox回归分析显示,服药组生存率要优于未服药组(1年OS:100.0%vs.78.6%,2 年 OS:93.1%vs.26.1%;HR=0.040,95%CI=0.011~0.152,P=0.000)(图 1)。
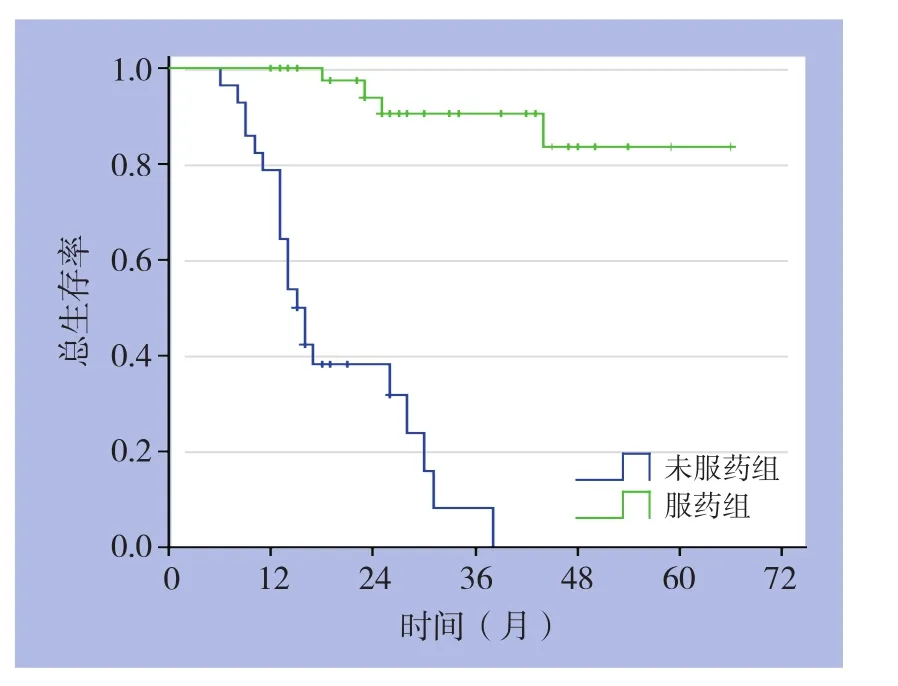
图1 服药与未服药晚期GIST患者的OS曲线Figure 1 OS curves of advanced GIST patients with and without imatinib treatment
截止最后随访时间,45例服用伊马替尼患者中位生存时间38个月,根据Choi标准进行客观疗效评估:CR 1例(2.2%),PR 31例(68.9%),SD 9例(20.0%),PD 4例(8.9%)。疾病缓解率71.1%,疾病控制率91.1%。4例服药中进展的患者,将剂量增至600 mg/d后,2例获得缓解,2例病情继续进展后死亡。另有3例患者在获得缓解后,自行停药,均在6个月后病情进展,其中2例死亡。
2.2.2 高危险度患者 平均随访45(6~73)个月,未服用伊马替尼、服用1、2、3年患者中,进展患者分别为32、6、2、0例。高危患者亚组分析示:高危患者术后服药1年组与未服药组比较,RFS明 显 提 高( 术 后 3年 RFS:66.7%vs.38.5%;HR=0.341,95%CI=0.134~0.868,P=0.024)。而服药2年组与服药1年组比较,RFS也明显提高(术后 1年 RFS:100%vs.100.0%,术后 2年 RFS:100.0%vs.88.9%,术后 3 年 RFS:91.7%vs.66.7%;HR=0.108,95%CI=0.015~0.778,P=0.027)。本组高危患者术后服用伊马替尼满3年患者仅5例,故未做比较,但中位随访达到56(38~72)个月,均未复发转移。
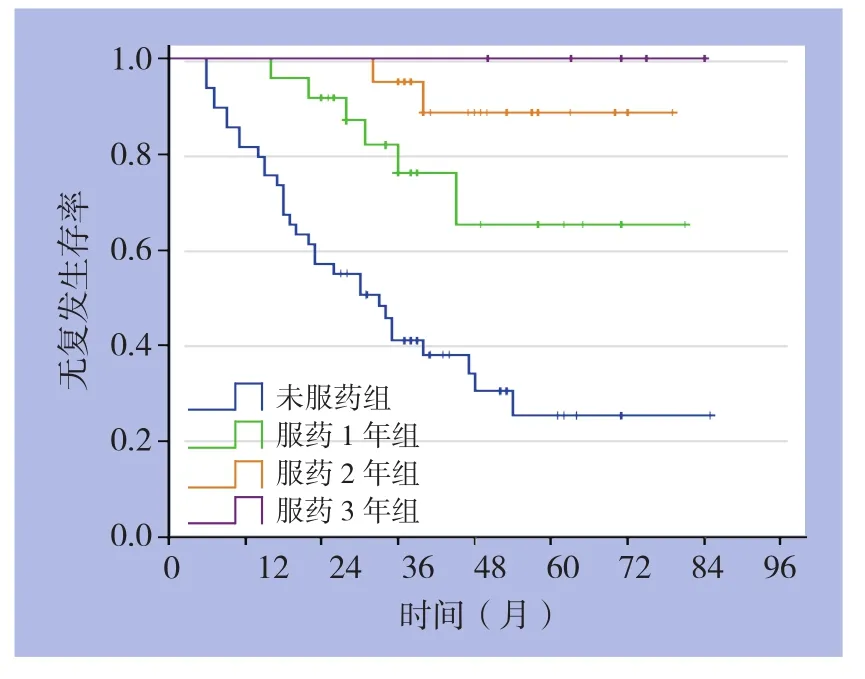
图2 服药与未服药高危GIST患者的RFS曲线Figure 2 RFS curves of high-risk GIST patients with and without imatinib treatment
2.3 毒副反应
本组96例患者服用伊马替尼,毒副反应主要是水肿(74.0%),恶心(56.3%),腹部不适(53.1%),白细胞下降(44.8%),贫血(29.2%)等,主要以1~2度毒性反应为主。8例患者发生3度毒性反应,其中3例白细胞下降,2例水肿,1例恶心,1例贫血,1例呕吐。共有23例2~3度毒性反应患者在门诊就诊治疗,14例对症处理后好转,5例停药好转后继续服药,4例剂量更改为300 mg/d,未发生因毒副作用死亡的情况。
3 讨 论
GIST是胃肠道最常见的间叶组织来源肿瘤,据相关报道每年发病率为1~2/10万[9]。Kit和PDGFR-α基因的获功能性突变使酪氨酸激酶异常活化,导致肿瘤细胞无限制增长是GIST发病的关键因素[10-11]。伊马替尼是一种酪氨酸蛋白酶抑制剂,能阻断酪氨酸蛋白激酶kit及PDGFR-α受体的功能,从而抑制肿瘤的形成及增殖[12-14]。
伊马替尼出现前,晚期GIST患者中位生存期仅为9~20个月。B2222及EORTC 62005研究结果显示,晚期患者口服伊马替尼能改善预后,中位生存期分别达到57、43个月。本研究显示,晚期GIST患者服用伊马替尼能提高术后生存率。截至最后一次随访,中位随访38个月,今后仍需进一步随访以获得最终的中位生存期。Blanke等[15]进行的多中心II期临床研究B2222中显示,完全缓解1.4%,部分缓解缓解66.7%,有效缓解率68.1%。本研究晚期患者口服伊马替尼400 mg/d,平均起效时间约12周,有效缓解率达到71.1%,与B2222及STI571B1202研究。相近。另外,关于不可切除/转移患者该服用多久的伊马替尼,BFR试验结果[16]显示即使在3年甚至5年的治疗后停药,病情也将快速进展。本组就有3例患者自行停药,病情均在6个月内再次进展,因而认为,若晚期患者能够耐受毒副反应,应连续长期治疗。
2007年ASCO年会,DeMatteo等[17]首次报道Z9001的研究结果:术后服用伊马替尼1年对比安慰剂,改善了术后1年RFS(97%vs.83%,P<0.01);同年,有报告[18]中国高危GIST患者术后服用1年伊马替尼,能提高术后1年RFS。然而随着Z9001研究进一步随访,服用组第2年的R F S明显下降,说明术后仅服用1年是不够的。2011年,Joensuu等[19]研究报告,高度复发风险患者接受伊马替尼治疗3年,能进一步提高了5年无复发生存率及总生存率,证实了延长伊马替尼服用年限的意义。但目前,对于是否继续延长服药年限仍未有达成共识。本研究中,高危患者进行亚组分析,Cox回归显示,术后服药1年较未服药提高了术后3年RFS(66.7%vs.38.5%,HR=0.341,95%CI=0.134~0.868,P=0.024);术后服用2年较服用1年也有更高的3年RFS(HR=0.108,95%CI=0.015~0.778,P=0.027)。另外5例患者术后服用伊马替尼3年,至今平均随访56个月,均未见复发或转移,故笔者认为,目前高危险度患者应至少服用伊马替尼3年。越来越多文献报道,服用伊马替尼年限越长越能提高患者的RFS,国内Lin[20]报道,45例高危患者至少口服伊马替尼5年,其5年RFS、OS分别为90.8%、97.4%,分别高于口服伊马替尼3年者的71.2%、84.0%。故高危患者未来将极可能继续延长服药年限以进一步改善预后,但需未来更多研究数据作为支持,本中心也将继续对目前患者进一步进行随访,以期为此提供更多数据支持。
此外,尽管伊马替尼治疗晚期患者或术后高危患者的辅助治疗效果显著,但随着随访时间的延长,继发性耐药成为限制伊马替尼疗效的瓶颈[21-23]。SOO33[24]和EORTC62005研究[25]提示:服药患者若疾病进展,将400 mg/d更改为600 mg/d,甚至800 mg/d,约有1/3的患者能够再次受益。研究[26]发现,由于种族及体质量的差异,中国人很难耐受800 mg/d的剂量,600 mg/d耐受性较好,而且疗效与国外报道800 mg/d相近。本组有6例患者接受伊马替尼400 mg/d时病情进展,将剂量增至600 mg/d,有3例患者能够再次受益病情缓解,且未发生严重的毒副作用。
在毒副作用方面,本组患者基本与报道[27-28]一致,水肿、恶心、腹部不适、贫血是较常见的毒副反应,多数都为1~2级毒副反应,8例发生3级不良反应,主要发生在高龄、体质较弱、ECOG评分较高的患者,门诊经对症处理或将剂量降至300 mg/d后,症状均有所改善,因而中国GIST患者进行伊马替尼治疗耐受性好,安全性高。
综上,伊马替尼能提高中国晚期GIST患者1、2年生存率。高危患者术后至少应接受3年伊马替尼治疗,是否继续延长服药年限以进一步改善预后需更多研究作为依据。
[1] Nishida T, Blay JY, Hirota S, et al. The standard diagnosis,treatment, and follow-up of gastrointestinal stromal tumors based on guidelines[J].Gastric Cancer, 2016, 19(1):3–14. doi:10.1007/s10120–015–0526–8.
[2] 隋翔宇, 胡三元. 胃肠间质瘤的相关研究进展[J]. 中国普通外科杂志, 2014, 23(10):1411–1415. doi:10.7659/j.issn.1005–6947.2014.10.020.Sui XY, Hu SY. Research progress dealing with gastrointestinal stromal tumor[J]. Chinese Journal of General Surgery, 2014,23(10):1411–1415. doi:10.7659/j.issn.1005–6947.2014.10.020.
[3] Demetri GD, von Mehren M, Blanke CD, et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors[J].N Engl J Med, 2002, 47(7):472–480.
[4] Kapoor R, Khosla D, Kumar P, et al. Five-year follow up of patients with gastrointestinal stromal tumor: recurrence-free survival by risk group[J]. Asia Pac J Clin Oncol, 2013, 9(1):40–46. doi:10.1111/j.1743–7563.2011.01494.x.
[5] Li J, Gong JF, Wu AW, et al. Post-operative imatimib in patients with intermediate or high risk gastrointestinal stromal tumor[J]. Eur J Surg 0ncol, 2011, 37(4):319–324. doi:10.1016/j.ejso.2011.01.005.
[6] Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J]. Hum Pathol, 2008, 39(10):1411–1419. doi:10.1016/j.humpath.2008.06.025.
[7] EsMo/Eumpean Sarcoma Network Working Group. Gastrointestinal stromal tuntors: ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J]. Ann Oncol, 2014, 25(Suppl 3):iii21–6.doi: 10.1093/annonc/mdu255.
[8] National Cancer Institute Cancer Therapy Evaluation Program.Common Toxicity Criteria Manual, Version 2.0[S].National Cancer Institute, Rockville, MD, 1999. https://ctep.cancer.gov
[9] 罗云, 王崇树, 魏寿江, 等. 巨大胃肠道间质瘤39例临床分析[J].中国普通外科杂志, 2015, 24(10):1383–1387. doi:10.3978/j.issn.1005–6947.2015.10.008.Luo Y, Wang CS, Wei SJ, et al. Giant gastrointestinal stromal tumors: a clinical analysis of 39 cases[J]. Chinese Journal of General Surgery, 2015, 24(10):1383–1387. doi:10.3978/j.issn.1005–6947.2015.10.008.
[10] 叶云虹, 余福兵. 伊马替尼治疗胃肠道间质瘤继发性耐药机制[J].医学信息, 2015, 28(21):350–351.Ye YH, Yu FB. Mechanisms for secondary drug resistance in imatinib treatment of gastrointestinal stromal tuntors[J]. Medical Information, 2015, 28(21):350–351.
[11] Sako H, Fukuda K, Saikawa Y, et al. Antitumor effect of the tyrosine kinase inhibitor nilotinib on gastrointestinal stromal tumor (GIST)and imatinib-resistant GIST cells[J]. PLos One, 2014, 9(9):e107613.doi: 10.1371/journal.pone.0107613.
[12] 闵凯, 曹峰瑜, 任骏, 等. 靶向治疗高危胃肠道间质瘤的临床疗效[J]. 中国普通外科杂志, 2016, 25(10):1408–1411. doi:10.3978/j.issn.1005–6947.2016.10.007.Min K, Cao FY, Ren J, et al. Clinical effect of imatinib targeted therapy on high risk gastrointestinal stromal tumor[J]. Chinese Journal of General Surgery, 2016, 25(10):1408–1411. doi:10.3978/j.issn.1005–6947.2016.10.007.
[13] Jakhetiya A, Garg PK, Prakash G, et al. Targeted therapy of gastrointestinal stromal tumours[J]. World J Gastrointest Surg,2016, 8(5):345–352. doi:10.4240/wjgs.v8.i5.345.
[14] Yoo C, Ryu MH, Jo J, et al. Efficacy of Imatinib in Patients with Platelet-Derived Growth Factor Receptor Alpha-Mutated Gastrointestinal Stromal Tumors[J].Cancer Res Treat, 2016,48(2):546–552. doi:10.4143/crt.2015.015.
[15] Blanke CD, Demetri GD, von Mehren M, et al. Long-term results from a randomized phase II trial of standard-versus higher-dose imatinib mesylate for patients with unresectable or metastatic gastrointestinal stromal tumors expressing KIT[J]. J Clin Oncol, 2008, 26(4):620–625.doi:10.1200/JCO.2007.13.4403.
[16] Rios M, LeCesne A, Bui B, et al. Interruption of imatinib (IM) in GIST patients with advanced disease after one year of treatment:Updated results of the prospective French Sarcoma Group randomized phase III trial on long term survival[J]. J Clin Oncol,2007, 25(18 Suppl):10016.
[17] DeMatteo RP, Ballman KV, Antonescu CR, et al. Adjuvant imatinib mesylate after resection of localised, primary gastrointestinal stromal tumour: a randomised, double-blind, placebo-controlled trial[J]. Lancet, 2009, 373(9669):1097–1104. doi:10.1016/S0140–6736(09)60500–6.
[18] 中国CSCO胃肠间质瘤专家委员会. 中国胃肠间质瘤诊断治疗共识(2013年版)[J]. 中华胃肠外科杂志, 2014,17(4):393–398.doi:10.3760/cma.j.issn.1671–0274.2014.04.022.China CSCO Gastrointestinal Stromal Tumor Expert Committee.Consensus of diagnosis and treatment of gastrointestinal stromal tumors in China (2013 edition)[J]. Chinese Journal of Gastrointestinal Surgery, 2014, 17(4):393–398. doi:10.3760/cma.j.issn.1671–0274.2014.04.022.
[19] Jounsuu H, Eriksson M, Hatrmann J, et al. Twelve versus 36 months of adjuvant imatinib (IM) as treatment of operable GIST with a high risk of recurrence: Final results of a randomized trial (SSGXVIII/AIO)[J]. Am Soc Clin Oncol, 2011, abstr. LBA 1.
[20] Lin JX, Chen QF, Zheng CH, et al. Is 3-years duration of adjuvant imatinib mesylate treatment sufficient for patients with high-risk gastrointestinal stromal tumor? A study based on long-term followup[J]. J Cancer Res Clin Oncol, 2017, 143(4):727–734. doi:10.1007/s00432–016–2334–x.
[21] Asija AP, Mejia AV, Prestipino A, et al. Gastrointestinal Stromal Tumors: A Review[J]. Am J Ther, 2016, 23(2):e550–557. doi:10.1097/MJT.0b013e3182a1be76.
[22] Nagata K, Kawakami T, Kurata Y, et al. Augmentation of multiple protein kinase activities associated with secondary imatinib resistance in gastrointestinal stromal tumors as revealed by quantitative phosphoproteome analysis[J]. J Protemoics, 2015,115:132–142. doi:10.1016/j.jprot.2014.12.012.
[23] 张艳, 季峰. 胃肠道间质瘤继发耐药机制及其处理对策研究进展[J]. 国际消化病杂志, 2013, 33(2):105–108. doi:10.3969/j.issn.1673–534X.2013.02.010.Zhang Y, Ji F. Progress of mechanism for secondary drug resistance in gastrointestinal stromal tumors and the countermeasures[J].International Journal of Digestive Diseases, 2013, 33(2):105–108.doi:10.3969/j.issn.1673–534X.2013.02.010.
[24] Blanke CD, Rankin C, Demetri GD, et al. Phase III randomized,intergroup trial assessing imatinib mesylate at two dose levels in patients with unresectable or metastatic gastrointestinal stromal tumors expressing the kit receptor tyrosine kinase: S0033[J]. J Clin Oncol, 2008, 26(4):626–632.doi:10.1200/JCO.2007.13.4452.
[25] Debiec-Rychter M, Sciot R, Le Cesne A, et al. KIT mutations and dose selection for imatinib in patients with advanced gastrointestinal stromal tumours[J]. Eur J Cancer 2006, 42(8):1093–1103.
[26] Li J, Gong JF, Li J, et al. Efficacy of imatinib dose escalation in Chinese gastrointestinal stromal tumor patients[J]. World J Gastroenterol, 2012, 18(7):698–703. doi:10.3748/wjg.v18.i7.698.
[27] 魏亚楠, 苗儒林. 甲磺酸伊马替尼治疗胃肠道间质瘤的疗效和毒副反应分析[J]. 中国医药导报, 2013, 10(8):81–83. doi:10.3969/j.issn.1673–7210.2013.08.034.Wei YN, Miao RL. Analysis of curative effect and toxicity reaction of Imatinib Mesylate in treatment of gastrointestinal stromal tumor [J].China Medical Herald, 2013, 10(8):81–83. doi:10.3969/j.issn.1673–7210.2013.08.034.
[28] Ben AE, Demetri, GD. A safety evaluation of imatinib mesylate in the treatment of gastrointestinal stromal tumor[J]. Expert Opin Drug Saf, 2016, 15(4):571–578. doi:10.1517/14740338.2016.1152258.
