腹腔镜辅助与开腹胃癌根治术临床效果及对肠道屏障功能影响的比较
2017-03-23程康文王贵和束宽山郑明王昌青左伯海陆朋云
程康文,王贵和,束宽山,郑明,王昌青,左伯海,陆朋云
(安徽省铜陵市人民医院 胃肠外科,安徽 铜陵 244000)
胃癌是世界范围内第5位常见肿瘤,是导致癌症相关死亡的第3位恶性肿瘤[1],手术是其主要治疗手段,2010年修订的日本胃癌治疗指南中规定对于可切除的胃癌首选开腹手术治疗[2]。1994年Kitano等[3]首次报道早期胃癌应用腹腔镜手术,1997年Goh等将腹腔镜胃癌D2根治术成功应用于进展期胃癌,标志着胃癌腹腔镜手术适应症的扩大。之后随着手术技巧的提高、经验的积累以及手术器械的革新,目前国内外多项临床研究[3-5]都表明腹腔镜胃癌根治术相比开腹手术在肿瘤结局上相当,且安全有效、术后并发症低、术后恢复快及较好的术后生活质量等优点。但是,腹腔镜胃癌根治术仍存在争议,包括淋巴结清扫的彻底性、远期生存效果、机体生理功能的干扰影响等。因此,目前腹腔镜胃癌根治术是胃癌外科领域中的研究热点。
肠道屏障功能是指肠道上皮具有分隔肠腔内物质和防止致病性抗原侵入的功能,正常肠道屏障包括机械、化学、免疫和生物4个部分[6]。肠道是人体最大的细菌库和内毒素库,完整的肠道屏障是机体防御功能的一道重要防线。当肠黏膜屏障损伤时,肠道中的细菌和内毒素(endotoxin,ETX)等便可突破肠黏膜屏障,进入血液引起细菌内毒素移位,导致肠源性感染的发生,甚至发展为全身性炎症反应综合征或多器官功能衰竭[7]。肠黏膜屏障功能受损时血清二胺氧化酶(diamine oxidase,DAO)升高,因此,血液中的DAO活性可反映肠屏障功能状态[8-9]。关于腹腔镜胃癌手术对机体炎症因子、免疫功能的影响已有较多研究报道[10],但是对于肠道屏障功能影响的研究甚少。本研究通过比较应用腹腔镜胃癌根治术与开腹胃癌根治术观察患者肠道屏障功能影响,现报告如下。
1 资料与方法
1.1 临床资料
以2016年1月—2016年6月我院胃肠外科收治的经胃镜病理确诊胃癌的患者对象,电脑产生随机数字表将患者分为两组,即采用腹腔镜辅助胃癌根治术(腔镜组)与传统开腹方法的胃癌根治术(开腹组)。两组患者在性别、年龄、体质量指数(BMI)、肿瘤大小、肿瘤部位、术后TNM分期、手术方式、吻合方式的一般资料方面比较,差异无统计学意义,具有可比性(表1)。入选标准:⑴ 患者知情同意;⑵ 年龄18~65岁;⑶ 美国麻醉医师协会评分≤3分。排除标准:⑴ 全身状况差,有手术禁忌证;⑵ 既往有胃癌手术的复发患者;⑶ 术前无肺部感染、血流感染等其它脏器感染症状;⑷ 术前应用抗生素超过1周;⑸ 术前接受新辅助化疗;⑹ 围手术期使用激素治疗;⑺ 术后证实术中腹腔污染导致术后腹腔感染;⑻ 合并其它恶性肿瘤或其它自身免疫性疾病;⑼ 未行标准D2淋巴结清扫或术后病理淋巴结少于15枚的患者;⑽ 腹腔镜中转开腹患者。本研究通过我院伦理委员会审批。
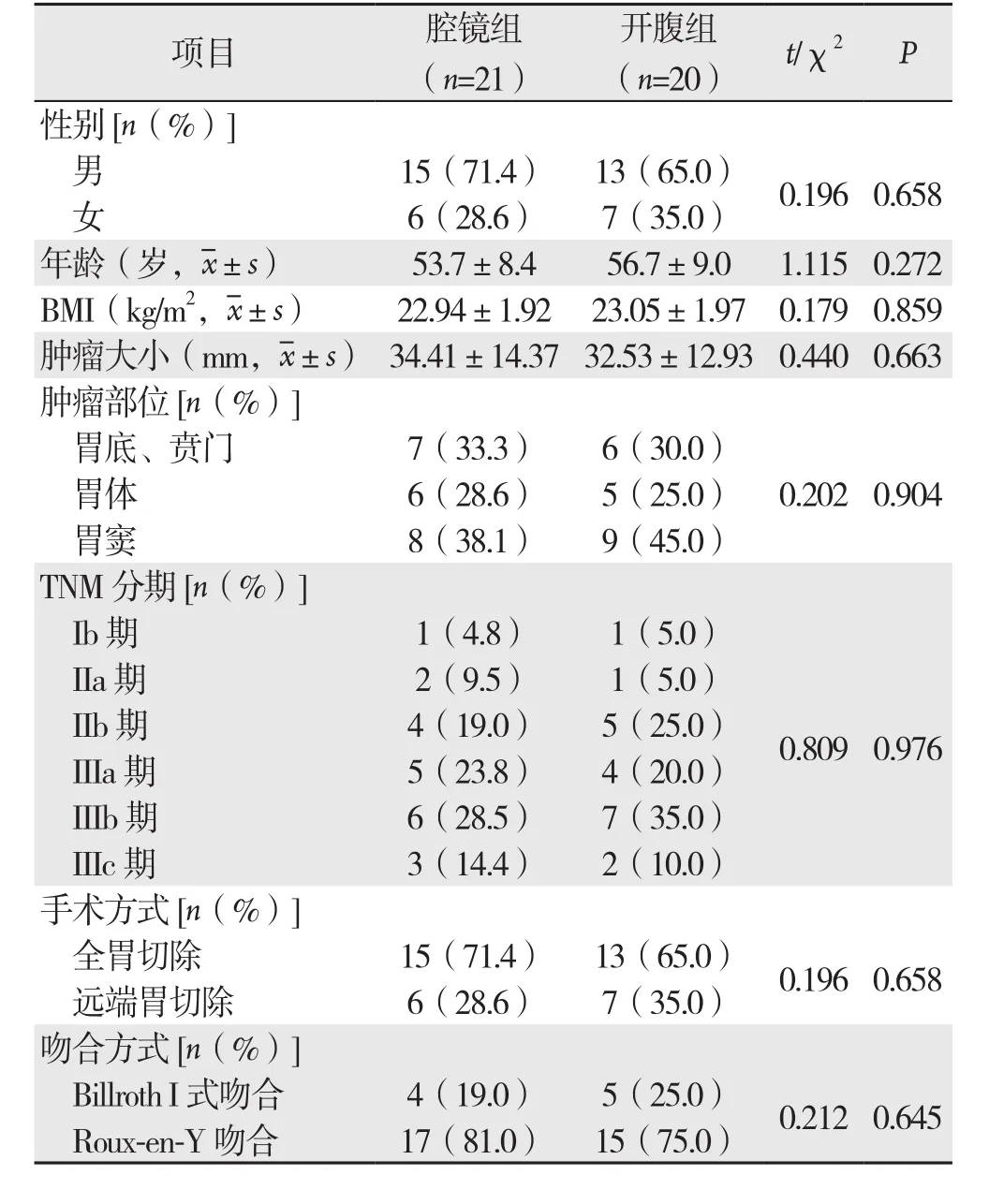
表1 两组患者一般资料比较Table 1 Comparison of the general data between the two groups of patients
1.2 手术方式
1.2.1 腔镜组 患者取平卧位,常规麻醉、建立气腹、置入Trocar,然后按照日本第14版胃癌处理规约[11]及我国腹腔镜胃癌手术操作指南(2007版)[12]行腹腔镜辅助下D2根治术。腹腔镜全胃切除组主要步骤为:常规探查肿瘤位置、浸润深度,有无腹盆腔、大网膜、肝脏转移等,超声刀分离胃结肠韧带,清除胃大弯侧淋巴结(4sb组),分别裸化胃网膜右动、静脉并于根部结扎切断(图1A),清扫幽门下淋巴结(6组)和第4d组淋巴结;继续分离胰腺被膜至胰腺上缘,充分显露冠状静脉、胃左静脉及腹腔干,用Hem-o-lok夹闭并切断冠状静脉及胃左动脉,清扫胃左动脉周围淋巴结(7组),清除肝总动脉周围淋巴结(8a组)(图1B);清扫腹腔干周围第9组淋巴结;沿胰体尾部上缘清扫脾动脉近端淋巴结(11p组),沿脾动脉远端清扫第11d组淋巴结、脾门淋巴结(10组);打开肝十二指肠韧带,显露胃十二指肠血管,沿肝总动脉向远端清扫肝固有动脉周围淋巴结(12a组),于胃右动脉根部离断,清扫幽门上淋巴结(5组),切断肝胃韧带至贲门右侧,清扫贲门右(1组)、胃小弯(3组)淋巴结脂肪组织,充分游离腹部食管,清扫贲门左淋巴结(2组),切断食道下端迷走神经,在上腹正中做5~8 cm切口,切除全胃,用吻合器行食管空肠Roux-en-Y吻合。腹腔镜根治性远端胃切除适用于胃窦癌,参照相关操作步骤[2,13]进行,相比全胃淋巴结清扫范围,术中无需常规进行第2组、11d组、10组淋巴结清扫术。首选Billroth I式吻合,如果预计肿瘤切除后吻合口张力过大则行胃空肠Roux-en-Y式吻合。两组患者于右上腹常规放置引流管及空肠营养管。
1.2.2 开腹手术组 患者取仰卧位,静脉复合麻醉后气管插管,取剑突下正中15~20 cm绕脐切口,贲门、胃底和胃体癌行根治性全胃切除术,胃窦癌行根治性远端胃切除术,淋巴结清扫按胃癌D2根治术要求,具体的手术方法详见参考文献[14]。
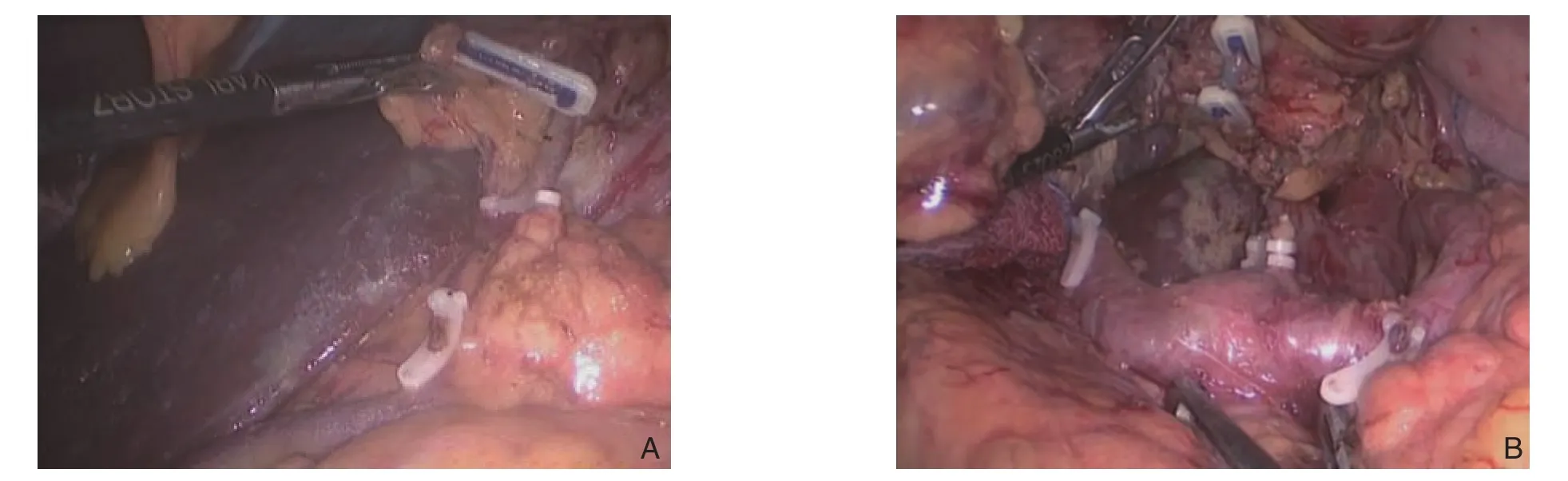
图1 术中照片 A:Hem-o-lok夹闭切断胃网膜右静脉、胰十二指肠下前静脉,显露胃网膜右动脉;B:Hem-o-lok夹闭切断胃左动脉、冠状静脉,显露腹腔干、肝总动脉及脾动脉Figure 1 Intraoperative views A: Clamp and division of the right gastroepiploic vein and anterior inferior pancreaticoduodenal vein, and exposure of the right gastroepiploic artery by using Hem-o-lok; B: Clamp and division of the left gastric artery and gastric coronary vein,exposure of the coeliac trunk, common hepatic artery and splenic artery
1.3 观察指标
⑴ 手术相关资料:两组患者手术切口长度、术中出血量、手术时间、术中是否输血、术后淋巴结的清扫数量、术后首次排气时间。⑵ 肠屏障功能:抽取手术前1 d及术后第1、3、7天静脉血5 mL于无热原加有抗凝剂的管中,分2份,离心后–70 ℃冰箱保存待测。采用活性比色法、紫外线分光光度计检测DAO,剂盒购自上海酶联生物科技有限公司。采用鲎试剂偶氮显色基质法、分光光度计检测ETX水平,试剂盒购自厦门鲎试剂实验厂有限公司。⑶ 术后感染性并发症:肺部感染主要定义为术后出现发热、咳嗽、咳痰,胸部X线或胸部CT提示肺部炎症;腹腔感染主要是术后出现腹痛、发热症状,腹部CT可见腹腔内脓腔、腹水或包裹性积液,引流液培养提示细菌阳性;胆囊炎主要定义为术后右上腹部胀痛,可伴畏寒、发热症状,实验室检查示白细胞、转氨酶升高,B超或腹部CT检查提示胆囊壁增厚,可伴有胆泥淤积。术后对体温>38.5 ℃或出现寒战的患者行静脉抽血培养,血培养见细菌定义为血流感染。
1.4 统计学处理
采用SPSS 19统计软件进行分析,计量资料采用t检验,非正态分布资料比较采用Mann-Whitney检验;计数资料采用χ2检验,相关性分析采用Pearson分析,P<0.05为差异有统计学意义。
2 结 果
2.1 手术相关资料比较
腔镜组手术切口长度、术中出血量均优于开腹组,但手术时间比开腹组长,差异均有统计学意义(均P<0.05)。两组患者手术切缘都是阴性;患者术中输血比例、清扫淋巴结数量、术后通气时间两组间差异无统计学意义(均P>0.05)(表2)。
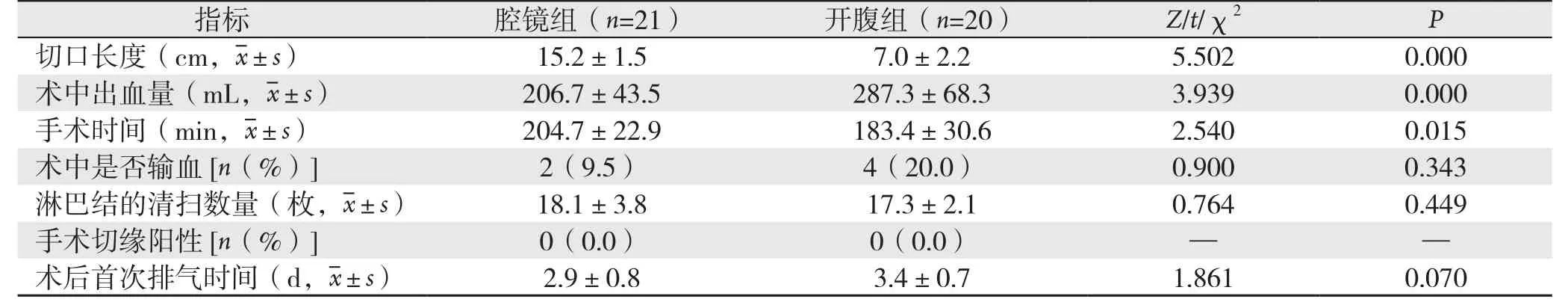
表2 两组患者手术相关指标的比较Table 2 Comparison of the surgical variables between the two groups of patients
2.2 肠屏障指标的比较
两组患者术前血DAO水平与血ETX水平无统计学差异(均P>0.05),术后第1天两组患者DAO与ETX水平与术前比较均表现为不同程度的上升趋势,差异均有统计学意义(均P<0.05),但腔镜组DAO、ETX水平与开腹组相比差异无统计学意义(P>0.05)。术后第3、7天两组患者DAO与ETX水平与术前比较无统计学意义,且两组之间对应时间段的DAO、ETX水平无统计学差异(均P>0.05)(表3-4)。
2.3 血DAO水平与血ETX水平的相关性分析
通过对两组患者血DAO水平与血ETX水平分别作相关性分析,腔镜组血DAO水平与血ETX水平呈正相关(r=0.759,P=0.000);开腹组血DAO水平与血ETX水平呈正相关(r=0.559,P=0.000)。
表3 两组患者手术前后DAO水平变化(mg/L,±s)Table 3 Changes in DAO levels before and after operation in the two groups of patients (mg/L, ±s)
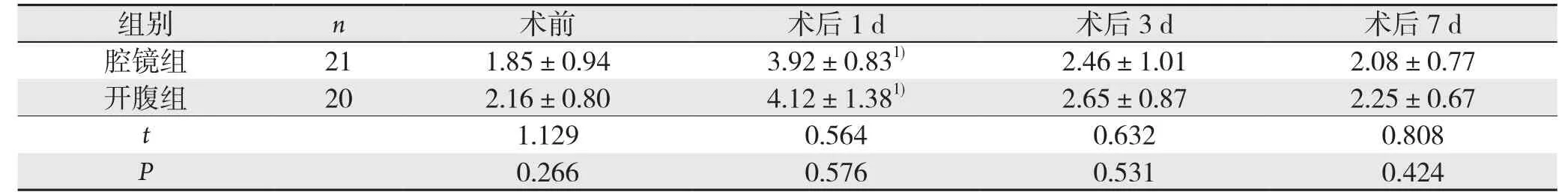
表3 两组患者手术前后DAO水平变化(mg/L,±s)Table 3 Changes in DAO levels before and after operation in the two groups of patients (mg/L, ±s)
注:1)与术前比较,P<0.05Note: P<0.05 vs. preoperative value
?
表4 两组患者手术前后ETX水平变化(EU/mL,±s)Table 4 Changes in ETX levels before and after operation in the two groups of patients (EU/mL, ±s)
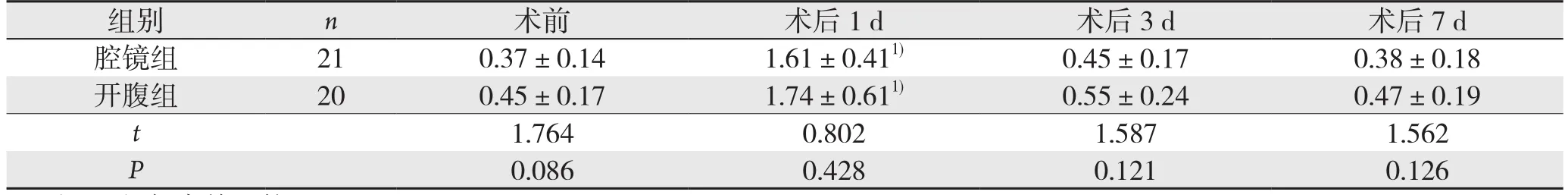
表4 两组患者手术前后ETX水平变化(EU/mL,±s)Table 4 Changes in ETX levels before and after operation in the two groups of patients (EU/mL, ±s)
注:1)与术前比较,P<0.05Note: P<0.05 vs. preoperative value
组别 n 术前 术后1 d 术后3 d 术后7 d腔镜组 21 0.37±0.14 1.61±0.411) 0.45±0.17 0.38±0.18开腹组 20 0.45±0.17 1.74±0.611) 0.55±0.24 0.47±0.19 t 1.764 0.802 1.587 1.562 P 0.086 0.428 0.121 0.126
2.4 感染性并发症的发生情况
腔镜组和开腹组共出现感染性并发症分别为7例、8例,两组之间差异无统计学意义(P>0.05)(表5)。腹腔感染都是术后导管引流液培养提示大肠埃希菌,腹部CT未见腹腔内脓腔或包裹性积液。腔镜组2例血流感染均为克雷伯杆菌;开腹组1例血培养为大肠埃希菌,另1例为葡萄球菌,同时该患者行粪涂片可见葡萄球菌,大便培养提示葡萄球菌,给予抗炎治疗后均痊愈。

表5 两组患者感染性并发症的发生情况[n(%)]Table 5 Infectious complications in the two groups of patients[n (%)]
3 讨 论
早期胃癌目前已被认可行腹腔镜手术,但腹腔镜胃癌手术在进展期胃癌中未获得广泛认可,现主要在较大的医学中心开展。进展期胃癌中推广腹腔镜手术缓慢的顾虑有:腹腔镜术中是否能达到肿瘤切缘阴性;是否能彻底进行淋巴结清扫;腹腔镜手术是否会促进癌细胞扩散[15]。本研究中发现腹腔镜胃癌相比开腹手术,在手术切口长度、术中出血量指标上优于开腹组,而在淋巴结清扫数量、术后肠通气时间及术后感染性并发症上无明显差异,但手术时间较长,表明腹腔镜胃癌应用于进展期胃癌是安全、有效的,相信随着学习曲线的延长,手术时间可以进一步缩短。国内多项研究[16-18]也表明进展期胃癌应用腹腔手术安全有效,淋巴结清扫效果及术后早期预后良好。腹腔镜术中需建立CO2气腹,有研究[19]表明气腹会对机体造成机械性压迫,而且由于机体吸收CO2也会导致高碳酸血症、高乳酸血症或酸中毒症状等生理功能干扰[20],可能导致肠道功能有影响。其主要原因可能是肠壁因高碳酸血症、炎症因子、缺氧、低灌注等因素共同作用下,造成肠屏障及肠功能受到影响[21]。有研究[22-23]表明手术方式都会对肠屏障功能产生不同程度影响。
DAO是肠黏膜上层绒毛膜细胞的细胞质内酶,在肠黏膜收到损伤时可释放DAO至肠黏膜细胞间和周围血管中,导致外周血中DAO升高。因此,血中DAO水平与肠黏膜的完整性相关,是反映肠黏膜结构和功能的理想指标[9]。研究[24]表明血中DAO可以作为评估肠损伤的血清标记物,并可作为评估失血性休克严重程度的指标。本研究中我们发现两组患者在术后第1天DAO水平高于术前,之后恢复至术前水平,表明肠屏障功能在术后第1天时受到不同程度影响,但两组之间无统计学差异,表明两种手术方式对肠屏障功能的影响无明显差异。近期Schietroma等[25]研究表明在腹腔镜结肠癌手术与开腹结肠癌手术中,对肠屏障功能影响无明显差异,其结果也支持我们的观点。但是国内李平等[21]、程军等[22]研究结果与我们不一致,不排除我们样本量偏少存在结果偏倚可能,具体仍有待循证医学证实。
本研究发现术后第1天两组患者ETX水平较术前均明显升高,至术后第3、7天内毒素水平恢复至术前水平,但两组之间无统计学差异,上述结果表明腹腔镜手术相比开腹手术至少不会加重肠屏障的破坏。术后出现内毒素水平升高原因可能是:术中操作可对肠道产生影响,致血管活性因子产生,导致局部和全身血流动力学改变,目前认为前列腺素在此过程中发挥重要的作用[25]。血管活性的前列腺素可导致肠道缺血,引起肠道黏膜完整性的破坏并增加肠道的通透性,可导致肠腔内细菌及内毒素移位至全身循环。而内毒素亦可以影响肠黏膜的完整性和通透性,从而对肠屏障功能进一步损害。此外,术中腹腔与外界空气的直接暴露,也可能导致术后出现内毒素水平升高的可能。
相关分析表明两组患者血DAO水平与血ETX水平呈正相关,表明术后ETX水平的上升与肠黏膜屏障功能受到影响有关。术后来源于肠道的肺部感染可能因肠道细菌移位至肠系膜静脉,并经门静脉回流至下腔静脉,最后经右心房流至肺动脉,从而导致肺部感染;同时也可经肠壁外淋巴结至肠系膜淋巴结至膈下、胸腔淋巴结,最后回流至胸导管,最终汇入下腔静脉后流至肺动脉途径[26]。术后腹腔感染可能因肠屏障功能减弱导致肠腔内细菌直接移位至腹腔所致,本研究中腹腔培养为大肠埃希菌为肠腔内常驻菌群,一定程度表明肠源性感染的可能。术后肠道内细菌移位至胆道可导致继发胆囊炎、胆管炎可能。本研究中两组患者术后感染性并发症无统计学差异,这与两组患者术后DAO、ETX水平无统计学差异一致。开腹组1例血流感染血培养与粪便培养细菌一致,表明肠源性感染可能。尽管不能证明上述感染皆是来源于肠源性感染的可能,但一定程度表明两组患者术后发生肠道细菌移位及内毒素血症的程度一致。
本研究存在一定的局限,首先,本研究是单中心小样本分析,需要多中心大样本前瞻性证实。其次,对于肠屏障功能障碍的定义所采用的是间接指标DAO、ETX,目前尚无一种从形态、结构及功能上去评估肠屏障功能的金标准。最后,本研究中时间点没有进一步细化,未来可以对术中、术后不同时间点进行对比分析,以明确手术方式在早期不同时间点对肠屏障功能的影响。
综上所述,腹腔镜辅助胃癌根治术安全、有效,具有切口小、出血少、近期疗效相当等优势,同时腹腔镜胃癌手术与开腹胃癌手术一样,对肠屏障功能影响也较小。
[1] Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5):E359–386. doi:10.1002/ijc.29210.
[2] Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2010 (ver.3)[J]. Gastric Cancer, 2011,14(2):113–123. doi: 10.1007/s10120–011–0042–4.
[3] Park YK, Yoon HM, Kim YW, et al. Laparoscopy-Assisted versus Open D2 Distal Gastrectomy for Advanced Gastric Cancer: Results from a Randomized Phase II Multicenter Clinical Trial (COACT 1001)[J]. Ann Surg, 2017, doi: 10.1097/SLA.0000000000002168.[Epub ahead of print]
[4] Lu Y, Jiang B, Liu T. Laparoscopic versus open total gastrectomy for advanced proximal gastric carcinoma: a matched pair analysis[J]. J BUON, 2016, 21(4):903–908.
[5] Haverkamp L, Brenkman HJ, Seesing MF, et al. Laparoscopic versus open gastrectomy for gastric cancer, a multicenter prospectively randomized controlled trial (LOGICA-trial)[J]. BMC Cancer, 2015, 15:556. doi: 10.1186/s12885–015–1551–z.
[6] 吴秀文, 任建安, 黎介寿. 慢重症患者肠屏障功能的维护[J]. 中华胃肠外科杂志, 2016, 19(7):740–742. doi:10.3760/cma.j.issn.1671–0274.2016.07.005.Wu XW, Ren JA, Li JS. Maintenance of intestinal barrier function in patients with chronic critical illness[J]. Chinese Journal of Gastrointestinal Surgery, 2016, 19(7):740–742. doi:10.3760/cma.j.issn.1671–0274.2016.07.005.
[7] Leaphart CL, Tepas JJ 3rd. The gut is a motor of organ system dysfunction[J]. Surgery, 2007, 141(5):563–569.
[8] Fukudome I, Kobayashi M, Dabanaka K, et al. Diamine oxidase as a marker of intestinal mucosal injury and the effect of soluble dietary fiber on gastrointestinal tract toxicity after intravenous 5- fl uorouracil treatment in rats[J]. Med Mol Morphol, 2014, 47(2):100–107. doi:10.1007/s00795–013–0055–7.
[9] Chen C, Huang P, Lai L, et al. Dexmedetomidine improves gastrointestinal motility after laparoscopic resection of colorectal cancer[J]. Medicine (Baltimore), 2016, 95(29):e4295. doi: 10.1097/MD.0000000000004295.
[10] 张治国, 薛慧婧, 宋仕茂, 等. 腹腔镜根治术治疗胃癌的效果观察及其免疫功能和应激炎性因子的变化情况分析[J]. 胃肠病学和肝病学杂志, 2015, 24(6):724–727. doi:10.3969/j.issn.1006–5709.2015.06.024.Zhang ZG, Xue HJ, Song SM, et al. Changes of immune function and inflammatory factors of patients with gastric cancer treated by laparoscopic radical resection[J]. Chinese Journal of Gastroenterology and Hepatology, 2015, 24(6):724–727.doi:10.3969/j.issn.1006–5709.2015.06.024.
[11] 胡祥. 2014 年第4 版日本《胃癌治疗指南》更新要旨[J]. 中国实用外科杂志, 2015, 35(1):16–19.HU X. Japanese gastric cancer treatment guidelines-the 4th Edition 2014 update message[J]. Chinese Journal of Practical Surgery,2015, 35(1):16–19.
[12] 中华医学会外科学分会腹腔镜与内镜外科学组. 腹腔镜胃癌手术操作指南(2007版)[J]. 中华消化外科杂志, 2007, 6(6):476–480.doi:10.3760/cma.j.issn.1673–9752.2007.06.029.Laparoscopic and Endoscopic Surgery Group of Surgery Branch of Chinese Medical Association. Operation guidelines for laparoscopic gastric cancer surgery (2007 edition)[J]. Chinese Journal of Digestive Surgery, 2007, 6(6):476–480. doi:10.3760/cma.j.issn.1673–9752.2007.06.029.
[13] 黄鑫, 刘少壮, 于斐, 等. 腹腔镜与开腹胃癌根治术的临床效果对比[J]. 腹腔镜外科杂志, 2016, 21(1):41–45. doi: 10. 13499 /j. cnki.Fqjwkzz. 2016. 01. 041.Huang X, Liu SZ, Yu F, et al. Comparative analysis of short-term outcomes between laparoscopy-assisted gastrectomy and open gastrectomy for gastric cancer[J]. Journal of laparoscopic surgery,2016, 21(01):41–45. 21(1):41–45. doi: 10. 13499 /j. cnki. Fqjwkzz.2016. 01. 041.
[14] 张启瑜, 钱礼. 钱礼腹部外科学[M]. 北京: 人民卫生出版社,2006:250–258.Zhang QY, Qian L. Qian Li abdominal surgery[M]. Beijing:People's Medical Publishing Press, 2006. 250–258.
[15] Hao Y, Yu P, Qian F, et al. Comparison of laparoscopy-assisted and open radical gastrectomy for advanced gastric cancer:A retrospective study in a single minimally invasive surgery center[J]. Medicine (Baltimore), 2016, 95(25):e3936. doi: 10.1097/MD.0000000000003936.
[16] 仝德峰, 刘江文, 孙琳, 等. 进展期胃癌腹腔镜辅助D2根治术的临床疗效分析[J]. 中国普通外科杂志, 2015, 24(8):1201–1204.doi:10.3978/j.issn.1005–6947.2015.08.030.Tong DF, Liu JW, Sun L, et al. Laparoscopic-assisted D2 gastrectomy for advanced gastric cancer: a clinical study[J]. Chinese Journal of General Surgery, 2015, 24(8):1201–1204. doi:10.3978/j.issn.1005–6947.2015.08.030.
[17] 张衍胜, 高翔宇. 腹腔镜辅助全胃切除术与开腹全胃切除术治疗胃癌的疗效及早期预后比较[J]. 中国普通外科杂志, 2014,23(10):1447–1449. doi:10.7659/j.issn.1005–6947.2014.10.030.Zhang YS, Gao XY. Laparoscopic- assisted total gastrectomy and open total gastrectomy for gastric cancer: comparison of therapeutic effi cacy and short-term prognosis[J]. Chinese Journal of General Surgery, 2014, 23(10):1447–1449. doi:10.7659/j.issn.1005–6947.2014.10.030.
[18] 阴法文, 尚磊, 张传宝. 进展期胃癌患者全胃切除D2淋巴结清扫微创手术效果研究[J]. 中国普通外科杂志, 2015, 24(11):1636–1639. doi:10.3978/j.issn.1005–6947.2015.11.029.Yin FW, Shang L, Zhang CB. Effect of minimally invasive total gastrectomy and D2 lymph nodes dissection for advanced gastric cancer[J]. Chinese Journal of General Surgery, 2015, 24(11):1636–1639. doi:10.3978/j.issn.1005–6947.2015.11.029.
[19] 郝龙, 洪晓明, 沙洪存.腹腔镜胃癌根治术对肠道屏障功能的影响[J]. 中华普通外科杂志, 2013, 28(12):938–940. doi:10.3760/cma.j.issn.1007–631X.2013.12.012.Hao L, Hong XM, Sha HC. Effect of laparoscopic radical gastrectomy on intestinal barrier function[J]. Zhong Hua Pu Tong Wai Ke Za Zhi, 2013, 28(12):938–940. doi:10.3760/cma.j.issn.1007–631X.2013.12.012.
[20] 李世宽. 腹腔镜手术相关的高乳酸血症或乳酸性酸中毒[J].腹腔镜外科杂志, 2016, 21(12):954–957. doi:10.13499/j.cnki.fqjwkzz.2016.12.954.LI SK. Hyperlactacidemia or lactic acidosis associated with laparoscopic surgery[J]. Journal of Laparoscopic Surgery, 2016,21(12):954–957. doi:10.13499/j.cnki.fqjwkzz.2016.12.954.
[21] 李平, 张卫卫, 顾园, 等. 腹腔镜胃癌根治术对肠道屏障功能损伤的研究分析[J]. 腹腔镜外科杂志, 2014, 19(11):804–807. doi: 10.13499 /j. cnki. Fqjwkzz. 2014. 11. 804.Li P, Zhang WW, GU Y, et al. The research and analysis of intestinal barrier function injury caused by laparoscopic radical surgery for gastric cancer[J]. Journal of Laparoscopic Surgery, 2014,19(11):804–807. doi: 10. 13499 /j. cnki. Fqjwkzz. 2014. 11. 804.
[22] 程军, 胡晓立, 杨潇, 等. 腹腔镜下胃癌根治术对患者肠道屏障功能及炎性因子的影响[J]. 疑难病杂志, 2016, 15(7):698–701.doi:10.3969/j.issn.1671–6450.2016.07.010.Cheng J, Hu XL, Yang X, et al. The effect of intestinal barrier function and inflammatory cytokines after laparoscopic gastrectomy[J]. Chinese Journal of Difficult and Complicated Cases,2016, 15(7):698–701. doi:10.3969/j.issn.1671–6450.2016.07.010.
[23] 许夕霞, 王彦霞, 王玲玲, 等. 不同消化道吻合方式对胃癌全胃切除术后患者胃肠功能的影响[J]. 中国全科医学, 2014,17(11):1314–1316. doi:10.3969/j.issn.1007–9572.2014.11.26.Xu XX, Wang YX, Wang LL, et al. Effect of Different Gastrointestinal Anastomoses on Gastrointestinal Function Recovery in Patients with Gastric Cancer [J]. Chinese General Practice, 2014,17(11):1314–1316. doi:10.3969/j.issn.1007–9572.2014.11.26.
[24] Zhao L, Luo L, Jia W, et al. Serum diamine oxidase as a hemorrhagic shock biomarker in a rabbit model[J]. PLoS One,2014, 9(8):e102285. doi: 10.1371/journal.pone.0102285.
[25] Schietroma M, Pessia B, Carlei F, et al. Gut barrier function and systemic endotoxemia after laparotomy or laparoscopic resection for colon cancer: A prospective randomized study[J]. J Minim Access Surg, 2016, 12(3):254–259. doi: 10.4103/0972–9941.169982.
[26] 黎介寿. 肠内营养与肠屏障功能[J]. 肠外与肠内营养, 2016,23(5):257-259. doi: 10.16151/j.1007-810x.2016.05.001.Li JS. Enteral nutrition and gut barrier function[J]. Parenteral &Enteral Nutrition, 2016, 23(5):257-259. doi: 10.16151/j.1007-810x.2016.05.001.
