术前D-二聚体及纤维蛋白原含量与胃肠道间质瘤患者预后的关系
2017-03-23蔡华霞王曙逢
蔡华霞,王曙逢
(1. 西安交通大学第一附属医院 普通外科,陕西 西安710061;2. 西安一四一医院 普通外科,陕西 西安 710089)
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是一类起源于胃肠道间叶组织的肿瘤,主要起源于胃肠道的Cajal细胞(intestinal cell of Cajal,ICC),绝大多数间质瘤特异性表达CD117与DOG1[1]。GIST早期可无任何症状和体征,往往是在健康查体或别的手术过程中发现[2]。对常规放疗、化疗不敏感,手术切除是主要的有效治疗方法。但GIST术后复发转移率高达40%~80%,绝大多数发生于首次切除的2年内,有些分化程度高的肿瘤,甚至在10年以上复发[3]。一旦出现复发转移,再次手术疗效不佳。故需要一种简便的方法能够预测GIST的预后,以便早期给予干预治疗。近年来,国内外学者对恶性肿瘤患者血浆D-二聚体(D-D)和纤维蛋白原(fibrinogen,FIB)水平异常有许多报道,肿瘤细胞可直接或间接地影响血液流变学改变,主要表现为凝血和纤溶异常[4]。FIB是血浆中含量最高的凝血因子,同时也是血浆中主要的急性时相反应蛋白,在感染、炎症、创伤、手术、组织坏死、恶性肿瘤等多种情况下,其均呈现出不同程度的升高[5-7]。对于肿瘤细胞,FIB能够刺激肿瘤血管生成,从而直接导致肿瘤进展,有研究[8-9]发现结直肠癌患者术后预后与术前FIB升高相关。而国内目前尚缺乏血浆FIB及其他凝血指标水平与GIST的相关研究。为此我们回顾性分析了170例行根治手术GIST患者的临床资料,收集患者术前D-D及FIB,分析其与GIST术后生存的关系,明确术前D-D及FIB在预测GIST患者术后预后方面的临床意义。
1 资料与方法
1.1 临床资料
收集自2010年1月1日—2015年12月31日间在西安交通大学第一附属医院收治且行GIST根治手术、符合入组标准的患者170例,记录患者术前血浆D-D及FIB。
纳入标准:⑴ 有明确的病理诊断,确诊为原发GIST,且术前未行甲磺酸伊马替尼(格列卫)等靶向治疗;⑵ 在我院行GIST根治切除术;⑶ 有完整的病例档案、随访资料及相关检查、检验结果。排除标准:⑴ 既往接受过术前新辅助治疗或已转移复发无法手术者;⑵ 无明确手术病理诊断或术后病理提示为其他组织来源恶性肿瘤者;⑶ 近2个月内曾使用雌激素、肾上腺皮质激素、抗凝剂如阿司匹林等影响凝血功能药物者;⑷ 患有凝血异常疾病者;⑸ 随访资料不全。
1.2 研究内容
观察指标包括性别、年龄、术前D-D、FIB和肿瘤大小及部位,术后肿瘤危险度分级等。其中,血液学的指标均为术前最后一次检测的实验室结果。凝血均为凝血6项检查,血浆D-D正常范围为0~1.0 mg/L,FIB正常范围为2.00~4.00 g/L。其中D-D、FIB等指标的最佳截点值取值基于ROC曲线选取。GIST危险度分级参照2008年改良版美国国立卫生署(NIH)GIST危险分级标准[10]。
1.3 随访
170例患者均采用门诊复诊或电话方式进行随访,记录患者术后恢复、复查情况以及复发转移、死亡等。术后两年内每3个月随访1次,以后每6个月随访1次,5年后每年随访1次。局部复发或转移均经多排螺旋CT或核磁、胃肠镜等至少1项影像学检查证实。无复发生存时间(recurrence free survival,RFS)定义为自接受根治性手术至出现肿瘤复发或远处转移所经历的时间。随访截止日期为2016年12月1日,仍然存活且无肿瘤复发或远处转移的影像学证据患者,或由于非GIST原因导致死亡的患者定义为截尾数据。
1.4 统计学处理
采用ROC曲线评估各指标的预测能力,选取各指标的最佳截点值。Kaplan-Meier法估算RFS并使用Log-rank法检验做单因素分析;筛选有意义的指标纳入Cox比例风险模型,采用向前法筛选影响GIST术后生存的独立危险因素。记录危险因子及其回归系数(B)、标准误(SE)、危险比(risk ratio,RR)。Cox模型的基本形式为:h(t,x)=h0(t)exp(β1x1+β2x2+…+βpxp)。其中,x表示可能影响生存的诸因素,也成为协变量。t表示生存时间,h(t,x)称为具有协变量x的个体在t时刻的风险函数,h0(t)称为基线风险函数。风险函数定义为具有协变量x的个体在活过t时刻以后在t到t+∆t这一很短时间内死亡概率与∆t之比的极限值。参数βi(i=1,2,…,p)为总体回归系数。分类变量各指标之间相关性分析采用χ2检验。以上统计学分析均使用SPSS 18.0软件完成,P<0.05为有统计学差异。
2 结 果
2.1 一般情况
本研究共纳入1 7 0例行根治性手术的原发GIST患者,随访期间有共有24例出现转移复发,因复发死亡15例,因车祸死亡1例。术后RFS为1~80个月,中位RFS为32个月。男91例(53.5%),女79例(46.5%),男女比例为1.15:1。年龄19~80岁,中位年龄61岁,<61岁者78例,≥61岁者92例,发病主要集中在50~70岁患者。胃间质瘤122例,非胃间质瘤48例(小肠34例,直肠8例,结肠2例,食管1例,盆腔3例)。按照2008年改良版GIST危险度分级标准,极低危、低危、中危、高危患者分别为18、65、37、50例。肿瘤直径范围为0.5~29 cm,肿瘤直径中位数为5 cm,≤5 cm者97例,>5 cm者73例。
以生存结局(出现转移或复发)为状态变量绘制R O C曲线(图1)选取指标的最佳截点值。本研究中,当D-D为1.24 mg/L时,曲线下面积为0.739,灵敏度为0.708,特异度为0.760,Youden指数最大值0.469,95%可信区间(CI)为0.629~0.850,故以1.24 mg/L作为D-D指标的最佳截点值;当FIB为3.24 g/L时,曲线下面积为0.758,灵敏度为0.875,特异度为0.616,Youden指数最大值0.491,95%CI为0.666~0.850,故以3.24 g/L作为FIB指标的最佳截点值(图1)。

图1 D-D、FIB评估GIST患者生存结局的ROC曲线Figure 1 ROC cures of D-D and FIB for predicting survival outcomes of the GIST patients
2.2 单因素分析
用Kaplan-Meier法绘制生存曲线和Log-rank检验对生存曲线进行比较,结果显示,GIST患者D-D≥1.24 mg/L、FIB≥3.24 g/L、NIH危险度分级的中高危组、肿瘤直径>5 cm及发生在胃以外部位均与GIST术后差的预后有关(均P<0.05)。而其性别、年龄与术后复发无关(均P>0.05)。即GIST患者D-D、FIB等水平越高,NIH危险度分级的恶性潜能越大、肿瘤直径越大,患者RFS率越低,预后越差;发生在胃以外部位的GIST预后差于发生在胃部位的GIST。术后3、5年总RFS率分别为85%、75%(表1)(图2)。
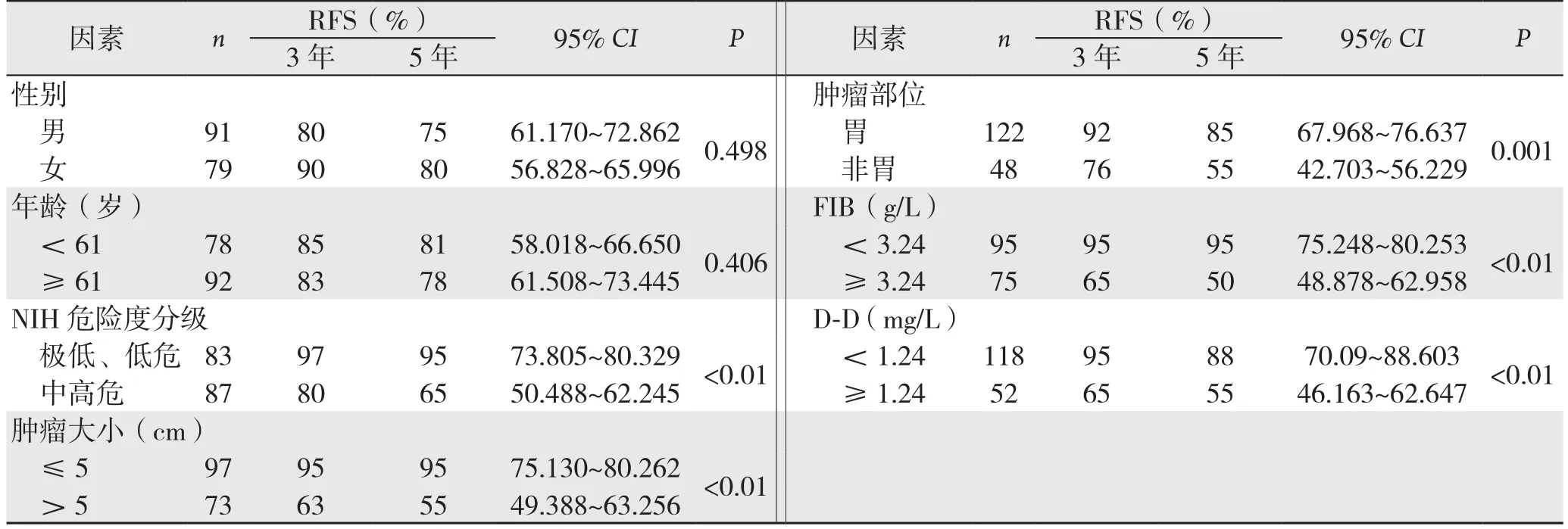
表1 GIST患者病理资料与预后关系的单因素分析Table 1 Univariate analysis of relations of clinicopathologic features with prognosis in GIST patients
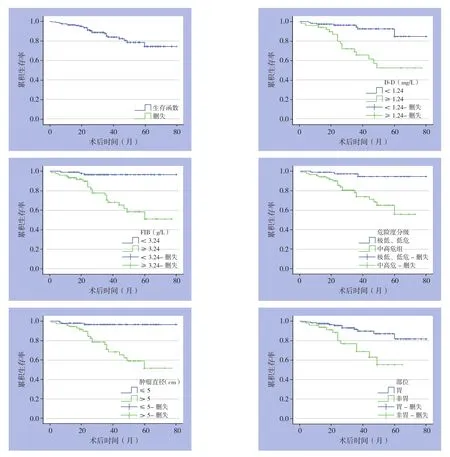
图2 全组GIST患者RFS曲线及不同因素分组患者RFS曲线比较Figure 2 RFS curve of the entire group of GIST patients and comparison of RFS curves between GIST patients grouped by different factors
2.3 多因素分析
将单因素分析结果中有统计学意义的因素通过向前法纳入Cox比例风险模型,并以是否服用格列卫等分子靶向治疗为基线分层后(表2),结果显示,D-D、FIB、NIH危险度分级均是影响GIST患者术后复发的独立危险因素(均P<0.05),其RR值分别为0.382、0.123、0.149,其相应的RR 95%CI分别为0.151~0.967、0.035~0.430、0.042~0.524;提示升高的D-D、FIB及恶性潜能高的NIH危险度分级分别较相应的正常组GIST术后复发风险增加0.382、0.123、149倍。Cox模型表达式为:h(t,x)=h0(t)exp(0.964 D-D+2.095 FIB+1.903危险度分级)。表达式右边指数部分取值越大,则风险函数h(t,x)越大,预后相对越差,称为预后指数(prognosticindex,PI)。本研究P I=0.9 6 4 D-D+2.0 9 5 FIB+1.903危险度分级。即升高的D-D、FIB、危险度分级与GIST差的预后呈正相关。
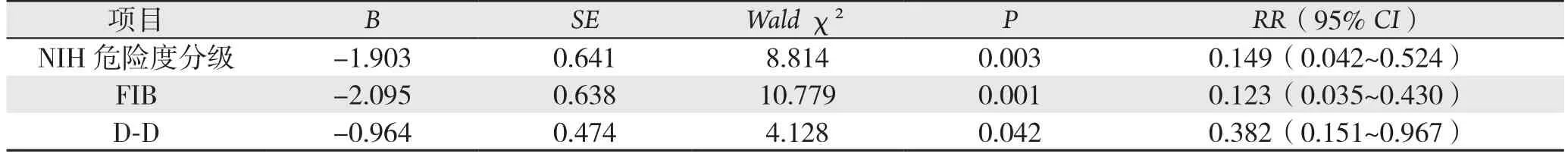
表2 分层后GIST患者病理因素与预后关系的多变量分析Table 2 Multivariate analysis of relations of clinicopathologic features with prognosis in GIST patients after strati fication
2.4 相关性分析
NIH危险度分级与D-D、FIB之间的相关性分析表明,NIH危险度分级与D-D、FIB之间存在中等程度相关(均P<0.01),其相关系数r分别为0.648、0.868,且NIH危险度分级与FIB之间的相关性强于与D-D之间的相关性(表3)。
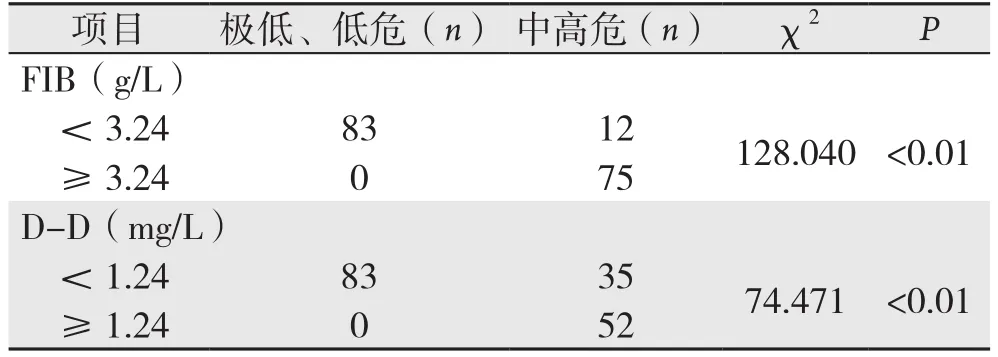
表3 NIH危险度分级与FIB、D-D的相关性Table 3 Correlation between the NIH risk category and FIB or D-D levels
3 讨 论
GIST是源于Cajar细胞或间充质干细胞的消化道肿瘤,是一种最常见的起源于非上皮细胞的间叶组织的肿瘤,其发病率每年约为1~2/10万[11]。GIST可发生于胃肠道任何部位,偶尔也可见于胃肠道外[12],如肠系膜、腹腔、盆腔、卵巢,也可罕见发生于肝脏、胰腺、前列腺、膀胱和阴道等[13]。本研究发现,GIST患者年龄集中在19~80岁,中位年龄61岁,发病主要集中在50~70岁患者;170例GIST患者中,男9 1例,女7 9例,男女比例为1.15:1,男性发病率略高于女性。据报道[14],GIST最常发生在胃(60%~70%),其次为小肠(25%~35%),本研究中胃间质瘤122例,占7 1.8%(1 2 2/1 7 0);小肠3 4例,占2 0%(34/170),与前述报道基本相符。
GIST临床表现无特异性,起病隐匿,消化道出血、腹部不适及腹部肿块是GIST常见的症状[15]。对传统的放疗、化疗不敏感[16],目前主要的方法是手术切除联合格列卫等分子靶向治疗,但术后复发转移率高。一旦出现复发转移,再次手术疗效不佳。另外,由于靶向治疗药物费用昂贵及副作用,很多患者无法持续坚持服用。本研究170例患者中NIH分级的中高危组87例患者,术后服用格列卫治疗的只有61例。故需要一种简便的方法能够预测GIST的预后,以便早期给予干预治疗。
由于肿瘤的异质性以及病理情况的多样性,肿瘤患者的预后情况和治疗效果往往存在较大差别。本研究中170例GIST患者3年、5年RFS率分别为85%、75%,与研究[17]报道的3、5年生存率分别是54%、42%的结果不同,考虑可能与本研究纳入的病例不包括术前已有转移的患者有关。
在这种情况下,探索既可以诊断GIST,又可以评估其预后的标志物成为GIST研究的重要方向。据报道[18],恶性肿瘤的发生与发展过程常常伴随凝血功能的紊乱,表现为患者凝血功能亢进,抗凝系统功能减退。恶性肿瘤的进展与凝血、纤溶功能异常表现密切相关,可发生凝血、抗凝和纤溶的失衡,使患者处于高凝状态,这种状态对肿瘤的生长与转移起着非常重要的作用[19]。而FIB是一种重要的凝血因子,即凝血因子I,是凝血过程中的主要蛋白,其水平在胃癌、肺癌等多种恶性肿瘤患者中被发现异常升高,可作为诊断及评估疗效的指标[20]。有研究[4]显示,FIB及其降解产物的血浆含量在患癌时增高,可以增强血小板对癌细胞的黏附,从而有利于癌细胞转移。另有研究[21]指出,在恶性肿瘤患者中,术前FIB水平较低者其术后复发率较低,相反,术前存在高纤维蛋白原血症者,其术后复发率较高且复发后FIB水平会进一步升高。提示血浆FIB水平的变化可能对恶性肿瘤患者治疗的疗效有预测价值。
D-D是交联纤维蛋白降解的一个稳定的最终产物[22],其结果是纤维蛋白的形成和溶解,其在凝血异常的疾病中升高,如弥散性血管内凝血、深静脉血栓形成、肺栓塞和冠心病。研究[23-24]表明,90%的癌症患者存在凝血障碍,如缩短的凝血酶原时间、部分凝血活酶时间,增加的因子II、V、VIII、IX、XI、XII、FIB及纤维蛋白降解产物,且升高的血浆D-D与多种恶性疾病的预后不良有关,包括肺癌、结直肠癌、卵巢癌、胃癌和乳腺癌[25]。
基于目前国内关于D-D、FIB变化水平同GIST预后的关系研究尚少,本研究回顾性分析了170例GIST患者,研究术前D-D、FIB 与GIST预后之间的关系。发现除性别、年龄外,D-D、FIB、GIST危险度分级、肿瘤大小及部位均与GIST术后预后有关(P<0.05);且从多因素分析的Cox模型表达式“h(t,x)=h0(t)exp(0.964 D-D+2.095 FIB+1.903危险度分级)”中可以看出,D-D、FIB、GIST危险度分级均是影响GIST术后复发的独立危险因素。即D-D、FIB值越大,NIH危险度分级的恶性潜能越高,预后越差。另外,从前述表4可知,D-D、FIB值的变化与NIH危险度分级的恶性潜能等级呈中等程度的正相关。这更进一步提示在临床上运用血D-D、FIB、GIST的NIH危险度分级来判断GIST的生物学行为和预测预后是有效的方法。
目前GIST尚无理想的肿瘤标志物,D-D、FIB为术前常规检验的凝血指标,检测方法简便、快速、敏感性高、损伤小、费用低,因此D-D、FIB可考虑作为GIST辅助诊断及判断预后的参考指标,对临床工作有较大裨益。本研究的不足之处在于,为回顾性研究,存在不可避免的局限性,有潜在的偏倚。但该研究的结论可以为相关研究指出下一步研究方向,本研究结论支持D-D、FIB等凝血相关标记物及NIH危险度分级作为GIST术后预后指标,但该结论尚需进一步证实。
[1] 王进, 贾宗良, 樊林, 等. 腹腔镜胃间质瘤切除的可行性与安全性的肿瘤位置匹配对照研究[J]. 中国普通外科杂志, 2016,25(4):581–586. doi:10.3978/j.issn.1005–6947.2016.04.019.Wang J, Jia ZL, Fan L, et al. Feasibility and safety of laparoscopic resection for gastric stromal tumor: a tumor location matched case-control study[J]. Chinese Journal of General Surgery, 2016,25(4):581–586. doi:10.3978/j.issn.1005–6947.2016.04.019.
[2] 孙涛, 郭晋, 谢余澄, 等. 胃肠间质瘤的临床病理分析[J]. 临床误诊误治, 2012, 25(9):76–79. doi: 10.3969/j.issn.1002–3429.2012.09.035.Sun T, Guo J, Xie YC, et al. Clinicopathological analysis of gastrointestinal stromal tumors[J]. Clinical Misdiagnosis and Mistherapy, 2012, 25(9):76–79. doi: 10.3969/j.issn.1002–3429.2012.09.035.
[3] 张云, 曹晖, 汪明, 等. 181例胃肠间质瘤的临床病理及预后分析[J]. 中华胃肠外科杂志, 2009, 12(2):150–154. doi:10.3760/cma.j.issn.1671–0274.2009.02.018.Zhang Y, Cao H, Wang M, et al. Analysis of clinicopathology and prognosis in 181 patients with gastrointestinal stromal tumors[J].Chinese Journal of Gastrointestinal Surgery, 2009, 12(2):150–154.doi:10.3760/cma.j.issn.1671–0274.2009.02.018.
[4] 黄喜顺, 邓立新, 邱耀辉, 等. 早期胃癌筛查血清学指标研究进展[J]. 临床误诊误治, 2016, 29(8):109–116. doi: 10.3969 /j. issn.1002–3429.2016.08.035.Huang XS, Deng LX, Qiu YH, et al. Progress of serum markers for early gastric cancer screening[J]. Clinical Misdiagnosis and Mistherapy, 2016, 29(8):109–116. doi: 10.3969/j.issn.1002–3429.2016.08.035.
[5] 喻晓洁, 张一清, 竺鹏飞. 宫颈癌手术前后血浆纤维蛋白原和D-二聚体水平变化[J]. 中国妇幼保健, 2013, 28(3):418–420.doi:10.7620/zgfybj.j.issn.1001–4411.2013.28.12.Yu XJ, Zhang YQ, Zhu PF. Changes of plasma fibrinogen and D-dimer levels before and after cervical cancer surgery[J]. Maternal& Child Health Care of China, 2013, 28(3):418–420. doi:10.7620/zgfybj.j.issn.1001–4411.2013.28.12.
[6] 刘彦洁, 杨慧君, 蔡世洁, 等. 非小细胞肺癌患者纤维蛋白原状态与预后的相关性探讨[J]. 临床肺科杂志, 2014, 19(2):326–328.doi:10.3969/j.issn.1009–6663.2014.02.047.Liu YJ, Yang HJ, Cai SJ, et al. Correlative study between fibrinogen and prognosis in patients with non-small cell lung cancer[J]. Journal of Clinical Pulmonary Medicine, 2014, 19(2):326–328. doi:10.3969/j.issn.1009–6663.2014.02.047.
[7] 汪晓东, 刘丹, 吕东昊, 等. 结直肠癌血清纤维蛋白原和炎性介质、肿瘤标志物的术前诊断价值[J]. 肿瘤防治研究, 2010,37(5):566–569. doi:10.3971/j.issn.1000–8578.2010.05.021.Wang XD, Liu D, Lu DH, et al. Values for Preoperative Staging of Fibrinogen, Inflammatory Mediators and Tumor Markers in Colorectal Cancer[J]. Cancer Research on Prevention and Treatment,2010, 37(5):566–569. doi:10.3971/j.issn.1000–8578.2010.05.021.
[8] Tang L, Liu K, Wang J, et al. High preoperative plasma fibrinogen levels are associated with distant metastases and impaired prognosis after curative resection in patients with colorectal cancer[J]. J Surg Oncol, 2010, 102(5): 428–432. doi: 10.1002/jso.21668.
[9] Son HJ, Park JW, Chang HJ, et al. Preoperative plasma hyperfibrinogenemia is predictive of poor prognosis in patients with nonmetastatic colon cancer[J]. Ann Surg Oncol, 2013, 20(9):2908–2913. doi: 10.1245/s10434–013–2968–8.
[10] 王坚, 喻林, 刘绮颖. 胃肠间质瘤病理诊断和分子检测[J]. 中国实用外科杂志, 2015, 35(4):369–374.Wang J, Yu L, Liu QY. Pathological diagnosis and molecular assay of gastrointestinal stromal tumor[J]. Chinese Journal of Practical Surgery, 2015, 35(4):369–374.
[11] 罗云, 王崇树, 魏寿江, 等. 巨大胃肠道间质瘤39例临床分析[J].中国普通外科杂志, 2015, 24(10):1383–1388. doi:10.3978/j.issn.1005–6947.2015.10.008.Luo Y, Wang CS, Wei SJ, et al. Giant gastrointestinal stromal tumors: a clinical analysis of 39 cases[J]. Chinese Journal of General Surgery, 2015, 24(10):1383–1388. doi:10.3978/j.issn.1005–6947.2015.10.008.
[12] Goh BK, Chok AY, Allen JC Jr, et al. Blood neutrophil-tolymphocyte and platelet-to-lymphocyte ratios are independent prognostic factors for surgically resected gastrointestinal stromal tumors[J]. Surgery, 2016, 159(4):1146–1156. doi: 10.1016/j.surg.2015.10.021.
[13] 廖辉军, 聂剑宏, 吴新军. 原发性肝脏间质瘤并颈部淋巴结转移1 例并文献复习[J]. 中国普通外科杂志, 2017, 26(1):116–120. doi:10.3978/j.issn.1005–6947.2017.01.019.Liao HJ, Nie JH, Wu XJ. Primary hepatic stromal tumor with metastasis to cervical lymph nodes: a case report and literature review[J]. Chinese Journal of General Surgery, 2017, 26(1):116–120. doi: 10.3978/j.issn.1005–6947.2017.01.019.
[14] 李桂臣, 陈旭春, 成东华, 等. 十二指肠间质瘤29例的诊治分析[J]. 中国普通外科杂志, 2014, 23(3):352–356. doi:10.7659/j.issn.1005–6947.2014.03.018.Li GC, Chen XC, Cheng DH, et al. Diagnosis and management of duodenal gastrointestinal stromal tumors: a review of 29 cases[J].Chinese Journal of General Surgery, 2014, 23(3):352–356.doi:10.7659/j.issn.1005–6947.2014.03.018.
[15] 隋翔宇, 胡三元. 胃肠间质瘤的相关研究进展[J]. 中国普通外科杂志, 2014, 23(10):1411–1415. doi:10.7659/j.issn.1005–6947.2014.10.020.Sui XY, Hu SY. Research progress dealing with gastrointestinal stromal tumor[J]. Chinese Journal of General Surgery, 2014,23(10):1411–1415. doi:10.7659/j.issn.1005–6947.2014.10.020.
[16] 闵凯, 曹峰瑜, 任骏, 等. 靶向治疗高危胃肠道间质瘤的临床疗效[J]. 中国普通外科杂志, 2016, 25(10):1408–1411. doi:10.3978/j.issn.1005–6947.2016.10.007.Min K, Cao FY, Ren J, et al. Clinical effect of imatinib targeted therapy on high risk gastrointestinal stromal tumor[J]. Chinese Journal of General Surgery, 2016, 25(10):1408–1411. doi:10.3978/j.issn.1005–6947.2016.10.007.
[17] Pierie JP, Choudry U, Muzikansky A, et al. The effect of surgery and grade on outcome of gastrointestinal stromal tumors[J]. Arch Surg, 2001, 136(4): 383–389.
[18] 蔡军, 尹杰, 张军, 等. 胃癌患者血浆D-二聚体检测的临床意义[J]. 临床和实验医学杂志, 2014, 13(11):894–896. doi:10.3969/j.issn.1671–4695.2014.11.013.Cai J, Yin J, Zhang J, et al. Measurement of plasma D-dimer in gastric cancer patients and its clinical significance[J]. Journal of Clinical and Experimental Medicine, 2014, 13(11):894–896.doi:10.3969/j.issn.1671–4695.2014.11.013.
[19] 庄华章, 陈永杰. 高凝状态相关指标在结直肠癌患者手术前后的变化及术式的影响[J]. 中国普通外科杂志, 2014, 23(4):458–461.doi:10.7659/j.issn.1005–6947.2014.04.011.Zhuang HZ, Chen YJ. Pre-and postoperative changes of parameters related to hypercoagulability in colorectal patients and the in fl uence of mode of operation[J]. Chinese Journal of General Surgery, 2014,23(4):458–461. doi:10.7659/j.issn.1005–6947.2014.04.011.
[20] Lee JH, Hyun JH, Kim DY, et al. The role of fibrinogen as a predictor in preoperative chemoradiation for rectal cancer[J]. Ann Surg Oncol, 2015, 22(1):209–215. doi: 10.1245/s10434–014–3962–5.
[21] 苏毓. 高纤维蛋白原血症同胃癌术前临床病理参数的关系及预后分析[D]. 石家庄: 河北医科大学, 2015.Su Y. The association between hyperfibrinogenemia and clinicopathological factors, and the survival analysis of Gastric Cancer[D]. Shijiazhuang: Hebei Medical University, 2015.
[22] Afshar M, Hamilton P, Seligmann J, Lord S, et al. Can D-Dimer Measurement Reduce the Frequency of Radiological Assessment in Patients Receiving Palliative Imatinib for Gastrointestinal Stromal Tumor (GIST)?[J]. Cancer Invest, 2015, 33(8):347–353. doi:10.3109/07357907.2015.1047504.
[23] Diao D, Wang Z, Cheng Y, et al. D-dimer: not just an indicator of venous thrombosis but a predictor of asymptomatic hematogenous metastasis in gastric cancer patients[J]. PLoS One, 2014,9(7):e101125. doi: 10.1371/journal.pone.0101125.
[24] Tekeşin K, Bayrak S, Esatoğlu V, et al. D-Dimer and Carcinoembryonic Antigen Levels: Useful Indicators for Predicting the Tumor Stage and Postoperative Survival[J]. Gastroenterol Res Pract, 2016, 2016:4295029. doi: 10.1155/2016/4295029.
[25] Liu L, Zhang X, Yan B, et al. Elevated plasma D-dimer levels correlate with long term survival of gastric cancer patients[J]. PLoS One, 2014, 9(3):e90547. doi: 10.1371/journal.pone.0090547.
