导电玻璃负载CuO/V2O5复合纳米纤维光电极的制备及光电催化性能
2016-12-14李佑稷唐宁梅李紫琴韩志英
林 晓,李佑稷,李 铭,唐宁梅,李紫琴,韩志英
(吉首大学化学化工学院,吉首416000)
导电玻璃负载CuO/V2O5复合纳米纤维光电极的制备及光电催化性能
林晓,李佑稷,李 铭,唐宁梅,李紫琴,韩志英
(吉首大学化学化工学院,吉首416000)
以聚乙烯吡咯烷酮(PVP)为高分子模板剂,乙酰丙酮钒(C15H21O6V)和三水合硝酸铜[Cu(NO3)2· 3H2O]为原料,导电玻璃(FTO)为载体,结合溶胶⁃凝胶法和静电纺丝技术制备了前驱体纤维,经高温焙烧后得到分布均匀、具有纤维结构的导电玻璃负载的CuO/V2O5复合光电极(CuO/V2O5/FTO).采用热重⁃差热分析仪(TG⁃DTA)、X射线衍射仪(XRD)、扫描电子显微镜(SEM)、透射电子显微镜(TEM)和X射线光电子能谱仪(XPS)等对材料的结构进行表征,以亚甲基蓝(MB)为目标降解物,探讨了合成产物的光电催化性能.结果表明,CuO与V2O5能有效形成异质结构,其光电催化活性均比纯V2O5有明显提高,并且改变CuO与V2O5的比例对光电催化性能有较大影响,其中n(Cu)∶n(V)=1∶1时降解效率最高,达到96%.
静电纺丝;CuO/V2O5/FTO;复合纳米纤维;光电催化
随着人们环境保护意识的日益增强,利用可再生能源对污染物进行处理引起了人们的广泛关注,其中,光电催化技术是一种将光催化和电催化相协同处理污染物的有效方法[1~3].在众多光催化剂中,以TiO2为代表的氧化物半导体材料由于其优异的光催化性能和良好的稳定性一直备受关注[4~6],但其较宽的带隙使其受激发产生电子⁃空穴对时需要紫外光照射,在可见光下则不能产生光催化效果,从而限制了TiO2光催化剂的广泛应用[7].一些带隙相对较窄的半导体(如等)虽然可以利用太阳光中的大部分可见光,但其较高的电子⁃空穴复合率降低了催化的效率.因此,人们通过各种方法(如离子掺杂[13,14],半导体复合[15~17]等)对半导体氧化物进行改性以提高半导体光催化材料光生电子⁃空穴对的分离效率,减少复合,提高其光催化性能.
V2O5的带隙值较窄(0.2~3 eV),有较宽的光响应范围,但由于V2O5中多价态金属离子形成的晶格缺陷使电子⁃空穴对复合加速,导致其在可见光下的催化活性降低[18].为了提高V2O5的光催化活性,研究者采用多种方法对V2O5进行了改性:Suresh等[19]通过热分解法制备了Co掺杂的Co⁃V2O5纳米微粒,并探讨了Co掺杂量对材料光催化性能的影响,发现Co掺杂的Co⁃V2O5纳米微粒明显比纯V2O5纳米微粒的催化效率高,当Co的掺杂量为10%(质量分数)时催化效率最佳.Wang等[20]通过静电纺丝法制备了具有纳米结构的V2O5/TiO2异质材料,并通过改变V与Ti的摩尔比来调变V2O5/TiO2异质结构的物相组成,发现复合材料的光催化效率明显比纯V2O5的高,当n(V)/n(Ti)为1∶1时光催化效率最佳.CuO晶体是常见的p型半导体(0.46~2.16 eV),在可见光照射下能被激发,将其与n型半导体V2O5复合,可以有效构建p⁃n异质结[21,22],降低电子⁃空穴对的复合率,从而提高光催化性能,具有很高的利用价值.
由于粉体在催化过程中具有容易损耗、难回收和易造成二次污染等缺点,限制了其广泛应用,将催化剂固载可以克服上述问题,同时还可以避免催化剂颗粒之间的遮蔽现象,提高催化活性.目前,催化剂常用的载体有玻璃类、陶瓷类、吸附剂类和金属类等[23,24],其中氟掺杂氧化锡(FTO)导电玻璃具有良好的导电、传热及耐高温等特性,且制备的光电极能重复利用.
本文以乙醇为溶剂,PVP为纤维骨架,乙酰基丙酮钒和三水合硝酸铜为原料,结合溶胶⁃凝胶法,采用静电纺丝技术制备了具有不同摩尔比的CuO/V2O5/FTO复合纳米纤维光电极,对其结构进行了表征,并以亚甲基蓝溶液为目标降解物,研究了不同复合比例下CuO/V2O5/FTO的光电催化性能.
1 实验部分
1.1 试剂与仪器
聚乙烯吡咯烷酮(PVP,Mw=1.3×106)和乙酰丙酮钒(C15H21O6V,华威锐科有限公司);三水合硝酸铜和亚甲基蓝(科密欧化学试剂有限公司);无水乙醇(永大化学试剂有限公司).以上试剂均为分析纯.实验用水为蒸馏水.
北京富友马科技有限责任公司FM⁃1206型静电纺丝设备;瑞士Mettler Toledo公司TGA/DSCI型差热分析仪(空气氛围,升温速率为10℃/min);德国Bruker公司Y⁃2000型X射线衍射仪(Cu Kα靶,λ=0.14506 nm,工作电压40 kV,工作电流30 mA,扫描步长0.02°);美国FEI公司FEI Tecnai G20透射电子显微镜;日本日立公司S3400⁃N扫描电子显微镜;美国Thermal Electron公司VG Multilab 2000型X射线光电子能谱仪[Mg Kα靶(1253.6 eV),采用C1s(284.6 eV)的峰值结合能为参照];Nicolet公司iS10型傅里叶变换红外光谱仪.
1.2 光电极的制备
称取0.18 g乙酰丙酮钒加入7 mL无水乙醇中,密封搅拌1 h至溶质完全溶解;将0.80 g PVP加入上述溶液中,密封搅拌4 h制得PVP/C15H21O6V溶胶,备用;将0.12 g三水合硝酸铜溶于2 mL水和3 mL乙醇的混合溶液中,密封搅拌1 h直至完全溶解,然后将其缓慢加入上述PVP/C15H21O6V溶胶中,制得黏稠的PVP/C15H21O6V/Cu(NO3)2·3H2O溶胶,将配制好的前驱体溶胶倒入带有金属针头的注射器内,接上15 kV正高压,用导电玻璃作为接收装置,接上1 kV的负高压,调整金属针头尖端与导电玻璃的距离为14 cm,调整注射器中溶液的推进速度为0.01 mL/min,进行静电纺丝.随着接收时间的延长,最终在导电玻璃上附着一层纤维毡(如图1所示).将附着有纤维的导电玻璃置于干燥箱中干燥5 h,随后置于马弗炉中煅烧,控制升温速率为2℃/min,升温至500℃并保温3 h,再自然降至室温即得到n(V)∶n(Cu)=1∶1的CuO/V2O5/FTO复合光电极,记为VC⁃1.在相同实验条件下,改变V与Cu的摩尔比,分别制备V/Cu摩尔比为4∶1,2∶1,1∶2,1∶4的复合光电极和纯V2O5光电极.

Fig.1 Schematic of the fabrication of precursor fibers by electrospinning
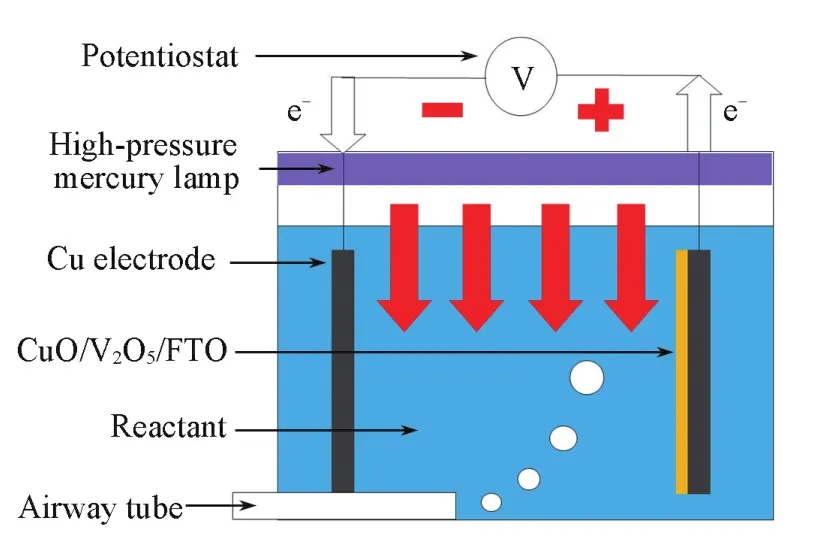
Fig.2 Schematic of photoelectrocatalytic degradation apparatus
1.3 光电催化实验
取2 mg/L的亚甲基蓝水溶液置于光电催化反应容器中(如图2所示),将附着有复合纤维的导电玻璃和同等大小的铜片固定在反应容器两侧,分别作为光阳极和光阴极,加上4 V的偏电压.反应过程中对亚甲基蓝溶液进行鼓气,通气速率为40 L/h,采用55 W的高压汞灯作为光源,在可见光下进行MB的光电催化降解实验.光电催化反应每20 min取一次样,在紫外⁃可见分光光度计上测定665 nm下的吸光度值,降解效果以脱色率D(%)表示:

式中:A0为染料溶液的初始吸光度;A为染料溶液的最终吸光度.
2 结果与讨论
2.1 热重⁃差热分析
由于不同摩尔比例的前驱体纤维组成物质相同,选取n(V)/n(Cu)=1∶1的纤维VC⁃1进行热重⁃差热分析.由图3可以看出,样品出现4个阶段的热失重.样品在0~100℃之间质量损失约16%,同时DTA曲线上出现相应的吸热峰,主要是复合纤维未完全挥发的乙醇和吸附的水吸热所致;DTA曲线在100~245℃之间有一个大的放热峰,相应的质量损失约为15%,归因于硝酸铜热分解向无机晶型转变;在245~380℃之间DTA曲线上有一个范围较宽的放热峰,对应的质量损失为28%,主要是由乙酰丙酮钒发生热分解所致;样品在380~500℃之间出现一个大的放热峰,同时伴有较大的质量损失,质量损失率达34%,主要是由有机物PVP与空气中的氧气发生反应完全分解所致;高于500℃后TG和DTA曲线趋于平衡,表明前驱体纤维完全热分解,只剩下无机组分;在650℃以后DTA曲线有一个逐渐的吸热过程,主要是由于V2O5晶体逐渐熔化形成无定形态的缘故[25].可见,控制煅烧温度为500℃时,可使复合光电极材料中的PVP完全热分解,同时保证乙酰丙酮钒和硝酸铜向V2O5和CuO转变.

Fig.3 TG⁃DTA of VC⁃1 precursor fibers
2.2 XRD分析
图4为500℃保温3 h合成的不同光电极材料的XRD谱图.经500℃煅烧的纯V2O5在2θ=20.262°,21.711°,26.126°,31.004°,32.363°,34.281°,47.321°和51.209°处的衍射峰可分别归属于钒赭石斜方V2O5(PDF#41⁃1426)的(001),(101),(110),(301),(011),(310),(600)和(020)晶面,说明乙酰丙酮钒在500℃煅烧3 h后完全转变为V2O5.不同比例的CuO/V2O5复合材料不仅出现了V2O5的特征衍射峰,而且在2θ=32.475°,35.494°,38.685°,48.658°,58.248°和68.006°处出现新的特征衍射峰,分别归属于CuO(PDF#80⁃ 1916)的(220)晶面,说明Cu(NO3)2经过500℃煅烧后向CuO转变,并且随着n(Cu)∶n(V)的增加,V2O5的特征峰强度逐渐减弱,CuO的特征峰逐渐增强,说明异质结构材料中CuO的含量逐渐增加.以上结果表明,在空气氛围下经过500℃煅烧后PVP完全分解,前驱体纤维完全向无机晶型转变,生成所需目标产物.
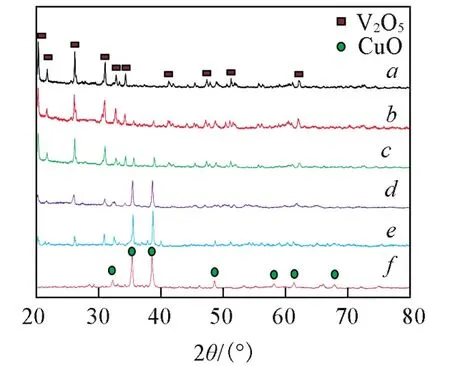
Fig.4 XRD patterns of pure V2O5and CuO/V2O5with different molar ratiosn(V)/n(Cu):a.1∶0;b.4∶1;c.2∶1;d.1∶1;e.1∶2;f.1∶4.
根据Sherrer公式计算得出样品的粒径大小.在相同热处理条件下,不同复合比例的V2O5和CuO晶粒尺寸相差不大,表明2种物质的复合对晶粒的生长影响不大,但随着两者复合比例的接近,两种物质的衍射峰有一定程度的减弱,可能与两种物质表面形成异质结构有关,这样能有效实现光生电子和空穴的分离,提高体系的量子效率,从而强化复合材料的催化性能.
2.3 微观结构分析
由图5(A)可以看出,未经过热处理的PVP/C15H21O6V/Cu(NO3)2·3H2O纤维具有良好的连续性,纤维表面光滑且粗细均匀,通过Image⁃Pro Plus软件对纤维直径进行统计,发现前驱体纤维直径大都分布在350 nm左右[图5(B)];图5(C)是经过500℃煅烧3 h后的VC⁃1纤维的SEM照片.可以看出,样品仍保持纤维形貌,纤维表面由未烧之前的光滑变得粗糙,同时出现少量的团聚现象,主要是由于纤维中有机成分的热分解和纤维在热处理过程中晶体生长造成的;纤维经过煅烧后直径明显变小,纤维直径大多分布在150~200 nm之间[图5(D)],由于样品较小的直径和粗糙的表面,使样品具有很高的比表面积,增加了样品与降解物的接触面积,有利于提高样品的催化效率.

Fig.5 SEM images(A,C)and fiber diameter distributions(B,D)of VC⁃1 precursor fibers(A,B)and VC⁃1(C,D)and TEM(E,F)images of VC⁃1
图5(E)和(F)是VC⁃1的TEM照片.可以看出,纤维状的样品是由V2O5和CuO细小颗粒堆积而成,颗粒间紧密接触,有利于p⁃n异质结的形成,可有效实现光生电子和空穴的分离.当2种物质的比例接近时,形成的异质结构增多,使光生电子和空穴的复合几率降低.
2.4 XPS分析
图6为样品的XPS全谱图和V,O及Cu的分峰拟合结果.根据峰形特点及元素结合能数据,复合体表面存在钒、铜和氧3种元素[图6(A)],与纯V2O5对比发现,VC⁃1的全谱图中有明显的铜元素的信号峰,其中少量C元素来自校正元素和有机物炭化未完全分解的产物.图6(B)为V元素的分峰拟合结果.在纯V2O5/FTO中V2p3/2的峰形对称,结合能为517.25 eV,证明V元素以V5+的形式存在[26];而VC⁃1中V2p3/2的结合能未发生明显改变,同样以V5+的形式存在,说明与CuO的复合并未对V的价态造成影响.图6(C)为VC⁃1中Cu元素的分峰拟合结果.Cu2p3/2和Cu2p1/2的结合能分别为934.2和954.0 eV,峰间距为19.8 eV,与标准CuO谱图Cu2p3/2和Cu2p1/2的峰间距(20.0 eV)相近,且存在Cu2p3/2谱线的振激峰S,说明Cu元素的价态为二价[27].从图6(D)V2O5的谱线中可以看出,V2O5/FTO表面O1s的峰相对复杂,峰较宽且不对称,经分峰拟合得最大峰值分别为530.10和531.55 eV的2个峰,说明样品表面存在2种结合态的氧,其中530.10 eV处的谱峰归属V2O5表面晶格氧的特征峰,531.55 eV处的弱峰对应于吸附水,是表面羟基化的化学吸附所致[28];而图6(D)中VC⁃1的谱线在529.60,530.40,532.00 eV处出现信号峰,表明氧元素主要以Cu—O,V—O和O—H键存在,复合纤维中晶格氧(V—O)和O—H与纯V2O5相比明显向高结合能方向移动,表明复合材料中V—O和O—H键能变大,这是由于形成Cu—O—V键导致O2-周围电子云密度增加所致,说明复合纤维不是以简单的物理形式复合,而是形成了新的化学键,形成异质结构.
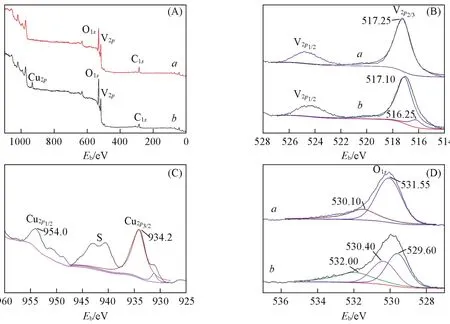
Fig.6 XPS spectra of pure V2O5(a)and VC⁃1(b)(A)Full spectrum;(B)V2p;(C)Cu2p;(D)O1s.
2.5 傅里叶变换红外光谱分析
图7为500℃保温3 h合成的纯V2O5和不同摩尔比CuO/V2O5复合材料的FTIR谱图.在纯V2O5的谱线上,600和842 cm-1处的吸收峰可归属为V—O—V键的伸缩振动峰,1020 cm-1处的吸收峰可归属为键的伸缩振动峰,表明V2O5晶体形成[29].在所有样品的谱图中,1630和3420 cm-1处均出现了吸收峰,分别为O—H键的弯曲振动峰和H2O的伸缩振动峰,是由复合材料表面存在大量活性基团强烈吸收水分子所致,高浓度的活性基团有利于光催化活性的提高.与纯V2O5对比发现,不同摩尔比的CuO/V2O5复合材料均在487 cm-1左右出现Cu—O的伸缩振动吸收峰,表明存在CuO,进一步证明CuO与V2O5复合.

Fig.7 FTIR spectra of pure V2O5(a)and CuO/V2O5(b—f)with different molar ratiosn(V)/n(Ti):b.4∶1;c.2∶1;d.1∶1;e.1∶2;f.1∶4.
2.6 光电催化活性
在MB光电催化降解之前,为了消除吸附作用对降解效率的影响,首先在没有光照的条件下,使体系达到吸附平衡.不同催化剂对MB的光电催化降解结果见图8.从图8(A)中可以看出,各催化剂均表现出一定的光电催化活性,随着催化时间的延长,对MB的光电催化降解率均有所增加,复合材料的光电催化活性均明显高于纯V2O5,随着CuO含量的增加,CuO/V2O5复合材料对MB的降解率先增加后减小,当n(Cu)/n(V)=1∶1时光电催化效率最高,为96%.从图8(B)可见,各拟合直线的相关系数都在0.99以上,可见催化剂对MB的光电催化降解符合一级动力学,从动力学常数kapp可见,与CuO的复合明显提高了材料的光电催化性能.这可能是由于当V2O5和CuO复合时,在可见光照射下V2O5和CuO表面电子同时受光激发产生光生载流子,由于在V2O5和CuO紧密接触的交界处形成异质结构,二者之间的能级差使空穴很容易从CuO价带迁移到V2O5价带,可有效抑制CuO中电子⁃空穴对的复合,提高光电催化效率;当CuO与V2O5的摩尔比相近时,可形成更多的异质结,从而具有更高的光电催化活性.
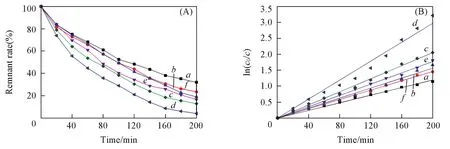
Fig.8 Effects of degradation time on MB degradation remnant rate and ln(c0/c)of different catalysta.V2O5.n(V)/n(Cu):b.4∶1;c.2∶1;d.1∶1;e.1∶2;f.1∶4.(B)a.y=0.0149x,R2=0.992;b.y=0.0088x,R2=0.999;c.y=0.0073x,R2=0.998;d.y=0.0060x,R2=0.997;e.y=0.0078x,R2=0.996;f.y=0.0103x,R2=0.999.
为了使材料具有更好的应用能力,探讨了材料的降解率与循环使用次数的变化关系.如图9所示,在相同的降解条件下,材料的降解率仅在前4次有明显变化,当循环使用4次后,降解率逐渐趋于平稳,表明CuO/V2O5/FTO光电极具有一定的重复使用性能,并且不需要经过中间处理过程就可以直接进行下一次循环使用,在环境催化领域具有很好的应用前景.

Fig.9 Recycling performance of VC⁃1
综上所述,以乙醇为溶剂,PVP为纤维骨架,乙酰基丙酮钒和三水合硝酸铜为原料,结合溶胶⁃凝胶法,采用静电纺丝技术制备了具有不同摩尔比的CuO/V2O5/FTO复合光电极材料,材料并且探讨了不同复合比例下CuO/V2O5/FTO的光电催化性能,研究发现,CuO与V2O5复合能有效构建p⁃n异质结,抑制光生电子⁃空穴对的复合,从而提高了复合光电极的催化性能;不同n(Cu)/n(V)的CuO/V2O5/FTO光电催化活性比纯V2O5/FTO均有不同程度的增强,当n(Cu)/n(V)=1∶1时,MB的降解率最高,达到96%.可见,CuO/V2O5/FTO复合光电极是一种性能优异的光电催化材料.
[1] Dai G.P.,Liu S.Q.,Liang Y.,Luo T.,Appl.Surf.Sci.,2013,264,157—161
[2] Xin Y.J.,Gao M.C.,Wang Y.C.,Ma D.,Chem.Eng.J.,2014,242,162—169
[3] Li M.,Li Y.J.,Xu P.,Lin X.,Han W.X.,Chem.J.Chinese Universities,2015,36(8),1596—1605(李铭,李佑稷,徐鹏,林晓,韩文轩.高等学校化学学报,2015,36(8),1596—1605)
[4] Dimitrijevic N.M.,Tepavcevic S.,Liu Y.,Rajh T.,Silver S.C.,Tiede D.M.,J.Phys.Chem.C,2013,117(30),15540—15544
[5] Sui Y.j.,Su C.Y.,Yang X.D.,Hu J.L.,Lin X.J.,J.Mol.Catal.A:Chem.,2015,410(2),226—234
[6] Guo H.F.,Marianna K.,Mikko H.,Markku L.,Appl.Catal.B:Environ.,2010,95(3),358—364
[7] Li S.P.,Liao J.J.,Lin S.W.,Cao Y.,Li J.B.,J.Chin.Ceram.Soc.,2011,39(6),1034—1044(李士普,廖建军,林仕伟,曹阳,李建保.硅酸盐学报,2011,39(6),1034—1044)
[8] Brezesinski K.,Ostermann R.,Hartmann P.,Perlich J.,Brezesinski T.,Chem.Mater.,2010,22,3079—3084
[9] Lu B.G.,Li X.D.,Wang T.H.,Xie E.Q.,J.Mater.A:Chem.,2013,1(12),3900—3906
[10] Liu B.X.,Wang J.S.,Li H.Y.,Wu J.S.,Li Z.F.,Chinese J.Inorg.Chem.,2012,28(3),465—470(刘柏雄,王金淑,李洪义,吴俊书,李志飞.无机化学学报,2012,28(3),465—470)
[11] Dai Y.M.,Lee W.W.,Lin W.,Chen.C.,J.Chin.Chem.Soc.,2013,60(12),1415—1424
[12] Li X.M.,Lü N.,Liang S.L.,Li X.H.,Chin.J.Lumin.,2014,35(6),695—700(李晓梅,吕娜,梁士利,李兴华.发光学报,2014,35(6),695—700)
[13] Yousef A.,Barakat A.M.,Kim H.Y.,Appl.Catal.A,2013,467,98—106
[14] Li X.,Li J.H.,Li S.J.,Fang X.,Fang F.,Chu X.Y.,Wang X.H.,Hu J.X.,Chem.Res.Chinese Universities.,2013,29(6),1032—1035
[15] Shi H.M.,Zhou M.,Song D.F.,Pan X.J.,Fu J.C.,Zhou J.Y.,Ma S.Y.,Wang T.,Ceram.Int.,2014,40(7),10383—10393
[16] Chuai H.Y.,Zhou D.F.,Zhu X.F.,Yang G.C.,Li Z.H.,Chem.J.Chinese Universities,2014,35(5),941—948(揣宏媛,周德凤,朱晓飞,杨国程,李朝辉.高等学校化学学报,2014,35(5),941—948)
[17] Wang H.Z.,Liu N.,Lu J.,Yao S.W.,Jiang S.S.,Zhang W.G.,Chem.Res.Chinese Universities.,2015,31(5),846—850
[18] Luo F.,Zhou D.F.,Yang G.C.,Liu J.W.,Li Z.H.,Meng J.,Chinese J.Inorg.Chem.,2013,29(3),500—506(罗飞,周德凤,杨国程,刘建伟,李朝辉,孟健.无机化学学报,2013,29(3),500—506)
[19] Suresh R.,Giribabu K.,Manigandan R.,Munusamy S.,Kumar S.P.,Muthamizh S.,Stephen A.,Narayanan V.,J.Alloys Compd.,2014,598,151—160
[20] Wang Y.,Zhang J.W.,Liu L.X.,Zhu C.Q.,Liu X.Q.,Su Q.,Mater.Lett.,2012,75,95—98
[21] Guo Y.,Li J.H.,Gao Z.Q.,Zhu X.,Liu Y.,Wei Z.B.,Zhao W.,Sun C.,Appl.Catal.B⁃Environ.,2016,192(5),57—71
[22] Marwa A.,Joseph P.T.,Zhang L.,Kam T.L.,Sol.Energy Mater.Sol.Cells,2016,152,87—93
[23] Liu W.M.,Chem.Res.Chinese Universities,2013,29(2),314—318
[24] Cornelia B.,Corina O.,Corina M.,Carmen L.,Paula S.,Sorin O.,Chin.J.Chem.Eng.,2014,22(1),38—42
[25] Liu H.,Wu Y.,Zhang J.,ACS Appl.Mat.Interfaces,2011,3(5),1757—1764
[26] Wang D.J.,Guo L.,Li D.S.,Fu F.,Wang W.L.,Yan H.T.,Spectrosc.Spect.Anal.,2008,28(4),788—792(王丹军,郭莉,李东升,付峰,王文亮,闫宏涛.光谱学与光谱分析,2008,28(4),788—792)
[27] Chin S.,Park E.,Kim M.,Bae G.,Jurng J.,Mater.Lett.,2012,75,57—60
[28] Su C.Y.,Shao C.L.,Liu Y.C.,J.Colloid Interface Sci.,2011,59,220—227
[29] Patil C.E.,Jadhav P.R.,Tarwal N.L.,Deshmukh H.P.,Karanjkar M.M.,Patil P.S.,Mater.Chem.Phys.,2011,126,711—716
(Ed.:S,Z,M)
†Supported by the National Natural Science Foundation of China(No.21476095)and the Program for Science and Technology Innovative Research Team in Higher Educational Institution of Hunan Province,China.
Preparation and Photoelectrocatalytic Performance of CuO/V2O5/FTO Composite Nanofibers Electrode†
LIN Xiao,LI Youji∗,LI Ming,TANG Ningmei,LI Ziqin,HAN Zhiying
(Department of Chemistry and Chemical Engineering,Jishou University,Jishou 416000,China)
CuO/V2O5/FTO composite nanofibers photoelectrode was fabricated by electrospinning method with polyvinyl pyrrolidone(PVP)as fiber skeleton,copper(Ⅱ)nitrate hydrate and vanadium(Ⅳ)⁃oxy acety⁃lacetonate as raw materials.The structure of the samples was characterized by thermogravimetry⁃differential thermal analysis(TG⁃DTA),X⁃ray diffraction(XRD),scanning electron microscopy(SEM),transmission electronic microscopy(TEM)and X⁃ray photoelectron spectroscopy(XPS).The photoelectrocatalytic perform⁃ance of the samples was analyzed by the degradation of methylene blue(MB)solution.The results show that the heterojunctions between CuO and V2O5were formed,and the separation of photogenerated electron⁃hole pairs on CuO/V2O5/FTO was promoted,which made the degradation rate of MB catalyzed by CuO/V2O5/FTO much higher than that catalyzed by pure V2O5/FTO.The different molar ratios of n(Cu)/n(V)had influence on photoelectrocatalytic activity,and the CuO/V2O5/FTO with n(Cu)/n(V)=1∶1 had the highest catalytic activity(degradation rate of MB was 96%).
Electrospinning;CuO/V2O5/FTO;Composite Nanofibers;Photoelectrocatalysis
O643
A
10.7503/cjcu20160428
2016⁃06⁃13.网络出版日期:2016⁃11⁃18.
国家自然科学基金(批准号:21476095)和湖南省高校科技创新团队支持计划项目资助.
联系人简介:李佑稷,男,博士,教授,主要从事纳米材料合成与应用研究.E⁃mail:bcclyj@163.com
