氧化锌纳米棒光电极对核黄素的光致电化学响应及应用
2016-12-14何艳艳葛军营赵常志
何艳艳,葛军营,2,赵常志
(1.生化分析山东省重点实验室,青岛科技大学化学与分子工程学院,青岛266042;2.潍坊工程职业学院应用化学与生物工程学院,青州262500)
氧化锌纳米棒光电极对核黄素的光致电化学响应及应用
何艳艳1,葛军营1,2,赵常志1
(1.生化分析山东省重点实验室,青岛科技大学化学与分子工程学院,青岛266042;2.潍坊工程职业学院应用化学与生物工程学院,青州262500)
基于核黄素在第二工作电极上的预还原,将还原型核黄素作为电子给体纳入氧化锌纳米棒光电极的光致电化学反应过程,构建了一种新的光致电化学反应系统.优化了电化学制备氧化锌纳米棒光电极的方法,研究了核黄素与氧化锌纳米棒光电极的光致电化学反应机理,建立了一种测定核黄素的光致电化学分析法.在pH=6.5的缓冲溶液中,以玻碳电极为预还原电极,在峰值波长为365 nm、能量为450 μW/cm2的光照下,在偏压0.1 V处测得的光电流与1.00×10-5~1.00 μmol/L核黄素浓度的对数值成正比,检出限为6.0×10-7μmol/L(S/N=3),灵敏度为195.6 nA/lg[c(μmol/L)].对实际样品测定的相对标准偏差小于6.25%,回收率为99.0%~104%,常见生化物质对核黄素光电流的响应无干扰.
核黄素;氧化锌纳米棒;光致电化学分析法;四电极电化学系统
近年来,伴随着纳米材料发展的日新月异,借助于纳米界面光电极的光致电化学(PEC)分析法获得了长足的发展[1],并在蛋白质[2]、免疫[3]和DNA[4]分析中得到广泛应用.然而,相对于众多可作为光敏后电子受体的纳米材料,作为底物的电子给体仅有抗坏血酸、多巴胺和过氧化氢等少数化合物,导致电子受体和电子给体组成的PEC体系不多,制约了PEC分析法的发展[5].黄素辅酶包括黄素单核苷酸(FMN)和黄素腺嘌呤二核苷酸(FAD),是黄素蛋白(主要为氧化还原酶)的辅基,它可以接受2个氢而还原为FMNH2或FADH2,参与体内多种氧化还原反应[6].黄素辅酶中的FMN是呼吸链的重要氢和电子传递体,FAD主要参与有机物如脂肪酸等的氧化脱氢.FADH2可将氢通过呼吸链传递至氧生成水,释放能量用于三磷酸腺苷(ATP)的合成;也可将氢直接传递给氧而生成H2O2[7].FMN和FAD的前体是核黄素(Riboflavin,RF),它通常由微生物和高等植物合成,动物从食物中摄取RF后,在体内磷酸化成为FMN和FAD,再构成多种酶参与氧化还原反应,促进糖、氨基酸、脂和蛋白质的代谢[8].因而,采用核黄素作为电子给体,构建一种新的PEC反应系统,创建PEC分析的反应平台,具有重要意义.
纳米ZnO的导带能级结构与TiO2十分相似,带隙相同,但ZnO的电荷传输性能是TiO2的几十倍,用ZnO纳米材料制备的光电极更有利于注入电子到半导体的导带,从而提高光电转换效率[9,10].ZnO纳米结构有纳米棒、纳米线、纳米阵列、纳米管、空心纳米微球和反蛋白石光子晶体(IOPCs)等多种.同ZnO纳米粒子相比,ZnO纳米棒(ZnONRs)因其制备成本低、无毒、电子通路大、表面积大和电子迁移率高等属性,更适合构建电化学生物传感器[10~13].
本文利用四电极双通道电化学系统,在电化学还原RF后,使其与光激发下的氧化锌纳米棒光电极(ZnONRP)发生PEC反应,构建了一种纳米界面光电极与RF的PEC反应通道,并通过测量光电流实现了对RF的直接检测.
1 实验部分
1.1 仪器与试剂
MPI⁃EO型光致电化学分析仪(西安瑞迈分析仪器有限公司);配有双工作电极光电化学池的PEAC200A型光电化学反应仪(天津艾达科技恒晟科技发展有限公司);F⁃4600型荧光分光光度计(日本Hitachi公司);JSM⁃2100F型透射电子显微镜和JSM 7500型场发射扫描电子显微镜(日本电子公司);CHI832B型双通道电化学工作站(上海辰华仪器有限公司);以ITO导电玻璃片(5.0 cm×0.8 cm,15 Ω/cm2,深圳华南湘城科技有限公司)为基底制备的ZnONRP为工作电极,玻碳电极(GCE,直径3.0 mm)作为第二工作电极(还原电极),Ag/AgCl电极为参比电极,铂丝为对电极组成四电极工作系统.核黄素(RF,纯度>98.5%)购于上海化学试剂有限公司;其它试剂纯度均高于分析纯;实验用水为超纯水(电阻率>18 MΩ·cm).
1.2 ZnONRP的制备
依次用乙醇、丙酮和水超声清洗ITO导电玻璃片5 min,干燥后在其一端留出1.0 cm的一段作为电极端子,在另一端表面留出直径为5.0 mm的空白作为ITO电极的工作面,其它部分用绝缘漆封住.将100 mL由4.5 mmol/L的Zn(NO3)2和稀HNO3组成的电解液倒入电解池中,再将电解池置于水浴锅中恒温至80℃,以ITO电极为工作电极,以Pt板作为对极,以Pt丝为伪参比电极,控制电解电位为-1.40 V,恒电位电解50 min后,用水洗掉表面吸附的杂质,干燥后即制得ZnONRP.
1.3 实验方法
将测试溶液置于光电化学反应仪的光电化学池中,插入ZnONRP并使其对准光电化学池的光窗,插入GCE至光电化学池的侧面电极孔中并使其距ZnONRP工作面为1.0 mm,分别连接四电极至电化学工作站.由光致电化学分析仪施加连续激发光扫描或由光电化学反应仪的LED施加紫外光(365 nm)作为激发光,设置激发光强度为450 μW/cm2,偏压为0.10 V;同时控制GCE的还原电位为-0.40 V.先启动电流检测(预还原同时自动启动),待电流趋于平稳后,开启光闸,记录ZnONRP的光电流⁃时间曲线.
2 结果与讨论
2.1 ZnONRP制备条件的优化和表征

Fig.1 SEM image of the cross⁃section of ZnONRPInset is the surface photography of ZnONRP.

Fig.2 SEM image of the cross⁃section of ITO electrode
ZnO纳米材料的制备方法较多,由不同的方法制得的纳米ZnO的结构和性能各异.与其它方法相比,电化学沉积法具有膜厚和形貌可控、速度快、成本低、环保且易于实现实验室向规模化生产的转变等优点[14].通过电极反应使ZnO沉积在ITO电极上形成ZnONRs层,ZnO的沉积量会显著影响ZnONRP的性能.电沉积ZnO的量太少,光电化学反应弱,灵敏度低,稳定性也较差;而沉积量过多,ZnONRs膜过厚,传质阻力增大,响应迟钝,灵敏度不增反降[15].由于ZnONRs层的厚度与Zn(NO3)2的初始浓度、沉积电位和时间密切相关,实验中通过在100 mL电解液中调节Zn(NO3)2的浓度范围为2.0~5.0 mmol/L,沉积电位和时间分别在-1.2~-1.5 V和1500~4000 s,考察了它们对ZnONRE性能的影响,发现Zn(NO3)2的初始浓度为4.5 mmol/L,沉积电位控制在-1.40 V,沉积时间为3000 s时,制得的ZnONRP的光电流响应最明显,且重现性较好.在ZnONRP表面有乳白色膜生成(图1插图),对比ZnONRP(图1)和ITO电极(图2)断面的扫描电子显微镜照片可见ZnO纳米棒的宽度约为120 nm、长度约为530 nm,呈棒状堆积在ITO电极表面.ZnONRP表面的XRD谱图(图3)中34.50°处的衍射峰为ZnO的(002)主峰,非常接近于ZnO六边纤锌矿结构(34.421°)[11].另外,谱图中还存在强度低于(002)晶面强度的(100),(101)和(103)3个晶面的纳米ZnO衍射峰,表明ZnONRs已沉积在ITO电极的表面.

Fig.3 XRD pattern of ZnONRP surface
2.2 预还原引导RF在ZnONRP上的光致电化学反应
从分子结构上看,RF分子中存在共轭双键,具有刚性的平面构造和发生氧化还原反应的位点,具有良好的光化学和电化学活性.然而,由于RF的氧化电位远低于氧的还原电位,所以通常水溶液中的RF处于氧化态.图4示出了RF在原始状态(曲线a)和还原后(曲线b)在玻碳电极上的循环伏安曲线,可见初始状态的RF仅出现还原峰(曲线a,约-0.42 V);在经过电化学还原后,才出现氧化峰(图4曲线b).处于氧化状态的RF在波长520 nm处有较强的荧光;在还原态时,RF异咯嗪环上的N5吸收质子成为季胺,进一步吸收1个电子和1个质子,成为二氢化物(RFH2)后,原有的荧光会消失[16].RF溶液的荧光光谱(图5)显示,经电化学还原一段时间后,RF的荧光强度(图5谱线b)比其原始状态(图5谱线a)明显减小;将还原后的RF置于空气中,会被氧化而失去电子,其荧光强度得以恢复,表明RF的还原态RFH2通常很难存在于水溶液中.因此,只有使用ZnONRP附近的第二工作电极GCE,先还原RF分子,使其成为电子供体,才有可能被光激发的纳米ZnO氧化而发生PEC反应.
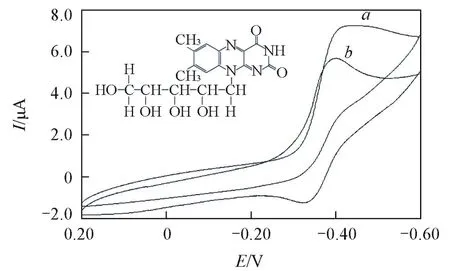
Fig.4 Cyclic voltammograms of RF solution(1.00×10-4mol/L)before(a)and after electrochemical reduction(b)Inset is the structural formula of RF.

Fig.5 Fluorescence spectra of RF solution(1.00×10-6mol/L)before(a)and after electrochemical reduction(b)
纳米ZnO作为一种重要的氧化物半导体材料,在室温下禁带宽度为3.37 eV,激子结合能高达60 MeV.在365 nm的光照下,ZnONRs价带的电子会被激发至导带,同时留下带正电的空穴[10];当其导带上的电子转移到电极上时,经GCE还原RF产生的RFH2的电子会立即注入ZnONRs价带上的空穴而被氧化,产生阳极光电流[图6(A)].继而RF不断被GCE还原,持续生成电子供体RFH2,使得PEC反应不间断.相对于纳米ZnO电子⁃空穴对复合的光电流[图6(B)谱线a]和未经过GCE还原的RF[图6(B)谱线b],经GCE还原的RF产生了1个明显增强、连续且稳定的光电流[图6(B)谱线c].通过测量光电流的强度即可实现对RF的直接检测.
2.3 实验条件的优化
2.3.1 电解液pH值对光电流响应的影响 RF是有机碱,它的还原和氧化涉及到质子的得失,电解液的pH值会影响光电化学反应.由于光电流响应关联到基质的还原和氧化2个因素,所以基于实验结果确定电解液的pH值是比较科学的选择.在pH=5.5~8.0的范围调节电解液的pH值,发现随着磷酸盐缓冲溶液pH值的增大,光电流随之增大;但当pH>6.5后,光电流逐渐降低;最后确定在pH=6.5的电解液中可获得最大的光电流响应.

Fig.6 Photoelectrochemical response mechanism of RF on ZnONRP(A)and photocurrent responses(B)of blank solution(a),the unreduced RF(b)and reduced RF(c)on ZnONRP
2.3.2 偏压对光电流响应的影响 纳米ZnO是一种具有光电活性的无机材料,施加在ZnONRP上的电极电位会影响纳米ZnO的电子状态,因而偏压是与光电流响应相关的重要因素.考虑到体系中存在诸多电活性物质以及过电位的影响,实验中采用逐次调大偏压的方法来获得合适的偏压.固定其它实验条件不变,当从-0.20到0.20 V每隔0.05 V顺次调高偏压时,观察到光电流随之增大.当设定的偏压大于0.10 V时,光电流强度不再明显增大.因此,实验中将偏压设定在0.10 V.
2.3.3 还原电位对光电流响应的影响 由图4(A)可知,RF需经ZnONRP附近的第二工作电极GCE还原成RFH2,才能被纳米ZnO价带上的空穴氧化,从而产生阳极光电流.图2显示,水溶液中RF的还原峰约为-0.42 V.固定其它实验条件不变,当从-0.30到-0.50 V每隔0.05 V顺次调低电位时,观察到光电流随之增大.当设定的还原电位介于-0.40和-0.45 V之间时,光电流强度不再明显增大.因此,实验中将还原电位固定在-0.40 V.
2.4 ZnONRP对核黄素的光电流响应
基于光作用下的电化学过程而发展起来的PEC分析法一般通过检测光电流定量基质的浓度.在优化的测试条件下,测得ZnONRP对RF的光电流响应如图7所示.随着基质浓度的增加,光电流随之增大,在RF的浓度为0.10 μmol/L处出现拐点,然后逐渐放缓,呈对数增加的态势.经过对基质浓度作对数变换,在1.00×10-5~1.00 μmol/L的浓度范围内,光电流强度与RF浓度的对数值成正比,与相关系数R2=0.996,检出限为6.00×10-7(S/N=3),灵敏度为195.6 nA/lg[c(μmol/L)].与毛细管电泳[17]、液相色谱[18]、荧光[19]和电化学分析技术[20]相比,PEC分析法具有响应范围宽、灵敏度高、成本较低和操作简便的优点.
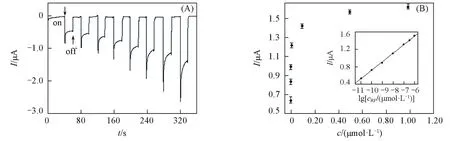
Fig.7 Photocurrent responses to various concentration of RFs(A)and response curve(B)(A)From left to right,cRF/(μmol·L-1):0,1.00×10-5,1.00×10-4,1.00×10-3,1.00×10-2,0.10,0.50,1.00.(B)Inset is the calibration curve on the photocurrent responses to concentration logarithm.
2.5 生化物质对光电流响应的影响
在最佳实验条件下,以测量误差在5%以内为标准,考察了一些生化物质对RF光电流响应的影响.分别将5.00 μmol/L的葡萄糖、抗坏血酸、柠檬酸、多巴胺,维生素A,B1,B6,B12和E加入到电解液中,按实验方法测定,未观察到相应的光电化学响应.再分别将0.50 μmol/L的各种维生素或化合物加入到含有1.00×10-2μmol/L RF的试液中,按实验方法测定,基质的光电化学响应没有超过2.5%的变化,说明本方法对RF有很好的选择性.另外,还考察了非电活性蛋白质可能产生的影响.经在1.00×10-2μmol/L的RF溶液中添加5.0 μg/mL牛血清白蛋白的实验,按95%可信度计算,干扰值<1.95S.
2.6 ZnONRP的重现性和稳定性
在测试过程中,第二工作电极GCE在还原RF时可能产生钝化,从而影响测定的重现性和稳定性.图8示出了连续10次测定同一浓度RF的同时双电流响应实验结果,可见GCE上RF的还原电流无明显波动,ZnONRP的光电流信号稳定性良好.

Fig.8 Reduction current curve of RF at GCE(a)and photocurrent response curve of RF at ZnONRP(b)
重复测定1.00×10-2μmol/L RF的实验结果显示,同一支ZnONRP测定7次的相对标准偏差(RSD)<3.56%,连续重复测定20次的RSD<3.82%;按相同方法制备的5支工作电极测定相同浓度RF的RSD<4.65%.ZnONRP在干燥避光环境下保存10 d后,对同浓度基质的光电流强度仅比初次测量减少了4%,保存30 d后光电流响应仍能保留在93%.虽然湿润避光保存的效果稍差,但保存30 d后光电流响应仍然不低于初次测量的90%.ZnONRP的良好稳定性显示出采用电化学方法在ITO电极表面制备ZnO NRs的优点.
2.7 电极的分析应用
将3种市售小米分别在研钵中碾碎至粉末状,称取样品粉末100.0 mg溶解于100 mL稀NaOH溶液中,充分搅拌,于暗处静置24 h.抽滤,所得滤液配成100 mL试液,经适当稀释和调节pH值后,测定试液中RF的量,同时进行了加标回收实验和荧光分析法的对比分析.结果(表1)显示,相对标准偏差<6.25%,回收率为99.0%~104%.

Table 1 Determination results of the riboflavin in millet
3 结 论
采用四电极双通道电化学系统,先将氧化态的RF还原为电子供体RFH2,继而使其与ZnONRP发生PEC反应,建立了以RF为电子供体,ZnONRP为电子受体的PEC反应平台.优化了实验条件,测定了RF的响应范围和灵敏度,建立了一种新的RF分析法.与其它方法相比,本文方法具有修饰电极制备简单、可控、操作简便、检测范围宽和灵敏度高的特点.若将其应用于黄素辅酶相关蛋白质的检测,会进一步拓展光致电化学分析法在生化领域的应用.另外,由于不是所有的小分子都在电极上有还原性,并且它们的还原电位也不同,采用双电极系统可将无法作为电子给体的物质转变为电子给体,这就为与具有光敏和电子受体功能的光电极组成PEC系统以开展下一步研究和进一步提高PEC方法的选择性提供了可能.
[1] Zhang X.,Guo Y.,Liu M.,Zhang S.,RSC Adv.,2013,9,2846—2857
[2] Zhao C.Z.,Yu J.,Zhao G.S.,Jiao K.,Scientic Sinica Chim.,2011,41,1075—1080(赵常志,俞佳,赵改爽,焦奎.中国科学:化学,2011,41,1075—1080)
[3] Xu R.,Jiang Y.,Xia L.,Zhang T.,Xu L.,Zhang S.,Liu D.,Song H.,Biosens.Bioelectronics,2015,74,411—417
[4] Wang G.L.,Shu J.X.,Dong Y.M.,Wu X.M.,Zhao W.W.,Xu J.J.,Chen H.Y.,Anal.Chem.,2015,87,2892—2900
[5] Zhang Z.,Zhao C.,Chinese J.Anal.Chem.,2013,41(3),436—444(张光霞,赵常志.分析化学,2013,41(3),436—444)
[6] Abbas C.A.,Sibirny A.A.,Microbiology and Molecular Biology Reviews,2011,75,321—360
[7] Lienhart W.D.,Gudipati V.,Macheroux P.,Archives of Biochemistry and Biophysics,2013,535,150—162
[8] Barile M.,Giancaspero T.A.,Brizio C.,Panebianco C.,Indiveri C.,Galluccio M.,Vergani L.,Eberini I.,Gianazza E.,Current Phar⁃maceutical Design,2013,19,2649—2675
[9] Wen Q.X.,Dong L.,Sun X.Y.,Zhuang J.,Chen Z.M.,Chem.Res.Chinese Universities,2016,32(3),437—442
[10] Arya S.K.,Saha S.,Ramirez⁃Vick J.E.,Gupta V.,Bhansali S.,Singh S.P.,Anal.Chim.Acta,2012,737,1—21
[11] Zhai Y.,Zhai S.,Chen G.,Zhang K.,Yue Q.,Wang L.,Liu J.,Jia J.,J.Electroanal.Chem.,2011,656,198—205
[12] Lee C.T.,Chiu Y.S.,Ho S.C.,Lee Y.J.,Sensors,2011,11,4648—4655
[13] Kang Z.,Gu Y.,Yan X.,Bai Z.,Liu Y.,Biosens.Bioelectronics,2015,64,499—504
[14] Weng J.,Zhang Y.,Han G.,Zhang Y.,Xu J.,Huang X.,Chen K.,Thin Solid Films,2005,478,25—29
[15] Hambali N.A.,Yahaya H.,Mahmood M.R.,Terasako T.,Hashim A.M.,Nanoscale Res.Lett.,2014,9,609—616
[16] Zhou T.Y.,Yu J.S.,Chem.J.Chinese Universities,1998,19(2),204—206(周桃玉,于俊生.高等学校化学学报,1998,19(2),204—206)
[17] Pérez⁃Ruiz T.,Martínez⁃Lozano C.,Sanz A.,Bravo E.,Electrophoresis,2001,22,1170—1174
[18] Andrés⁃Lacueva C.,Mattivi F.,Tonon D.,J.Chromatogr.A,1998,823,355—363
[19] Kang C.,Wu H.L.,Zhou C.,Xiang S.X.,Zhang X.H.,Yu Y.J.,Yu R Q.,Anal.Chim.Acta,2016,910,36—44
[20] Kumar D.R.,Manoj D.,Santhanalakshmi J.,Anal.Methods,2014,6,1011—1020
†Support by the National Natural Science Foundation of China(No.21475072),the Open⁃end Fund of Key Laboratory of Sensor Analysis of Tumor Marker of Ministry of Education,China(No.SATM201503)and the Open⁃end Fund of State Key Laboratory of Electroanalytical Chemistry,China(No.SKLEAC201106).
Photoelectrochemical Response and Application of ZnO Nanorods Photoelectrode to Riboflavin†
HE Yanyan1,GE Junying1,2,ZHAO Changzhi1∗
(1.Shandong Provincial Key Laboratory of Biochemical Analysis,College of Chemistry&Molecular Engineering,Qingdao University of Science&Technology,Qingdao 266042,China;2.Institute of Applied Chemistry&Biological Engineering,Weifang Engineering Vocational College,Qingzhou 262500,China)
In this work,based on the pre⁃reduction of riboflavin(RF)on the second working electrode,a new photoelectrochemical(PEC)system was fabricated by the reduced RF as an electron donor incorporated into PEC reaction process of zinc oxide nanorods photoelectrode(ZnONRP).After optimizing the electro⁃chemical preparation for ZnONRP and studying the reaction mechanism of RF with ZnONRP,a PEC method for the determination of RF was developed.Under the optimized conditions of pH=6.5,-0.40 V as pre⁃reduction potential,illumination at 365 nm and light energy of 450 μW/cm2,the photocurrent at bias voltage 0.1 V is proportional to the logarithm of RF concentration in the range of 1.00×10-5—1.00 μmol/L with sen⁃sitivity of 195.6 nA/lg[c(μmol/L)],and the detection limit was estimated to be 6.00×10-7μmol/L(S/N=3).Determination results for real samples showed that the relative standard deviation is less than 6.25%and the recovery rate is 99.0%—104%.Compared with other methods for the determination of RF,the proposed method has various advantages,such as wide measurement range,high sensitivity,simple equipment and con⁃venient operation.And common biochemical substances were not interfering with the photocurrent response of RF.
Riboflavin;ZnO nanorods;Photoelectronchemical analysis;Four⁃electrode electrochemical system(Ed.:N,K)
O657.1
A
10.7503/cjcu20160522
2016⁃07⁃19.网络出版日期:2016⁃11⁃15.
国家自然科学基金(批准号:21475072)、肿瘤标志物传感分析教育部重点实验室开放基金(批准号:SATM201503)和电分析化学国家重点实验室开放基金(批准号:SKLEAC201106)资助.
联系人简介:赵常志,男,博士,教授,主要从事光电化学和电分析化学方面的研究.E⁃mail:zhaocz@qust.edu.cn
