抗坏血酸还原法制备金纳米花的机理
2016-12-14纪小会杨文胜
杨 爽,纪小会,杨文胜
(吉林大学化学学院,表面与界面化学省重点实验室,长春130012)
抗坏血酸还原法制备金纳米花的机理
杨爽,纪小会,杨文胜
(吉林大学化学学院,表面与界面化学省重点实验室,长春130012)
研究了以抗坏血酸和氯金酸为生长溶液制备金纳米花的反应机理.结果表明,通过改变生长溶液中抗坏血酸浓度可以调节小尺寸的初级金粒子在种子表面的聚集方式及金纳米花的熟化速度,从而影响金纳米花的形貌和光学性质.协同改变抗坏血酸浓度和pH值,可实现对金纳米花形貌及光学性质的有效调控.表面增强拉曼散射(SERS)性能评价结果表明,抗坏血酸还原法制备的金纳米花表面较清洁,对罗丹明6G有较好的拉曼增强效果.
金纳米花;抗坏血酸;粒子内熟化;聚集;种子法
金纳米粒子因其独特的光、电、磁学性质而受到广泛关注[1~5].其中,金纳米花独特的等离子体光学特性使其在表面增强拉曼散射(SERS)[6~10]、生物标记和生物成像[12~14]、光热治疗[15~18]及催化[19~23]等领域具有广阔的应用前景.种子法是制备高质量金纳米花的有效方法,通常采用强配体作为模板剂,诱导生长溶液中还原的单体沿特定晶面在种子上沉积生长得到金纳米花[24~29],也可利用强还原剂使生长溶液中的单体快速还原成大量小尺寸金粒子,并在种子表面聚集形成金纳米花[6,30~33].
抗坏血酸(AA)因其绿色环保特性和良好的生物相容性而被认为是一种理想的还原剂.利用AA作为还原剂采用种子法合成金纳米花,通常需要引入十二烷基三甲基溴化铵(CTAB)、聚乙烯吡咯烷酮(PVP)等表面活性剂作为配体诱导金纳米花的生成[27,34,35].这些表面活性剂在金纳米花表面吸附能力较强,不利于金纳米花的后续表面修饰及在SERS和催化反应中的应用[33,36,37].Burt等[32]尝试了在不引入表面活性剂的条件下,以AA与氯金酸混合物为生长溶液制备了金纳米花,并对金纳米花的晶格结构进行了分析.然而,利用AA还原法目前还无法实现对金纳米花形貌及光学性质的有效调控.
本文对AA还原法的机理进行了研究,发现通过改变生长溶液中的AA浓度,可以调控小尺寸金粒子在种子表面的聚集方式及金纳米花的熟化速度,从而影响金纳米花的形貌和光学性质.通过改变AA浓度和生长溶液的pH值,可以实现金纳米花的等离子体吸收在546~660 nm范围内的可调性. SERS性能评价结果表明,抗坏血酸还原法制备的金纳米花的表面更“清洁”,对罗丹明6G探针分子具有较好的拉曼增强效果.
1 实验部分
1.1 试剂与仪器
氯金酸(HAuCl4·4H2O)和十六烷基三甲基溴化铵(CTAB)购于国药集团化学试剂有限公司;抗坏血酸(AA)购于阿法埃莎化学有限公司;柠檬酸钠(Na3Cit)、氢氧化钠(NaOH)、罗丹明6G(R6G)和聚乙烯吡咯烷酮(PVP)购于Sigma⁃Aldrich公司;以上试剂均为分析纯.实验用水为自制高纯水,电阻率为18.3 MΩ·cm.
Shimadzu UV⁃1800型紫外光谱仪(日本岛津公司);HR4000⁃UV⁃NIR型高分辨光谱仪(美国海洋光学公司);JEM⁃2010型透射电子显微镜(TEM,日本JEOL公司);MiniRam型拉曼光谱仪(上海BWTEK公司),激发波长785 nm,功率100 mW,积分时间为60 s;NanoBrook 90Plus Zeta电位仪(美国Brookhaven公司).
1.2 实验过程
1.2.1 球形金种子的制备 参照文献[38]方法制备球形金种子.将100 mL 0.25 mmol/L的HAuCl4水溶液加入250 mL圆底烧瓶中,搅拌下加热至沸腾后,加入5%(质量分数)的柠檬酸钠水溶液1 mL,待溶液变成酒红色5 min后停止加热,得到球形金纳米粒子,其尺寸约为25 nm.将上述溶液在10000 r/min转速下离心15 min,移除上层清液后,将沉淀分散到与原溶液相同体积的超纯水中,再次以相同条件离心移除上层清液,将沉淀分散到原溶液10倍体积的超纯水中储存备用.
1.2.2 金纳米花的制备 在室温和搅拌下,向2 mL金种子储备液中分别加入7.5,12.5,17.5,25.0和50.0 μL AA水溶液(0.2 mol/L),然后加入58.0 μL HAuCl4溶液(终浓度为0.25 mmol/L),溶液颜色在5 s之内迅速地由浅粉色变为紫红色至蓝紫色.
向2 mL金种子储备液中加入17.5 μL AA水溶液(0.2 mol/L),并用NaOH(0.1 mol/L)将溶液pH值分别调节至3.1,4.0,5.1,6.0和7.0.在室温及搅拌下,向上述溶液中加入58.0 μL HAuCl4溶液(终浓度0.25 mmol/L,pH值已分别调至3.1,4.0,5.1,6.0和7.0),溶液颜色在5 s之内迅速地由浅粉色变为蓝紫色至蓝绿色.
1.2.3 SERS样品的制备 将上述得到的1 mL金纳米花溶液在6000 r/min转速下离心5 min,移除上层清液,将沉淀重新分散到1 mL超纯水中,取100 μL分散后的溶液与11.5 μL罗丹明6G乙醇溶液(10-3mol/L)混合,于4℃下静置12 h后进行SERS测试.
将1 mL金纳米花溶液(λmax=660 nm)在6000 r/min转速下离心5 min,移除上层清液,将沉淀分别分散到1 mL浓度为2.5 mmol/L的AA溶液、Na3Cit溶液、CTAB以及PVP溶液中,并用NaOH(0.1 mol/L)将混合溶液的pH值调节至6.8,于4℃下静置12 h;再次以6000 r/min转速离心5 min,将沉淀分散到1 mL超纯水中.取100 μL分散后的溶液与11.5 μL罗丹明6G溶液(10-3mol/L)混合,于4℃下静置12 h后进行SERS测试.
2 结果与讨论
2.1 AA浓度对金纳米花形貌及光学性质的调控
在所有反应中固定生长溶液中的HAuCl4浓度为0.25 mmol/L([Au3+]∶[Au0]=10∶1),当AA浓度为0,0.75,1.25,1.75,2.50和5.00 mmol/L时,AA与HAuCl4的摩尔比分别为0∶1,3∶1,5∶1,7∶1,10∶1和20∶1(AA与HAuCl4反应计量比为1.5∶1).如图1(A)所示,当AA浓度为0时,金种子的等离子吸收峰位置(520 nm)保持不变;当AA浓度增加至0.75,1.25和1.75 mmol/L时,粒子的吸收峰红移至545,550和570 nm,表明球形金种子逐渐衍变为金纳米花,且其枝长逐渐增加[28];当AA浓度继续增加至2.50和5.00 mmol/L时,金纳米花的吸收峰反而从570 nm蓝移至566 nm.透射电子显微镜(TEM)结果[图1(B)~(F)]进一步证实当AA浓度为0时,种子形貌不发生变化,而AA浓度从0.75 mmol/L增加至1.75 mmol/L时,金纳米花枝长逐渐变长,粒子表面变得更粗糙.而当AA浓度进一步增大时,金纳米花枝长反而略有变短.
2.2 生长溶液中AA的作用
为进一步理解AA对金纳米花生长过程的影响,对AA浓度为0.75和1.75 mmmol/L时的反应过程进行了吸收光谱监测.图2(A)给出了AA浓度为0.75和1.75 mmol/L条件下光谱最大吸收值随反应时间的变化曲线.可见在2个AA浓度下,2条曲线近乎重合,均在约4 s时达到最大值,表明AA还原HAuCl4是一个快速过程,不同AA浓度下金纳米花的形貌变化不是由HAuCl4还原速度差异导致的[39].图2(B)给出了等离子体吸收峰位置随反应时间的变化曲线.不同AA浓度下峰位均存在先红移后蓝移的现象,表明金纳米花发生了粒子内熟化[30].当AA浓度为0.75 mmol/L时,峰位在反应4 s后开始蓝移,与图2(A)中吸收值达到最大的时间点相同;而当AA浓度为1.75 mmol/L时,峰位在3 s时就开始发生蓝移,表明虽然较高的AA浓度有利于金纳米花枝长的增加,但金纳米花会提前发生熟化,从而在一定程度上抵消了浓度增加的效应.
上述研究结果表明,在强还原剂存在的条件下,生长溶液中HAuCl4被快速还原生成大量小尺寸金粒子,在无模板剂存在的条件下倾向于以随机附着(Random attachment)的方式在种子表面聚集形成金纳米花.图1(F)为合成的金纳米花花枝的高分辨电镜照片.晶格间距为0.236和0.204 nm的晶面分别对应于面心立方金纳米晶的(200)和(111)晶面,2种晶面在同一花枝中交叠存在,表明花枝部分具有多重孪晶结构,证实了金纳米花枝状部分是通过小粒子聚集形成的[30,33].在上述反应机制下,粒子内熟化会在很大程度上对金纳米花的生长产生不利影响.增加氯离子浓度及降低反应体系pH均会对金纳米花的熟化起到促进作用[30].在上述反应体系中,HAuCl4的浓度是固定不变的,因此可以推断由于AA加入量变化导致的体系pH值变化是影响金纳米花熟化的主要因素.由于反应过程很快(反应时间小于5 s),难以对反应过程中pH变化进行监测,因此本文仅对反应后的pH值进行比较分析.如图3(A)所示,当AA浓度从0.75 mmol/L增加到1.75 mmol/L时,体系的pH值从3.4降低到3.1(AA浓度为0时体系pH为6.8).由此可以推断,当AA浓度高于1.75 mmol/L时,由于体系pH值较低,金纳米花更容易发生熟化.

Fig.1 UV⁃Vis spectra(A)and corresponding TEM images(B—F)of gold nanoparticles obtained under different concentrations of AAConcentration of AA/(mmol·L-1):(A)a.0;b.0.75;c.1.25;d.1.75;e.2.50;f.5.00.(B)0;(C)0.75;(D)1.25;(E)1.75;(F)5.00.Inset of(F):high⁃resolution TEM images of a branch of the gold nanoflowers.All the data were collected after 10 s of the reactions when color of the solutions kept unchanged.
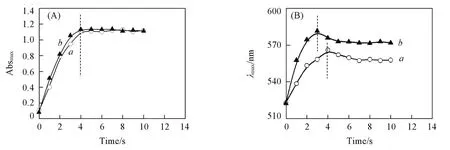
Fig.2 Temporal evolution of the maximum extinction(A)and position of the plasmon bands(B)in UV⁃Vis spectra under AA concentrations of 0.75 mmol/L(a)and 1.75 mmol/L(b)
为了进一步理解AA在金纳米花生长中的作用,将AA浓度为0.75和1.75 mmol/L的2个反应的起始pH值均升高到5.1.图3(B)和(C)分别给出了光谱监测过程中最大吸收值和等离子体峰位置的变化.可以看出2个反应过程吸收峰值达到最大的时间仍基本相同(t=4 s),而其峰位变化曲线则呈现出显著差异.当AA浓度为1.75 mmol/L时,峰位从520 nm迅速红移至630 nm且不再发生蓝移,表明此时由于pH值的升高,金纳米花的熟化得到了有效抑制;而当AA浓度为0.75 mmol/L时,其变化过程与未调节pH时的基本相同[图2(B)],表明此时pH值的升高对金纳米花生长无明显影响.为了理解这一过程,研究了pH=5.1条件下AA浓度对金纳米粒子表面电荷的影响[图3(D)].结果表明,当AA浓度从0增加到1.75 mmol/L时,粒子表面电荷逐渐减少,进一步增加AA浓度时,粒子表面电荷基本上不发生变化.由此可以理解,当AA浓度为1.75 mmol/L时,由于金粒子稳定性较差,生长溶液中小尺寸金粒子之间容易发生聚集,从而导致金纳米花表面变得更粗糙;当AA浓度为0.75 mmol/L时,金粒子稳定性较好,小尺寸金粒子更倾向于均匀地附着在种子表面从而使生成的金纳米花表面粗糙程度降低[40].同时,由于AA内部C3位上的烯二醇结构(pKa1=4.2)可以发生去质子化,因此反应体系pH值的升高有利于AA通过基团吸附到金粒子表面[41],从而降低了金纳米粒子表面电荷,促进金纳米花的形成.
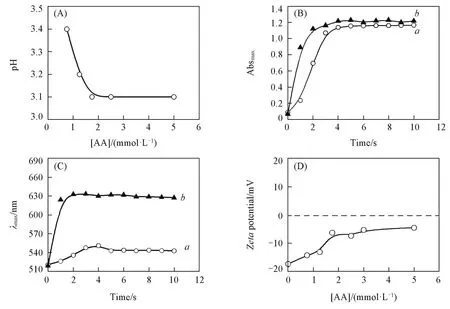
Fig.3 Variation in pH values of the reaction solutions with AA concentrations(A),temporal evolution of the maximum extinction(B)and position of the plasmon bands(C)in UV⁃Vis spectra with AA concentrations of 0.75 mmol/L(a)and 1.75 mmol/L(b)at pH=5.1 and variation in zeta⁃potential of the 25 nm gold seeds with the AA concentration at pH=5.1(D)
2.3 pH对金纳米花的形貌和光学性质调控
通过上述分析可以看出,AA浓度增加会导致体系pH值降低,一方面降低了金粒子稳定性,促进了生长溶液中小尺寸金粒子之间的聚集,从而使金纳米花枝长增加;另一方面pH值的降低也加快了粒子间熟化,使金纳米花枝长变短.实验中尝试固定体系的AA浓度(1.75 mmol/L),在不同起始pH值下制备金纳米花.如图4(A)所示,当pH值从3.1提高到4.0,5.1和6.0时,粒子的吸收峰位置从570 nm红移到660 nm;当pH值进一步提高到7.0时,产物的吸收峰位置不再发生红移,这是因为当pH>6.0以后,AA已全部解离(pKa1=4.2),其对小尺寸金粒子聚集不再起促进作用.TEM观察结果[图4(B)~(D)]表明,随着pH值从3.1升高到6.0,得到的金纳米花枝长逐渐增加,与吸收光谱结果一致.通过改变AA浓度得到的金纳米花的吸收峰位置在546~570 nm之间可调,而固定AA浓度为1.75 mmol/L时,改变体系pH值得到的金纳米花的吸收峰位置在570~660 nm之间可调.这表明通过协同改变AA浓度和pH值,可以实现对金纳米花形貌和光学性质的有效调控.

Fig.4 UV⁃Vis spectra of the gold nanoflowers prepared under different pH values at AA concentration of 1.75 mmol/L(A),TEM images of the as⁃prepared gold nanoflowers under pH=3.1(B),5.1(C)and 6.0(D)at AA concentration of 1.75 mmol/LpH:a.3.1;b.4.0;c.5.1;d.6.0;e.7.0.

Fig.5 SERS spectra of R6G(10-4mol/L)in presence of the gold nanoparticles as prepared(A)and the gold nanoflowers synthesized under pH=7.0(λmax=660 nm)capped by CTAB,PVP,citrate and AA(B)(A)a.Gold nanospheres;b.gold nanoflowers prepared under pH=3.1;c.gold nanoflowers prepared under pH=5.1;d.gold nanoflowers prepared under pH=7.0.(B)a.Capped by CTAB;b.capped by PVP;c.capped by citrate;d.capped by AA.
2.4 金纳米花的SERS性能评价
以罗丹明6G(R6G)为探针分子,对制备的金纳米花的SERS性能进行了评价.由图5(A)可见,随着金纳米花吸收峰位置的红移,其SERS光谱中对应R6G分子的—C—C—C—伸缩振动(610 cm-1)、C—H面外变形振动(775 cm-1)、C—C环伸缩振动(1364,1510和1649 cm-1)以及N—H弯曲振动(1180 cm-1)和伸缩振动(1310 cm-1)的特征峰[9,42,43]信号逐渐增强,表明枝长较长的金纳米花具有更高的电磁场强度[44,45].进一步考察了不同配体修饰的金纳米花(λmax=660 nm)的SERS性能.如图5(B)所示,CTAB和PVP修饰的金纳米花对R6G几乎没有增强效果,这表明CTAB和PVP与金纳米花表面作用很强,从而阻碍了R6G在金纳米花表面的吸附.与柠檬酸钠修饰的金纳米花相比,AA修饰的金纳米花对R6G具有更好的拉曼增强效果,表明与柠檬酸钠相比,AA对于金纳米花是一种更弱的配体[41],所修饰的金纳米花表面更“清洁”.
3 结 论
对利用种子生长法以AA为还原剂制备金纳米花的反应机理进行了研究,在固定HAuCl4加入量的前提下,调节AA浓度以及反应体系的pH值,可以影响小尺寸金粒子在种子表面的聚集沉积方式以及生成的金纳米花的熟化过程,从而实现对金纳米花形貌和光学性质的调控.以R6G为探针分子对不同配体修饰的金纳米花的SERS性能进行了评价,结果表明,由于AA的弱配体特性,所制备的金纳米花表面更“清洁”,有利于其表面功能化及在SERS和催化领域中的应用.
[1] Liu L.L.,Tai X.S.,Yu G.L.,Meng Q.G.,Guo H.M.,Chem.Res.Chinese Universities,2016,32(3),443—450
[2] Ma X.Y.,Yang J.M.,Cai W.S.,Zhu G.D.,Liu J.Y.,Chem.Res.Chinese Universities,2016,32(4),702—708
[3] Zhao T.T.,Chen Y.Q.,Zhang M.,Wang Y.R.,Zhang H.Y.,Hu P.,Chem.J.Chinese Universities,2016,37(5),829—834(赵甜甜,陈雨晴,张敏,王月荣,章弘扬,胡坪.高等学校化学学报,2016,37(5),829—834)
[4] Wang B.C.,Wang W.,Zhang J.W.,Yuan Z.,Chem.J.Chinese Universities,2015,36(8),1619—1626(王碧翠,王蔚,张经纬,袁直.高等学校化学学报,2015,36(8),1619—1626)
[5] Fang Y.,Ma L.L.,Shan D.L.,Lu X.Q.,Chem.J.Chinese Universities,2015,36(8),1491—1497(方艳,马琳琳,陕多亮,卢小泉.高等学校化学学报,2015,36(8),1491—1497)
[6] Zou X.Q.,Ying E.B.,Dong S.J.,Nanotechnology,2006,17,4758—4764
[7] Jiang Y.Y.,Wu X.J.,Li Q.,Li J.J.,Xu D.S.,Nanotechnology,2011,22,3589—3594
[8] Li Q.,Jiang Y.Y.,Han R.C.,Zhong X.L.,Liu S.Y.,Li Z.Y.,Sha Y.L.,Xu D.S.,Small,2013,9,927—932
[9] Wu L.F.,Wu W.W.,Jing X.L.,Huang J.L.,Sun D.H.,Odoom⁃Wubah T.,Liu H.Y.,Wang H.T.,Li Q.B.,Ind.Eng.Chem.Res.,2013,52,5085—5094
[10] Su Y.,He Q.,Yan X.H.,Fei J.B.,Cui Y.E.,Li J.B.,Chem.Eur.J.,2011,17,3370—3375
[11] Sun X.J.,Zhao L.L.,Ji X.H.,Yang W.S.,Chem.J.Chinese Universities,2010,31(9),1084—1087(孙雪娇,赵丽丽,纪小会,杨文胜.高等学校化学学报,2010,31(9),1084—1087)
[12] Wang X.,Deng W.P.,Shen L.,Yan M.,Yu J.H.,New.J.Chem.,2016,40,2835—2842
[13] He Z.Y.,Zang S.,Liu Y.J.,He Y.,Lei H.T.,Biosens.Bioelectro.,2015,73,85—92
[14] Jiang Y.Z.,Deng Z.J.,Yang D.,Deng X.,Li Q.,Sha Y.L.,Li C.H.,Xu D.S.,Nano Res.,2015,8,2152—2161
[15] Li S.N.,Zhang L.Y.,Wang T.T.,Li L.,Wang C.G.,Su Z.M.,Chem.Commun.,2015,51,14338—14343
[16] Broek B.V.D.,Devoogdt N.,D’Hollander A.,Gijs H.L.,Jans K.,Lagae L.,Muyldermans S.,Maes G.,Borghs G.,ACS Nano,2011,27,4319—4328
[17] Cheng L.C.,Huang J.H.,Chen H.M.,Lai T.C.,Yang K.T.,Liu R.S.,Hsia M.,Chen C.H.,Her L.J.,Tsai D.P.,J.Mater.Chem.,2012,22,2244—2253
[18] Song W.Z.,Jiang Y.P.,Ji X.H.,Zhao L.L.,Yin W.Z.,Yang W.S.,Chem.J.Chinese Universities,2012,33(9),1886—1888(宋文植,姜雅萍,纪小会,赵丽丽,尹万忠,杨文胜.高等学校化学学报,2012,33(9),1886—1888)
[19] Liao H.G.,Jiang Y.X.,Zhou Z.Y.,Chen S.P.,Sun S.G.,Angew.Chem.Int.Ed.,2008,47,9100—9103
[20] Mahmoud M.A.,Tabor C.E.,El⁃Sayed M.A.,Ding Y.,Wang Z.L.,J.Am.Chem.Soc.,2008,130,4590—4591
[21] Xu J.G.,Wilson A.R.,Rathmell A.R.,Howe J.,Chi M.F.,Wiley B.J.,ACS Nano,2011,5,6119—6127
[22] Wang A.J.,Li Y.F.,Wen M.,Yang G.,Feng J.J.,Yang J.,Wang H.Y.,New J.Chem.,2012,36,2286—2291
[23] Li Y.J.,Ding W.C.,Li M.R.,Xia H.B.,Wang D.Y.,Tao X.T.,J.Mater.Chem.A,2015,3,368—376
[24] Gou L.F.,Murphy C.J.,Chem.Mater.,2005,17,3668—3672
[25] Jana N.R.,Gearheart L.,Murphy C.J.,Langmuir,2001,17,6782—6786
[26] Brown K.R.,Natan M.J.,Langmuir,1998,14,726—728
[27] Chen S.H.,Wang Z.L.,Ballato J.,Foulger S.H.,Carroll D.L.,J.Am.Chem.Soc.,2003,125,16186—16187
[28] Jana N.R.,Gearheart L.,Murphy C.J.,J.Phys.Chem.B,2001,105,4065—4067
[29] Wang W.T.,Han Y.C.,Gao M.Y.,Wang Y.L.,Cryst.Eng.Comm.,2013,15,2648—2656
[30] Zhao L.L.,Ji X.H.,Sun X.J.,Li J.,Yang W.S.,Peng X.G.,J.Phys.Chem.C,2009,113,16645—16651
[31] Wang W.,Yang X.,Cui H.,J.Phys.Chem.C,2008,112,16348—16353
[32] Burt J.L.,Elechiguerra J.L.,Reyes⁃Gasga J.,Montejano⁃Carrizales J.M.,Jose⁃Yacaman M.,J.Cryst.Growth,2005,285,681—691
[33] Luo Y.S.,Ji X.H.,Zhuang J.Q.,Yang W.S.,Colloids Surf.A,2014,463,28—36
[34] Sau T.K.,Murphy C.J.,J.Am.Chem.Soc.,2004,126,8648—8649
[35] Kuo C.H.,Huang M.H.,Langmuir,2005,21,2012—2016
[36] Ciganda R.,Li N.,Deraedt C.,Gatard S.,Zhao P.X.,Salmon L.,Hernandez R.,Ruiz J.,Astruc D.,Chem.Commun.,2014,50,10126—10129
[37] Bastus N.G.,Merkoci F.,Piella J.,Puntes V.,Chem.Mater.,2014,26,2836—2846
[38] Ji X.H.,Song X.N.,Li J.,Bai Y.B.,Yang W.S.,Peng X.G.,J.Am.Chem.Soc.,2007.129,13939—13948
[39] Dong X.Y.,Ji X.H.,Wu H.L.,Zhao L.L.,Li J.,Yang W.S.,J.Phys.Chem.C,2009,113,6573—6576
[40] Wang R.,Ji X.H.,Huang Z.Z.,Xue Y.R.,Wang D.Y.,Yang W.S.,J.Phys.Chem.C,2016,120,377—385
[41] Wang L.,Hu C.P.,Nemoto Y.,Tateyama Y.,Yamauchi Y.,Cryst.Growth Des.,2010,10,3454—3460
[42] Mai F.D.,Hsu T.C.,Liu Y.C.,Yang K.H.,J.Raman Spectrosc.,2012,43,724—729
[43] Wang Y.Q.,Ma S.,Yang Q.Q.,Li X.J.,Appl.Surf.Sci.,2012,258,5881—5885
[44] Hao E.,Bailey R.C.,Schatz G.C.,Hupp J.T.,Li S.Y.,Nano Lett.,2004,4,327—330
[45] Bakr O.M.,Wunsch B.H.,Stellacci F.,Chem.Mater.,2006,18,3297—3301
(Ed.:V,Z,K)
†Supported by the National Natural Science Foundation of China(No.51372097).
Mechanism in the Preparation of Gold Nanoflowers by Ascorbic Acid Reduction†
YANG Shuang,JI Xiaohui,YANG Wensheng∗
(Key Laboratory of Surface and Interface Chemistry of Jilin Province,College of Chemistry,Jilin University,Changchun 130012,China)
The mechanism in the preparation of gold nanoflowers using the mixture of HAuCl4and ascorbic acid(AA)as growth solution was investigated.It was identified that the AA concentration affected the attachment of the small gold particles on the seeds and the intraparticle ripening of the gold nanoflowers,thus resulting in the formation of the flowers with different morphologies and optical properties.It is effective to tune morphology and optical property of the gold nanoflowers by optimizing the AA concentration and pH of the growth solution simultaneously.Surface enhanced Raman scattering(SERS)results indicated the as⁃prepared gold nanoflowers showed good SERS activity to Rhodamine 6G,suggesting the clean surface character of the flowers prepared by AA reduction.
Gold nanoflowers;Ascorbic acid;Intraparticle ripening;Aggregation;Seeding approach
O614;O648
A
10.7503/cjcu20160608
2016⁃08⁃29.网络出版日期:2016⁃11⁃18.
国家自然科学基金(批准号:51372097)资助.
联系人简介:杨文胜,男,博士,教授,博士生导师,主要从事胶体与表面化学的研究.E⁃mail:wsyang@jlu.edu.cn
