扶正解毒祛瘀方对大肠癌术后化疗增效减毒的作用
2016-12-12刘晓芸赵秀梅张桂贤张俊仲柴仲秋
刘晓芸,赵秀梅,张桂贤,张俊仲,柴仲秋,周 冰
实验研究
扶正解毒祛瘀方对大肠癌术后化疗增效减毒的作用
刘晓芸1,赵秀梅2,张桂贤2,张俊仲3,柴仲秋3,周冰3
目的:探讨中药扶正解毒祛瘀方(扶正方)与抗癌药奥沙利铂(L-OPH)联合治疗结直肠癌的疗效。方法:L-OPH单独作用或者与扶正方联合作用在培养的HT-29人结直肠癌细胞及动物移植瘤模型中,L-OPH与扶正方的LD50值的测定为单独试验,使用正常小鼠测定。结果:L-OPH的LD50为17 mg/kg,高于使用剂量(6~10)mg/kg。中药处方的LD50为131 g生药/kg,也高于使用的剂量(48 g生药/kg)。单独使用体外培养的HT-29细胞时发现,L-OPH可减低细胞增殖的时间剂量依赖性。扶正方可增加L-OPH的抗癌作用,扶正方增强L-OPH的抗癌作用也在体内动物模型中得到体现。结论:在细胞培养和动物结直肠癌模型中发现,扶正方方可增加L-OPH的抗癌作用。
扶正解毒祛瘀法;奥沙利铂;大肠癌;增效;抑瘤率
大肠癌(colorectal cancer)是世界范围内常见的恶性肿瘤[1],在我国,随着饮食结构和生存环境的改变,其发病率及致死率也呈逐年上升的趋势[2-3],并分别占据恶性肿瘤中的第3位和第2位。我们曾经对天津市滨海新区部分大肠癌术后患者进行辨证分析,发现病机为毒邪久滞不去,并与体内的瘀血、痰湿、浊气搏结,使正气日益耗损,久之则呈复发之势。课题组以扶正解毒祛瘀为立法组方,以参苓白术散、桃红四物汤和小承气汤为基础,针对大肠癌术后常见的气虚毒瘀证型治疗,临床疗效显示扶正方既可扶助体内正气,亦可增强化疗药物的抗癌效果,同时通腑泻浊减轻化疗毒副作用。为了进一步验证其疗效,本课题组从体外细胞试验和体内动物试验两方面开展研究。
1 材料与方法
1.1药品
1.1.1扶正方药材及制备该方由太子参、薏苡仁、生槐花、知母、当归、黄柏、桃仁、红花等中药按照一定比例组成,由天津市滨海新区塘沽中医医院提供,经由天津市医药科学研究所肿瘤研究室按照临床用药煎煮方法浓缩成含药量为1 g/mL的浸膏。浸膏1 g相当于生药2.244 g,制配好后装于三角瓶,4℃保存。小鼠用药剂量按照国家中药管理局的相关规定,人鼠单位体重用药量直接换算后的11倍作为给药剂量,最终换算制成等效剂量47.77 g生药/kg(等效剂量换算方法:304 g生药/平均人体体重70 kg× 11倍)。
1.1.2L-OPH注射用L-OPH 50 mg/瓶,南京制药厂有限公司,批号201411132。
1.1.3试剂培养基RPMI1640(批号1285082)—GIBCO公司;小牛血清(批号041113)—杭州四季青生物工程材料有限公司;胰蛋白酶(0.25%胰酶、0.02%EDTA)—杭州吉诺生物医药技术有限公司;MTT(批号T15051/15181)—北京欣经科生物技术有限公司;二甲基亚砜DMSO(批号040820)—天津市化学试剂六厂;注射用盐酸多柔比星(批号050703)—汕头经济特区明治医药有限公司;注射用青霉素钠(批号041207)—华北制药股份有限公司;注射用硫酸链霉素(批号A05029115)—哈药集团制药总厂。
1.2试剂配制
1.2.1营养液配制将RPMI1640干粉(10.4 g)缓慢加入到三蒸水中,边加边搅拌助溶。将碳酸钠2 g,青霉素62.5 mg,链霉素100.0 mg分别溶于适量三蒸水,依次加入到上述溶液中,定容至1 L。以1 mol/L的NaOH调至pH 7.2~7.4,将配制好的培养基用孔径为0.22 μm的滤膜滤过除菌。在无菌条件下分装,4℃冰箱保存。使用时加入已灭活(56℃,30 min)的小牛血清,配制成含10%小牛血清的营养液。
1.2.2MTT溶液的配制称取MTT 10 mg,溶于2 mL PBS中,配制成浓度为5 mg/mL的溶液。
1.3试验细胞及培养
1.3.1细胞HT-29人结肠癌细胞购自中国科学院细胞库。
1.3.2细胞培养细胞培养于含5%CO2的饱和湿度、37℃恒温培养箱,使用含有10%小牛血清的RPMI-1640营养液,每2 d以1∶3传代。
1.4试验动物及饲养选用SPF级昆明鼠110只、BALB/c鼠80只,体重(18±2)g,均购自北京维通利华实验动物技术有限公司,合格证号SCXK-(军)2014-0001,检疫。动物饲养于天津医药科学研究所SPF级屏障实验内,室温20~25℃,湿度40%~70%,照明/黑暗12 h/12 h,室内定期进行紫外线照射,自由摄食由维通利华公司生产的标准饲料,自由饮用反渗透水。
1.5细胞试验
1.5.1评价试药抗肿瘤活性—体外肿瘤细胞的增殖抑制试验取已调整好浓度的HT-29细胞悬液,以每孔100 μL加于96孔板中,细胞对照组(孔)再加入100 μL含10%小牛血清的1640培养液,实验组(孔)加入100 μL不同浓度的药液。L-OPH及扶正方试药各设8个浓度梯度组,每组12个复孔。用医用胶布把培养板封存于37℃,5%CO2孵育箱中,分别培养24 h、48 h、72 h。培养结束,每孔加入MTT溶液10 μL,封好再放回孵育箱中继续培养4 h。用微量加样器吸出80%(160 μL)上清液弃去,每孔加入DMSO 180 μL,震荡1 min,使生成的甲臢颗粒完全溶解,在酶标仪上选择波长为570 nm测定OD值。根据OD值计算抑瘤率(抑瘤率=(细胞对照OD值-实验组OD值)/细胞对照OD值×100%)及IC50。1.5.2评价试药增效作用—体外肿瘤细胞的增殖抑制试验设置药物对照组2孔,加入100 μL含10%小牛血清的1640培养液,其余94孔板加入100 μL已调整好浓度的HT-29细胞悬液。细胞对照组(孔)再加入100 μL含10%小牛血清的1640培养液。实验组(孔)分3部分,每组32个复孔。单用L-OPH试药组加入100 μL不同浓度L-OPH药液,L-OPH与扶正方合用2组,各加入50 μL不同浓度的L-OPH及50 μ L不同浓度的扶正方药液。L-OPH试药设7个浓度梯度组,每组12个复孔;扶正方设2个浓度梯度组,每组32个复孔。测定方法同上,根据OD值,计算抑瘤率及增效系数Q值[Q= Ea+b/(Ea+Eb)-Ea×Eb]。
1.6动物试验
1.6.1急性毒性试验昆明种小鼠60只,按体质量,随机分成6组,每组10只,雌雄各半。禁食不禁水24 h后,分别按9.6、13.7、19.6、28.0、40.0 mg/kg,灌胃给予相应剂量的扶正方提取物,0.4 mL/20 g体质量。连续观察2周,记录动物状态及死亡情况。
1.6.2CT-26抑瘤试验取接种CT-26细胞生长良好的荷瘤BALB/c小鼠,断颈椎处死,无菌条件下摘取肿瘤组织,用0.9%氯化钠溶液以1 g∶3 mL研磨成肿瘤细胞悬液,于每只0.2 mL接种于BALB/c小鼠右前肢腋皮下。24 h后,按体质量随机分成8组,每组12只。即:荷瘤对照组;扶正方组;L-OHP低剂量组(6 mg/kg);L-OHP中剂量组(8 mg/kg);L-OHP高剂量组(10 mg/kg);扶正方+L-OHP低剂量组(50 g生药/kg+6 mg/kg);扶正方联合L-OHP中剂量组(50 g生药/kg+8 mg/kg);扶正方联合L-OHP高剂量组(50 g生药/kg+10 mg/kg),另设正常对照组。其中,正常对照组和荷瘤对照组灌胃等量蒸馏水,其他各组给予相应药物。提取物组为灌胃(ig)给药,1次/d,连续7 d。L-OHP为接种后24 h腹腔注射给药(ip)1次。末次给药后24 h,将小鼠断颈椎处死,剥离瘤体,胸腺及脾脏,称重并计算抑瘤率。(脏器系数=脏器/体重×100;抑瘤率(%)=(1-试验组平均瘤重/对照组平均瘤重)×100%)
2 结果
2.1对结直肠癌HT-29细胞的增殖的抑制作用与对照组细胞比较,试药在各浓度范围内对HT-29细胞的增殖均表现出明确的抑制作用,根据培养24 h、48 h、72 h的检测结果显示,时间长短不同,药物的抑瘤率不同。扶正方培养细胞72 h,表现出抑瘤率最强,各样品的抑瘤率均高于24 h、48 h的结果。其24 h、48 h、72 h的IC50分别是9671.5、2884.07、2656.96 mg/mL。且随试药浓度的升高抑瘤率增加,用SPSS16.0统计软件的随机区组设计方差分析得出结论F=60.416,P<0.001。L-OPH培养细胞48 h略高于24 h、72 h的抑瘤率,用SPSS16.0统计软件的随机区组设计方差分析得出结论F=6.530,P<0.005,其IC50分别是432.441、30.136、10.255 μg/ mL。亦随试药浓度的升高抑瘤率增加,用SPSS16.0统计软件的随机区组设计方差分析得出结论F= 32.269,P<0.001。见表1、表2。
表1 扶正方对HT-29细胞生长的影响(±s,n=4)
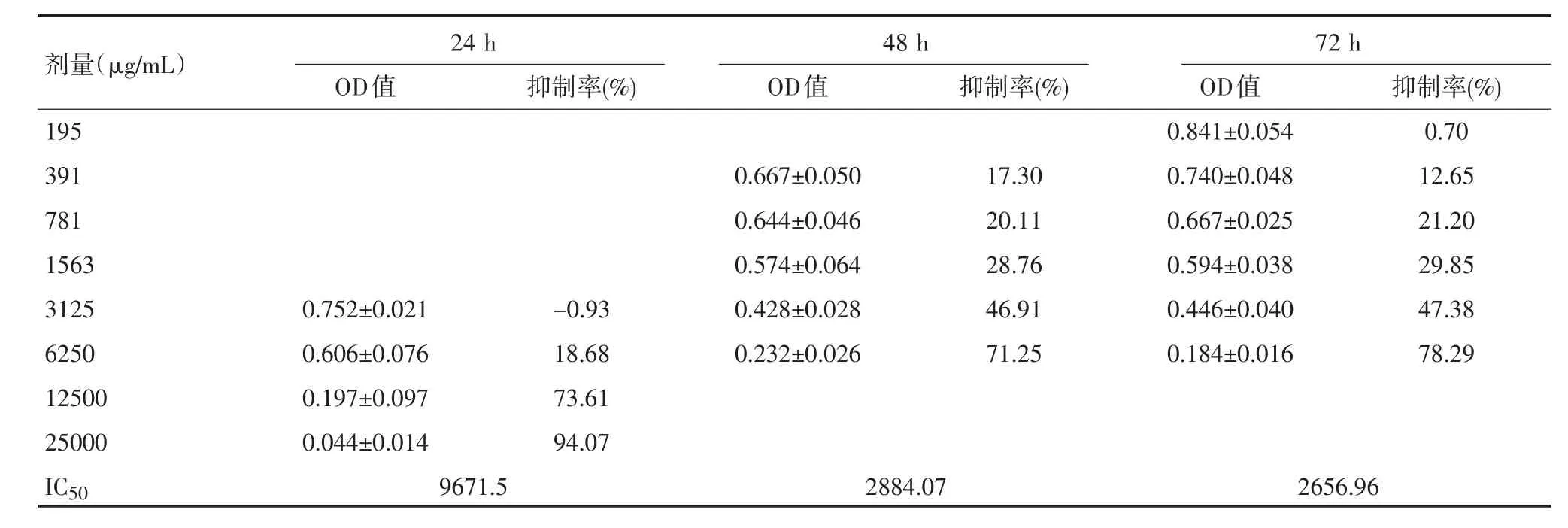
表1 扶正方对HT-29细胞生长的影响(±s,n=4)
剂量(μg/mL)195 391 781 1563 3125 6250 12500 25000 IC50 72 h 24 h OD值 抑制率(%) 48 h OD值 抑制率(%) 0.752±0.021 0.606±0.076 0.197±0.097 0.044±0.014 -0.93 18.68 73.61 94.07 0.667±0.050 0.644±0.046 0.574±0.064 0.428±0.028 0.232±0.026 17.30 20.11 28.76 46.91 71.25 OD值0.841±0.054 0.740±0.048 0.667±0.025 0.594±0.038 0.446±0.040 0.184±0.016抑制率(%) 0.70 12.65 21.20 29.85 47.38 78.29 9671.52884.072656.96
表2 L-OPH对HT-29细胞生长的影响(±s,n=4)
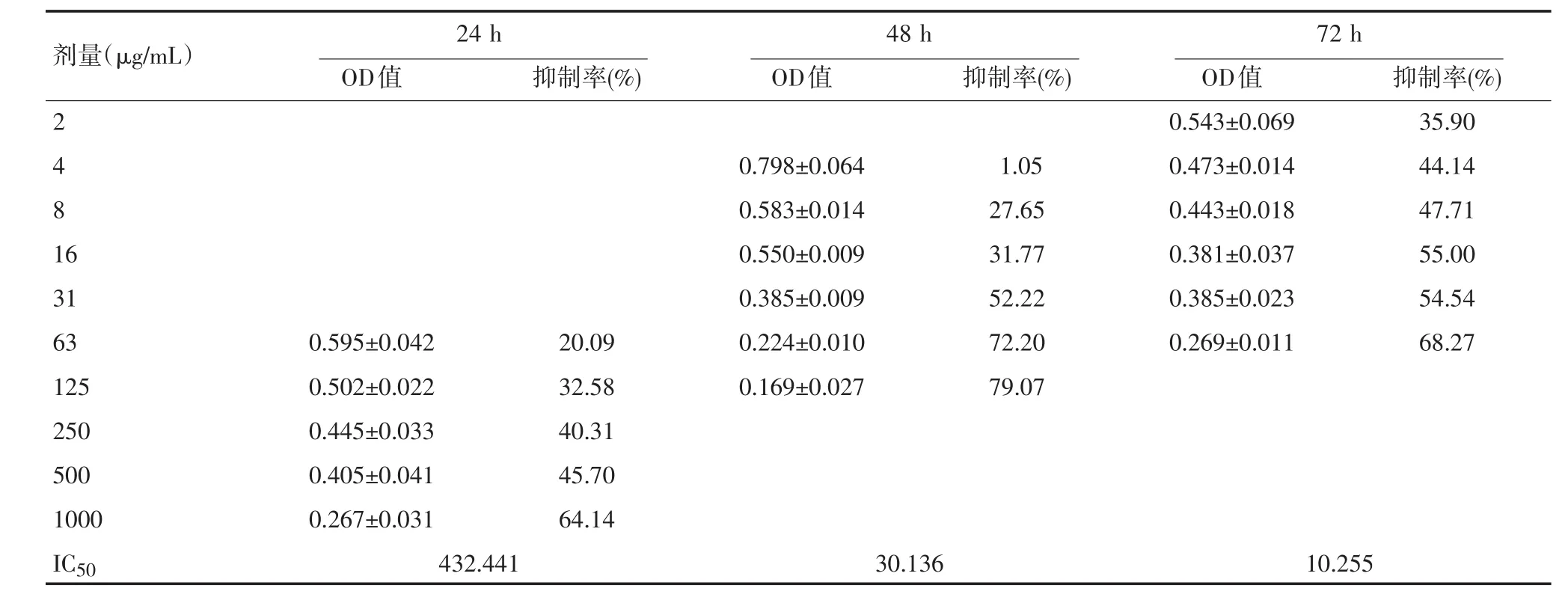
表2 L-OPH对HT-29细胞生长的影响(±s,n=4)
剂量(μg/mL)72 h 24 h OD值 抑制率(%) 48 h OD值 抑制率(%) 2 4 8 1 6 31 63 125 250 500 1000 IC50 0.595±0.042 0.502±0.022 0.445±0.033 0.405±0.041 0.267±0.031 20.09 32.58 40.31 45.70 64.14 0.798±0.064 0.583±0.014 0.550±0.009 0.385±0.009 0.224±0.010 0.169±0.027 1.05 27.65 31.77 52.22 72.20 79.07 OD值0.543±0.069 0.473±0.014 0.443±0.018 0.381±0.037 0.385±0.023 0.269±0.011抑制率(%) 35.90 44.14 47.71 55.00 54.54 68.27 432.44130.13610.255
2.2HT-29结直肠癌细胞的形态学观察倒置相差显微镜下可见,HT-29细胞对照组随着培养时间的延长,细胞数量呈明显增加的趋势;而加入扶正方及L-OHP处理过的细胞,随着药物作用时间增长,细胞破碎,数量逐渐减少。具体见图1~图3。

图1 不同时间HT-29细胞生长的形态

图2 1563 μg/mL扶正方作用不同时间后HT-29细胞生长的形态
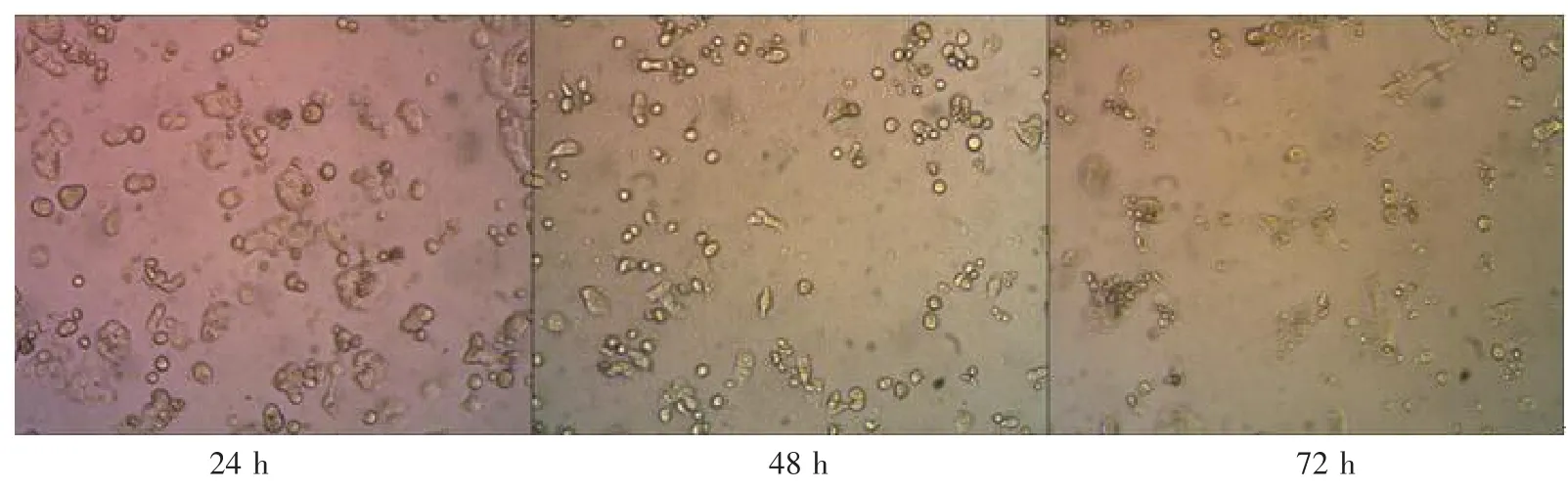
图3 63 μg/mL L-OHP作用不同时间后HT-29细胞生长的形态
2.3扶正方对L-OPH的增效作用与L-OPH单用组相比,扶正方与L-OPH合用组的各浓度均对HT-29细胞的增殖有明显的抑制作用。扶正方合用剂量为2000 μg/mL较1000 μg/mL抑瘤率略有增高,其中24 h L-OPH剂量为125 μg/mL,48 h L-OPH剂量为16、63、125 μg/mL,72 h L-OPH剂量为4 μg/mL时P<0.05,;48 h L-OPH剂量为31 μg/mL,72 h L-OPH剂量为16、31 μg/mL时P<0.01。根据培养24 h、48 h、72 h的检测结果显示,同一剂量,作用时间长短不同,药物的抑瘤率不同。同时计算出增效系数Q值[4],评分标准:Q>1.15协同增效;0.85~1.15单纯相加;Q<0.85互相拮抗。其中24 h时L-OPH剂量为31 μg/mL时,扶正方合用均表现为显著增效;48 h时L-OPH剂量为2、4、8 μg/mL时,扶正方合用1000 μg/mL时表现为显著增效,效果明显。见表3~5。
2.4体内毒性试验试药在某些浓度范围内对昆明鼠表现出明显的毒性作用,且随着剂量升高昆明鼠的死亡率也在增加。以简化几率法计算,扶正方的LD50为(131.04±7.18)g生药/kg,L-OHP的LD50为(17±2.86)mg/kg。根据计算扶正方的小鼠等效剂量为48 g生药/kg,即相当于临床上患者的使用药量,小于试验中扶正方的半数致死量,因此临床上患者使用的剂量为安全剂量。经实验观察扶正方高剂量小鼠腹泻严重,脱水死亡,组方中含有大黄、元明粉等,故临床不宜多食。见表6、表7。
2.5对BALB/c鼠体内结直肠肿瘤增殖的抑制作用与荷瘤对照组相比,50 g生药/kg的扶正方及6、8 mg/kg的L-OHP抑瘤效果不明显,而10 mg/kg的L-OHP抑瘤作用较强(P<0.05)。扶正方分别与不同剂量的L-OHP合用时,与单独使用L-OHP相比,随着其剂量增加抑瘤效果明显增强(P>0.05;P< 0.05;P<0.05);其中扶正方与8 mg/kg的L-OHP合用后其抑瘤率与单用10mg/kg的L-OHP组相当(P>0.05),二者相加作用明显;扶正方与10 mg/kg的L-OHP合用后协同作用明显。见表8。
表3 扶正方增加L-OPH抑制HT-29细胞增殖的作用(±s,n=4,24 h)

表3 扶正方增加L-OPH抑制HT-29细胞增殖的作用(±s,n=4,24 h)
注:与相同剂量的单用组比较,aP<0.05,bP<0.01
剂量(μg/mL)31 63 125 250 500 1000 2000单用组OD值0.470±0.043 0.396±0.056 0.355±0.041 0.300±0.032 0.253±0.025 0.195±0.022 0.145±0.014与扶正方(1000 μg/mL)合用 与扶正方(2000 μg/mL)合用IR(%) 21.48 33.93 41.13 49.97 57.69 67.37 75.84 OD值0.305±0.020a0.227±0.030b0.209±0.018a0.187±0.045a0.158±0.024b 0.090±0.010b0.077±0.003bIR(%) 49.09 62.04 65.07 68.74 73.63 85.04 87.13 Q值1.60 0.93 0.84 0.83 0.85 0.93 0.90 OD值0.274±0.033a0.204±0.033b0.154±0.014b0.148±0.010b0.136±0.016b 0.099±0.004b0.093±0.011bIR(%) 54.30 65.93 74.35 75.35 77.33 83.49 84.55 Q值1.64 0.94 0.93 0.86 0.86 0.90 0.88
表4 扶正方增加L-OPH抑制HT-29细胞增殖的作用(±s,n=4,48 h)

表4 扶正方增加L-OPH抑制HT-29细胞增殖的作用(±s,n=4,48 h)
注:与相同剂量的单用组比较,aP<0.05,bP<0.01
剂量(μg/mL) 与扶正方(1000 μg/mL)合用 与扶正方(2000 μg/mL)合用2 4 8 1 6 31 63 125单用组OD值0.539±0.032 0.504±0.013 0.507±0.014 0.483±0.012 0.376±0.012 0.195±0.007 0.140±0.005 IR(%) 26.81 31.53 31.18 34.41 48.99 73.54 80.98 OD值0.409±0.030b0.391±0.025b0.368±0.019b0.390±0.010b0.333±0.018a0.170±0.016a 0.120±0.010aIR(%) 44.55 46.94 50.11 47.10 54.86 76.91 83.70 Q值1.24 1.17 1.26 1.10 0.99 1.00 1.00 OD值0.381±0.038b0.340±0.044b0.351±0.034b0.329±0.028b0.248±0.014b0.134±0.012b 0.090±0.011bIR(%) 48.34 53.84 52.35 55.39 66.29 81.87 87.81 Q值1.03 1.07 1.04 1.05 1.05 1.01 1.02
表5 扶正方增加L-OPH抑制HT-29细胞增殖的作用(±s,n=4,72 h)
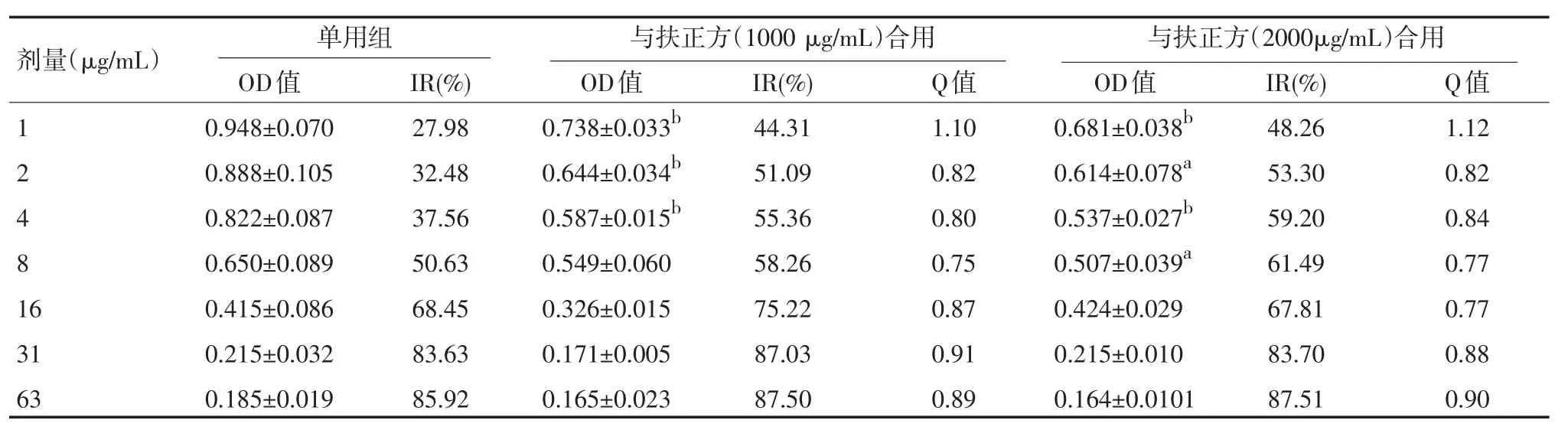
表5 扶正方增加L-OPH抑制HT-29细胞增殖的作用(±s,n=4,72 h)
注:与相同剂量的单用组比较,aP<0.05,bP<0.01
剂量(μg/mL) 与扶正方(1000 μg/mL)合用 与扶正方(2000μg/mL)合用1 2 4 8 1 6 31 63单用组OD值0.948±0.070 0.888±0.105 0.822±0.087 0.650±0.089 0.415±0.086 0.215±0.032 0.185±0.019 IR(%) 27.98 32.48 37.56 50.63 68.45 83.63 85.92 OD值0.738±0.033b 0.644±0.034b 0.587±0.015b0.549±0.060 0.326±0.015 0.171±0.005 0.165±0.023 IR(%) 44.31 51.09 55.36 58.26 75.22 87.03 87.50 Q值1.10 0.82 0.80 0.75 0.87 0.91 0.89 OD值0.681±0.038b 0.614±0.078a 0.537±0.027b0.507±0.039a0.424±0.029 0.215±0.010 0.164±0.0101 IR(%) 48.26 53.30 59.20 61.49 67.81 83.70 87.51 Q值1.12 0.82 0.84 0.77 0.77 0.88 0.90

表6 扶正方的毒性观察
表8 扶正方增加L-OPH对CT-26荷瘤小鼠抑瘤作用的结果(±s,n=12)

表8 扶正方增加L-OPH对CT-26荷瘤小鼠抑瘤作用的结果(±s,n=12)
注:与荷瘤对照组相比,aP<0.05;与相同剂量的L-OPH单用组组比较,bP<0.05
组别荷瘤对照扶正方组L-OPH L-OPH L-OPH扶正方+L-OPH扶正方+L-OPH扶正方+L-OPH剂量(mg/kg)n 体重(g) 抑瘤率(%)Q值50×1036 8 1 0 50×103+6 50×103+8 50×103+10初始12 12 12 12 12 12 12 12结束12 12 12 12 12 12 12 12初始19.0±0.8 18.9±0.9 19.2±1.0 19.1±1.0 19.1±1.0 19.0±0.7 18.8±0.9 19.0±0.9结束20.7±1.5 21.0±1.3 21.0±1.2 20.1±1.3 20.1±1.1 21.4±1.5 20.8±1.3 20.0±1.4瘤重(g)2.950±0.513 2.597±0.465 2.591±0.513 2.567±0.421 2.328±0.650a2.562±0.448 2.336±0.662a、b 1.655±0.499a、b 11.96 12.19 12.99 21.08 13.15 20.81 43.91 0.58 0.89 1.44
3 讨论
大肠癌属于中医学“积聚”、“肠癖”、“便血”、“脏毒”等范畴,病机为正气内虚,气滞、瘀血、痰结、湿聚、热毒等互相纠结,日久积滞而成[5],故课题组以扶正方解毒祛瘀为治疗大法,参苓白术散、桃红四物汤和小承气汤为基础加味组方来治疗大肠癌。其中,参苓白术散可调节肠道运动,抑制细菌的生长,提高胃肠道黏膜屏障作用,防止因化疗所致的恶心呕吐、腹泻及食欲不振等消化道症状,保证放化疗的进行,在恶性肿瘤的综合治疗中具有重要作用[6-7]。而桃红四物汤是补血、调血的经典方剂,药理学研究其具有抗缺氧、抗氧化、抗肿瘤、增强免疫等多种功效[8-9]。小承气汤则具有通腑除瘀的作用,可明显改善胃肠道肠内营养不耐受现象,减少腹胀、恶心、呕吐等症状,恢复术后的胃肠功能,同时有助于改善肝功能[10]。
L-OPH是一种稳定的水溶性铂类烷化剂,是第一个明显对结肠癌有效以及在体内外均有广谱抗肿瘤活性的铂类抗肿瘤药物。在体内和体外研究中,均可观察到L-OPH与5-氟尿嘧啶联合应用的协同细胞毒作用。基于在临床实践中的发现,课题组设计了本项实验来验证扶正方是否对L-OPH具有协同增效作用。同时为中西医结合用于治疗癌症提供一些实验依据。陈小东[11]、张玉人[12]等用中药复方配合化疗药治疗大肠癌,均发现其能提高患者的治疗临床获益率,改善生存质量,同时通过提高机体免疫功能,调整癌症微环境,缓解各种现代医学疗法导致的乏力、食欲不振、贫血、骨髓抑制等不良反应。本项研究中,也的确发现了扶正方本身的体内外抗肿瘤效果并不明显,但当其与L-OPH合用时,则能明显增加后者的抗肿瘤作用,于细胞试验中扶奥合用组较相同剂量的单用组对HT-29细胞的增殖有明显的抑制作用(P<0.05),呈剂量-时间依赖性。动物试验中,扶奥合用对肿瘤增殖的抑制作用,通过瘤重、抑瘤率及增效系数均可表现出来。陈鹊汀[13]、栗敏[14]等建立的荷瘤小鼠模型,观察中药方剂对化疗后荷瘤小鼠增效作用,均减轻小鼠瘤重,抑瘤率增加。本研究与上述试验结果均证实了中药方剂与化疗药合用有明显增效作用。与此同时,从动物体重上来说,扶正方在增加L-OPH疗效的同时,并没有增加其毒性,而且动物生存状体良好。说明扶正方对L-OPH具有协同增效的作用,并且在该剂量下安全的。由此可见,中西结合法治疗肿瘤方面有较良好的前景。
中药在肿瘤术后化疗中的优势在于“辨证施治”,从而提高机体免疫功能,促进化疗的顺利进行,改善患者的临床症状,提高生存质量,延长生存期。庄虔翠[15]、李猛[16]等运用中药方剂联合化疗药治疗大肠癌,发现临床疗效及1年生存率等其他指标明显优于单独化疗组。本研究也证实了扶正方对L-OPH具有协同增效的作用,但其具体机制尚不清楚,课题组拟在以后的工作中,做进一步的研究和阐述。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics.2013[J].CA Cancer J Clin,2013,63(1):11-30.
[2]Jemal A,Bray F,Center MM,et al.Global Cancer Statistics[J].Ca Cancer J Clin,2011,61(2):69-90.
[3]Siegel R,Naishadham D.Cancer statistics.2014[J].CA Cancer J Clin,2014,6,64(1):9-29.
[4]廖志勇,张胜华,甄永苏.格尔德霉素与抗肿瘤药物的协同作用(英文)[J].药学学报,2001,36(8):569-575.
[5]郑浩,陆为民.国医大师徐景藩治疗大肠癌经验[J].湖南中医杂志,2015,31(2):20-21.
[6]范先基,杨子玉,石彧.参苓白术散联合化疗、对症治疗恶性肿瘤随机平行对照研究[J].实用中医内科杂志,2013,27(2):25-27.
[7]乔新梅,赵金岭.参苓白术散配合常规化疗治疗恶性肿瘤患者80例[J].四川中医,2013,31(8):77-78.
[8]李翊,彭代银.桃红四物汤的药理学研究进展[J].安徽医药,2011, 15(5):529-531.
[9]连红琴,秦铮然,张月虹,等.桃红四物汤对实验性大肠癌Bcl-2/Bax蛋白及Casepase-3mRNA表达的影响[J].中华中医药学刊,2011, 29(10):2240-2242.
[10]王洪军,刘洪波,张保华,等.小承气汤对胰十二指肠切除术后患者胃肠功能的作用分析[J].临床合理用药杂志,2015,8(9):79-80.
[11]陈小东,梁启廉,李小英,等.复方丹参滴丸联合化疗治疗47例大肠癌[J].中国中西医结合外科杂志,2005,11(4):300-302.
[12]张玉人,董倩.康艾注射液治疗消化系统肿瘤的研究概况[J].中国中西医结合外科杂志,2014,20(1):97-100.
[13]陈鹊汀,刘智勤,朱惠学,等.当归补血汤对阿霉素化疗荷瘤小鼠的增效减毒作用[J].时珍国医国药,2012,23(2):349-350.
[14]栗敏,马洪宇,沈继朵,等.复方阿胶浆对H22肝癌荷瘤小鼠5-FU化疗的增效减毒作用 [J].中国实验方剂学杂志,2012,18(20): 216-219.
[15]庄度翠,于红霞.补中益气汤加减配合化疗治疗大肠癌的临床观察[J].吉林医学,2008,9(15):1307.
[16]李猛.健脾消癥瘕法治疗晚期大肠癌的临床研究[J].西部中医药,2011,24(7):70-72.
(收稿:2015-12-08修回:2016-03-14)
(责任编辑王 丰)
Fuzheng Jiedu Quyu on Postoperative Colorectal Cancer Chemotherapy Synergistic Effect
LIU Xiao-yun,ZHAO Xiu-mei,ZHANG Gui-xian,et al.Tianjin University of Traditional Chinese Medicine,Tianjin (300193),China
ObjectiveTo investigate whether a medicinal herb prescription for Fuzheng Jiedu Quyu and the anticancer drug oxaliplatin cooperate in the treatment of colon cancer.MethodsOxaliplatin was used in the absence and presence of the herbal prescription in two colon cancer models,namely incubation of HT-29 hu⁃man colon cancer cells and athymic mice carrying HT-29 cells.In a separate experiment,LD50values of oxalipa⁃tin and the herbal prescription were tested in normal mice.ResultsThe LD50of oxaliplatin was 17 mg/kg, which was higher than the doses we used[(6~10)mg/kg].The LD50of herbal prescription was 131 g(of raw herbs)/ kg,which was also higher than the doses(48 g/kg)we used.When used separately in cultured HT-29 cells,oxali⁃platin decreased cell population time-and dose-dependently.In addition,the anticancer effect of oxaliplatin was greater in the presence of the herbal prescription.Oxaliplatin also decreased tumor grafts made of HT-29 cells. Again,the anticancer effect of oxaliplatin in vivo was also enhanced in the presence of the herbal presciption. ConclusionThe herbal prescription for Fuzheng Jiedu Quyu increases the anticancer effect of oxaliplatin in two colon cancer models.
Fuzheng Jiedu Quyu;oxaliplatin;colorectal cancer;synergistic effect;inhibition rate
Q95-33;R735.3+4
A
1007-6948(2016)02-0150-07
10.3969/j.issn.1007-6948.2016.02.012
天津市中医药管理局中医中西医结合科研课题(13164);天津市滨海新区联合攻关项目(2012MS05-05);塘沽科技局民生科技项目(2013MS05-03);塘沽科技局科技兴区项目(2013KJXQ09);天津市滨海新区卫生局一般扶持项目(2014BWKY014)
1.天津中医药大学研究生院(天津 300193)
2.天津市医药科学研究所肿瘤病理研究室(天津 300020)
3.天津市滨海新区中医医院肛肠科(天津 300451)
周冰,E-mail:tgzygcbx@126.com
