紫檀茋和乙酰紫草素抑制B16F10细胞增殖的协同作用
2016-07-07张闪闪董锦蕾王晓琴
陈 虹,张闪闪,董锦蕾,钟 晶,王晓琴,张 波
(石河子大学 1.药学院,2.省部共建新疆特种资源植物药重点实验室,新疆 石河子 832002)
紫檀茋和乙酰紫草素抑制B16F10细胞增殖的协同作用
陈虹1,2,张闪闪1,2,董锦蕾1,2,钟晶1,2,王晓琴1,张波1,2
(石河子大学 1.药学院,2.省部共建新疆特种资源植物药重点实验室,新疆 石河子832002)
摘要:目的研究紫檀茋和乙酰紫草素对B16F10细胞的增殖抑制的协同作用与相关机制。方法通过系统药理学的方法对紫檀茋和乙酰紫草素的联合作用进行预测,并对可能靶点进行筛选及分析。体外采用MTT法测定紫檀茋、乙酰紫草素及联合用药对B16F10细胞的抑制效应;形态学水平观察细胞核的凋亡情况;流式细胞技术检测细胞凋亡及周期的变化;RT-PCR法检测细胞内相关基因的表达;体内实验采用C57BL/6小鼠移植瘤方法。结果紫檀茋有14个靶点与周期相关,乙酰紫草素有12个靶点与凋亡相关,且均有靶点与p53信号通路相关。紫檀茋、乙酰紫草素及联合用药对B16F10细胞的增殖均有抑制作用,并呈浓度剂量依赖性,并具有显著协同效果;联合给药组细胞凋亡率最高,且周期阻滞在G1期;单一给药组的p53、Bax及p21基因的表达随给药时间的延长而增加,而Bcl-2、CDK2、Cyclin E基因的表达随给药时间而减少,联合给药组p53,Bax和Bcl-2的变化差异较单独给药组显著;体内抑瘤实验给药组均有不同程度的抑瘤效果,以联合给药组抑瘤率最大。结论紫檀茋和乙酰紫草素对B16F10细胞的增殖有一定协同抑制作用,认为二者协同激活p53信号通路,诱导周期阻滞和凋亡而发挥药效。
关键词:黑色素瘤;紫檀茋;乙酰紫草素;联合用药;凋亡;细胞周期;抑瘤率
马钱子蜈蚣膏方剂的主要活性成分紫檀茋和乙酰紫草素[1],文献报道对肿瘤均具有较好的疗效[2-3]。紫檀茋是一种低毒的二苯乙烯结构白藜芦醇衍生物,其具有良好的抗炎、抗氧化等活性[4]。而乙酰紫草素属于有毒的萘醌类结构,具有抗菌、助氧化等活性,对多种癌症细胞株的IC50<10 μmol·L-1,并且能引起细胞凋亡,甚至坏死[5-6]。目前仅有文献报道紫草提取物对B16F10黑色素瘤的抗肿瘤活性[7]。紫檀茋和乙酰紫草素是否存在协同的抗肿瘤药效,尚不明确。为了阐述马钱子蜈蚣膏方剂中的两种活性成分的可能药理作用,本研究以黑色素瘤体内外实验为基础,结合系统药理分析其相关机制。
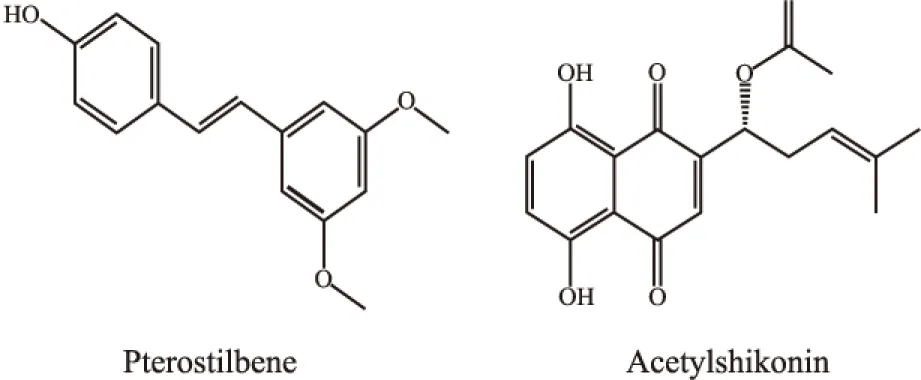
Fig 1 Structure of pterostilbene and acetylshikonin
1材料与方法
1.1实验细胞及动物
小鼠黑色素瘤细胞B16F10,购自中国科学院细胞库;C57BL/6小鼠购于新疆医学院。
1.2主要药物及试剂
乙酰紫草素(ACS,纯度98%)及紫檀茋(PTER,纯度98%),上海源叶生物科技有限公司;胰蛋白酶,美国Sigma公司,批号509D043;胎牛血清,杭州四季青生物工程材料有限公司,批号20150512;DMEM细胞培养基,Gibco公司,批号1643132;MTT、Hoechst 33258染液为北京索莱宝公司,批号为303H058、20150814;Annexin V/FITC凋亡检测试剂盒,南京凯基生物科技发展有限公司,批号20150922;PI染料,购于美国Becton dickinson公司,批号2226867;TaKaRa逆转录试剂盒,日本TaKaRa公司,批号AK5401;UNIQ-10柱式TRIzol总RNA抽提试剂盒,为上海生工公司产品,批号13909KA1108;引物均购自上海生工。
1.3主要仪器
CO2细胞培养箱(Thermo 3131,Thermo,美国);超净工作台(ZHJH 1112B,智诚分析仪器,上海);倒置荧光显微镜(MIC00266,Zeiss,德国);倒置生物显微镜(BDS200 PH,奥特光学仪器,重庆);多功能酶标仪(Thermo VarioFlash 3001,Thermo,美国);低温离心机(5424,Eppendorf,德国);流式细胞仪(FACSCalibur,BD,美国)。
2方法
2.1活性化合物的筛选
马钱子蜈蚣膏方剂由马钱子、蜈蚣、紫草和血竭各等分组成,且对皮肤癌有一定疗效。本研究采用系统药理学的方法,从TCMSP数据库和文献挖掘获得4味药中156个活性化合物,依据化合物的脂水分布系数(alogP)和类药性(DL)等性质,及所含肿瘤相关靶点的数量,与肿瘤疾病的相关性筛选出化合物乙酰紫草素和紫檀茋,采用这两种化合物的联合用药验证此处方对皮肤癌的疗效。同时挖掘出其相关的靶点群,并在后续的实验中加以验证[8]。
2.2细胞培养
取生长状态良好B16F10细胞,用含10%胎牛血清、青霉素(终浓度100 kU·L-1)及链霉素(终浓度100 mg·L-1)的DMEM培养液(pH=7.5),在37℃、5% CO2饱和湿度的培养箱中培养,取对数生长期细胞进行各项实验。
2.3细胞抑制率的测定
96孔培养板上,每孔接种5×104个细胞,培养液体积为100 μL,24 h后加入不同浓度的乙酰紫草素(0、0.125、0.25、0.5、1.0、2.0、3.0、4.0、5.0 μmol·L-1),紫檀茋(0、15、30、45、60、75、90、105 μmol·L-1),联合给药(乙酰紫草素分别为0、0.25、0.5、1.0、2.0 μmol·L-1,紫檀茋均为20 μmol·L-1),每组设6个复孔,37 ℃分别培养24 h,每孔加入5 g·L-1的MTT溶液20 μL,继续培养4 h,800×g离心5 min弃上清,加入DMSO 150 μL,振荡10 min,酶标仪检测570 nm处的吸光度(OD)值,按下式计算细胞增殖抑制率[9]:

2.4倒置显微镜观察B16F10细胞的形态
取对数生长期B16F10细胞,在超净工作台上,用吸管吹打细胞瓶壁,制成细胞悬液,细胞计数并调整细胞悬液的浓度为1×105个,并接种在6孔板上,每孔加2 mL,置于培养箱中培养24 h后给药,终浓度为0 μmol·L-1,紫檀茋20 μmol·L-1,乙酰紫草素0.5 μmol·L-1,联合给药组(紫檀茋20 μmol·L-1和乙酰紫草素0.5 μmol·L-1),药物作用24 h后,分别在倒置显微镜下拍照观察其形态的变化[9]。
2.5Hoechst 33258荧光法观察细胞形态
取对数期细胞,消化制成细胞悬液,按每孔1×105个置于预先置入玻璃盖玻片的6孔培养板中,每孔加细胞悬液2 mL,24 h后给药,终浓度为0 μmol·L-1,紫檀茋20 μmol·L-1,乙酰紫草素0.5 μmol·L-1,联合给药组(紫檀茋20 μmol·L-1和乙酰紫草素0.5 μmol·L-1),在孵育24 h后吸尽培养液,PBS洗2遍,每孔加入1 mL固定液(甲醇 ∶冰醋酸=3 ∶1),固定15 min,去除固定液,用PBS洗2遍,加入10 μg·L-1的Hoechst 33258,染色10 min,用PBS洗2遍,之后将盖玻片放于载玻片之上,于荧光显微镜下观察细胞内凋亡情况[10]。
2.6流式细胞技术检测细胞凋亡率
取对数期细胞,消化制成细胞悬液,按2×105个置于细胞培养瓶内,每瓶加细胞悬液2 mL,24 h后给药,终浓度为0 μmol·L-1,紫檀茋20 μmol·L-1,乙酰紫草素0.5 μmol·L-1,联合给药组(紫檀茋20 μmol·L-1和乙酰紫草素0.5 μmol·L-1),孵育24 h后收集细胞,用冷PBS洗1遍后,置0℃水浴中,加500 μL Binding Buffer悬浮细胞,再加入5 μL Annexin V和5 μL PI,轻轻混匀细胞,10 min后进行流式细胞仪检测[11]。
2.7流式细胞仪检测细胞周期
取对数期细胞消化制成细胞悬液,按2×105个置于细胞培养瓶内,每瓶加细胞悬液2 mL,24 h后给药,终浓度为0 μmol·L-1,紫檀茋20 μmol·L-1,乙酰紫草素0.5 μmol·L-1,联合给药组(紫檀茋20 μmol·L-1和乙酰紫草素0.5 μmol·L-1),孵育24 h后收集细胞,PBS洗2次,体积分数为70%冷乙醇固定过夜。次日离心洗涤后,加入25 mg·L-1的RNase和50 mg·L-1的 PI,避光染色30 min。流式细胞仪检测细胞周期分布,用Modfit软件分析数据[10]。
2.8RT-PCR方法来检测细胞凋亡相关分子
分别按终浓度为紫檀茋20 μmol·L-1,乙酰紫草素0.5 μmol·L-1,联合给药组(紫檀茋20 μmol·L-1和乙酰紫草素0.5 μmol·L-1)处理细胞0、6、12、24 h。使用UNIQ 10柱式TRIzol总RNA提取试剂盒提取RNA,并用TaKaRa逆转录试剂盒,将RNA逆转录为cDNA。PCR扩增条件为:热启动,起始温度94℃,5 min;变性94℃,30 s;退火温度根据引物而设,30 s;延伸72℃,30 s;重复延伸72℃,5 min;扩增循环数22~28。PCR产物经琼脂糖凝胶(2%)电泳后,使用核酸染料染色,凝胶成像系统拍照分析[9]。引物序列及退火温度见Tab 1。
2.9体内实验
小鼠黑色素瘤B16F10细胞用胰酶消化后收集,将0.2 mL含有2×106个细胞的悬液注射到C57BL/6小鼠右侧腋下区域。肿瘤接种24 h后,严格按随机数字表示分成6组[模型组、溶剂对照组,环磷酰胺组20 mg·kg-1、紫檀茋组60 mg·kg-1,乙酰紫草素组6 mg·kg-1,联合用药组(紫檀茋60 mg·kg-1和乙酰紫草素6 mg·kg-1)],紫檀茋和乙酰紫草素用玉米油溶解,每组6只,做黑色素瘤的抑瘤率实验。环磷酰胺每日腹腔注射给药,紫檀茋每日灌胃给药,乙酰紫草素隔日灌胃,给药10 d后,颈部脱臼处死小鼠,剥离腋下瘤,并称重拍照。肿瘤抑瘤率/%=[1-(给药组平均瘤重/模型组平均瘤重)]×100%[13]。

Tab 1 Primer sequence table[12]
2.10数据分析

3结果
3.1靶点群
紫檀茋的靶点中有14个是与周期相关的(淡紫色),乙酰紫草素靶点中有12个是与凋亡相关的(粉色),且紫檀茋和乙酰紫草素分别有6、9个靶点与p53信号通路相关(淡紫色与粉色交集)(Fig 2)。

Fig 2 The network for pterostilbene and acetylshikonin and their candidate targets
3.2联合用药对B16F10细胞有明显的协同作用
紫檀茋对B16F10细胞的24 h半数抑制浓度(IC50) 为78 μmol·L-1,乙酰紫草素对B16F10细胞的24 h半数抑制浓度(IC50) 为2.7 μmol·L-1,紫檀茋和乙酰紫草素对B16F10细胞的抑制作用均随作用浓度与时间增加而增强,呈现一定的时效与量效关系(Fig 3)。二者联合用药的(IC50)为紫檀茋20 μmol·L-1和乙酰紫草素1.1 μmol·L-1,从中可以看出联合给药能明显抑制B16F10细胞的增长。当紫檀茋浓度为20 μmol·L-1时,其对B16F10细胞的抑制率为15.1%,乙酰紫草素浓度为0.5 μmol·L-1时,抑制率为12.3%,当以这两种药物浓度共同作用于B16F10细胞时,抑制率达到37.7%,明显高于单一用药的抑制率。

Fig 3 Changes in melanoma cell viability by afterinvitroacetylshikonin,pterostilbene and combination of both±s,n=3)
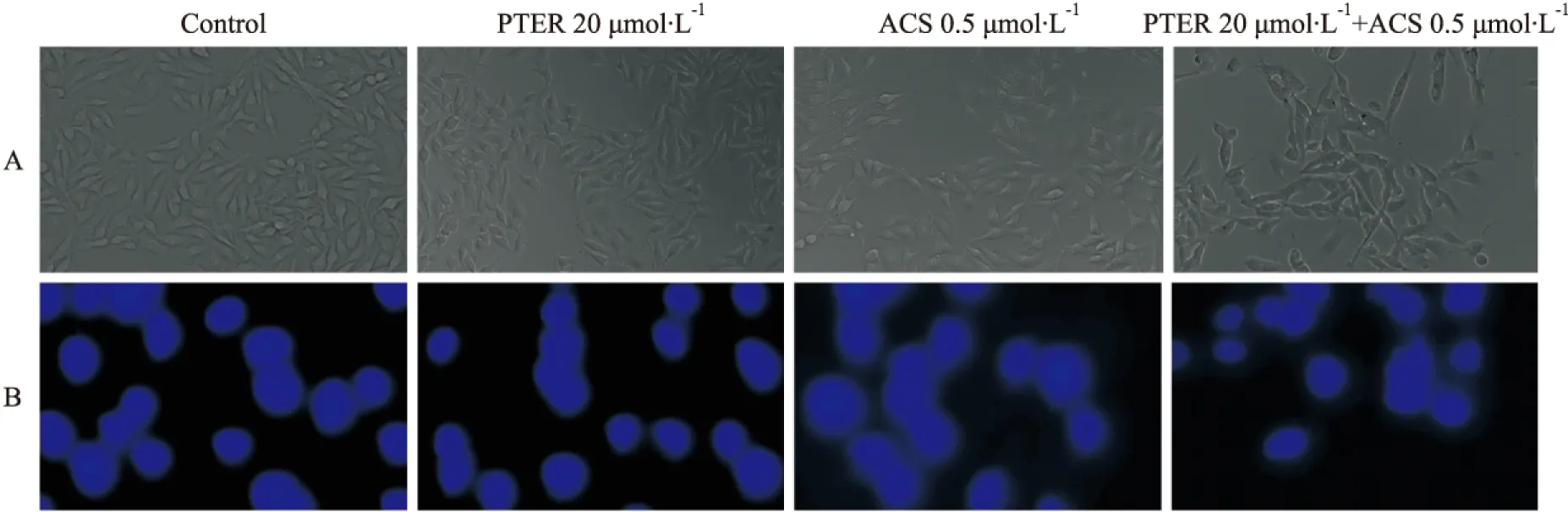
Fig 4 Effect of treatment on morphological changes of B16F10 cells
A:Morphological changes of B16F10 treated with pterostilbene, acetylshikonin, and combination of both under microscope (×200);B: Morphological changes of B16F10 treated with pterostilbene, acetylshikonin, and combination of both observed by Hoechst 33258 stain(×400)
3.3联合用药诱导B16F10细胞凋亡形态变化
普通光镜下观察正常组、紫檀茋组、乙酰紫草素组、联合用药组,可以看到给药后,细胞增殖受到不同程度的抑制,以联合给药组的抑制程度最为明显。细胞核DNA经Hoechst荧光试剂染色后,联合用药组出现了凋亡现象,核固缩、碎裂及凋亡小泡不均一化形态。紫檀茋组基本上没出现凋亡现象,乙酰紫草素有凋亡现象,但较联合用药组凋亡现象少。见Fig 4。
3.4联合用药诱导B16F10细胞凋亡率明显升高
由Fig 5可知,20 μmol·L-1的紫檀茋处理细胞24 h后细胞凋亡率为3.4%,与对照组的3.0%相差不大。在相同条件下,0.5 μmol·L-1的乙酰紫草素的凋亡率为6.7%。二者联合用药后凋亡率明显升高,为11.5%(P<0.05)且有部分晚期凋亡的细胞。
3.5联合用药致B16F10细胞G1期阻滞,减少G2/M期
20 μmol·L-1紫檀茋和0.5 μmol·L-1乙酰紫草素单药作用于细胞24 h后,检测到G1期细胞比例分别为(67.3±2.5)%和(56.0±1.6)%,G2/M期细胞比例分别为(9.6±1.4)%和(10.3±3.5)%,紫檀茋可以引起细胞的G1期阻滞(P<0.05)。联合用药组G1期细胞比例为(72.9±2.4)%,G2/M期为(6.5±1.4)%,从中可以看到联合用药引起G1期明显阻滞,与正常组相比差异有显著性(P<0.01),同时减少G2/M期细胞比例(P<0.05),见Fig 6。
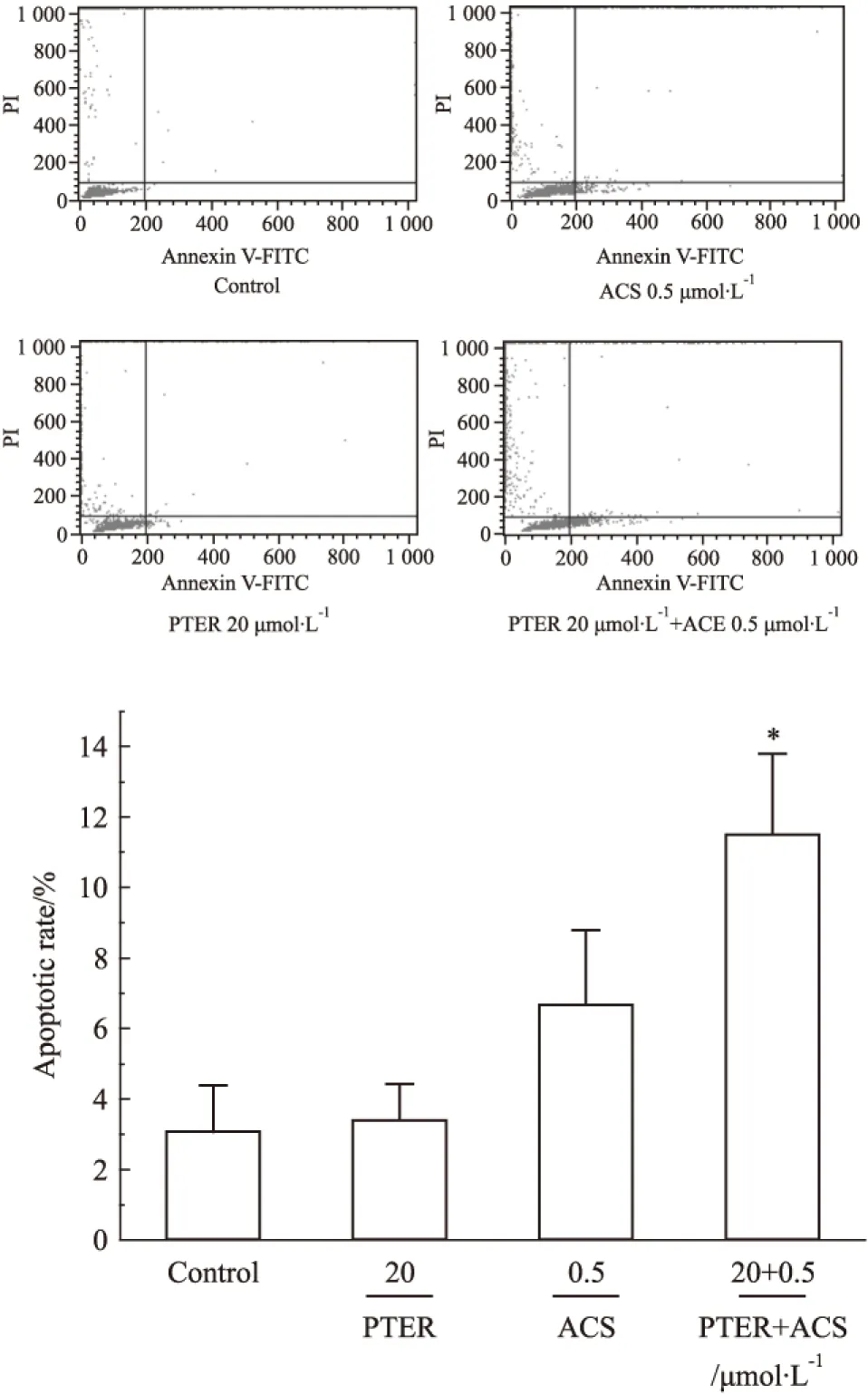
Fig 5 Pterostilbene, acetylshikonin and combination of both induced apoptosis in B16F10 cells(n=3)
*P<0.05vscontrol
3.
3.6RT-PCR法检测细胞周期及凋亡相关蛋白mRNA表达的变化
20 μmol·L-1的紫檀茋和0.5 μmol·L-1乙酰紫草素分别处理B16F10细胞,随作用时间延长p53、p21及Bax的mRNA的表达均逐渐增加,Cyclin E、CDK2、Bcl-2的mRNA的表达逐渐降低。联合给药组随着给药时间的延长,p53、p21及Bax的mRNA的表达逐渐增加,Cyclin E、CDK2、Bcl-2的mRNA的表达逐渐降低,其中p53、Bax及Bcl-2表达差异大于单药组(Fig 7)。

Fig 6 The cell cycle of B16F10 cells treated with acetylshikonin, pterostilbene and combination of both by flow±s,n=3)
*P<0.05,**P<0.01 treated groupvscontrol
3.7联合用药对皮内黑色素移植瘤具有明显的抑瘤作用
从Fig 8可知,环磷酰胺组的抑瘤率为67.2%,对黑色素移植瘤的生长有明显的抑制作用。紫檀茋组和乙酰紫草素组的瘤块大小明显小于模型组,抑瘤率分别为13.4%和12.7%,联合用药组的瘤块大小明显小于任一单药用药组,抑瘤率为19.9%(P<0.05)。
4讨论
恶性黑色素瘤是皮肤中产生的最严重的癌症,其发病率也比其他癌症更迅速,黑色素瘤的发病危险系数与总体死亡率逐年上升,并对化疗的反应很差。近年来,天然产物以毒性低、药源丰富等特点受到人们的广泛关注。
马钱子蜈蚣膏对皮肤癌有很好的疗效,从中筛选出的紫檀茋(甲基化的茋类结构)具有抗炎、雌激素受体激动等较出色生物活性,同时兼具较好的生物利用度和亲脂性[4],但是紫檀茋细胞毒活性低。另一个筛出的乙酰紫草素(萘醌结构)是紫草的主要活性成分[3,6],细胞毒活性高,药物毒性大。在本实验中,细胞毒实验结果显示,紫檀茋和乙酰紫草素均能有效地抑制B16F10细胞的增殖,协同作用效果更加明显,且呈现浓度依赖性。
通过TCMSP化合物-靶点关系数据库预测出紫檀茋和乙酰紫草素的相关靶点,紫檀茋有14个靶点与周期相关[14],乙酰紫草素有12个靶点与凋亡相关[11],同时这两个化合物有13个靶点与p53通路相关[15-16]。在后续实验中发现紫檀茋作用于B16F10细胞后,凋亡率没有增加,而联合用药后凋亡率较单用药组明显升高,且有晚期凋亡的出现,这现象与增加了促凋亡基因Bax的表达,降低抗凋亡基因Bcl-2的表达有关,紫檀茋这两个基因的表达变化不明显。同时联合用药可以引起G1期明显阻滞,降低CDK2和Cyclin E基因的表达。

Fig 7 Expression of cell cycle progression and apoptosis related mRNA assessed by semi-quantitative RT-PCR.

Fig 8 Effects of pterostilbene, acetylshikonin and combination of both on carcinoma inhibition rate induced by melanoma(n=6).
*P<0.05,**P<0.01 treated groupvsmodel group
p53肿瘤抑制蛋白是一个多功能的转录因子,它调控增殖、细胞周期检查点和凋亡的细胞过程。细胞周期阻滞、细胞凋亡及衰老是公认的p53抑制肿瘤形成的主要机制[16]。实验结果可知紫檀茋和乙酰紫草素的协同作用较好,推测其作用机制为通过激活p53信号通路,增加p53及p21基因的表达,诱导周期阻滞和凋亡。
在体内黑色素移植瘤实验中,本研究发现紫檀茋和乙酰紫草素的共同给药在一定程度上能抑制黑色素移植瘤的生长。紫檀茋和乙酰紫草素在其抑制率较低的浓度共同给药时,就能达到很好的抑制B16F10细胞增殖的效果,并具有一定协同作用,这有利于降低药物的毒性反应。紫檀茋和乙酰紫草素可通过改变细胞周期分布,促进细胞凋亡,激活p53信号通路,从而产生协同抑制作用,但对此机制仍需更深层次的研究。
(致谢:本研究在石河子大学药学院新疆特种植物药资源教育部重点实验室完成。衷心感谢导师张波老师和本课题研究中给予我关怀和支持的同学!)
参考文献:
[1]赵建成,谢继增,杨建宇.肿瘤方剂大辞典[M].北京:中国古籍出版社,2009:594.
[1]Zhao J C,Xie J Z,Yang J Y.The dictionary of cancer prescriptions[J]. Beijing:China Ancient Books Publish Comp,2009:594.
[2]Zhang B, Wang X Q, Chen H Y, Liu B H. Involvement of the Nrf2 pathway in the regulation of pterostilbene-induced apoptosis in HeLa cells via ER Stress[J].JPharmacolSci, 2014, 126(3):216-29.
[3]Cho S C, Choi B Y. Acetylshikonin inhibits human pancreatic PANC-1 cancer cell proliferation by suppressing the NF-κB activity[J].BiomolTherap, 2015, 23(5):428-33.
[4]McCormack D, McFadden D. A review of pterostilbene antioxidant activity and disease modification[J].OxidMedCellLongev, 2013:575482.
[5]Zhang B, Chen N, Chen H M, et al. The critical role of redox homeostasis in Shikonin-induced HL-60 cell differentiation via unique modulation of the Nrf2/ARE pathway[J].OxidMedCellLongev, 2012:781516.
[6]Zeng Y, Liu G, Zhou L M. Inhibitory effect of acetylshikonin on human gastric carcinoma cell line SGC-7901invitroandinvivo[J].WorldJGastroenterol, 2009, 15(15):1816-20.
[7]Rajasekar S, Park D J, Park C, et al.Invitroandinvivoanticancer effects ofLithospermumerythrorhizonextract on B16F10 murine melanoma[J].JEthnopharmacol, 2012, 144(2):335-45.
[8]Ru J L, Li P, Wang J N, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J].JCheminf, 2014, 6: 13.
[9]龚福恺,王晓琴,李照雪,等.α维尼非林经线粒体凋亡途径诱导K562细胞凋亡[J].中国药理学通报,2015,31(3):391-5.
[9]Gong F K, Wang X Q, Li Z X, et al. α-viniferin induced apoptosis in K562 cells via mitochondrial pathway[J].ChinPharmacolBull, 2015, 31(3):391-5.
[10]高默杰,徐忠伟,王凤梅,等.钠钾泵抑制剂通过调节细胞周期相关蛋白的生成介导肝癌HepG2细胞周期S期阻滞与凋亡[J].中国药理学通报,2010,26(4):452-6.
[10]Gao M J, Xu Z W, Wang F M, et al. The linkage between cell cycle S phase arrest and apoptosis on human hepatocellular carcinoma HepG2 induced by Na+,K+-ATP ase inhibitors via regulating proteins associated with cell cycle[J].ChinPharmacolBull, 2010, 26(4):452-6.
[11]Moon J, Koh S S, Malilas W, et al. Acetylshikonin induces apoptosis of hepatitis B virus X protein-expressing human hepatocellular carcinoma cells via endoplasmic reticulum stress[J].EurJPharmacol, 2014, 735:132-40.
[12]Liu L L, Zhang B, Yuan X, et al. Alternol induces an S-phase arrest of melanoma B16F10 cells[J].CellBiolInternat, 2014, 38(3):374-80.
[13]郑振洨,张玲菊,黄常新,等.茅莓总皂苷对黑色素瘤的抗肿瘤作用研究[J].中国中药杂志,2007,32(19):2055-8.
[13]Zheng Z X, Zhang L J, Huang C X, et al. Antitum our effect of total saponins ofrubusparvifoliuson malignat melanoma[J].ChinaJChinMatMed, 2007, 32(19):2055-8.
[14]Hsiao P C, Chou Y E, Tan P, et al. Pterostilbene simultaneously induced G0/G1-phase arrest and MARK-mediated mitochondrial-derived apoptosis in human acute myloid leukemia cell lines[J].PloSOne, 2014, 9(8):e105342.
[15]Lin V C, Tsai Y C, Lin J N, et al. Activation of AMPK by pterostilbene suppresses lipogenesis and cell-cycle progression in p53 positive and negative human prostate cancer cells[J].AgricultFoodChem, 2012, 60(25):6399-407.
[16]Li T Y, Kon N, Jiang L, et al. Tumor suppression in the absence of p53-mediated cell-cycle arrest, apoptosis, and senescence[J].Cell, 2012, 149(6):1269-83.
The synergistic antiproliferative effect of pterostilbene and acetylshikonin on B16F10 cells
CHEN Hong1,2,ZHANG Shan-shan1,2,DONG Jin-lei1,2,ZHONG Jing1,2, WANG Xiao-qin1, ZHANG Bo1,2
(1.SchoolofPharmaceutics; 2.KeyLaboratoryofXinjiangEndemicPhytomedicineResources,MinistryofEducation,ShiheziUniversity,ShiheziXinjiang832002,China)
Abstract:AimTo evaluate the synergistic effect of anti-tumor by the pterostilbene and acetylshikonin acting on B16F10 cells and investigate the interrelated mechanisms.MethodsThe research screened and analyzed the target-related of pterostilbene and acetylshikonin by system-pharmacological methods. The proliferative inhibition rate of B16F10 cells were measured by MTT. The apoptosis in B16F10 cells were proved by both cellular morphological and biochemical methods. The expression of apoptotic genes were assessed via RT-PCR. The apoptotic rate and cell cycle were measured by flow cytometry. Melanoma models were established in C57BL/6 mice, and the inhibitory rate of tumor growth was measured.ResultsThe 14 targets of pterostilbene were closely related to cell cycle, acetylshikonin′s 12 targets displayed a relationship with apoptosis, and correlated with p53 signaling pathway. Pterostilbene along with acetylshikonin significantly inhibited cell proliferation of B16F10 cells in a dose-dependent way and resulted a remarkable synergistic effect. The apoptotic rate reached highest with a blocked-cell cycle at G1phase in the co-treatment group. The RT-PCR results showed that the expressions of p53, Bax and p21 were up-regulated and the expressions of Bcl-2, CDK2 and Cyclin E were down-regulated with time. The changes of p53, Bax and Bcl-2 were obvious in combined treated group. All treatmentsinvivoshowed different tumor inhibition rates while co-treatment group showed highest.ConclusionPterostilbene cooperated with acetylshikonin inhibits the proliferation in B16F10 cells, and activates the p53 signaling pathway to induce the B16F10 cells apoptosis and a cell cycle arrest.
Key words:melanoma; pterostilbene; acetylshikonin; drug combination; apoptosis; cell cycle; tumor inhibition rate
收稿日期:2016-01-06,修回稿日期:2016-02-26
基金项目:国家自然科学基金资助项目(No 81460566);兵团医药专项(No 2014BA029);石河子大学对口支援高校名师“结对子”计划资助(No SDJDZ201503)
作者简介:陈虹(1989-),女,硕士生,研究方向:肿瘤药理学,E-mail:541103537@qq.com;
doi:10.3969/j.issn.1001-1978.2016.06.016
文献标志码:A
文章编号:1001-1978(2016)06-0818-07
中国图书分类号:R284.1;R329.24;R329.25;R739.5
网络出版时间:2016-5-25 15:39网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160525.1539.032.html
张波(1978-),男,博士,教授,研究方向:系统药理学,通讯作者,E-mail:bozhang_lzu@126.com
