早期绒毛和足月分娩胎盘组织中雌二醇水平测定及其意义
2016-11-12柳洁张园崔毓桂高莉公益明刘嘉茵
柳洁,张园,崔毓桂,高莉,公益明,刘嘉茵
·论著·
早期绒毛和足月分娩胎盘组织中雌二醇水平测定及其意义
柳洁,张园,崔毓桂,高莉,公益明,刘嘉茵
目的:通过检测自然妊娠早期孕妇外周血及绒毛组织、足月分娩时孕妇外周血、胎盘组织以及脐动脉血中雌二醇(E2)水平,并体外培养滋养层细胞系BeWo细胞,探讨E2的作用。方法:本研究纳入20例非意愿妊娠行妊娠早期流产者、20例足月妊娠行剖宫产者,采用化学发光免疫分析(CLIA)检测妊娠早期流产绒毛组织、孕妇外周血以及足月分娩时孕妇外周血、脐动脉血和胎盘组织中E2水平。单层培养BeWo细胞,用0 mol/L、5×10-7mol/L、5×10-8mol/L、5×10-9mol/L浓度的E2各处理1,3,6,12 h后,用Millicell ESR-2测定其跨膜电阻(TEER),观察BeWo细胞间紧密连接的完整性。结果:妊娠早期的孕妇血清E2浓度[(3.44±1.30)nmol/L]低于足月妊娠孕妇[(509.78±197.82)nmol/L],差异有统计学意义(t=10.2,P<0.001);而绒毛组织中E2浓度[(30.82±13.91)pmol/mg]显著高于足月胎盘组织中E2浓度[(17.21± 5.37)pmol/mg],差异有统计学意义(t=4.1,P<0.001)。用5×10-7mol/L的E2处理BeWo细胞12 h后,TEER下降(P<0.05);5×10-8mol/L和5×10-9mol/L E2处理对BeWo细胞TEER无明显影响(P>0.05)。结论:妊娠早期绒毛组织中含有高浓度的E2,足月分娩时胎盘组织中E2相对较低;在体外实验中,不同浓度雌激素可能影响胎盘滋养细胞连接功能的维持,5×10-7mol/L可作为E2处理BeWo细胞的有效浓度。
妊娠;绒毛膜绒毛;胎盘;雌二醇
(J Int Obstet Gynecol,2016,43:298-301)
人类妊娠早期雌激素主要由卵巢黄体产生,妊娠9周以后胎盘利用来自母体和胎儿肾上腺的雄激素作为前体合成雌二醇(E2)取代黄体成为雌激素的主要来源[1]。胎盘中雌激素作用贯穿妊娠的各个阶段,有研究提示非生理浓度雌激素环境与异常胎盘相关的妊娠期并发症如子痫前期(PE)、胎儿生长受限(FGR)有关[2-4]。然而,胎盘中雌激素的确切功能仍不明确,甚至绒毛组织和胎盘组织中的雌激素水平及其变化规律亦未阐明。现有的研究大多是关于孕妇外周血或脐血中的E2水平,或者是基于孕妇外周血中雌激素水平进行的滋养层细胞体外试验[5]。组织中的激素合成与分泌、激素结合蛋白、受体、靶细胞构成等机制,使组织中雌激素水平与外周血中激素水平不完全一致[6]。所以,直接测定绒毛组织和胎盘组织中的E2浓度,对阐明雌激素在胎盘形成、功能以及胎儿发育等过程中的作用非常重要。本研究检测正常妊娠早期绒毛组织和足月妊娠胎盘组织中的E2水平,并用E2处理单层培养滋养层细胞系(BeWo细胞)观察跨膜电阻(TEER)的变化,为今后体内、体外研究雌激素对胎盘功能和胚胎发育作用提供参考。
1 对象与方法
1.1 研究对象选择2015年7月在南京医科大学第一附属医院产科足月分娩的孕产妇共20例,年龄25~41岁,孕38+3~39+6周,单胎,无妊娠期并发症,因其他因素行择期剖宫产手术分娩,而非子宫内膜、胎盘发育、胎儿发育的原因。其他因素是指骨盆略小、身体较瘦弱、产妇严重怕疼、不具备无痛分娩条件等,这些因素对胎盘组织结构与功能的影响小;而择期剖宫产的产妇应激反应小、产程短而且更加可控,因而对胎盘组织中激素水平的影响小。新生儿出生体质量(3 560± 545)g,Apgar评分为10分。另选择同期本院计划生育科因非意愿妊娠而行人工流产手术的患者共20例,年龄21~40岁,平均孕周为7.74(6.00~9.48)周,所有患者均通过术前B超确认为单胎妊娠,无胚胎停育,无其他妊娠相关合并症。所有受试者均签订知情同意书,本研究方案得到本院伦理委员会批准。
1.2 标本的采集和处理
1.3 细胞培养和TEER检测BeWo细胞(中国武汉大学中国典型培养物保藏中心)用10%胎牛血清(美国Cell Science公司)+90%F12K(美国Gibco公司)+10%青霉素和链霉素的培养液于培养瓶中进行培养,待细胞密度达到80%时,将细胞消化离心后用培养液重悬,浓度调制为5×105个/mL;Millicell培养小室中(美国Millipore公司)每孔滴细胞悬液500 μL,进行单层培养,方法参见文献[13]。待BeWo细胞形成完整的单层细胞后,分别用含有0(对照),5×10-9,5×10-8,5×10-7mol/L E2(美国Sigma公司)的培养液培养1,3,6,12 h,每个时间点均用Millicell ESR-2(美国Millipore公司)测定其TEER。以上试验使用不同批次细胞,重复3次。本研究比较的是以对照为基数(设定为1),不同E2处理浓度下TEER的相对表达倍数,而非TEER的具体数值。
1.4 统计学方法采用SPSS 20.0统计软件进行统计学分析。定量资料用均数±标准差(±s)表示,组间比较采用Student′s t检验。P<0.05为差异有统计学意义。
2 结果
2.1 妊娠早期和足月分娩患者血清、胎盘(绒毛)组织匀浆液中E2水平在妊娠早期,绒毛组织中有较高浓度的E2。妊娠早期孕妇外周血血清E2浓度低于足月妊娠孕妇,而孕妇绒毛组织E2浓度显著高于足月妊娠孕妇胎盘组织,差异有统计学意义(均P<0.001)。足月分娩时,新生儿脐动脉血清中E2浓度低于足月孕妇外周血清中E2浓度,差异有统计学意义(t=7.3,P<0.001)。见表1。
表1 2组患者血清、胎盘(绒毛)组织匀浆液中E2水平(±s)

表1 2组患者血清、胎盘(绒毛)组织匀浆液中E2水平(±s)
组别n外周血(nmol/L)胎盘(绒毛)(pmol/mg)脐动脉血(nmol/L)妊娠早期203.44±1.3030.82±13.91-足月分娩20509.78±197.8217.21±5.37137.41±44.43 t(P)10.2(<0.001)4.1(<0.001)-
2.2 不同浓度E2处理条件下滋养层细胞的TEER变化5×10-8mol/L和5×10-9mol/L的E2处理单层培养的BeWo细胞,各个时间点的TEER与对照组相比差异均无统计学意义(P>0.05);5×10-7mol/L E2处理BeWo细胞12h,TEER较对照组显著下降,差异有统计学意义(P<0.05),提示细胞电势能异常,BeWo细胞紧密连接受损,并因此影响细胞渗透性。见图1。
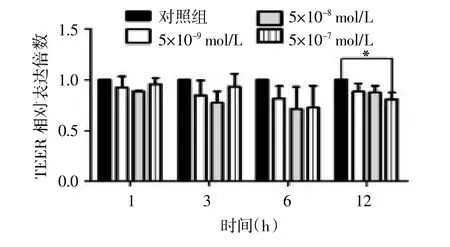
图1 不同浓度E2处理条件下,滋养层细胞跨上皮电阻
3 讨论
在妊娠过程中,母体外周血E2水平稳步上升,且妊娠中、晚期的升高速率远高于妊娠早期,这是由于胎盘在妊娠期作为内分泌器官向母体循环系统中分泌大量雌激素[6];既往文献报道在妊娠早期末,母体外周血中的E2由最初的0.34~0.45 nmol/L升至5~11 nmol/L,临产前可达50~100 nmol/L[14-17]。本研究结论与文献报道一致,确切数值略有差别,可能是由于检测方法不同和病例数相对较少。
本研究结果显示,妊娠早期的绒毛组织中E2水平显著高于足月分娩胎盘组织中的E2水平,这与母亲外周血E2水平的变化明显不同。胎盘组织中的雌激素来源,除母体来源外,胎盘本身还能够合成雌激素,且在妊娠9周以后成为母体(外周血中)雌激素的主要来源[1]。本研究中20例非意愿妊娠行早期流产者,平均孕周为7.74周,因此其绒毛组织中E2来源于母体和胎盘两方面;同时,绒毛组织可能存在特殊的雌激素富集机制。本研究采用体外单层培养滋养层细胞系BeWo细胞,用5×10-9、5×10-8、5×10-7mol/L浓度的E2处理1,3,6,12 h,测定TEER以评估BeWo细胞间紧密连接的完整性,也说明在体外实验中设计E2浓度的合理性。结果发现,5×10-7mol/L E2处理Bewo细胞12 h后,TEER显著降低,提示不同浓度的雌激素可能参与胎盘滋养细胞功能的维持和调节,在体外实验中,5×10-7mol/L可作为处理BeWo细胞的有效浓度。
与妊娠早期绒毛组织相比,足月分娩胎盘组织中的E2水平降低。足月胎盘组织一方面合成雌激素逐渐下降,另一方面对E2的代谢更为旺盛,同时也说明足月分娩时胎盘功能对E2的依赖性有所下降。雌激素可促进胎盘血管生成,改变孕产妇心血管功能以适应妊娠状态[18-20],并对胚胎发育与成熟起重要作用[21]。胎盘组织中雌激素水平异常,可能与妊娠期并发症有关,如PE、FGR、新生儿低体质量的风险增加。研究表明,胚胎植入、胎盘形成和成熟时的非生理剂量雌激素环境,可能通过影响滋养层细胞的侵袭功能,并使胎盘血管重塑受限,继而出现胎盘缺血、缺氧,导致胎盘功能异常,最终导致不良妊娠结局[22-24]。通过体内、体外试验,研究雌激素对胎盘结构和功能的影响,对研究诸如PE、子痫、FGR等妊娠病理也是必要的。
综上所述,本研究直接测定了正常自然妊娠女性妊娠早期绒毛组织和足月分娩胎盘组织中的E2水平,并在体外单层培养的BeWo细胞上初步探讨E2的作用。妊娠早期绒毛组织中含有高浓度的E2,足月分娩时胎盘组织中E2相对较低;在体外实验中,不同浓度的雌激素可能参与胎盘滋养细胞功能的维持和调节,5×10-7mol/L可作为E2处理BeWo细胞的有效浓度。
[1]Albrecht ED,Pepe GJ.Placental steroid hormone biosynthesis in primate pregnancy[J].Endocr Rev,1990,11(1):124-150.
[2]Farhi J,Ben-Haroush A,Andrawus N,et al.High serum oestradiol concentrations in IVF cycles increase the risk of pregnancy complications related to abnormal placentation[J].Reprod Biomed Online,2010,21(3):331-337.
[3]Kalra SK,Ratcliffe SJ,Coutifaris C,et al.Ovarian stimulation and low birth weight in newborns conceived through in vitro fertilization [J].Obstet Gynecol,2011,118(4):863-871.
[4]Imudia AN,Awonuga AO,Kaimal AJ,et al.Elective cryopreservation of all embryos with subsequent cryothaw embryo transfer in patients at risk for ovarian hyperstimulation syndrome reduces the riskof adverseobstetric outcomes:a preliminary study[J].FertilSteril,2013,99(1):168-173.
[5]Chen JZ,Wong MH,Brennecke SP,et al.The effects of human chorionic gonadotrophin,progesterone and oestradiol on trophoblast function[J].Mol Cell Endocrinol,2011,342(1/2):73-80.
[6]Evain-Brion D,Malassine A.Human placenta as an endocrine organ [J].Growth Horm IGF Res,2003,13(Suppl A):S34-S37.
[7]Sood R,Zehnder JL,Druzin ML,et al.Gene expression patterns in human placenta[J].Proc Natl Acad Sci U S A,2006,103(14):5478-5483.
[8]崔毓桂,张桂元,郁琦,等.男性假两性畸形临床与实验研究(对雄激素不敏感综合征三例)[J].南京医科大学学报(自然科学版),1997,17(1):28-31.
[9]贾金铭,崔毓桂,张桂元,等.中药消癃通闭对犬前列腺组织中T、E2、DHT、AR和5α-还原酶的影响[J].现代泌尿外科杂志,1997,2(1):45-49.
[10]崔毓桂,华力新,王兴海,等.犬自发性前列腺增生组织中雄激素和5α-还原酶活性研究[J].国际生殖健康/计划生育杂志,2009,28(5):334-336.
[11]崔毓桂,张桂元.男性不同发育阶段包皮组织中雄激素和5α-还原酶活性变化的研究[J].中华内分泌代谢杂志,1998,14(5):287-290.
[12]崔毓桂,张桂元.男性胎儿5α-还原酶活性和雄激素及其受体的研究[J].中华男科学杂志,2001,7(4):223-225.
[13]Bode CJ,Jin H,Rytting E,et al.In vitro models for studying trophoblast transcellular transport[J].Methods Mol Med,2006,122:225-239.
[14]Hassiakos D,Mantzavinos T,Kalomiris K,et al.Comparison of maternal serum estradiol and progesterone levels in pregnancies after induced and spontaneous ovulation[J].Arch Gynecol Obstet,1991,248(3):145-150.
[15]O′Leary P,Boyne P,Flett P,et al.Longitudinal assessment of changes in reproductive hormones during normal pregnancy[J].Clin Chem,1991,37(5):667-672.
[16]Soldin OP,Guo T,Weiderpass E,et al.Steroid hormone levels in pregnancy and 1 year postpartum using isotope dilution tandem mass spectrometry[J].Fertil Steril,2005,84(3):701-710.
[17]Tulchinsky D,Hobel CJ,Yeager E,et al.Plasma estrone,estradiol,estriol,progesterone,and17-hydroxyprogesteroneinhuman pregnancy.I.Normal pregnancy[J].Am J Obstet Gynecol,1972,112 (8):1095-1100.
[18]BurtonGJ,WoodsAW,JauniauxE,etal.Rheologicaland physiological consequences of conversion of the maternal spiral arteries for uteroplacental blood flow during human pregnancy[J]. Placenta,2009,30(6):473-482.
[19]Chang K,Lubo Zhang.Review article:steroid hormones and uterine vascular adaptation to pregnancy[J].Reprod Sci,2008,15(4):336-348.
[20]Magness RR,Rosenfeld CR.Local and systemic estradiol-17 beta: effects on uterine and systemic vasodilation[J].Am J Physiol,1989,256(4 Pt 1):E536-E542.
[21]Albrecht ED,Aberdeen GW,Pepe GJ.The role of estrogen in the maintenance of primate pregnancy[J].Am J Obstet Gynecol,2000,182(2):432-438.
[22]Imudia AN,Awonuga AO,Doyle JO,et al.Peak serum estradiol level during controlledovarianhyperstimulationis associatedwith increased risk of small for gestational age and preeclampsia in singleton pregnancies after in vitro fertilization[J].Fertil Steril,2012,97(6):1374-1379.
[23]Bonagura TW,Pepe GJ,Enders AC,et al.Suppression of extravillous trophoblast vascular endothelial growth factor expression and uterine spiral artery invasion by estrogen during early baboon pregnancy[J]. Endocrinology,2008,149(10):5078-5087.
[24]Lyall F,Robson SC,Bulmer JN.Spiral artery remodeling and trophoblast invasion in preeclampsia and fetal growth restriction: relationship to clinical outcome[J].Hypertension,2013,62(6):1046-1054.
Placental and Villous Concentrations of Estradiol in the Pregnancy and Its Significance
LIU Jie,ZHANG Yuan,CUI Yu-gui,
GAO Li,GONG Yi-ming,LIU Jia-yin.Clinical Center of Reproductive Medicine,The First Affiliated Hospital of Nanjing Medical University,Nanjing 210029,China
ZHANG Yuan,E-mail:zhangyuan_ccrm@126.com;LIU Jia-yin,E-mail:jyliu_nj@126.com
Objective:To test estradiol(E2)levels in the maternal peripheral blood,villi and placenta in the first trimester and term parturition,as well as the estradiol level of umbilical artery blood in term delivery.Culture trophoblast cell line BeWo in vitro to investigate the role of E2.Methods:This study included 20 unwilling pregnant women who want to have early artificial abortion and 20 pregnant women of full term cesarean delivery.The levels of E2in the tissues of early abortion,peripheral blood of pregnant women and umbilical artery blood,placenta tissue of the women during labor were measured by chemiluminescence immunoassay(CLIA).After BeWo cells in monolayer culture,those cells were treated with E2of 0 mol/L,5×10-7mol/L,5×10-8mol/L and 5×10-9mol/L for 1,3,6 and 12 h,and then transepithelial resistance(TEER)was measured by millicell ESR-2 to observe the integrity of the tight junctions between BeWo cells.Results:E2were lower in peripheral plasma from early pregnancy[(3.44±1.30)nmol/L]compared with that from third trimesters[(509.78±197.82)nmol/L](t=10.2,P<0.001).However,E2were higher in tissue obtained from villus[(30.82±13.91)pmol/mg]than that from third trimesters placenta[(17.21±5.37)pmol/mg](t= 4.1,P<0.001).A decrease of TEER was observed after the treatmeat of E2at a concentration of 5×10-7mol/L for 12 hours(P<0.05).The other two concentrations,5×10-8mol/L and 5×10-9mol/L,had no significant effect on the TEER of BeWo cells at all time points(P>0.05).Conclusions:The concentrations of E2in villus obtained from first trimester is higher;E2in full-term birth placenta tissues is relatively lower;In vitro,different concentrations of E2may affect the maintenance of junction between trophoblast cells,5×10-7mol/L can be used as the effective concentrations of estradiol to treat with BeWo cells.
Pregnancy;Chorionic villi;Placenta;Estradiol
2015-11-28)
[本文编辑 王昕]
国家自然科学基金(81401265);国家973项目(2012CB944902,2012CB944703);江苏省自然科学青年基金(BK20141025)
210029南京医科大学第一附属医院生殖医学科
张园,E-mail:zhangyuan_ccrm@126.com;刘嘉茵,E-mail:jyliu_nj@126.com
