川芎嗪对宫颈癌HeLa细胞免疫抑制作用的影响
2016-11-12张雯珂陈亚琼
张雯珂,陈亚琼
川芎嗪对宫颈癌HeLa细胞免疫抑制作用的影响
张雯珂,陈亚琼
目的:研究川芎嗪(LHC)对宫颈癌HeLa细胞免疫抑制的影响。方法:以LHC作用HeLa细胞后,培养48 h,离心后收集上清(LHC-S1),重悬,再次培养48 h,离心后收集上清(LHC-S2),重悬,再次培养48 h,离心后收集上清(LHC-S3)。以与LHC组相同条件培养未经药物作用的HeLa细胞作为对照,同样连续收集3次的培养上清(Control-S1、Control-S2、Control-S3)。用酶联免疫吸附试验(ELISA)法检测上清中转化生长因子β1(TGF-β1)、白细胞介素10(IL-10)的含量,紫外分光光度法检测前列腺素E2(PGE2)含量,噻唑蓝(MTT)法检测对植物血凝素(PHA)诱导的外周血单核细胞(PBMC)增殖及对细胞毒性T淋巴细胞(CTL)细胞毒作用的影响,以流式细胞术(FCM)分析经及不经药物作用的HeLa上清对外周血淋巴细胞亚群表型的影响。结果:(1)对照组3次培养上清中TGF-β1、IL-10和PGE2A278 nm值差异均无统计学意义(P>0.05);LHC组3次培养上清中差异均有统计学意义(P<0.05),TGF-β1逐渐降低,IL-10前2次相似,均低于第3次,PGE2A278 nm在第2次最低;除第2次的IL-10外,LHC组IL-10均低于相应对照组。(2)3次培养上清对PBMC增殖的抑制率和对CTL的杀伤率在对照组,以及对CTL的杀伤率在LHC组和LHC组与相应对照组间差异均无统计学意义(P>0.05);LHC组第1次培养上清对PBMC增殖的抑制率最低。(3)对照组3次培养上清、LHC组3次培养上清外周血淋巴细胞亚群表型之间差异均有统计学意义;与对照组相比,相应LHC组的前2次培养上清CD3+、CD4+、CD25+、CD4+CD25-升高(P<0.05),CD4+CD25+降低,第3次之间差异无统计学意义(P>0.05)。结论:LHC可下调HeLa细胞分泌免疫抑制分子,减少免疫抑制分子对PHA诱导的PBMC增殖的抑制,降低CD4+CD25+表达,上调CD3+、CD4+、CD25+、CD4+CD25-,可在一定程度上逆转HeLa细胞的肿瘤免疫抑制。
川芎嗪;HeLa细胞;免疫耐受
(J Int Obstet Gynecol,2016,43:348-352)
肿瘤细胞通过分泌转化生长因子β1(TGF-β1)、白细胞介素10(IL-10)及前列腺素E2(PGE2)等免疫抑制分子,逃避免疫监视是肿瘤发生发展的重要机制。已有实验证明HeLa细胞可分泌上述免疫抑制分子[1-3]。因此,寻找可下调宫颈癌免疫抑制分子分泌的药物,是宫颈癌免疫治疗的重要研究方向。川芎嗪是我国的传统中药,具有抗肿瘤作用[4],对于其下调HeLa细胞免疫抑制分子分泌的研究,国内外报道较少,现将笔者的研究报告如下。
1 材料与方法
1.1 材料
海克隆生物化学制品(北京)有限公司生产,每升完全培养液(complete medium,CM)中含小牛血清0.1 L,青霉素1×105U、链霉素100 mg;标准胎牛血清为天津市灏洋生物制品科技责任有限公司产品;青霉素及链霉素为华北制药集团产品;胰蛋白酶、植物血凝素(PHA)、噻唑蓝(MTT)、TGFβ1及IL-10定量酶联免疫吸附试验(ELISA)检测试剂盒均为Sigma公司产品;分析纯二甲基亚砜(DMSO)、氢氧化钾(KOH)及甲醇为天津市永大化学制剂开发中心产品;盐酸川芎嗪(Ligustrazine Hydrochloride,LHC)注射液为北京市永康药业有限公司产品,国药准字H11020960,每支2 mL,40 mg/支,4℃避光保存,实验前用DMEM稀释至所需浓度;抗人CD25-FITC,CD-PE 及CD3-ECD抗体为BECKMAN COULTER公司产品;MK353型酶联免疫仪为芬兰Thermolabsystems产品;TU-1901型紫外分光光度仪为北京浦西通用仪器有限公司产品。
1.2 方法
PBMC浓度调整至2×106/mL,取250 μL接种于培养瓶,加入2 μg/mL PHA 250 μL,同时各瓶分别加入500 μL LHC-S1、LHC-S2、LHC-S3及Control-S1、Control-S2、Control-S3,37℃5%CO2饱和湿度中培养48 h后收集洗涤,重悬细胞后加入抗人CD3-ECD、CD25-FITC及CD4-PE单克隆抗体,各10 μL,室温下混匀孵育30 min,洗涤细胞。FCM检测阳性细胞百分率。阳性细胞抑制率=(对照组阳性细胞百分率-实验组阳性细胞百分率)/对照组阳性细胞百分率×100%。对照组为荧光标记相同的人PBMC无关同型IgG1为对照,设淋巴细胞门。
1.3 统计学方法应用SPSS 19.0软件处理,定量资料正态分布的数据用均数±标准差(±s)表示,结果进行方差齐性检验后,用成组设计两样本均数比较的单侧t或t′检验,以直线回归方程表示免疫抑制分子的含量。P<0.05为差异有统计学意义。
2 结果
2.1 免疫抑制分子TGF-β1、IL-10及PGE2含量及LHC作用与免疫抑制功能的关系以标准品浓度的对数值为横坐标,以ELISA法检测的A值为纵坐标,绘制TGF-β1、IL-10的标准曲线,直线回归分析显示,检测2种免疫抑制分子的直线回归曲线方程分别为:TGF-β1=0.081+0.099X(t=3.608,P<0.05);IL-10=-0.068+0.265X(t=4.583,P<0.05)。PGE2A值见表1,3个对照组的TGFβ1、IL-10的含量及PGE2的A278值差异均无统计学意义(P>0.05);3个LHC组差异均有统计学意义(P<0.05),3组的TGF-β1逐渐下降,除第2次的IL-10外,LHC组IL-10均低于相应对照组,PGE2A278 nm值在第2次培养后降低,而第3次培养后又升至第1次培养后水平。除LHC-S2组与Control-S2组的IL-10比较差别无统计学意义外,其余的LHC组均低于相应的对照组。
2.2 培养上清对PBMC增殖及对CTL杀伤活性的影响Control-S1和LHC-S1均对PHA诱导的PBMC增殖有抑制作用。LHC-S1对PBMC增殖的抑制率低于Control-S1(P<0.05);LHC-S2及LHC-S3 对PBMC增殖的抑制率与相应对照组相似(P>0.05)。人外周血单核细胞正常杀伤对照组(无上清作用)的杀伤率为(68.74±4.67)%,与正常杀伤对照相比,Control组和LHC组均可显著抑制CTL的杀伤活性(P<0.01);与Control相应对照组相比,LHC各组对CTL杀伤活性的抑制作用无明显变化(P>0.05)。见表2。
2.3 培养上清对PHA诱导的T淋巴细胞亚群的影响与PHA转化正常组(Control不含上清)CD3+、CD4+、CD25+、CD4+CD25-细胞百分率相比,Control-S1相应各组细胞百分率明显降低(P<0.05),CD4+CD25+升高。LHC组3次培养上清外周血淋巴细胞亚群表型之间差异均有统计学意义(P<0.05);与对照组相比,相应LHC组的前2次培养上清CD3+、CD4+、CD25+、CD4+CD25-升高(P<0.05),CD4+CD25+降低,第3次之间差异无统计学意义(P>0.05)。见表3。
表1 LHC作用后的HeLa细胞培养上清中免疫抑制因子的浓度(±s)
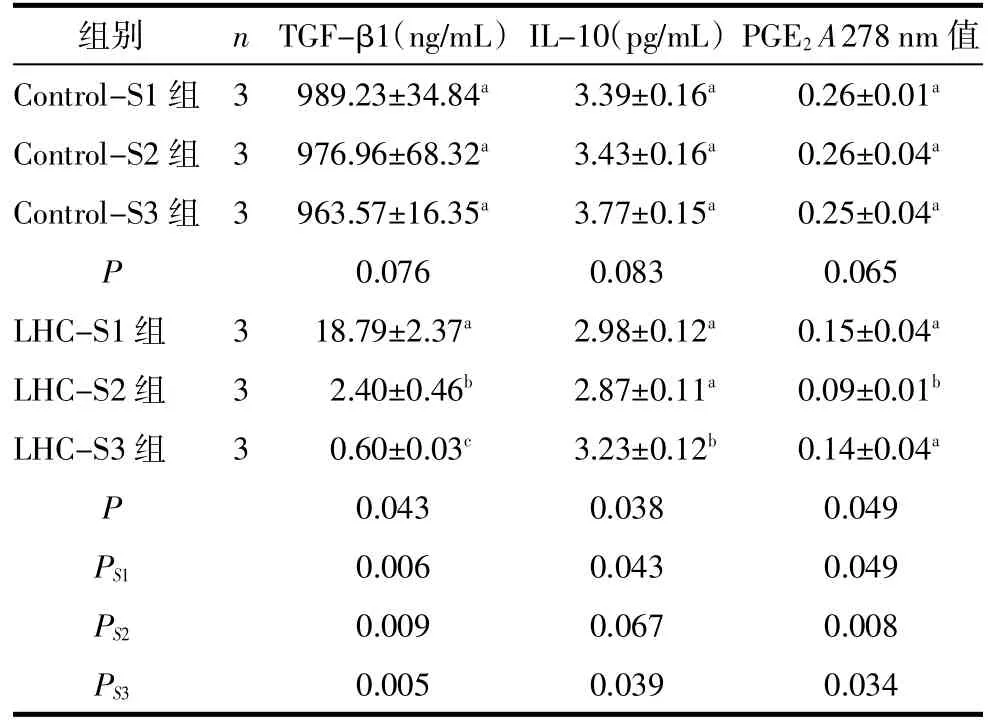
表1 LHC作用后的HeLa细胞培养上清中免疫抑制因子的浓度(±s)
注:Control 3组及LHC 3组单因素方差分析的结果,多重比较见字母a,b,c标示,字母一致的组间差异无统计学意义,字母不一致的组间差异有统计学意义,P<0.05;PS1~PS3为LHC组与相对应的Control组比较结果。
组别nTGF-β1(ng/mL)IL-10(pg/mL)PGE2A278 nm值Control-S1组3989.23±34.84a3.39±0.16a0.26±0.01aControl-S2组3976.96±68.32a3.43±0.16a0.26±0.04aControl-S3组3963.57±16.35a3.77±0.15a0.25±0.04aP 0.0760.0830.065 LHC-S1组318.79±2.37a2.98±0.12a0.15±0.04aLHC-S2组32.40±0.46b2.87±0.11a0.09±0.01bLHC-S3组30.60±0.03c3.23±0.12b0.14±0.04aP 0.0430.0380.049 PS10.0060.0430.049 PS20.0090.0670.008 PS30.0050.0390.034
表2 LHC作用后的HeLa细胞培养上清对PBMC增殖及对CTL杀伤活性的影响(%,±s)
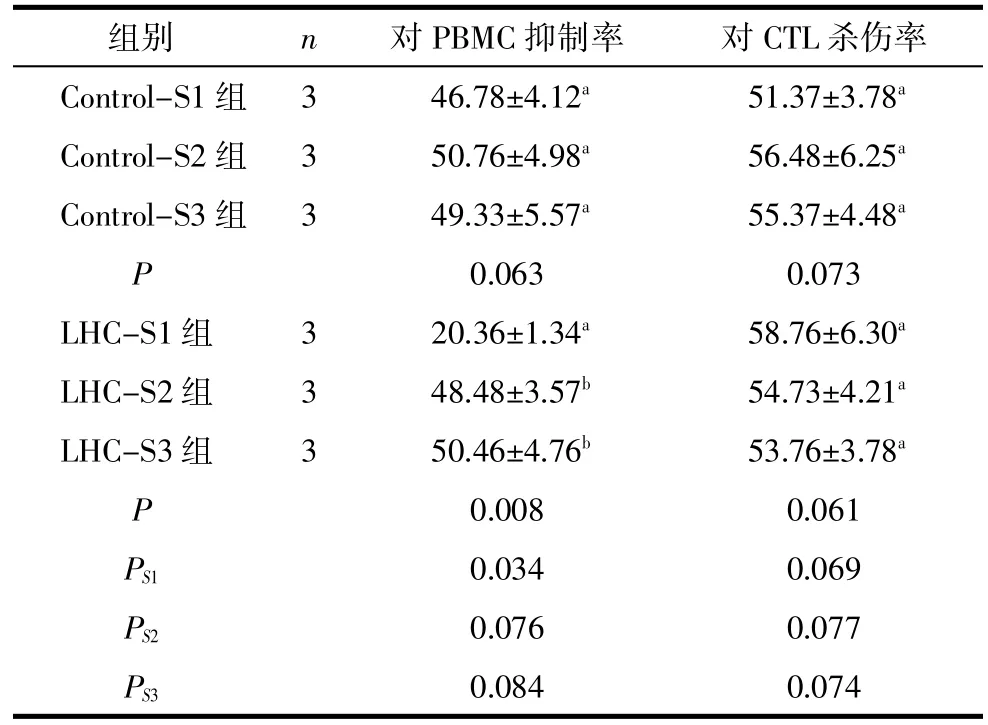
表2 LHC作用后的HeLa细胞培养上清对PBMC增殖及对CTL杀伤活性的影响(%,±s)
注:Control 3组及LHC 3组单因素方差分析的结果,多重比较见字母a,b,c标示,字母一致的组间差异无统计学意义,字母不一致的组间差异有统计学意义,P<0.05;PS1~PS3为LHC组与相对应的Control组比较结果。
组别n对PBMC抑制率对CTL杀伤率Control-S1组346.78±4.12a51.37±3.78aControl-S2组350.76±4.98a56.48±6.25aControl-S3组349.33±5.57a55.37±4.48aP 0.0630.073 LHC-S1组320.36±1.34a58.76±6.30aLHC-S2组348.48±3.57b54.73±4.21aLHC-S3组350.46±4.76b53.76±3.78aP 0.0080.061 PS10.0340.069 PS20.0760.077 PS30.0840.074
3 讨论
宫颈癌是最常见的妇科恶性肿瘤,在中国妇女中发病率居第2位,世界每年新发宫颈癌病例中,我国占1/3。临床治疗主要包括手术治疗、放疗及化疗。后两种治疗手段会对机体免疫系统产生持久而显著的影响。目前,宫颈癌的免疫治疗逐渐成为研究的热点。已有研究表明,宫颈癌像其他大多数肿瘤一样,可以通过分泌免疫抑制分子抑制免疫活性细胞的增殖、分化及活化,封闭细胞传导通路,影响机体免疫应答。TGF-β1[1]、IL-10[2]及PGE2[3]是其中发挥主要作用的免疫抑制分子。
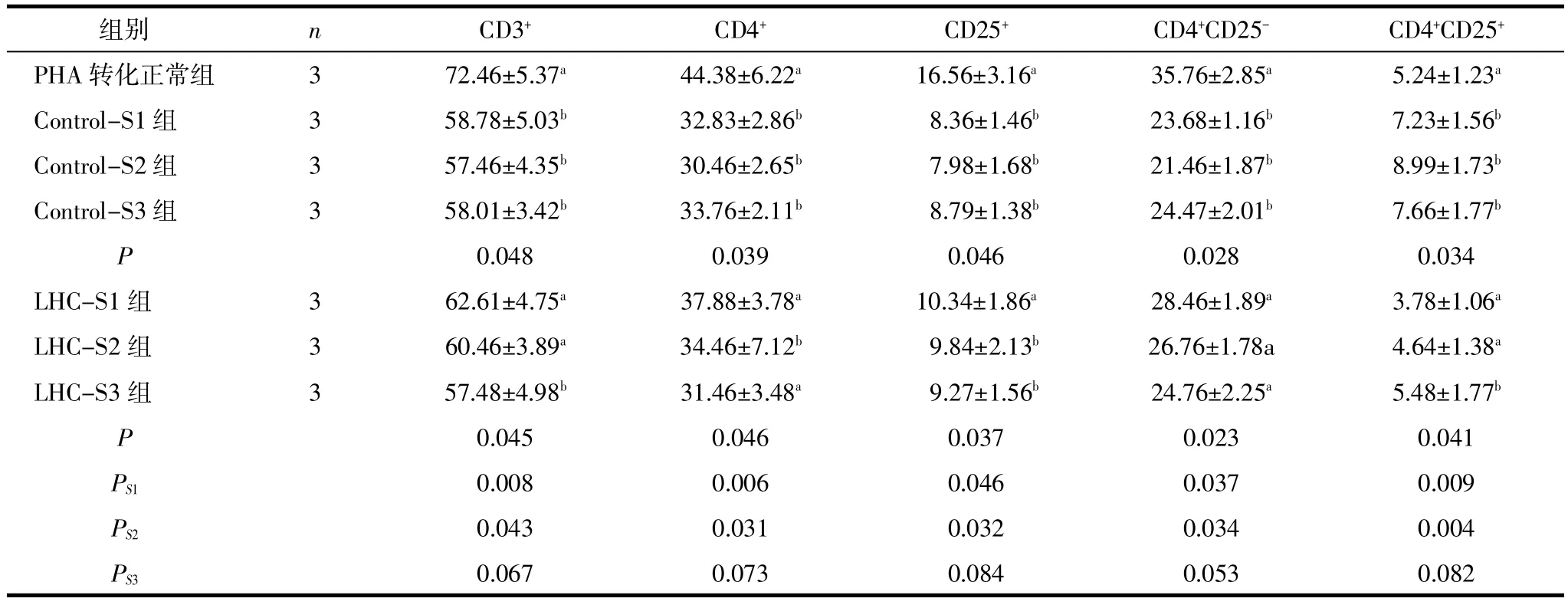
注:Control 3组及LHC 3组单因素方差分析的结果,多重比较见字母a,b,c标示,字母一致的组间差异无统计学意义,字母不一致的组间差异有统计学意义,P<0.05;PS1~PS3为LHC组与相对应的Control组比较结果。
本研究表明,宫颈癌HeLa细胞可以稳定分泌上述免疫抑制分子,以TGF-β1量最大,浓度2×105/mL 的HeLa细胞,37℃5%CO2饱和湿度中培养48 h TGF-β1浓度可达989.23 ng/mL,经LHC作用后,HeLa细胞所分泌的免疫抑制分子浓度呈下降趋势,以TGF-β1最为明显,因而所测试的3种免疫抑制分子中,TGF-β1为优势分泌的免疫抑制分子。研究表明,TGF-β1为目前已知的最主要的免疫抑制分子。而经再培养后,随着药物作用被洗脱,上清中免疫抑制分子呈逐渐上升趋势。可证明,经LHC作用后的培养上清可下调HeLa细胞免疫抑制分子的分泌。
本研究表明,经LHC作用后的HeLa细胞第1次培养上清,可以部分逆转抑制分子对PBMC增殖的抑制作用,但是随着LHC作用被洗脱,LHC-S2 及LHC-S3的培养上清这种作用明显减弱。PHA可诱导具有活性的T细胞进行转化,CD3+是淋巴细胞的主要成分,CD4+为辅助性T淋巴细胞,而CD25+是T细胞活化的标志,其表达率反应T细胞活化水平。CD4+CD25+Treg为免疫抑制细胞[5-7]。将HeLa细胞培养上清作用于上述淋巴细胞,发现其有免疫抑制作用,促使CD4+CD25-向CD4+CD25+Treg转化,抑制CD4+CD8+T细胞功能。经LHC作用后的上清可部分逆转这种免疫抑制现象,进一步说明LHC可下调导致免疫抑制分子的分泌。CTL细胞是肿瘤免疫的主要效应细胞。本研究以肿瘤细胞作为抗原,经含有IL-2的培养基反复刺激诱导获得特异性的CTL。本研究表明,HeLa细胞培养上清具有降低CTL细胞杀伤率的作用,但经LHC作用后的HeLa细胞培养上清对CTL细胞杀伤及诱导转化的抑制无明显改变,说明目前实验中所采用的LHC浓度不能逆转免疫抑制分子对CTL细胞杀伤及诱导转化的抑制。
LHC作为我国传统中药,具有促进一氧化氮生成、减少氧自由基及抗细胞凋亡的作用[8-10],常被应用于心脑血管疾病的治疗,在肿瘤治疗中多用于辅助治疗,用于降调节免疫抑制因子少见报道。本研究表明LHC作用后,所培养的HeLa细胞培养上清可逆转PHA诱导的淋巴细胞增殖抑制及上调CD4+CD25-T细胞的百分率,这有可能为LHC抗瘤作用机制之一。
本研究发现LHC的抗瘤机制可能为:下调上清中TGF-β1、IL-10及PGE2的含量,即LHC下调了HeLa细胞分泌的免疫抑制分子,减少对PBMC增殖的抑制,同时通过某种机制降低CD4+CD25+表达,上调CD3+、CD4+、CD25+、CD4+CD25-,可在一定程度上逆转HeLa细胞的肿瘤免疫抑制。提示可在宫颈癌患者术前、术中及术后加用LHC,可能部分逆转宫颈癌免疫抑制,增强疗效,预防肿瘤复发。但免疫抑制分子如何引起免疫细胞表达的变化,这种机制目前尚未明确,有待进一步研究。
[1]Cheng YX,Qi XY,Huang JL,et al.Toll-like receptor 4 signaling promotes the immunosuppressive cytokine production of human cervical cancer[J].Eur J Gynaecol Oncol,2012,33(3):291-294.
[2]Chaqas BS,Gurgel AP,da Cruz HL,et al.An interleukin-10 gene polymorphism associated with the development of cervical lesions in womeninfectedwithhumanPapillomavirusandusingoral contraceptives[J].Infect Genet Evol,2013,10(19):32-37.
[3]Zhang LX,LiuZN,Ye J,etal.Artesunate exerts anantiimmunosuppressive effect on cervical cancer by inhibiting PGE2production and FOXP3 expression[J].Cell Boil Int,2014,38(5):639-646.
[4]万慧芳,余波,涂硕,等.川芎嗪对人结肠癌LoVo细胞增殖与凋亡的影响[J].中成药,2014,3(7):1367-1370.
[5]Chen Z,Ding J,Pang N,et al.The Th17/Treg balance and the expression of related cytokines in Uygur cervical cancer patients[J]. Diagn Pathol,2013,15(8):61-64.
[6]Chen ZY,Xu Q,Ding JB,et al.CD4+CD25+FOX3+Treg and TGF-beta play important roles in pathogenesis of Uygur cervical carcinoma[J]. Eur J Gynaecol Oncol,2012,33(5):502-507.
[7]Adurth S,Mukherjee G,Krishnamurthy H,et al.Functional tumor infiltrating TH1 and TH2 effectors in large early-stage cervical cancer are suppressed by regulatory T cells[J].Int J Gynecol Cancer,2012,22(7):1130-1137.
[8]Yu K,Chen Z,Pan X,et al.Tetramethylpyrazine-mediated suppression of C6 gliomas involves inhibition of chemokine receptor CXCR4 expression[J].Oncol Rep,2012,28(3):955-960.
[9]杨华.川芎嗪注射液对慢性肺源性心脏病患者生命质量及氧化应激的影响[J].中国中医急症,2014,23(2):351-352.
[10]刘延梅,马少群,苗青,等.川芎嗪联合胚胎干细胞治疗大鼠肺纤维化的机制研究[J].陕西医学杂志,2014,43(1):10-14.
The Immunosuppression of Cervical Carcinoma Cell Line HeLa after Inoculating by LHC
ZHANG Wen-ke,CHEN Ya-qiong.Department of Obstetrics and Gynecology,The Affiliated Hospital of the Chinese People's Armed Police Force Logistics College,Tianjin 300162,China
Objective:To study the variation of immunosuppression of HeLa inoculated by LHC.Methods: HeLa was inoculated by LHC,for 48 h,the supernatants were collected(LHC-S1),after centrifuging the cells,and then adjusted the concentration of HeLa,inoculated for 48 h,centrifuged cells,collect the supernatants(LHC-S2),adjusted the concentration of HeLa,inoculated for 48 h,after centrifuging the cells collected the supernatants (LHC-S3).Compared with the HeLa′s supernatant without LHC,which was inoculated in the same condition,collected the supernatant for 3 times(Control-S1,Control-S2,Control-S3),test the TGF-β1 and IL-10 by ELISA,PGE2by ultraviolet spectrophotometry,by means of MTT to detect the proliferation of PHA induce PBMC and antibody-dependent cellular cytotoxicity of CTL.Flow cytometry(FCM)to analyze the subpopulation of peripheral blood lymphocytes,which was inoculated by the supernatants.Results:(1)The TGF-β1,IL-10 and PGE2A278 nm of control group had no significant difference in statistics(P>0.05);in LHC-group the difference were statically significant(P<0.05);TGF-β1 gradually decreased,IL-10 was similarity in LHC-S1 and LHC-S2,less than that in LHC-S3,PGE2A278 nm was the minimum in LHC-S2;except in LHC-S2,IL-10 was less than the control group.(2)All the supernatants of the control group could inhibit the proliferation of PHA induced PBMC and cytotoxicity of CTL,had no significant statistic difference(P>0.05),the inhibition to CTL in LHC group and corresponding control group had no significant statistic difference(P>0.05);in LHC group,the inhibition ratio in LHC-S1 was the lest.(3)All the supernatants could influence the expression of the subpopulation of lymphocyte,it had statistic difference(P<0.05);Compared with control group,the percentage of CD3+,CD4+,CD25+and CD4+CD25-increased in LHC-S1 and LHC-S2 group,the percentage of CD4+CD25+decreased(P<0.05),in the LHC-S3 group,the difference was not significant(P>0.05).Conclusions:The immunosuppressive molecules of HeLa could be reduced by LHC;LHC could decrease the inhibition of the proliferation of PHA induce PBMC;LHC also could increase the percentage of CD3+,CD4+,CD25+and CD4+CD25-,reduce CD4+CD25+;LHC could reverse the immunosuppression of HeLa to a certain degree.
Tetramethylpyrazine;HeLa cells;Immune tolerance
2015-10-13)
[本文编辑 王琳]
300162天津,武警后勤学院附属医院妇产科
