Kisspeptin对早期胎盘滋养层细胞的调节作用
2018-01-11孙新六
孙新六
(泰山医学院附属泰山医院中心实验室,山东 泰安 271000)
Kisspeptin对早期胎盘滋养层细胞的调节作用
孙新六
(泰山医学院附属泰山医院中心实验室,山东 泰安 271000)
目的 探讨黑色素转移抑制基因(Kisspeptin,KP)基因在早期胚胎中对滋养层细胞的调节作用。方法 免疫细胞化学法检测滋养层细胞KP和KP受体GPR54表达,实时定量RT-PCR检测Kisspeptin基因表达,SDS-PAGE和western-blot检测 Kisspeptin蛋白表达,细胞划痕实验检测滋养层细胞侵袭性。结果 90%以上培养的细胞均表达KP和其受体GPR54;KP抑制滋养层细胞迁移率为44.1%,KP抑制MMP-9和VEGF表达。结论 KP抑制早期胎盘滋养层细胞迁移,抑制ERK和血管活化相关因子。
黑色素转移抑制基因;滋养层细胞;早期胎盘
胎盘形成中绒毛膜滋养层细胞对子宫壁不断侵蚀,侵入母体子宫内壁蜕膜和子宫肌层,改造子宫壁螺旋动脉,形成丰富血管通道,使母体和胎儿之间具有足够的营养和气体交换[1],此过程的失调可导致多种孕期并发症,滋养层细胞入侵贫乏可导致子痫前期症状和胎儿宫内生长受限,过度入侵则导致胎盘异常增生[2]。本研究旨在探讨黑色素转移抑制基因(Kisspeptin,KP)调节早期胎盘绒毛膜滋养层细胞侵袭行为中的作用。
1 材料和方法
1.1试剂和抗体
鼠源抗人GPR54抗体,鼠源抗人Kisspeptin抗体,鼠源抗人β-actin抗体,均购于BOSTER公司。Kisspeptin抑制剂P234购于美国Abcam公司。
1.2方法
1.2.1组织收集 胎盘来自患者自愿终止妊娠,均为3个月内早期胎盘。患者均知情同意,并经过医院伦理委员会批准。取下胎盘后立即无菌状态下剪取胎盘绒毛膜组织,用预先冰冷的PBS液漂洗3遍,分离滋养层细胞进行培养。
1.2.2滋养层细胞分离和培养 无菌操作,胎盘组织以眼科镊子剪成碎块,在含有0.25%胰蛋白酶和DNA酶(200 U/ml)溶液中37℃消化3次,每次30 min,收集悬浮细胞,弃去组织块,PBS液漂洗2次,以Percoll液梯度离心(3000 r/min,20 min)分离细胞。收集的细胞在培养皿中用RPMI 1640液培养1 h使巨噬细胞贴壁吸附去除,悬浮细胞转于24孔板中,用含10%胎牛血清、1%青霉素和链霉素的RPMI 1640培养液在37 ℃、5%二氧化碳环境中培养,隔天半量换液。
1.2.3免疫细胞化学分析 滋养层细胞培养于放有盖玻片的6孔板中,爬满细胞后,弃培养液并以PBS液轻轻漂洗。取出覆有细胞的玻片,细胞固定后,以甲醇处理10 min,灭活细胞内过氧化酶,分别加入标记的鼠抗人cytokeratin-7(1∶50稀释)和抗GPR54(1∶50稀释)一抗,37 ℃作用1 h,PBS液漂洗后加辣根过氧化物酶标记的二抗作用1 h,最后加入底物DAB液显色。同时以DAPI染液将滋养层细胞染成蓝色。
1.2.4Kisspetin及GPR54 mRNA检测 总RNA采用TriZol液常规提取,首先RNA逆转录成cDNA:42 ℃,30 min逆转录,95 ℃,1 min灭活转录酶。反应产物进行荧光定量PCR。Kisspetin基因上游引物P1:5’-CTCACTGGTTTCTTGGCAGCTAC-3’,下游引物P2:5’-AGAGCCTACCCAGATGCTGAG-3’;GPR54基因上游引物:5’-GCTGGTACGTGAC GGTGTTC-3’,GPR54基因下游引物:5’-AGAGCCTACCCAGATGCTGAG-3’。MMP-9基因上游引物:P1:5’-TGGAGGTTCGACGTGAAGG-3’,下游引物P2:5’-AAATAGGCTTTC TCTCGGTACTGG-3’;VEGF基因上游引物:5’- ACATCTTCAAGCCATCCTGTGTG-3’,下游引物P2:5’-TGGCCGTTGAGGTTGGAATG-3’。反应条件(40个循环):95℃,15 s变性; 60℃,40 s复性和延伸,内参基因β-actin同时扩增。以2-△△T法检测Kisspetin基因相对于内参基因表达率。
1.2.5蛋白质提取和SDS-PAGE 滋养层细胞离心漂洗收集后,用蛋白提取试剂盒进行蛋白质提取。BCA法测量样品蛋白浓度:标准品系列梯度浓度稀释,标准品和样品各加入200 μl BCA工作液,37 ℃静置30 min,酶标仪以A562 nm测定样品蛋白含量。取100 μl蛋白液混合等体积样品上样液,以120 V电压进行SDS-PAGE电泳1.5 h。
1.2.6免疫印迹 SDS-PAGE电泳分离的蛋白质电转移到PVDF膜,PVDF膜在封闭液(5%脱脂奶粉,0.5% Tween-20)中轻摇1 h,加入鼠源抗GPR54抗体 (1∶500稀释),鼠源抗Kisspeptin (1∶500稀释),4 ℃过夜,漂洗后加入 HRP标记的二抗( 1∶5000稀释)作用1h,加入化学发光底物,在UVP成像系统以Dynamic Integration模式拍照分析。
1.2.7细胞外调节蛋白激酶(ERK)检测 滋养层细胞分为3组培养。对照组:培养液不加KP和抑制剂;KP组:培养液加KP蛋白,终浓度为100 nM;KP+P234组:培养液加KP和抑制剂,终浓度为100 nM。各组培养液与滋养层细胞共同孵育30 min后,收集滋养细胞,SDS-PAGE电泳,转PVDF膜,wersten-blot检测ERK和磷酸化ERK(P-EKR),求出其比值。
1.2.8细胞划痕实验 滋养层细胞分3组培养(分组方法同1.2.7)。滋养层细胞在6孔板中生长融合后,以吸头轻轻划痕,以无菌PBS液轻柔冲去划痕中散落的细胞,细胞在37 ℃和5%的二氧化碳环境中培养48 h。在显微镜下分别测量在0 h和48 h划痕的宽度,迁移率是48 h时划痕两边缘距离减小值与0 h划痕两边缘距离比值,没有加KP和KP抑制剂P234的对照组迁移率被认为是1。
1.3统计学分析
使用GraphPad Prism 5.0统计分析,两组数据以t检验方法,多组以ANOVA方法统计分析组间实验数据差异显著性。以P≤0.05为统计学有显著意义。
2 结 果
2.1滋养层细胞KP和GPR54表达
培养的细胞首先进行抗细胞角蛋白(cytokeratin-7)染色以确定滋养层细胞比例,再进行KP受体GPR54染色。染色结果显示,cytokeratin-7阳性细胞比例为(92.2±5.4)%, 几乎所有的细胞都表达GPR54。染色结果显示培养的细胞大约90%同时表达cytokeratin-7 和GPR54(图1),表明分离的滋养层细胞纯度符合研究要求。

图1 滋养层细胞免疫染色 (×400)
2.2早期胎盘滋养层细胞GPR54和KP mRNA表达
以荧光定量PCR法检测滋养层细胞KP-54和其受体GPR 54相对表达,早期胎盘滋养层细胞均表达GPR54和KP mRNA,SDS-PAGE和Western-blot显示滋养层细胞表达GPR54和KP蛋白(图2)。

图2 滋养层细胞KP-54和GPR54蛋白表达
2.3细胞外调节蛋白激酶(ERK)在滋养层细胞表达
KP蛋白与滋养层细胞共同孵育30 min, 磷酸化的P-ERK与未磷酸化的ERK比值相对于对照组(不加KP和抑制剂P234)增加(2.3±0.5)倍,KP和KP的抑制剂P234与滋养层细胞共培养,P-ERK/ERK相对增加(1.6±0.3)倍。三组实验数据经ANOVA统计分析差异具有统计学意义(P<0.05),实验显示滋养层细胞与KP和 KP拮抗剂共培养,抑制了KP诱导的ERK磷酸化作用。

图3 早期胎盘滋养层细胞 P-ERK和ERK表达
2.4KP抑制滋养层细胞迁移
以细胞划痕-迁移(scratch-migration)实验评估KP对早期胎盘滋养层细胞迁移的影响。相对于未经处理的细胞,KP治疗滋养层细胞48 h后抑制细胞迁移率44.1%。滋养层细胞和KP、P234共培养阻遏了KP介导的对早期胎盘滋养层细胞迁移抑制作用,相对抑制细胞迁移率减为18.2%。具体数据见表1。此实验表明KP抑制滋养层细胞迁移,此作用能被KP的拮抗剂P234所抑制。
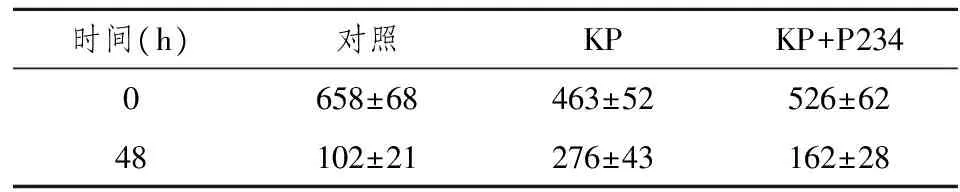
表1 滋养层细胞划痕迁移(μm)
2.5KP对MMP-9和VEGF表达的影响
荧光定量PCR检测在KP和抑制剂P234作用下MMP-9和VEGF表达变化(表2)。滋养层细胞在KP作用下降低了MMP-9和VEGF的表达,空白对照组表达率设为1,则MMP-9和VEGF表达率分别为0.362±0.102、0.482±0.126。加入抑制剂P234后,KP降低效应减少,两者表达率分别为0.624±0.153和0.846±0.172。以ANOVA方法统计分析,三组间差异具有统计学意义(P<0.05)。

图4 滋养层细胞相对迁移率
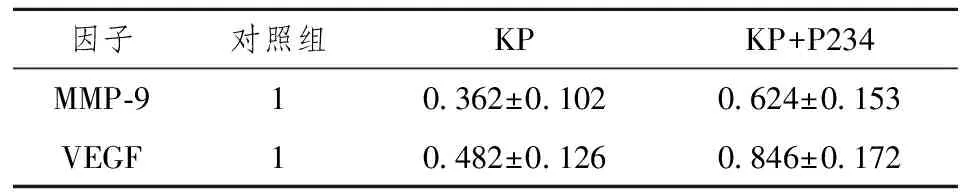
因子对照组KPKP+P234MMP⁃910362±01020624±0153VEGF10482±01260846±0172
3 讨 论
绒毛膜滋养层细胞对子宫内壁入侵过程与肿瘤转移相似[2],两者具有相似的分子机制进行迁移和入侵。其中基质金属蛋白酶(MMP)和血管内皮细胞生长因子(VEGF)至关重要。MMP-9在滋养层细胞入侵中发挥重要作用[3],,基质金属蛋白酶的活性又受到组织金属蛋白酶抑制剂(TIMPs)影响。Kisspeptin(KP)是由KiSS-1基因(黑色素瘤转移抑制基因)编码的肽类激素,其受体是G蛋白耦联受体GPR54,具有影响癌细胞的生长和转移、调节生殖功能和影响内分泌等作用。人KiSS-1基因定位于1q32区, 其基因结构包括4个外显子和3个内含子。KISS1基因编码145个氨基酸,不同剪接形成长短不一的KP多肽,KP可调节促性腺激素释放激素(GnRH)的分泌[4]。KP结合G蛋白受体GPR54,可激活磷脂酶C,导致细胞内钙离子增加。KP能够激活细胞中的ERK信号通路,使细胞永生化[5]。Ohtaki等人从人胎盘分离了由KiSS-1基因编码的Kisspeptin。KP和GPR54最初均表达于受精卵合胞体细胞,Kisspeptin与胎盘的形成有关,在绒毛膜滋养层细胞发现Kisspeptin和GPR54表达,Kisspeptin的转录表达在早期和末期胎盘无变化, 但GPR54的表达在早期的胎盘高于末期胎盘, 这与怀孕早期滋养层细胞高侵入性而末期胎盘低侵入性相一致。我们采用妊娠早期滋养层细胞,通过KP共培养效果来研究滋养层细胞迁移、细胞基质金属蛋白酶和血管内皮细胞生长因子表达变化。
实验表明早期胎盘滋养层细胞均表达GPR54和KP, KP抑制滋养层细胞迁移能力。KP能刺激ERK磷酸化,KP共培养可以抑制滋养层细胞的入侵能力,KP通过抑制滋养细胞迁移、基质金属蛋白酶(MMP)和血管内皮生长因子(VEGF)的表达控制滋养层细胞对子宫内壁侵袭力。免疫印迹显示KP蛋白可激活滋养层细胞中ERK,加入KP抑制剂P234则减弱了此抑制作用。KP作用机制是KP与其受体GPR54结合后,可激活磷脂酶C (PLC),使二磷酸磷脂酰肌醇(PIP2)水解,产生细胞内第二信使三磷酸肌醇 (IP3)和甘油二脂(DAG),从而使细胞内钙离子增加、磷酸化细胞外信号调节激酶(ERK),从而产生生物学作用。基质金属蛋白酶能降解细胞外基底膜,在组织形态发生中扮演重要角色。基质金属蛋白酶在绒毛膜滋养层细胞对螺旋动脉的入侵和改造过程中起重要作用[6],MMP-9表达减少时,滋养层细胞显示低弱入侵能力,易诱发子痫前期症状及胎儿宫内生长受限[7]。KP可控制基质金属蛋白酶MMP-9活性,KP通过调节基质金属蛋白酶的转录而产生抑制作用,此作用受到TIMP1抑制。滋养层细胞入侵子宫内膜,通过替换血管内皮细胞,转化子宫内壁血管。实验表明KP下调了VEGF表达,KP通过控制VEGF表达调控血管生成。滋养层细胞入侵子宫内壁受到多种细胞因子监控,TGF-β1通过刺激TIMP表达限制滋养层细胞入侵[8],TNFα则激活蜕膜巨噬细胞,限制妊娠早期滋养层细胞的入侵[9]。细胞因子正向和负向调控使滋养层细胞对子宫内壁适当入侵。
我们研究结果表明,KP抑制早期胎盘滋养层细胞侵袭和移动。KP抑制MMP-9转录及促使VEGF转录。为进一步研究孕早期以KP体内调控滋养层细胞入侵胎盘提供了依据。
[1] Gupta S, Misra R, Ghosh UK, et al. Comparison of foetomaternal circulation in normal pregnancies and pregnancy induced hypertension using color Doppler studies[J]. Indian J Physiol Pharmacol, 2015, 58(3): 284-289.
[2] Gui S, Ni S, Jia J,et al.nconformity of CXCL3 plasma level and placenta expression in preeclampsia and its effect on trophoblast viability and invasion[J]. PLoS One,2014,9(12):1289-1295.
[3] Estella C, Herrer I, Atkinson SP.Inhibition of histone deacetylase activity in human endometrial stromal cells promotes extracellular matrix remodelling and limits embryo invasion[J]. PLoS One,2012,7(1):113-118.
[4] Feng T, Chu MX, Zhang YJ. KISS-1/GPR54 genes and their role in reproduction[J]. Yi Chuan, 2008, 30(4): 419-425.
[5] Ji K, Ye L, Ruge F, et al. Implication of metastasis suppressor gene, Kiss-1 and its receptor Kiss-1R in colorectal cancer[J]. BMC Cancer, 2014, 14: 723.
[6] Cartwright JE, Williams PJ.Altered placental expression of kisspeptin and its receptor in pre-eclampsia[J]. J Endocrinol,2012,214:79-85.
[7] Patel A, Dash PR. Formation of atypical podosomes in extravillous trophoblasts regulates extracellular matrix degradation[J]. Eur J Cell Biol, 2012, 91(3): 171-179.
[8] Cheng JC, Chang HM, Leung PC. Transforming growth factor-beta 1 inhibits trophoblast cell invasion by inducing snail-mediated down-regulation of vascular endothelial-cadherin protein[J]. J Biol Chem, 2013, 288(46): 33181-33192.
[9] Cha HH, Hwang JR, Kim HY, et al. Autophagy induced by tumor necrosis factor alpha mediates intrinsic apoptosis in trophoblastic cells[J]. Reproductive Sciences, 2014, 21(5): 612-622.
Regulating effect of Kisspeptin on trophoblast cells of early placenta
SUN Xin-liu
(Taian Central Hospital, Taian 271000,China)
Objective: To investigate the role of Kisspeptin gene in the regulation of trophoblast cells of early placenta. Methods: The expression of Kisspeptin and GPR54 were detected with immunocytochemistry, Kisspeptin gene expression by real-time quantitative RT-PCR, the expression of Kisspeptin protein with SDS-PAGE and western-blot, and cell scratch assay was made on invasion of trophoblast cells. Results: KP and GPR54 was expressed in 90% cells cultured; KP inhibited the migration of trophoblast cells, Kisspeptin inhibited the expression of MMP-9 and VEGF. Conclusion: KP inhibits cell migration of early placental trophoblast cells, and ERK and vasoactivation related factors.
Kisspeptin;trophoblast cell;early embryo
孙新六(1970—),男,安徽安庆人,硕士,主要从事临床分子生物学研究工作。
R737.9
A
1004-7115(2018)01-0010-04
10.3969/j.issn.1004-7115.2018.01.003
2017-11-16)
