兔妊娠早中期滋养层细胞侵润的观察研究
2014-05-12勾俊洁贺斌徐祥波武斌石翠格张树成王介东
勾俊洁,贺斌,徐祥波,武斌,石翠格,张树成,王介东*
(1.北京协和医学院研究生院,北京 100730;2.国家人口计生委科学技术研究所,北京 100081)
妊娠过程中,胎盘绒毛外滋养层细胞在囊胚着床后便开始分化迁移,向子宫蜕膜层和肌层血管侵袭,启动螺旋动脉的重塑过程,这一过程是建立母胎循环的关键。绒毛外滋养层细胞具有的侵袭功能是保证子宫螺旋动脉重塑和妊娠顺利完成的重要基础。如果绒毛外滋养层细胞的迁移及侵袭功能出现异常,侵入到母体组织不够深或不完全,即胎盘着床过浅,会造成血管重塑不足而致胎盘血液灌注出现障碍,容易引起先兆子痫、流产、胎儿生长受限等妊娠性疾病[1-3]。深入了解绒毛外滋养层细胞侵袭能力的调节机制将有助于阐明这些妊娠相关疾病的发病机制。
兔、啮齿类和灵长类动物的胎盘同属于血绒毛型胎盘。除了灵长类动物和人,兔和大鼠均具有子宫螺旋动脉。基因组学数据显示,兔在生殖方面比啮齿类更近似于人类[4],而且肾素-血管紧张素系统和血液动力变化系统的基因关系图显示,兔是研究母体血压及胎盘灌注合适的模型动物[5-6]。细胞角蛋白(CK)在上皮样细胞中表达,滋养层细胞是独特的上皮细胞[7]。Blaschitz等[8]在人类妊娠早期胎盘中的试验结果显示,细胞角蛋白7(CK7)能够特异性标记滋养层细胞及其亚群。Maldonado-Estrada等[9]用CK7作为第一选择标记,用以监测纯化的细胞滋养层细胞的纯度,将CK7视为是滋养层分离的广泛使用的标记。本文中我们利用CK7免疫组化方法探讨兔妊娠早中期滋养层细胞侵润子宫的深度及侵润方式,以期为胚胎着床及子宫螺旋动脉重塑的机制提供理论基础。
材料和方法
一、材料
1.实验动物:6~7月龄新西兰兔(购自北京金牧阳实验动物养殖有限责任公司),体重3.5~3.9kg。环境温度20~22℃,相对湿度70%~85%,每日光照12h,单笼单只饲养,自由摄食进水。
2.主要试剂:小鼠抗人细胞角蛋白7(CK7)抗体、PV6002二抗试剂盒、AP-Red kit试剂盒、辣根酶标记羊抗小鼠IgG,均购自北京中杉金桥生物技术有限公司。
3.实验仪器:Leica LMD6000激光显微捕获仪(德国)。
二、实验方法
1.取材:发情期雌兔于晚上8:00~10:00进行交配,观察阴道涂片确定交配成功与否,交配成功的次日上午记为妊娠第0.5天。交配前一天开始每天进行耳缘静脉取血,每次约1.0ml,室温静置40min,3 000rpm离心5min,取血清-20℃冷冻保存。妊娠雌兔分别于第6.0、7.5、9、10.5、12、13、14、15和19天处死取材,且处死前耳缘静脉取血,血清-20℃保存。每组各妊娠时间点取至少5个胎盘于4%多聚甲醛固定。
2.免疫组织化学染色:胎盘组织常规石蜡包埋制片,切片脱蜡、水化,经EDTA缓冲液(pH 8.0)煮沸20min进行抗原修复,3%双氧水室温下10min,加羊血清室温孵育20min,小鼠抗人CK7(1∶200)4℃过夜(小鼠IgG抗体为阴性对照),辣根酶标记羊抗小鼠二抗37℃孵育30min,DAB显色8min,苏木精复染1min,脱水透明,中性树胶封片。
3.过碘酸雪夫(PAS)染色:石蜡切片常规脱蜡至水,高碘酸溶液染色10min,充分蒸馏水洗,擦干多余水分,雪夫试剂浸染10min,流水冲洗,Harris明矾苏木素复染2min,95%酒精、无水酒精脱水,二甲苯透明,中性树胶封片。
4.碱性磷酸酶染色:胎盘冰冻组织,下冰冻切片,冷丙酮固定5min,蒸馏水冲洗数秒,按AP-Red kit试剂盒说明书显色20min,蒸馏水洗,Harris明矾苏木素复染5s,蒸馏水洗,水溶性封片剂封片。
5.血清雌和孕激素水平测定:使用放射免疫法测定采集血清中的激素含量(试剂盒由南京迪安医学检验所有限公司提供)。
结 果
一、妊娠早、中期血清雌二醇和孕酮变化
雌二醇水平在妊娠第6天后开始升高,第12天达高峰,此后下降,第15天时接近初始水平(图1A)。孕酮水平第3天开始呈升高趋势,第6天开始显著增高,第12天达到最高水平,此后一直维持这个水平(图1B)。
二、子宫内膜血管管周蜕膜化变化
妊娠第9天,子宫内膜血管管周出现蜕膜化细胞,胞质比较致密(图2A),富含碱磷酶(图2E)和糖蛋白(图2G);第10.5天,蜕膜化细胞由管周扩充到整个间质,蜕膜细胞发生空泡化(图2B);从第12天开始,蜕膜化细胞高度空泡化(图2C),间质被挤压成狭长的条索状(图2C、F、H);第15天,蜕膜细胞仍然保持高度空泡化(图2D),空泡化的蜕膜细胞不再富含碱磷酶(图2F)和糖蛋白(图2H)。

图1 雌兔妊娠早、中期血清雌二醇与孕酮水平
三、妊娠早中期滋养层细胞的侵润
CK7免疫组化方法检测显示,在兔妊娠第6天,CK7阳性定位于扩张的子宫腔上皮细胞(图3A);在第7.5天,在胚胎着床处,定位于滋养层粘结点(图3B箭头示);到第9天时滋养层粘附完成,被滋养层粘附的内膜部位失去上皮样结构,阳性信号减弱,在滋养层粘附部位偶见CK7阳性的滋养层细胞(图3C箭头示);在第10.5天,胎盘小叶出现(图3D箭头示),CK7阳性的合胞体滋养层细胞已经开始侵润到子宫内膜基质(图3D);在第12天,迷路区结构较明显,CK7阳性的滋养层细胞在迷路下子宫基质中剧增,且在此区域动脉窦形成(图3E);在第13天和14天,胎盘下的动脉窦进一步扩张,在动脉窦周围的间质及管周蜕膜细胞CK7阳性的滋养层细胞增多(图3F、3G):在绒毛柱的末梢细胞滋养层细胞形成内含三四个或更多个核的合胞体滋养层细胞(图3G2),而迷路区大部分为空泡化的合胞体滋养层细胞(图3G2、3G3)。此外,在非着床位点,细胞滋养层细胞融合成数个核的合胞体滋养层细胞,但是此处的合胞体滋养层细胞与迷路区的合胞体滋养层细胞明显不同,其核的数量较多达数个至数十个,而且均未见空泡样改变(图3G1)。在第15天,胎盘形成,且胎盘连接区全部被CK7阳性的滋养层细胞侵润,动脉窦管腔又进一步扩张(图3H);在第19天,CK7阳性的滋养层细胞侵袭至子宫肌层和肌层动脉管壁,而连接区基质细胞基本全部发生退行性改变,形成少细胞的松散区域,动脉窦里的CK7阳性滋养层细胞基本消失,且管腔较第15天扩大更加明显(图3I)。
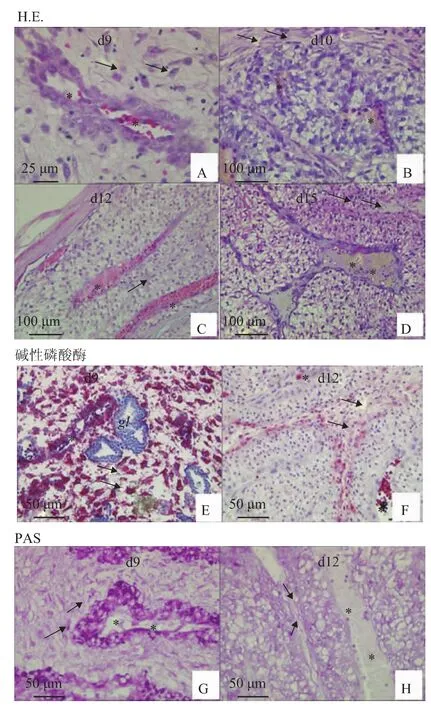
图2 妊娠早、中期血管管周蜕膜化变化(HE、PAS、碱性磷酸酶染色)
在妊娠第12天到第15天的胎盘组织中,子宫蜕膜区滋养层细胞侵润部位均同时存在以下三种情况:(1)管内充满滋养层细胞而管壁和管周没有滋养层细胞(图3E1);(2)正在向管周细胞渗透的滋养层细胞(图3E2);(3)血管之间的间质充满滋养层细胞,管周没有滋养层细胞渗透(图3E3)。

图3 妊娠早、中期胎盘CK7免疫组织化学染色
讨 论
子宫螺旋动脉重塑及滋养层细胞侵润与先兆子痫、植入性胎盘、胎儿生长受限等疾病相关,研究滋养层细胞侵润的分子机制在基础研究和临床指导上都具有重大意义。
在人的妊娠过程中,细胞滋养层祖细胞有两种分化途径:一是部分细胞滋养层细胞融合形成多核的合胞体滋养层细胞,使绒毛能够漂浮在母体血液中,同时构成与母体血之间的屏障,调节氧气、蛋白质等物质的运输;二是部分细胞滋养层细胞分化成绒毛外滋养层细胞,绒毛外滋养层细胞向母体蜕膜组织侵润,对子宫螺旋动脉重塑起重要作用[10-11]。在我们的研究中发现,在兔的妊娠过程中滋养层细胞主要为含三四个核或更多核的空泡化合胞体滋养层细胞,绒毛中只含单核的细胞滋养层细胞,在绒毛柱末端往往为多个核的合胞体滋养层细胞。同时,空泡化的滋养层细胞呈CK7强阳性染色,而非空泡化的滋养层细胞CK7则阳性信号很弱。因此我们推测兔妊娠中合胞体滋养层细胞形成的一种方式为:绒毛中细胞滋养层细胞逐渐融合成多核的合胞体滋养层细胞,并从绒毛柱末端脱落下来,之后逐渐发生空泡化,侵袭能力加强,向蜕膜区及肌层血管侵袭。另外,在非着床点我们还看到单核的细胞滋养层细胞融合成巨大的含数个核的合胞体滋养层细胞,在这些细胞侵润的部位见到不完整的细胞结构,推测这些细胞对非着床位点连接区的建立具有重要作用,其机制仍有待于探讨。
在人类子宫螺旋动脉重塑机制中,关于滋养层细胞是通过管周间质细胞侵润方式进入血管,还是从血管远端进入逆行向上侵润整个子宫动脉,这一直存在争议[12]。在本研究中初步观察在兔中滋养层细胞的侵润方式,在同一胎盘组织中总能同时观察到以下3种情况:(1)管内充满滋养层细胞而管壁和管周没有滋养层细胞;(2)正在向管周细胞渗透的滋养层细胞;(3)血管之间的间质充满滋养层细胞,管周没有滋养层细胞渗透。同时发现在妊娠第19天肌层处存在大量滋养层细胞,而肌层与连接区之间的蜕膜组织中没有滋养层细胞。因此,这些结果提示兔滋养层细胞可能以间质渗入、蜕膜细胞渗入、血管内逆行向上多种方式并行向肌层方向进行侵润。
另外我们发现,在兔的妊娠子宫中,在蜕膜化的初始阶段碱性磷酸酶活性较高,蜕膜细胞逐渐空泡化后,不再显示碱性磷酸酶活性,所以在兔中碱性磷酸酶的强阳性是管周蜕膜化开始的一个指示,这与Zook等[13]通过皮埋雌孕激素诱导蜕膜化的结果相一致,具体的机制有待于进一步研究。
Albrecht等[14]在猩猩体内的研究表明,雌二醇能够明显地抑制绒毛外滋养层细胞的侵袭能力和血管重塑过程。而对于孕酮,大量研究结果表明其对绒毛外滋养层细胞的增殖、迁移和侵袭能力起着负调节性作用[15-16]。但也有人得到与此 相反的 结果[17]。本研究中通过测定兔妊娠早中期的雌孕激素水平,结果也提示滋养层细胞的侵袭功能可能受到孕酮、雌二醇等激素的调节。此外,兔妊娠阶段雌和孕激素水平变化特点还提示,孕酮的高水平是维持蜕膜化的关键,雌激素对蜕膜化起诱导作用。Elton等[18]的实验结果印证了这一点。他们通过皮下注射双醋炔诺酮加美雌醇诱导兔子宫蜕膜化,结果显示,只给双醋炔诺醇组,子宫蜕膜率随着双醋炔诺醇浓度的增加而升高,但最高只能达到74%,而给予适宜剂量美雌醇时蜕膜率升高到100%。
滋养细胞的浸润程度受到自身、蜕膜组织及母体雌孕激素诱导的网络信号转导通路的调节。对这些调节机制的探索有利于先兆子痫、胎儿生长受限、植入性胎盘等妊娠相关性疾病的认识,通过其发病机制的深入研究进而从源头上找到治疗这些疾病的新靶点。
[1] Roberts JM,Cooper DW.Pathogenesis and genetics of Preeclampsia[J].Lancet,2001,357:53-56.
[2] Reus AD,El-Harbachi H,Rousian M,et al.Early firsttrimester trophoblast volume in pregnancies that result in live birth or miscarriage[J].Ultrasound Obstet Gynecol,2013,42:577-584.
[3] Nadeem L,Munir S,Fu G,et al.Nodal signals through activin receptor-like kinase7to inhibit trophoblast migration and invasion:implication in the pathogenesis of preeclampsia[J].Am J Pathol,2011,178:1177-1189.
[4] Graur D,Duret L,Gouy M.Phylogenetic position of the order Lagomorpha(rabbits,hares and allies)[J].Nature,1996,379:333-335.
[5] McArdle AM,Denton KM,Maduwegedera D,et al.Ontogeny of placental structural development and expression of the renin-angiotensin system and 11beta-HSD2genes in the rabbit[J].Placenta,2009,30:590-598.
[6] McArdle AM,Roberts CT,Maduwegedera D,et al.Chronic maternal hypertension characterized by renal dysfunction is associated with reduced placental blood flow during late gestation in rabbits[J].Am J Physiol Regul Integr Comp Physiol,2010,298:R1043-R1049.
[7] Gauster M,Blaschitz A,Siwetz M,et al.Keratins in the human trophoblast[J].Histol Histopathol,2013,28:817-825.
[8] Blaschitz A,Weiss U,Dohr G,et al.Antibody reaction patterns in first trimester placenta implications for trophoblast isolation and purity screening[J].Placenta,2000,21:733-741.
[9] Maldonado-Estrada J,Menu E,Roques P,et al.Evaluation of Cytokeratin 7as an accurate intracellular marker with which to assess the purity of human placental villous trophoblast cells by flow cytometry[J].J ImmunolMethods,2004,286:21-34.
[10] Aplin JD.Implantation,trophoblast differentiation and haemochorial placentation:mechanistic evidence in vivo and in vitro[J].J Cell Sci,1991,99:681-692.
[11] Pijnenborg R.Trophoblast invasion[J].Reprod Med Rev,1994,3:53-73.
[12] Dixon HG,Robertson WB.A study of the vessels of the placental bed in normotensive and hypertensive woman[J].J Obstet Gynaecol Br Emp,1958,65:803-809.
[13] Zook BC,Jänne OA,Abraham AA,et al.The development and regression of deciduosarcomas andother lesions caused by estrogens and progestins in rabbits[J].Toxicol Pathol,2001,29:411-416.
[14] Albrecht ED,Bonagura TW,Burleigh DW,et al.Supression of extravillous trophoblast invasion of uterine spiral arteries by estrogen during early baboon pregnancy[J].Placenta,2006,27:483-490.
[15] Goldman S,Shalev E.Difference in progesterone-receptor isoforms ratio between early and late first-trimester human trophoblast is associated with differential cell invasion and matrix metalloproteinase2expression[J].Biol Reprod,2006,74:13-22.
[16] Goldman S,Shalev E. A proposed mechanism for progesterone regulation of trophoblast MMP2transcription independent of classical progesterone response elements on its promoter[J].J Exp Clin Assist Reprod,2006,3:4.
[17] Liu J,Matsuo H,Laoag-Fernandez JB,et al.The effects of progesterone on the apoptosis in the human trophoblastderived HTR-8/SV neo cells[J].Mol Hum Reprod,2007,13:869-874.
[18] Elton RL,Klimstra PD,Colton FB.Induction of deciduoma in rabbits without uterine trauma by treatment with ethynodiol diacetate:a synthetic progestogen[J].Proc Soc Exp Biol Med,1966,121:1194-1196.
