绵羊肌肉组织MyoG和PID1 基因的表达及其与肌内脂肪含量的关系
2016-11-08栾兆进贺建宁刘开东曲绪仙
栾兆进,贺建宁,程 明,刘开东,曲绪仙,柳 楠*
(1.青岛农业大学动物科技学院,青岛 266109;2.包头市农业科学研究所,包头 014013;3.青岛市畜牧兽医研究所,青岛 266121;4.山东省畜牧总站,济南 250000)
绵羊肌肉组织MyoG和PID1 基因的表达及其与肌内脂肪含量的关系
栾兆进1,2,贺建宁1,程明3,刘开东3,曲绪仙4,柳楠1*
(1.青岛农业大学动物科技学院,青岛 266109;2.包头市农业科学研究所,包头 014013;3.青岛市畜牧兽医研究所,青岛 266121;4.山东省畜牧总站,济南 250000)
本研究旨在探究绵羊不同部位肌肉MyoG和PID1基因mRNA的发育变化规律,分析MyoG和PID1 基因mRNA表达水平对肌内脂肪沉积的影响。选取2、4、5、6 月龄敖汉细毛羊公羔和12月龄敖汉细毛羊成年公羊各5只,屠宰后取背最长肌和股二头肌检测肌内脂肪(Intramuscular fat,IMF)含量,用实时荧光定量 PCR 检测两个部位肌肉MyoG和PID1 mRNA 表达量,并进一步分析表达量与肌内脂肪含量的关系。结果表明,2~5月龄时,背最长肌和股二头肌的IMF含量均随着月龄的增加而增加;而5~12月龄时则基本保持不变;同月龄背最长肌IMF 含量极显著高于股二头肌(P<0.01)。两个部位肌肉MyoG和PID1 mRNA 表达的发育模式有所不同,具有组织特异性。背最长肌MyoG基因表达量5月龄最高(P<0.01),PID1基因表达量6月龄最高(P<0.05),均呈上升-下降趋势;股二头肌MyoG和PID1基因各月龄之间表达量均差异极显著(P<0.01),MyoG基因表达量随着月龄增长呈上升-下降趋势,PID1基因表达量大体呈下降-上升趋势。同月龄MyoG和PID1 表达量存在组织差异。相关分析表明,MyoG和PID1 表达量与 IMF 含量呈不同程度正相关。综上,MyoG基因表达对绵羊肌内脂肪的沉积可能有正调控作用,而PID1基因表达可能对肌内脂肪的沉积产生一定的影响。
肌内脂肪;MyoG;PID1;表达规律;相关性
近年来,肥羔肉因其瘦肉率高、口感鲜嫩、营养价值高、胆固醇含量低等特点使得市场需求量不断上升[1],敖汉细毛羊因其适应性强、抓膘快、繁殖率高等优点比较适合肥羔生产,增加肥羔肉产量,以更好的适应市场需求量。肌内脂肪(Intramuscular fat,IMF)的沉积量在一定程度上决定了口感品质[2],若能在稳定瘦肉比例的基础上,适量提高IMF含量,可以有效的改善羊肉口感品质,了解脂肪沉积机理及规律可为改善肉质提供理论依据[3],此领域的研究具有较好的实际意义[4]。研究表明,0~6月龄绵羊肌内脂肪含量呈上升趋势,12月龄基本维持与6月龄相同的水平[5]。
遗传和环境因素的改变都会导致IMF沉积产生变化,其中遗传因素的影响较大。利用分子生物学的标记辅助选择来研究调控IMF含量的主效基因,通过品种选育来提高IMF含量是改善肉质的可行途径之一[6]。肌细胞生成素(Myogenin,MyoG)基因调控成肌细胞的分化与融合,是调节骨骼肌发育的重要因子[7],并参与骨骼肌损伤及修复过程[8],鸡Mrf4和MyoG基因共表达参与了骨骼肌细胞终末分化[9];杜琛检测到MyoG基因在成熟脂肪细胞中的表达量显著高于前体脂肪细胞[10],M.Bocian等发现猪MyoG基因对胴体脂肪沉积和肌肉增长有重要影响[11],L.Zhu等研究证实MyoG基因极显著影响肌内脂肪含量[12],相关研究表明MyoG启动子区的DNA甲基化变化对脂肪沉积具有一定的调控作用[13]。磷酸酪氨酸互作结构域1(Phosphotyrosine interaction domain containing1,PID1)基因通过引起线粒体功能障碍而导致与肥胖相关的胰岛素抵抗使葡萄糖摄取降低,同时影响成熟脂肪细胞线粒体中的脂肪酸合成酶合成乙酰基来调控脂肪酸的合成,进而对脂肪沉积产生促进作用[14-16]。PID1基因在山羊内脏和肌肉组织中均有不同程度表达,其中背最长肌的表达量在不同月龄间表现出发育特异性[17]。相关研究表明,PID1可能影响山羊和猪肌肉组织中IMF沉积[18-19]。绵羊MyoG和PID1基因的表达对IMF沉积是否产生影响鲜有报道。
本研究拟通过实时荧光定量PCR对绵羊不同肌肉组织MyoG和PID1基因的表达规律进行研究,并分析其与IMF含量的关系,为寻找绵羊肉质相关候选基因提供依据。
1 材料与方法
1.1试验动物
试验羊来自青岛奥特种羊场,饲养管理条件一致,分别选择2、4、5、6、12月龄的毛肉兼用型敖汉细毛羊各5只,现场屠宰,迅速采集背最长肌、股二头肌组织样,并立即置于液氮中,然后保存于-80 ℃冰箱,用于总RNA提取。另取背最长肌、股二头肌样各150 g,于-20 ℃保存,待测IMF含量。
1.2主要试剂
Tripure RNA Isolation Reagent,Transcriptor First Strand cDNA Synthesis Kit,LightCycler®480 SYBR Green I Master购于Roche公司;琼脂糖购于 Thermo scientific 公司;Dream Taq Green PCR Master Mix(2×) 购自天根生化科技(北京)有限公司。
1.3试验方法
1.3.1总RNA提取和cDNA第一链的合成取50 mg各组织样加液氮充分研磨,采用Trizol法提取背最长肌、股二头肌组织的总RNA,采用Eppendorf BioPhotometer Plus 分光光度计测量RNA浓度,并通过电泳检测其完整性。反转录总RNA用量为1 μg,按照Transcriptor First Strand cDNA Synthesis Kit试剂盒上的操作进行,合成的cDNA于-20 ℃贮存。
1.3.2引物设计参考GenBank绵羊MyoG和PID1基因序列(登录号:GU550517和XM_012147826),以3-磷酸甘油醛脱氢酶(Glyceraldehyde 3-phosphate dehydrogenase,GAPDH)为内参基因,采用Primer5.0设计特异性引物,由生工生物(上海)有限公司合成,引物序列信息见表1。
表1MyoG、PID1和GAPDH基因引物序列
Table 1MyoG,PID1 andGAPDHgenes primer sequence
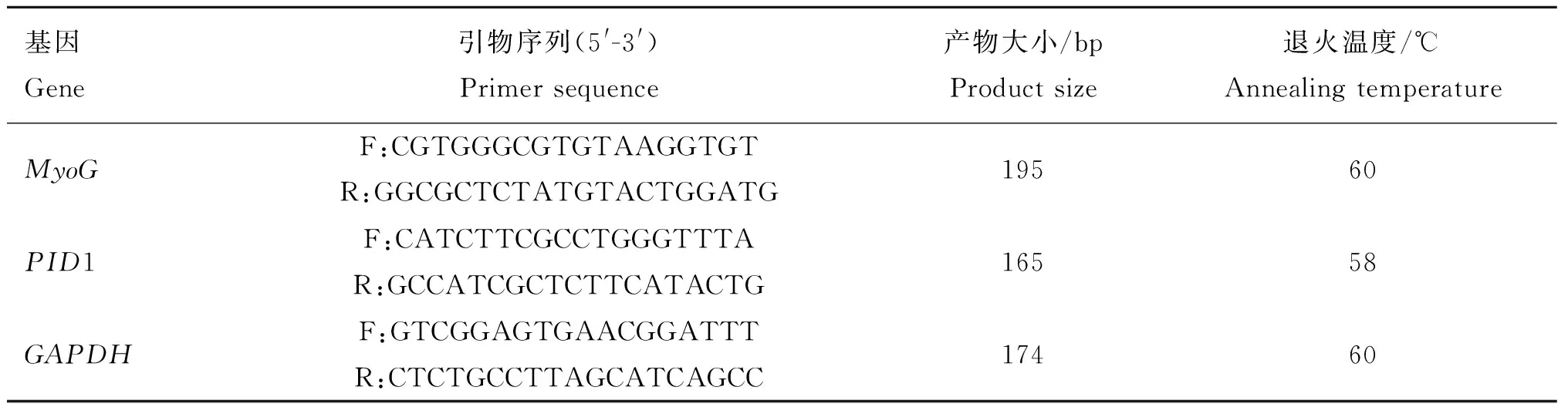
基因Gene引物序列(5'-3')Primersequence产物大小/bpProductsize退火温度/℃AnnealingtemperatureMyoGF:CGTGGGCGTGTAAGGTGTR:GGCGCTCTATGTACTGGATG19560PID1F:CATCTTCGCCTGGGTTTAR:GCCATCGCTCTTCATACTG16558GAPDHF:GTCGGAGTGAACGGATTTR:CTCTGCCTTAGCATCAGCC17460
1.3.3MyoG和PID1基因在绵羊肌肉组织的表达量测定采用罗氏LightCycler®480实时荧光定量PCR仪进行定量分析。每个待测样本设3个重复,以GAPDH为内参,采用2-ΔΔCt法计算分析数据。采用20 μL实时荧光定量PCR反应体系,包含10 μL SYBR@Premix EX Taq TMⅡ(2×)、0.5 μL PCR Forward primer(10 μmol·L-1)、0.5 μL PCR Reverse primer(10 μmol·L-1)、1.0 μL DNA Templet(<100 ng)、8.0 μL dd H2O(灭菌蒸馏水)。
1.3.4IMF含量测定采用索氏抽提法测定背最长肌、股二头肌中的IMF含量,每个样品重复测量3次,按照公式:IMF含量(%)=(x-y)/a×100%计算IMF含量,式中x表示浸提前含烘干样品滤纸包重,y表示浸提后含烘干样品滤纸包重,a表示烘干样品重。
1.3.5数据分析荧光定量的数据采用2-ΔΔCt法进行相对表达处理,构建单因素试验线性模型:
式中:yij表示mRNA的表达量,μ表示总体平均数,αi表示组织效应,εij表示试验误差。使用统计学软件SPSS17.0对试验结果进行单因素方差分析,采用Duncan法对各年龄间mRNA表达量和IMF含量的主效应进行多重比较,采用独立样本T检验分别对同月龄两块肌肉基因表达量和肌内脂肪含量进行比较,采用Pearson分析方法对MyoG和PID1基因 mRNA表达量与IMF含量进行相关分析。
2 结 果
2.1总RNA提取与检测
提取组织总RNA后,经Eppendorf BioPhotometer Plus 分光光度计检测,D260 nm/OD280 nm为1.8~2.0,并用1.0%琼脂糖凝胶电泳检测,由图1可见,28SRNA和18SRNA均较明亮,且两条带的比值接近2∶1,表明所提取的总RNA完整性较好,浓度和纯度可以满足后续试验要求。
M.DNA相对分子质量标准;1~2.总RNAM.DL-2000 bp marker;1-2.Total RNA图1 总RNA电泳图Fig.1 The electrophoresis of total RNA
2.2MyoG和PID1基因普通PCR扩增结果
由图2可见,内参基因GAPDH、目的基因MyoG和PID1的PCR电泳结果显示,引物扩增目的条带单一,大小与设计的一致,说明引物可用。

M.DNA相对分子质量标准M.DL-1000 bp marker图2 绵羊GAPDH(a)、MyoG(b)和PID1基因(c)扩增产物Fig.2 PCR products of sheep GAPDH (a),MyoG (b) and PID1(c) genes
2.3绵羊不同肌肉部位 IMF 含量的发育性变化
对5个时期绵羊肌肉IMF含量进行测定,结果见表2,2、4、5、6月龄敖汉细毛羊羔羊的背最长肌IMF含量逐渐增加,5、6、12月龄IMF含量极显著高于2和4月龄(P<0.01);其中2与4月龄差异不显著,5、6、12月龄间差异不显著(P>0.05)。股二头肌IMF含量呈缓慢的上升趋势,5月龄极显著高于2和4月龄(P<0.01),6和12月龄显著高于2和4月龄(P<0.05);其中2和4月龄差异不显著(P>0.05),5月龄与6和12月龄差异显著(P<0.05),6和12月龄差异不显著(P>0.05)。从同月龄不同肌肉部位IMF含量来看,背最长肌IMF含量极显著高于股二头肌(P<0.01)。
表2绵羊背最长肌和股二头肌IMF含量
Table 2IMF content oflongissimusdorsiandbicepsfemorisin sheep (Mean±SD)

月龄Monthsofage背最长肌IMF含量/%LongissimusdorsiIMFcontent股二头肌IMF含量/%BicepsfemorisIMFcontent23.067±0.404Aa1.733±0.153Bb44.467±0.503Aa3.300±0.608Bb59.160±0.985Aa**8.650±0.208Bb**69.167±1.258Aa**7.200±0.624Bb*129.163±0.777Aa**6.967±0.764Bb*
同一月龄不同部位间的差异用字母表示:不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。**.表示同部位不同月龄间差异极显著(P<0.01);*.表示同部位不同月龄间差异显著(P<0.05)
In different parts of muscles at the same age,different lowercase letters means significant difference between muscles (P<0.05),different capital letters means extremely significant differences between muscles(P<0.01).**. Indicates extremely significant differences (P<0.01) between different ages of the same part of muscles;*. Indicates significant differences (P<0.05) between different ages of the same part of muscles
2.4绵羊肌肉组织MyoG基因mRNA 表达量的发育性变化
如图3所示,内参和MyoG基因引物扩增特异性较好,可用于下一步试验。采用qRT-PCR法对2、4、5、6月龄绵羊羔羊和12月龄育成羊的背最长肌、股二头肌两个部位肌肉的MyoG基因mRNA表达量进行分析,结果显示(图4),绵羊两个部位肌肉MyoG基因表达的发育性变化规律有差异,背最长肌该基因的表达量先上升后下降,从2月龄开始逐渐增加,5月龄时最高,且极显著高于4月龄(P<0.01),而与6月龄差异不显著(P>0.05),12月龄有所下降,且与6月龄差异极显著(P<0.01);股二头肌该基因的表达量先上升后下降,各月龄之间表达量均差异极显著(P<0.01)。将同月龄不同部位肌肉MyoG基因mRNA表达量进行比较发现,4月龄背最长肌显著高于股二头肌(P<0.05),其余月龄背最长肌极显著高于股二头肌(P<0.01)。
图3 GAPDH(A)、PID1(B)和MyoG(C)基因熔解曲线Fig.3 Dissociation curves of GAPDH(A), PID1(B) and MyoG(C) genes
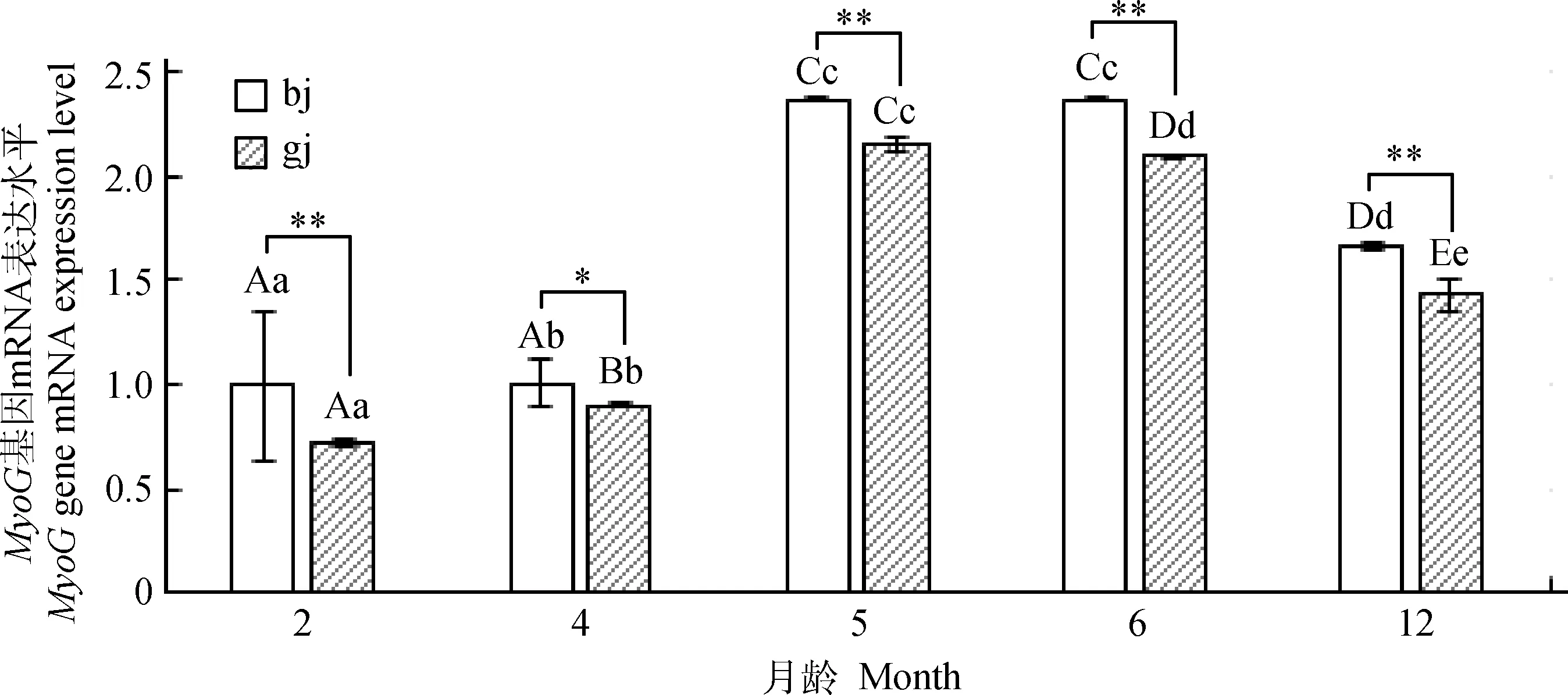
bj.背最长肌;gj.股二头肌。同部位不同月龄间的差异用字母表示,相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。**.表示同月龄不同部位间差异极显著(P<0.01);*.表示同月龄不同部位间差异显著(P<0.05)。图5同bj. Longissimus dorsi;gj.Biceps femoris. In the same part of muscles,common letter indicate no difference between ages (P>0.05),different lowercase letters means significant difference between ages (P<0.05),different capital letters means extremely significant difference between ages(P<0.01).**. Indicates extremely significant differences (P<0.01) between different parts of muscle at the same age;*. Indicates significant differences (P<0.05) between muscles at the same age.The same as Figure 5图4 MyoG基因组织表达量的发育性变化Fig.4 The developmental changes of the expression level of MyoG in tissues
2.5绵羊肌肉组织PID1基因 mRNA 表达量的发育性变化
如图3所示,内参和PID1基因引物扩增特异性较好,可用于下一步试验。采用qRT-PCR法对2、4、5、6月绵羊羔羊和12月龄育成羊的背最长肌、股二头肌两个部位肌肉的PID1 mRNA表达量进行分析,结果显示(图5),绵羊背最长肌该基因的表达量先上升后下降,2、4、5月龄间均差异极显著(P<0.01),6月龄与5和12月龄差异显著(P<0.05);股二头肌该基因的表达量先下降后上升,各月龄之间表达量均差异极显著(P<0.01)。将同月龄不同部位肌肉PID1 mRNA表达量进行比较发现:2月龄背最长肌与股二头肌差异不显著(P>0.05),4、5、6、12月龄背最长肌极显著高于股二头肌(P<0.01)。
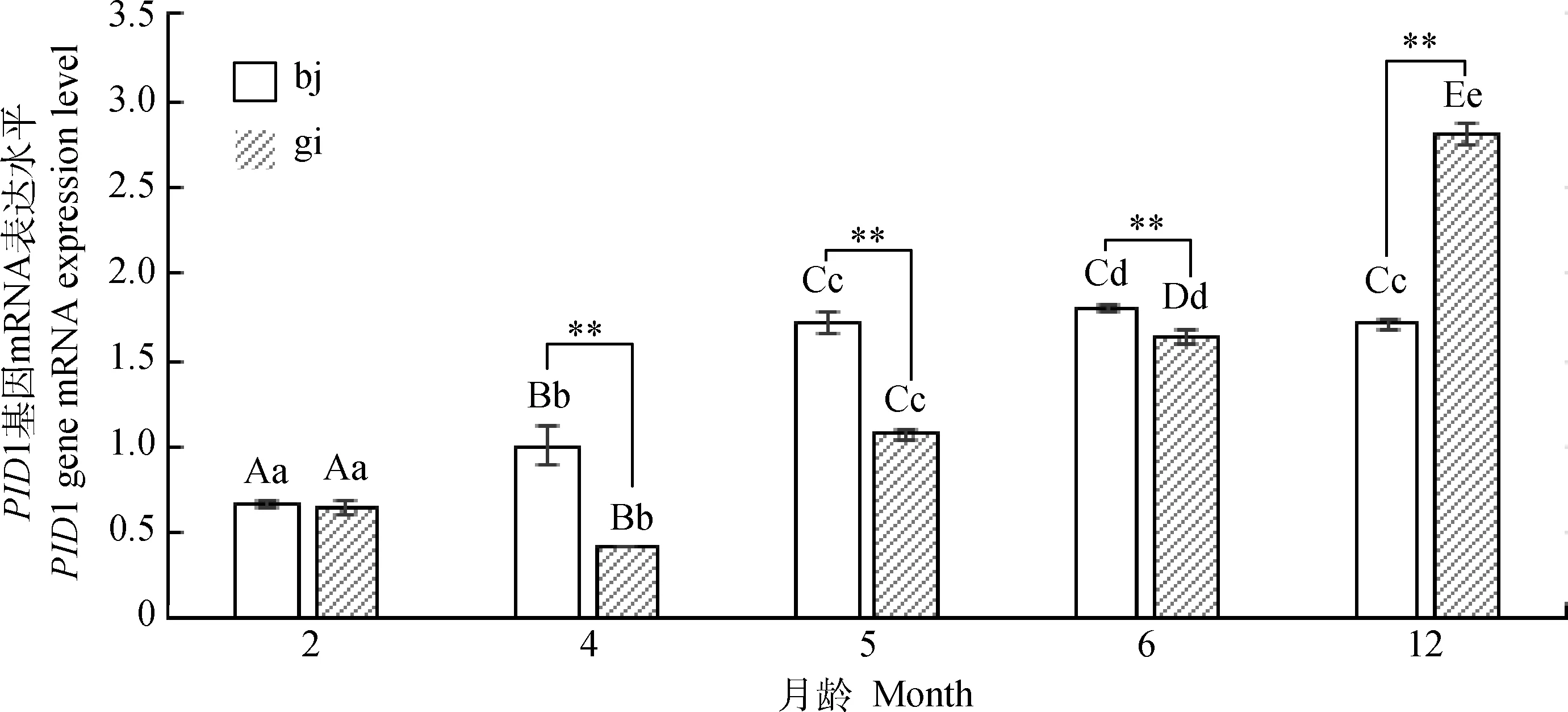
图5 PID1基因组织表达量的发育性变化Fig.5 The developmental changes of the expression level of PID1 in tissues
2.6绵羊肌肉组织MyoG和PID1基因 mRNA表达水平与肌内脂肪含量的相关性
对绵羊两个部位肌肉MyoG和PID1的表达量与IMF含量的相关分析(表3)表明,5个时期的背最长肌MyoG的表达量与IMF含量呈显著正相关(P<0.05),相关系数为0.896;5个时期的股二头肌MyoG的表达量与IMF含量呈显著正相关(P<0.05),相关系数为0.953;5个时期的背最长肌PID1的表达量与IMF含量呈极显著正相关(P<0.01),相关系数为0.996,5个时期的股二头肌PID1的表达量与IMG含量呈不显著正相关,相关系数为0.548。如图6所示,可以直观的看出背最长肌和股二头肌MyoG和背最长肌PID1基因的表达量与各自IMF含量趋势呈不同程度一致性,而股二头肌PID1基因的表达量与其IMF含量趋势的一致性不明显,这与相关分析数据的结果一致,也说明了数据的准确性。
表3MyoG和PID1 mRNA表达量与IMF含量的相关性
Table 3Correlation analysis ofMyoGandPID1 mRNA and IMF content

指标IndexMyoG基因mRNA表达量MyoGmRNAexpressionlevelPID1基因mRNA表达量PID1mRNAexpressionlevel背最长肌IMF含量LongissimusdorsiIMFcontent0.896*0.996**股二头肌IMF含量BicepsfemorisIMFcontent0.953*0.548
*.显著相关(P<0.05);**.极显著相关(P<0.01)
*.Indicates significant correlation (P<0.05);**.Indicates extremely significant correlation (P<0.01)
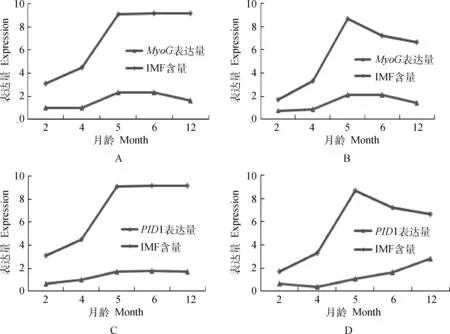
A.背最长肌MyoG与IMF;B.股二头肌MyoG与IMF;C.背最长肌PID1与IMF;D.股二头肌PID1与IMFA.Longissimus dorsi MyoG and IMF;B.Biceps femoris MyoG and IMF;C.Longissimus dorsi PID1 and IMF;D.Biceps femoris PID1 and IMF图6 背最长肌和股二头肌MyoG、PID1表达量与IMF含量趋势Fig.6 Longissimus dorsi and biceps femoris MyoG,PID1 expression and IMF content tendency
3 讨 论
MyoG是至关重要的成肌调节因子[7],其表达水平对肌细胞的生成、融合以及肌肉组织生长都会产生重要影响。M.Bocian等发现猪MyoG对胴体脂肪沉积和肌肉增长有重要影响[11]。L.Zhu等研究证实MyoG基因的表达对IMF含量产生极显著影响[12]。张晓卉研究显示MyoG只在骨骼肌组织中有所表达,而在内脏、消化器官、卵巢中均不表达[20],所以只选取肌肉组织作为MyoG基因表达的研究对象。相关遗传学、药理学和生理学试验结果都曾表明,PID1直接调节细胞生长和成脂过程,对脂肪细胞分化不产生影响[15,21]。PID1对多个组织胰岛素的敏感性有调节作用,可能与胰岛素PI3K和Ras-MAPK信号途径有关[22],通过影响脂肪细胞胰岛素敏感性的高低调控脂肪沉积[23]。PID1基因在肥胖者脂肪组织中的表达量显著高于健康者的脂肪组织,由此推断PID1是调节脂肪细胞成脂过程的相关基因[24]。
结合绵羊与山羊和猪的种间保守性[25],MyoG和PID1可能同样调控绵羊的脂质代谢。而肌肉组织是IMF沉积最主要的组织[26],由此选取了背最长肌和股二头肌两块典型的肌肉组织来研究MyoG和PID1对IMF沉积的影响。mRNA水平的表达分析是研究不同组织中分子调控机制要充分考虑的一个方面[27],为基因功能的验证提供选择依据。
本试验通过荧光定量PCR发现,2、4、5、6、12月龄绵羊两个部位肌肉MyoG和PID1 基因mRNA 表达的规律不同,背最长肌MyoG和PID1表达量呈上升-下降趋势;股二头肌MyoG表达量呈先上升后下降趋势,PID1基因呈下降-上升趋势。2、5、6、12月龄绵羊MyoG基因和4、5、6、12月龄绵羊PID1基因在背最长肌和股二头肌之间表达量存在极显著差异,表明MyoG和PID1的转录具有一定的组织特异性。IMF测定的结果显示,各月龄背最长肌和股二头肌的IMF含量差异极显著,并且这两个部位的MyoG基因表达量与各自的IMF含量均表现出显著正相关,而PID1基因表达量与各自的IMF含量分别表现出极显著和不显著正相关,初步表明MyoG和PID1基因表达对IMF沉积可能具有一定的积极作用,此结论与前人在其他物种上的研究基本相符,这两个基因对绵羊IMF同样有一定的调控作用。
MyoG和PID1对于绵羊IMF的影响和调控机制仍处在基础研究阶段,未来可以考虑通过细胞水平RNA干扰和超表达来验证其表达对绵羊细胞脂肪沉积的影响,找到其调控通路、互作基因以及调节因子,以准确判断MyoG和PID1是否为影响绵羊育肥性状的候选基因。
4 结 论
本研究发现MyoG和PID1在不同时期绵羊的背最长肌、股二头肌组织中均有表达,且MyoGmRNA表达量与各自的IMF含量均表现出显著正相关,PID1 mRNA表达量与各自的IMF含量分别表现出极显著和不显著正相关,结果可为进一步研究MyoG和PID1的功能和脂质代谢调控通路提供基础数据。
[1]赵有璋.羊生产学[M].北京:中国农业出版社,2002:69-75.
ZHAO Y Z.Production science of sheep and goat[M].Beijing:China Agriculture Press,2002:69-75.(in Chinese)
[2]URBAN T,MIKOLASOVA R,KUCIEL J,et al.A study of associations of theH-FABPgenotypes with fat and meat production of pigs[J].JApplGenet,2002,43(4):505-510.
[3]杜琛,李金泉,陈秀娟.白绒山羊PPARγ基因RNA干扰慢病毒载体的构建及对肌内脂肪细胞增殖分化的影响[J].畜牧兽医学报,2016,47(4):671-678.
DU C,LI J Q,CHEN X J.Construction of lentiviral RNAi vector ofPPARγgene in cashmere goat and its effect on proliferation and differentiation of intramuscular adipocytes[J].ActaVeterinariaetZootechnicaSinica,2016,47(4):671-678.(in Chinese)
[4]WANG Y H,BYRNE K A,REVERTER A,et al.Transcriptional profiling of skeletal muscle tissue from two breeds of cattle[J].MammGenome,2005,16(3):201-210.
[5]郝称莉,李齐发,乔永,等.湖羊肌肉组织H-FABP和PPARγ基因表达水平与肌内脂肪含量的相关研究[J].中国农业科学,2008,41(11):3776-3783.
HAO C L,LI Q F,QIAO Y,et al.Association of theH-FABPandPPARγgene expression with intramuscular fat content in Hu sheep muscles[J].ScientiaAgriculturaSinica,2008,41(11):3776-3783.(in Chinese)
[6]MEUWISSEN T H E,GODDARD M E.The use of marker haplotypes in animal breeding schemes[J].GenetSelEvol,1996,28(2):161-176.
[7]HASTY P,BRADLEY A,MORRIS J H,et al.Muscle deficiency and neonatal death in mice with a targeted mutation in the myogenin gene[J].Nature,1993,364 (6437):501-506.
[8]苏艳红,齐鸷,周越,等.Caveolin-3,MyoGenin,MyoD在大鼠力竭运动后骨骼肌损伤过程的时程表达[J].北京体育大学学报,2012,35(12):57-61.
SU Y H,QI Z,ZHOU Y,et al.Effect of Caveolin-3,Myogenin and MyoD on the rehabilitation of skeletal muscle injury after rats’exhausting exercise[J].JournalofBeijingSportUniversity,2012,35(12):57-61.(in Chinese)
[9]BERTI F,NOGUEIRA J M,WOHRLE S,et al.Time course and side-by-side analysis of mesodermal,pre-myogenic,myogenic and differentiated cell markers in the chicken model for skeletal muscle formation[J].JAnat,2015,227(3):361-382.
[10]杜琛.绒山羊肌内脂肪沉积特征及脂肪细胞分化机理的研究[D].呼和浩特:内蒙古农业大学,2014.
DU C.Characteristics of intramuscular fat deposition and mechanism of adipocyte differentiation in cashmere goat[D].Hohhot:Inner Mongolia Agricultural University,2014.(in Chinese)
[11]BOCIAN M,CIESLAK D,GRAJEWSKA S,et al.A relationship between genotypes at MYOG,MYF3 and MYF5 loci and carcass meat and fat deposition traits in pigs[J].AnimSciPapRep,2002,20(2):79-92.
[12]ZHU L,LI X W.The genetic effects of MyoG gene[J].Hereditas(Beijing),2005,27(5):710-714.
[13]姜美华,巨婷婷,刘洋,等.成肌细胞成脂过程中PPARγ、C/EBPα和Myogenin基因启动子的甲基化变化[J].中国农业科学,2013,46(14):3010-3021.
JIANG M H,JU T T,LIU Y,et al.Dynamics ofPPARγ,C/EBPαandMyogeningene promoter methylation during myoblasts intracellular lipid accumulation[J].ScientiaAgriculturaSinica,2013,46(14):3010-3021.(in Chinese)
[14]SHI C M,XU G F,YANG L,et al.Overexpression of TFAM protects 3T3-L1 adipocytes from NYGGF4 (PID1) overexpression-induced insulin resistance and mitochondrial dysfunction[J].CellBiochemBiophys,2013,66(3):489-497.
[15]ZHAO Y,ZHANG C,CHEN X,et al.Overexpression of NYGGF4(PID1) induces mitochondrial impairment in 3T3-L1 adipocytes[J].MolCellBiochem,2010,340(1-2):41-48.
[16]李娟,史春梅,季晨博,等.NYGGF4(PID1)基因过表达对脂肪细胞中脂肪酸合成酶表达的影响[J].江苏医药,2012,38(19):2233-2235.
LI J,SHI C M,JI C B,et al.Effect ofNYGGF4(PID1) gene over-expression on fatty acid synthase in adipocytes[J].JiangsuMedicalJournal,2012,38(19):2233-2235.(in Chinese)
[17]XU H,XU G,WANG D,et al.Molecular cloning and tissue distribution of the phosphotyrosine interaction domain containing 1 (PID1) gene in Tianfu goat[J].Gene,2013,515(1):71-77.
[18]殷捷,凌英会,丁建平,等.山羊PID1基因组织表达谱及其与肌内脂肪含量的相关性[J].江苏农业学报,2014,30(4):784-789.
YIN J,LING Y H,DING J P,et al.Expression ofPID1 and the association with intramuscular fat in goat[J].JiangsuJournalofAgriculturalSciences,2014,30(4):784-789.(in Chinese)
[19]钱源,曾勇庆,杜金芳,等.猪PID1基因CDS区的克隆及其mRNA表达与肌内脂肪沉积关系[J].遗传,2010,32(11):68-73.
QIAN Y,ZENG Y Q,DU J F,et al.CDS cloning and relationship between intramuscular fat content and mRNA expression ofPID1 gene in pig[J].Hereditas,2010,32(11):68-73.(in Chinese)
[20]张晓卉.民猪MyoG基因的克隆、表达与启动子核心区的定位[D].哈尔滨:东北农业大学,2012.
ZHANG X H.The cloning,expression and the core area promoter positioning of min pigMyoGgene[D].Harbin:Northeast Agricultural University,2012.(in Chinese)
[21]CHIBA T,YAMAZA H,KOMATSU T,et al.Pituitary growth hormone suppression reduces resistin expression and enhances insulin effectiveness:relationship with calonic restriction[J].ExpGerontol,2008,43(6):595-600.
[22]钱源,曾勇庆,崔景香,等.莱芜猪PID1基因的功能分析及表达谱研究[J].畜牧兽医学报,2011,42(5):621-628.
QIAN Y,ZENG Y Q,CUI J X,et al.Functional analysis and tissue specific expression profile ofPID1 gene in laiwu pig[J].ActaVeterinariaetZootechnicaSinica,2011,42(5):621-628.(in Chinese)
[23]WU W,GARI W,TONG M,et al.Over-expression of NYGGF4 (PID1) inhibits glucose transport in skeletal myotubes by blocking the IRS1/PI3K/AKT insulin pathway[J].MolGenetMetab,2011,102(3):374-377.
[24]WANG B,ZHANG M,NI Y,et al.Identification and characterization of NYGGF4,a novel gene containing a phosphotyrosine-binding (PTB) domain that stimulates 3T3-L1 preadipocytes proliferation[J].Gene,2006,379(1):132-140.
[25]WU D D,IRWIN D M,ZHANG Y P.Molecular evolution of the keratin associated protein gene family in mammals,role in the evolution of mammalian hair[J].BMCEvolBiol,2008,8:241.
[26]DA COSTA A S,PIRES V M,FONTES C M,et al.Expression of genes controlling fat deposition in two genetically diverse beef cattle breeds fed high or low silage diets[J].BMCVetRes,2013,9:118.
[27]GRAUGNARD D E,PIANTONI P,BIONAZ M,et al.Adipogenic and energy metabolism gene networks in longissimus lumborum during rapid post-weaning growth in Angus and Angus×Simmental cattle fed high-starch or low-starch diets[J].BMCGenomics,2009,10:142.
(编辑郭云雁)
Association of theMyoGandPID1 Gene Expression with Intramuscular Fat Content in Sheep Muscles
LUAN Zhao-jin1,2,HE Jian-ning1,CHENG Ming3,LIU Kai-dong3,QU Xu-xian4,LIU Nan1*
(1.CollegeofAnimalScienceandTechnology,QingdaoAgriculturalUniversity,Qingdao266109,China;2.BaotouAgriculturalResearchInstitute,Baotou014013,China;3.InstituteofAnimalHusbandryandVeterinaryMedicineofQingdao,Qingdao266121,China;4.StationoftheShandongAnimalHusbandryandVeterinary,Jinan250000,China)
The objectives of this study were to investigate the developmental changes of Myogenin (MyoG) and Phosphotyrosine interaction domain containing 1 (PID1) mRNA expression in different parts of muscles in sheep and research its effect on intramuscular fat (IMF) accumulation.Five Aohan fine wool sheep were slaughtered at 2,4,5,6,12 months,respectively,to collect samples fromlongissimusdorsiandbicepsfemoris,for determining the IMF content.The mRNA expression of theMyoGandPID1 in 2 parts of muscles was investigated by real-time PCR,and association between their mRNA levels and IMF contents were also analyzed.The results showed that,2-5 month,with growing of the age,the IMF contents oflongissimusdorsiandbicepsfemorisincreased.And 5-12 month,the IMF contents remained unchanged.The IMF content oflongissimusdorsiwere extremely significantly higher thanbicepsfemoris(P<0.01) at the same age.MyoGandPID1 mRNA expression level was different in 2 parts of muscles and had tissues-dependent.Inlongissimusdorsi,MyoGexpression level was the highest (P<0.01) in 5 month old sheep,PID1 expression level was the highest (P<0.05) in 6 month old sheep,there was an increase and then decrease trend in the 2 gene expression.Inbicepsfemoris,theMyoGandPID1 expression level difference was extremely significant(P<0.01) among different month ages,andMyoGexpression level presented increased and declined slowly with growing,PID1 expression level presented declined-increased with growing.In the same month,MyoGandPID1 expression level had significant difference in different parts.Correlation analysis showed thatMyoGandPID1 expression level was inordinately positively related to IMF content.In conclusion,MyoGexpression has positively effect on IMF accumulation in sheep,andPID1 expression is likely to influence on IMF accumulation.
IMF;MyoG;PID1;expression changes;correlation
10.11843/j.issn.0366-6964.2016.10.006
2016-02-03
山东省良种工程项目(2011-16)
栾兆进(1991-),女,山东青岛人,硕士生,主要从事动物遗传育种与繁殖研究,E-mail:15264246691@163.com
柳楠,教授,博士,E-mail:nanliu@sina.com
S826;S813.3
A
0366-6964(2016)10-1986-09
