高效液相色谱—串联质谱法测定肌肉组织中4 种兽药残留
2017-11-16耿宁卢剑
耿宁+卢剑
摘 要:建立同時测定肌肉组织中新霉素、灰黄霉素、多黏菌素B、喹乙醇及其代谢物3-甲基喹啉-2-羧酸(3-methyl-quinoxaline-2-carboxylic acid,MQCA)的高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)分析方法。肌肉组织匀浆均质后使用乙腈-5%甲酸水溶液提取,HLB固相色谱柱净化,HPLC分离,电喷雾离子源正离子模式及多反应监测模式检测,外标法定量。结果表明:4 种兽药在质量浓度1.0~200.0 ?g/L范围内均表现出良好的线性关系,R2均大于0.998 0;新霉素、灰黄霉素和多黏菌素B的方法检出限为5.0 μg/kg,喹乙醇及MQCA为0.5 μg/kg;阴性样品中4 种兽药的加标回收率为82.1%~98.4%,日内相对标准偏差(relative standard deviation,RSD)(n=6)为2.2%~6.7%。该方法前处理过程简单、干扰较少,检测结果准确,适用于肌肉组织中4 种兽药的定性与定量检测。
关键词:高效液相色谱-串联质谱法;固相萃取;肌肉组织;兽药残留
Simultaneous Determination of Four Veterinary Drugs in Edible Muscle Tissues by High Performance
Liquid Chromatography-Ttandem Mass Spectrometry
GENG Ning1,2, LU Jian2,*
(1.Quality Association of Jiangsu Province, Nanjing 210029, China;
2.Jiangsu Product Quality Inspection and Testing Institute, Nanjing 210007, China)
Abstract: A novel, simple and rapid method was established for the simultaneous determination of four veterinary drugs (neomycin, griseofulvin, polymyxin B, olaquindox and its metabolite 3-methyl-quinoxaline-2-carboxylic acid (MQCA)) in muscle tissues of food-producing animals by solid phase extraction (SPE) coupled with high performance liquid chromatography tandem triple quadrupole mass spectrometry (HPLC-MS-MS). After homogenized, muscle tissues were extracted with a mixture of acetonitrile and 5% formic acid solution and the extract was purified by an HLB solid phase extraction column, separated by HPLC, detected by positive electrospray ionization in multiple reaction monitoring mode (MRM), and quantified by an external standard method. Under the optimal conditions, the calibration for all five analytes showed a linear relationship in the range of 1.0–200.0 ?g/L with correlation coefficients higher than 0.998 0 and the limit of detection was
5.0 ?g/kg for neomycin, griseofulvin, polymyxin B and 0.5 ?g/kg for olaquindox and MQCA, respectively. The mean recoveries of spiked samples (spiked concentration levels: 20.0, 40.0 and 200.0 ?g/L for neomycin, griseofulvin and polymyxin B; 2.0, 4.0 and 20.0 ?g/L for qlaquindox and its metabolite) were ranged from 82.1% to 98.4% with relative standard deviation (RSD, n = 6) between 2.2% and 6.7%. This method is accurate, simple, rapid and applicable to the detection of veterinary drugs in muscle tissues.
Key words: high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS); solid phase extraction; muscle tissue; veterinary drugsendprint
DOI:10.7506/rlyj1001-8123-201708008
中圖分类号:O657.7 文献标志码:A 文章编号:1001-8123(2017)08-0039-05
随着现代养殖技术的迅速发展,兽药在畜禽养殖过程中的使用比例逐渐增加。兽药不仅能够用于畜禽的杀菌治疗,还有促进生长的作用。然而由于养殖人员的技术和知识水平参差不齐,因此经常出现盲目用药、重复给药、药物乱用、实验性用药等现象,这不仅导致畜禽体内大量的兽药残留,还给食品安全带来了巨大隐患[1-3]。
2017年的3·15晚会针对兽药滥用问题做了专题报道,主要涉及到的兽药包括喹乙醇、新霉素、灰黄霉素和黏菌素等杀菌、促生长类药物。其中喹乙醇是一种新型“瘦肉精”,它可以促进畜禽生长,近年来被广泛用于牛、鸡、猪的饲养[4-6],但毒理学研究表明,喹乙醇对动物具有致癌、致畸的作用。因此,欧盟在1998年禁止在可食性动物饲养中使用喹乙醇,但目前美国和中国仍允许将喹乙醇用于生猪饲养,并规定其在猪肌肉和猪肝中的代谢物3-甲基喹啉-2-羧酸(3-methyl-quinoxaline-2-carboxylic acid,MQCA)的最高残留限量分别为4 μg/kg和50 μg/kg。黏菌素是另一种具有抗感染和促生长作用的兽药,它对肾及神经系统具有毒害性[7-8]。动物饲养过程中大量使用黏菌素可造成其在动物体内的大量残留,并通过蛋、乳、肉等食品传递给人类。我国和欧盟均严格规定了黏菌素的残留量,其在动物肝脏和肌肉中的残留量分别不得超过200 μg/kg和150 μg/kg[9]。
鉴于兽药滥用造成动物体内大量兽药残留的现状,建立一种行之有效的同时检测动物肌肉组织中多种兽药残留的方法至关重要。目前针对喹乙醇[10-13]、灰黄霉素[14-17]、
新霉素[18-21]和黏菌素[21-24]等兽药的检测方法已有部分报道。GB/T 20797—2006《肉与肉制品中喹乙醇残留量的测定》[25]和GB/T 20746—2006《牛、猪肝脏和肌肉中卡巴氧、喹乙醇及代谢物残留量的测定 液相色谱-串联质谱法》[26]也规定了牛、猪的肝脏和肌肉中喹乙醇代谢物的检测方法;郑玲等[27]利用高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)法对动物源食品中的喹乙醇进行了检测;苏萌等[28]建立了检测动物源食品中黏杆菌素和多黏菌素的HPLC-MS/MS法。上述报道仅针对1~2 种兽药建立了检测方法,无法满足多种兽药同时筛查、同时检测的要求。鉴于此,本研究利用固相萃取净化技术和HPLC-MS/MS仪建立同时测定肌肉组织中新霉素、灰黄霉素、多黏菌素B、喹乙醇及其代谢物MQCA残留量的分析方法,并对方法的准确度和精密度进行评价,对同时测定肌肉组织中上述4 种兽药的残留量具有积极意义。
1 材料与方法
1.1 材料与试剂
鸡肉(8 份)、猪肉(8 份)、兔肉(4 份)样品,随机购自广州各市场。
硫酸新霉素(纯度>90.0%)、灰黄霉素(纯度>
98.0%)、硫酸多黏菌素B(纯度>84.0%)、喹乙醇(纯度>99.0%)、MQCA(纯度>99.0%)标准品
德国Dr.Ehrenstorfe公司;甲醇、乙腈(均为色谱纯) 德国Merck公司;甲酸(色谱纯) 上海安谱实验科技股份有限公司;实验用水均为超纯水;其他试剂均为分析纯 广州化学试剂厂。
1.2 仪器与设备
HLB固相萃取小柱(200 mg,6 mL) 德国CNW公司;1260超高效液相色谱仪、6490串联三重四极杆质谱仪 美国Agilent公司;MS3 Basic漩涡振荡器、T18高速均质机 德国IKA公司;Milli-Q纯水仪 美国
Millipore公司;KQ-250DV超声波清洗仪(250 W)
昆山市超声仪器有限公司;KDC-1044离心机 北京中科佳仪科技有限公司。
1.3 方法
1.3.1 标准溶液的配制
准确称取5 种标准品10.0 mg,分别置于100 mL棕色容量瓶中,用10 mL乙腈-1%甲酸水溶液(50∶50,V/V)溶解,用乙腈定容,得到质量浓度为100 mg/L的单标储备液;分别吸取5 种单标储备液各1.0 mL,用乙腈定容至100 mL,得到5 种标准品质量浓度均为1.0 mg/L的混合标准溶液。实验中所需的系列混合标准工作液均通过乙腈逐级稀释得到。所有标准溶液均于-18 ℃保存。
1.3.2 样品处理
1.3.2.1 提取
将肌肉组织切碎后使用均质机打碎,混合均匀,准确称取5.00 g(精确至0.01 g)均质后的样品于50 mL塑料离心管内,加入10 mL提取溶剂,涡旋1 min后,超声提取10 min,于4 000 r/min条件下离心3 min;将上清液转移至25 mL比色管中,用10 mL提取溶剂重复提取;合并2 次提取所得上清液,用提取溶剂定容至25.0 mL,摇匀,待净化。
其中提取溶剂分别选用乙腈、甲醇、5%甲酸水溶液等单一溶剂或二元溶剂提取体系,根据5 种化合物的提取效果选择最适提取溶剂。
1.3.2.2 净化
预先将HLB固相萃取柱分别用5 mL甲醇、10 mL超纯水活化后,取10 mL上述提取液上样;待液体完全流出后,用5 mL超纯水淋洗固相萃取柱,减压抽干;用10 mL净化洗脱液洗脱目标化合物至15 mL离心管,将洗脱液于50 ℃条件下氮气浓缩至近干;用1.0 mL初始流动相溶解浓缩物,0.22 μm滤膜过滤,进行HPLC-MS/MS测定。endprint
其中分别用10 mL乙腈含量不同的乙腈-5%甲酸水溶液(乙腈体积分数分别为100%、80%、50%和20%)作为净化洗脱液洗脱目标化合物,根据5 种化合物的净化效果选择最适洗脱液。
1.3.3 实验条件
1.3.3.1 色谱条件
选择Welch Ultimate AQ-C18(4.6 mm×150 mm,5.0 μm)、Welch Ultimate XB-Phenyl(4.6 mm×150 mm,5.0 μm)和Welch Ultimate XB C18(4.6 mm×150 mm,5.0 μm)3 种色谱柱进行实验,根据5 种化合物的分离效果选择合适的色谱柱;流动相A:0.1%甲酸水溶液,流动相B:0.1%甲酸乙腈溶液;梯度洗脱程序:0~3.0 min,流动相B体积分数由15%升至80%,3.0~5.5 min,流动相B体积分数80%,5.5~5.6 min,流动相B体积分数由80%降至15%,5.6~7.0 min,流动相B体积分数15%。柱温:35 ℃;流速:0.50 mL/min;进样量:10 μL。
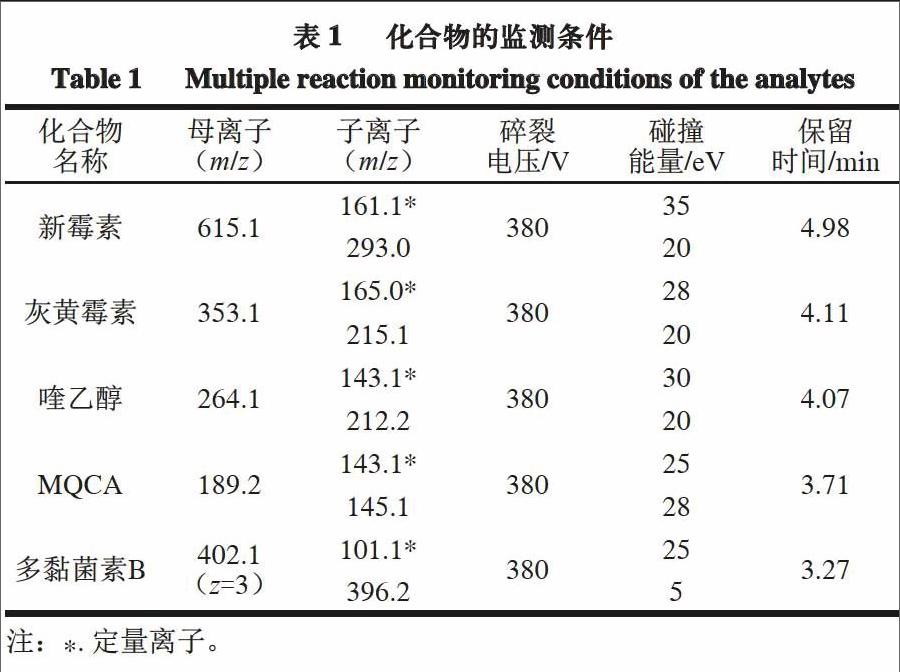
1.3.3.2 质谱条件
电喷雾离子源,正离子模式,多反应监测(multi reaction monitoring,MRM)采集模式;毛细管电压3 000 V;氮气为干燥气,气体温度280 ℃,流速
14 L/min;氮气辅助气温度350 ℃,流速11 L/min;驻留时间25 ms。待测化合物的监测离子对(质荷比,
m/z)、碎裂电压和碰撞能量如表1所示。
1.3.4 标准曲线的绘制
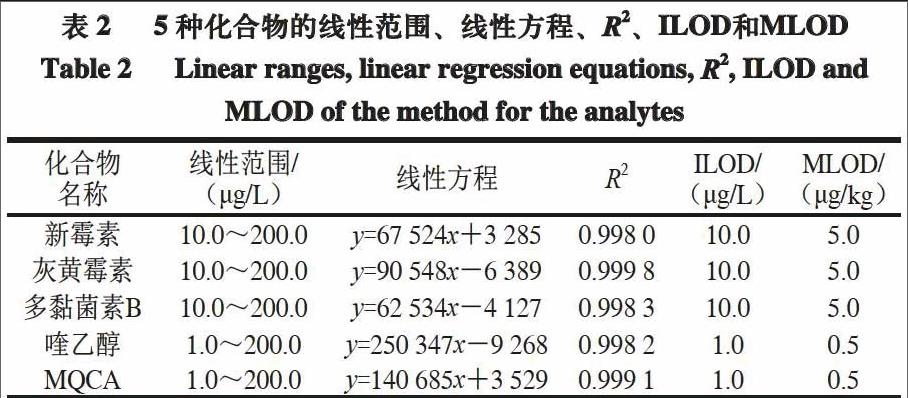
在最优实验条件下,分别对不同质量浓度的混合标准工作液(5 种标准品的质量浓度分别为1.0、2.0、5.0、10.0、20.0、50.0、100.0、200.0 μg/L)进行测定,以待测化合物的质量浓度为横坐标(x),定量离子对的峰面积为纵坐标(y)绘制标准曲线。各化合物的仪器检出限(the instrument detection limit,ILOD)根据3 倍信噪比(RS/N=3)计算得到。
1.3.5 回收率和精密度实验
在最优实验条件下,选取猪肉和兔肉的阴性样品,分别添加3 个质量浓度水平的混合标准工作液,计算方法的加标回收率和相对标准偏差(relative standard deviation,RSD)。新霉素、灰黄霉素和多黏菌素B的添加水平分别为20.0、40.0、200.0 μg/kg,喹乙醇和MQCA的添加水平分别为2.0、4.0、20.0 μg/kg。
1.4 数据处理
使用安捷伦质谱数据采集工作站(Version B.08.00)进行数据采集,Origin 8.0软件进行绘图。
2 结果与分析
2.1 样品提取和净化条件的选择
动物肌肉组织中含有许多脂溶性的内源性物质,这些物质在检测过程中会严重干扰化合物的响应,因此需要选择合适的提取溶剂和净化方式来去除干扰物质。
2.1.1 提取溶剂的选择
新霉素、多黏菌素B和喹乙醇极性较大,使用极性溶剂较易提取,而灰黄霉素和MQCA极性相对较小,需使用有机溶剂进行提取。由于新霉素和多黏菌素B在酸性条件下的提取效率较高,本研究比较了乙腈、甲醇、5%甲酸水溶液等单一溶剂或二元溶剂提取体系下的提取效果。结果表明,单一有机溶剂体系对灰黄霉素、喹乙醇和MQCA均有一定的提取效果,但对新霉素和多黏菌素B的提取效果较差,而单一的5%甲酸水溶液对灰黄霉素几乎没有提取效果。使用有机溶剂-5%甲酸水溶液二元体系进行提取时,乙腈或甲醇作为有机相时的提取效果差别不大,但二者在溶剂体系中的比例会影响提取或净化过程。有机相比例过低时(<10%),灰黄霉素的提取率低于60%,有机相比例过高时(>30%),提取液中的脂溶性干扰物质较多,影响固相萃取净化效果。综上所述,选择乙腈-5%甲酸水溶液(20∶80,V/V)作为提取溶剂,此时5 种化合物的提取率均达82%以上。
2.1.2 净化洗脱液的选择
固相萃取技术利用固相萃取小柱对提取液進行净化,可以有效去除杂质,减少基质干扰。本研究利用HLB固相萃取柱对肌肉组织提取液进行净化,分别用10 mL乙腈含量不同的乙腈-5%甲酸水溶液洗脱目标化合物。结果表明,用乙腈的体积分数为20%和50%的洗脱液进行洗脱时杂质最少,但仍有部分灰黄霉素未被洗脱(约30%~45%);纯乙腈洗脱液所得杂质最多,而采用80%乙腈-5%甲酸水溶液做洗脱液时,不仅洗脱后溶液中的杂质较少,而且5 种化合物的回收率均在80%以上。因此,选择10 mL 80%乙腈-5%甲酸水溶液为洗脱液。
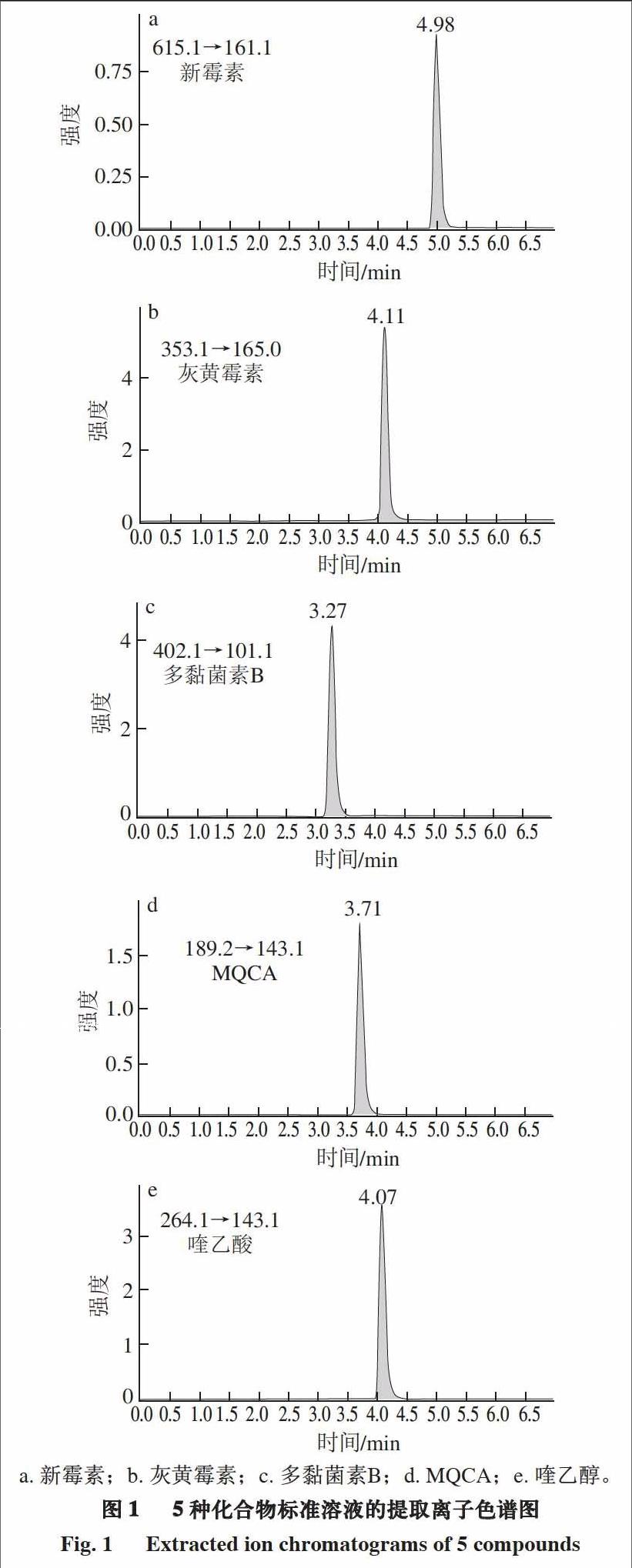
2.2 色谱柱的选择
5 种化合物的结构和极性不同,如灰黄霉素含有弱极性、疏水性的苯环和苯并呋喃酮环,新霉素含有多羟基和氨基,具有较强的极性和亲水性,因此需选择合适的色谱柱进行分离。本研究比较了3 种色谱柱对5 种化合物的分离效果。结果表明,灰黄霉素在AQ-C18色谱柱上的保留效果较差,不仅出峰时间短,而且峰形较差,不能实现很好的分离,这是由AQ-C18柱填料极性封端,对于弱极性、苯环较多的灰黄霉素保留作用较弱导致的,而
XB-Phenyl色谱柱填料键合了丙基苯基,对含有苯环的灰黄霉素有较好的保留作用,但对其他4 种化合物的保留较弱,整体上不能达到良好的分离效果。XB-C18色谱柱采用新型键合和双封尾技术,对强极性和弱极性化合物均有保留作用,可以实现4 种兽药的分离。采用优化后的方法对5 种化合物标准溶液进行测定的提取离子色谱图如图1所示。
2.3 线性方程和检出限
由表2可知,喹乙醇和MQCA标准线性方程的R2分别为0.998 2和0.999 1,其他3 种化合物的R2均大于0.998 0,说明5 种化合物的定量离子对峰面积与其质量浓度间的线性关系良好。综合考虑前处理过程中的浓缩倍数(2 倍)和前处理回收率,计算得到5 种化合物的方法检出限(the method detection limit,MLOD)。喹乙醇和MQCA的ILOD为1.0 μg/L,MLOD为0.5 μg/kg;其他3 种化合物的ILOD为10.0 μg/L,MLOD为5.0 μg/kg。表明方法灵敏度高,适用于5 种目标兽药的定量分析。endprint
2.4 回收率和精密度实验
由表3可知,5 种化合物的回收率在82.1%~98.4%之间,RSD在2.2%~6.7%之间,表明方法的回收率和精密度均能够满足肌肉组织中5 种化合物的检测要求。
2.5 实际样品测定
由表4可知,1 份鸡肉样品中检测出新霉素,含量为41.7 μg/kg;2 份猪肉样品和1 份兔肉样品中检测出喹乙醇或MQCA,其含量分别为21.7、59.1、11.4 μg/kg,其他样品中没有检测出4 种兽药。
3 结 论
本研究采用固相萃取净化技术和HPLC-MS/MS法建立了肌肉组织中新霉素、灰黄霉素、多黏菌素B、喹乙醇及MQCA 4 种兽药残留的检测方法。该方法前处理过程简单、干扰较少,检测结果准确,方法定量限、回收率及精密度等均能够满足肌肉组织中兽药的定性与定量检测要求。
参考文献:
[1]徐敏. 兽药滥用的危害性及其防控刍议[J]. 湖北畜牧兽医, 2017, 38(1): 41-43. DOI:10.16733/j.cnki.issn1007-273x.2017.01.023.
[2]于书洋. 滥用兽药的危害性分析[J]. 中国畜牧兽医文摘, 2015, 31(5): 225.
[3]柳锦根. 兽药在动物源食品中的残留及控制措施[J]. 上海畜牧兽医通讯, 2015(4): 94-95. DOI:10.14170/j.cnki.cn31-1278/s.2015.04.039.
[4]孙兴权, 李哲, 林维宣. 动物源性食品中多肽类抗生素残留检测技术研究进展[J]. 中国食品卫生杂志, 2008, 20(3): 263-266. DOI:10.13590/j.cjfh.2008.03.018.
[5]LI Daowen, DAI Chongshan, ZHOU Yan, et al. Effect of GADD45a on olaquindox-induced apoptosis in human hepatoma G2 cells: involvement of mitochondrial dysfunction[J]. Environmental Toxicology and Pharmacology, 2016, 46: 140-146. DOI:10.1016/j.etap.2016.07.012.
[6]LI Daowen, DAI Chongshan, YANG Xiayun, et al. GADD45a regulates olaquindox-induced DNA damage and sphase arrest in human hepatoma G2 cells via JNK/p38 pathways[J]. Molecules, 2017, 22(1): 124-142. DOI:10.3390/molecules22010124.
[7]王影, 李艷然, 韩镌竹, 等. 多黏菌素耐药性的研究进展[J]. 微生物学通报, 2017, 44(1): 200-206. DOI:10.13344/j.microbiol.china.160272.
[8]POIREL L, JAYOL A, NORDMANN P. Polymyxins: antibacterial activity, susceptibility testing, and resistance mechanisms encoded by plasmids or chromosomes[J]. Clinical Microbiology Reviews, 2017, 30(2): 557-596. DOI:10.1128/cmr.00064-16.
[9]European Union. Amending Council Directive 70/524/EEC concerning additives in feeding stuffs as regards the withdrawal of authorisation for certain growth promoters[J]. Official Journal of the European Communities, 1998, 3: 347.
[10]殷居易, 倪梅林, 寿成杰, 等. 鸡肉中喹乙醇、卡巴多及其代谢物的残留检测[J]. 中国兽药杂志, 2006, 40(1): 11-15.
[11]YU Ying, ZHANG Jing, SHAO Bing, et al. Development of a simple liquid chromatography-tandem mass spectrometry method for multiresidue determination of antifungal drugs in chicken tissues[J]. Journal of Aoac International, 2011, 94(5): 1650-1658. DOI:10.5740/jaoacint.10-244.
[12]WANG Hongwu, YAO Su, LIU Yanqing, et al. Molecularly imprinted electrochemical sensor based on Au nanoparticles in carboxylated multi-walled carbon nanotubes for sensitive determination of olaquindox in food and feedstuffs[J]. Biosensors and Bioelectronics, 2017, 87: 417-421. DOI:10.1016/j.bios.2016.08.092.endprint
[13]宋春美, 侯玉泽, 刘宣兵, 等. 喹乙醇的危害及检测方法研究进展[J]. 河南农业科学, 2009, 38(12): 13-17. DOI:10.15933/j.cnki.1004-3268.2009.12.036.
[14]高淑霞, 姜文学, 杨丽萍, 等. LC-MS/MS方法检测家兔组织中的灰黄霉素[J]. 西南农业学报, 2012, 25(2): 686-690. DOI:10.3969/j.issn.1001-4829.2012.02.068.
[15]LI Y S, LIU K L, BEIER R C, et al. Simultaneous determination of mequindox, quinocetone, and their major metabolites in chicken and pork by UPLC-MS/MS[J]. Food Chemistry, 2014, 160(10): 171-179. DOI:10.1016/j.foodchem.2014.03.094.
[16]PENG Juan, KONG Dezhao, LIU Liqiang, et al. Determination of quinoxaline antibiotics in fish feed by enzyme-linked immunosorbent assay using a monoclonal antibody[J]. Analytical Methods, 2015, 7(12): 5204-5209. DOI:10.1039/c5ay00953g.
[17]LE Tao, ZHU Liqian, YU Huan. Dual-label quantum dot-based immunoassay for simultaneous determination of Carbadox and Olaquindox metabolites in animal tissues[J]. Food Chemistry, 2016, 199: 70-74. DOI:10.1016/j.foodchem.2015.11.116.
[18]刘淑华, 何方洋, 冯才伟, 等. 牛奶中新霉素残留胶体金免疫层析快速检测技术的研制[J]. 食品工业科技, 2013, 34(6): 73-76. DOI:10.13386/j.issn1002-0306.2013.06.052.
[19]官斌, 袁东星. 牛奶样品中新霉素残留量的离子色谱法测定[J]. 分析实验室, 2007, 26(7): 1-4. DOI:10.13595/j.cnki.issn1000-0720.2007.0186.
[20]刘永涛, 李乐, 徐春娟, 等. 固相萃取-高效液相色谱/串联质谱法测定水产品中硫酸新霉素残留量[J]. 分析科学学报, 2017, 33(1): 6-10. DOI:10.13526/j.issn.1006-6144.2017.01.002.
[21]LE Tao, ZHU Liqian, SHU Lihui, et al. Simultaneous determination of five quinoxaline-1,4-dioxides in animal feeds using an immunochromatographic strip[J]. Food Additives and Contaminants: Part A-Chemistry Analysis Control Exposure and Risk Assessment, 2016, 33(2): 244-251. DOI:10.1080/19440049.2015.1124461.
[22]KAHSAY G, ADEGOKE A O, VAN SCHEPDAEL A, et al.
Development and validation of a reversed phase liquid chromatographic method for analysis of griseofulvin and impurities[J]. Journal of Pharmaceutical and Biomedical Analysis, 2013, 80(3): 9-17. DOI:10.1016/j.jpba.2013.02.035.
[23]EL-DESOKY H S. A validated voltammetric procedure for quantification of the antifungal drug griseofulvin in bulk form, tablets, and biological fluids at a mercury electrode[J]. Analytical Letters, 2005, 38(11): 1783-1802. DOI:10.1080/00032710500210568.
[24]梁雪琪, 劉红, 何凤芹. 液相色谱-串联质谱法测定牛奶中黏杆菌素和多黏菌素B的残留量[J]. 现代农业科技, 2013(22): 260-261; 268.
[25]中华人民共和国农业部质量监督检验测试中心(北京), 商务部屠宰技术鉴定中心. GB/T 20797—2006 肉与肉制品中喹乙醇残留量的测定[S]. 北京: 中国标准出版社, 2006.
[26]中华人民共和国秦皇岛出入境检验检疫局, 中华人民共和国深圳出入境检验检疫局. GB/T 20746—2006 牛、猪肝脏和肌肉中卡巴氧、喹乙醇及代谢物残留量的测定 液相色谱-串联质谱法[S]. 北京: 中国标准出版社, 2006.
[27]郑玲, 吴玉杰, 赵永锋, 等. 高效液相色谱-串联质谱法测定动物源食品中喹乙醇与卡巴氧残留量[J]. 分析测试学报, 2014, 33(1): 21-26. DOI:10.3969/j.issn.1004-4957.2014.01.004.
[28]苏萌, 艾连峰, 段文仲, 等. 高效液相色谱-串联质谱法测定动物源食品中黏杆菌素、多黏菌素B的残留量[J]. 分析实验室, 2012, 33(3): 73-77. DOI:10.13595/j.cnki.issn1000-0720.2012.0081.endprint
