多杀性巴氏杆菌脂多糖的结构与功能研究进展
2016-11-08华瑞其赵新新程安春
华瑞其,赵新新,2,3* ,程安春,2,3*
(1.四川农业大学动物医学院预防兽医研究所,成都 611130;2.四川农业大学动物医学院禽病防治中心,成都 611130;3.四川农业大学动物疫病与人类健康四川省重点实验室,成都 611130)
多杀性巴氏杆菌脂多糖的结构与功能研究进展
华瑞其1,赵新新1,2,3*,程安春1,2,3*
(1.四川农业大学动物医学院预防兽医研究所,成都 611130;2.四川农业大学动物医学院禽病防治中心,成都 611130;3.四川农业大学动物疫病与人类健康四川省重点实验室,成都 611130)
多杀性巴氏杆菌是一种兼性厌氧的革兰阴性菌,能够造成多种动物的巴氏杆菌病。脂多糖(lipopolysaccharide,LPS)既是细菌重要的毒力因子,又是主要的保护性抗原。依据LPS血清学反应,多杀性巴氏杆菌可分为16个血清型。与大多数革兰阴性菌不同,多杀性巴氏杆菌的脂多糖不含O-抗原,仅由类脂A和核心寡糖两部分组成。近年来人们通过质谱检测和基因测序陆续揭示了这16个血清型核心寡糖的化学结构和合成基因。研究表明,各血清型内核心寡糖结构十分保守,合成基因分散存在于基因组;外核心寡糖的化学组成具有多样性,其合成基因成簇存在,形成外核心寡糖基因簇。虽然有些血清型共享同样的外核心寡糖基因簇,但由于基因突变造成它们外核心寡糖结构的异质性。研究还发现核心寡糖的结构与多杀性巴氏杆菌的毒力有关。作者在本文中综述了多杀性巴氏杆菌16个血清型的核心寡糖的化学结构、基因组成及其结构与毒力的关系,为多杀性巴氏杆菌病的防治提供借鉴。
多杀性巴氏杆菌;脂多糖;化学结构;基因组成;毒力
多杀性巴氏杆菌(Pasteurellamultocida)是一种兼性厌氧的革兰阴性菌,可经呼吸道或消化道等方式感染宿主,造成多种动物的巴氏杆菌病,如猪萎缩性鼻炎、禽霍乱、猪肺疫、兔巴氏杆菌病、牛出血性败血症等;同时可经咬伤或接触带病动物鼻腔分泌物等途径感染人[1]。巴氏杆菌病多呈急性经过,在全球范围内流行,严重威胁着人畜健康[2],被中国农业部定为二类重要动物传染病。虽然多杀性巴氏杆菌的致病机制远未被研究清楚,但它的一些毒力因子,如荚膜[3]、脂多糖(lipopolysaccharide,LPS)[4]、外膜蛋白[5]、多杀性巴氏杆菌毒素[6]、全局调控基因[7-8]等,在细菌致病过程中的作用正被逐渐揭示。值得注意的是,全局调控基因phoP、hfq不仅参与细菌的生长代谢,还能够调控毒力因子的表达。phoP缺失造成铁离子代谢相关基因tonB/exbB、LPS中Kdo合成相关基因kdsA/kdsB的下调表达[9];hfq缺失则引起LPS中磷酸胆碱(phosphocholine,PCho)和磷酸乙醇胺(phosphoethanolamine,PEtn)合成相关基因的上调表达。这预示着多杀性巴氏杆菌毒力因子的表达不是一成不变的,其表达调控与全局调控基因信号网络相关[10]。
脂多糖是革兰阴性菌外膜重要的组成成分,为大多数革兰阴性菌完成其感染过程所必需。研究表明,脂多糖是很多致病菌重要的毒力因子[11],能够帮助细菌抵抗宿主固有免疫应答的活性成分,如抗菌肽[12]或血清补体[4],并能促进细菌在体内的存活;同时具有内毒素特性,能够与宿主细胞表面的Toll样受体4结合激活多种免疫细胞,引发细胞因子风暴而致病,甚至导致宿主的死亡[13-14]。大多数革兰阴性菌,如大肠埃希菌、沙门菌等,脂多糖由类脂A、核心寡糖、O-多糖抗原三部分所组成[4]。其中,类脂A(lipid A)和核心寡糖十分保守,O-多糖具有多样性,是划分血清型的重要依据。然而,在多杀性巴氏杆菌、流感嗜血杆菌等少数细菌中,脂多糖不含O-多糖抗原,仅由类脂A和核心寡糖两部分所组成,这种结构的脂多糖被称为脂寡糖(lipooligosaccharide,LOS)。1972年K.heddleston等根据脂多糖抗原的不同,用琼脂扩散沉淀试验将多杀性巴氏杆菌分为15个血清型[15],1978年K.Brogden等从火鸡身上分离到第16个血清型[16]。近年来,人们利用质谱检测技术已获得多杀性巴氏杆菌16个血清型的核心寡糖的化学组成,结果表明核心寡糖由内核心寡糖和外核心寡糖组成,内核心寡糖具有A、B两种形式,在大部分血清型中普遍存在,具有保守性;外核心寡糖则具有多样性,除2、5型血清型外,其他血清型的外核心寡糖的结构均不一致。此外,多杀性巴氏杆菌的脂多糖的结构与细菌的毒力有关,缺失核心寡糖的合成基因会增强细菌对血清补体或抗菌肽的敏感性,也会导致细菌毒力的下降。作者将总结近年来的最新进展,综述16种血清型核心寡糖的化学结构、合成基因及其与细菌毒力的关系,为脂多糖的后续研究或疫苗研制提供借鉴。
1 内核心寡糖
来自多杀性巴氏杆菌16个血清型的数据显示,多杀性巴氏杆菌的LPS包括2种构型,命名为A和B,它们具有相同的外核心寡糖,但内核心寡糖结构不同。如图1所示,A型LPS和B型LPS的内核心寡糖结构的差异在于:(1)B型中连接于类脂A的是2个Kdo基团,而A型则为1个磷酸化的Kdo基团;(2)A型的1号庚糖(heptose,Hep)连接1个额外的葡萄糖(glucose,Glc)残基;(3)在大多数情况下,A型的2号庚糖还会连接磷酸乙醇胺(PEtn)基团。研究表明,大多数多杀性巴氏杆菌会同时表达A、B两种型的内核心寡糖,但以A型的表达为主[3]。此外,研究还发现多杀性巴氏杆菌的A型内核心寡糖也存在于亲缘关系较近的溶血曼氏杆菌和胸膜炎放线杆菌中[17]。
通过生物信息学分析和多种突变株的LPS结构鉴定,合成多杀性巴氏杆菌内核心寡糖所需的绝大多数转移酶及其基因已被揭示(图1)。A型lipid A外端Kdo-P基团的连接由两个酶催化完成,其中KdtA酶催化完成Kdo基团的连接,KdkA激酶催化完成Kdo基团的磷酸化[18];而B型Lipid A外端Kdo-Kdo基团的连接由KdtA酶催化完成[4]。随后,HptA酶、HptB酶分别将1号庚糖连接于A、B型内核心寡糖的Kdo基团[19],HptC酶、HptD酶则分别介导两种型2号庚糖、3号庚糖的连接。当庚糖侧链合成完成后,在GctB转移酶的催化作用下,1号葡萄糖残基被连接于A、B型的1号庚糖;同时,GctA酶将2号葡萄糖残基连接于A型的1号庚糖[3]。在某些菌株中,如血清型3 PM70株,A型内核心寡糖的2号庚糖还会连接磷酸乙醇胺残基,这由lpt_3基因所调控。图1列出了合成这些转移酶的基因及其发挥作用的位置。研究证实,这些基因位于多杀性巴氏杆菌基因组的几个不同片段上[19-20],其中kdtA、kdkA、hptA、gctB基因位于同一位点,hptB、hptC基因位于基因组上的另一个位点且共享同一个启动子,hptD、gctA、lpt_3基因则分别独立存在于基因组的不同位点。
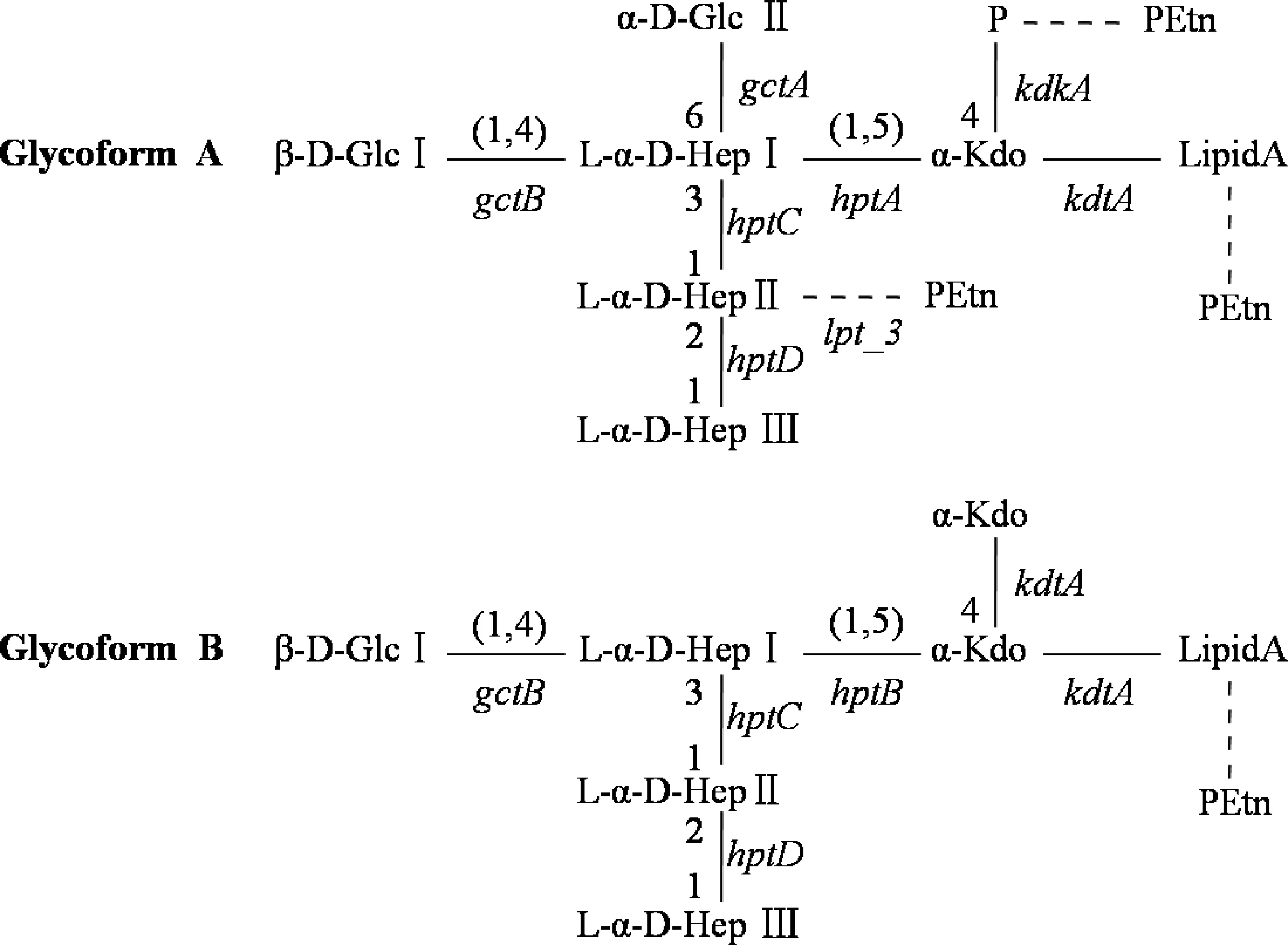
图1 两种多杀性巴氏杆菌脂多糖内核心寡糖的化学结构[3]Fig.1 Two structures of Pasteurella multocida LPS inner core oligosaccharide[3]
2 外核心寡糖
通过多种突变株的构建和质谱分析,多杀性巴氏杆菌16种血清型的外核心寡糖的化学结构和合成基因相继被揭示或预测[20-26]。相比内核心寡糖的保守性,多杀性巴氏杆菌的外核心寡糖具有多样性,除了血清型2和5具有相同的外核心寡糖之外,其余14种血清型的外核心寡糖的化学结构均不一致,这源于它们具有多样性的合成基因[3]。研究表明,合成外核心寡糖的基因在基因组中成簇存在,形成外核心寡糖基因簇,它位于保守基因priA和fpg之间[4]。图2显示了16种血清型外核心寡糖的化学结构和相应的基因簇组成,根据基因簇的相似性将外核心寡糖分为8个型,即L1~L8型[27]。如图所示,同一型具有相同的外核心寡糖基因簇,但因基因簇中某些基因的突变最终导致同一型内各血清型外核心寡糖化学结构的不同。
在禽类上广泛流行的血清型1的LPS结构及合成基因是最早被揭示的。血清型1的外核心寡糖基因簇由6个基因组成,包括:hptE,编码庚糖转移酶,负责将4号庚糖连接于内核心寡糖中的1号葡萄糖;gatA,编码双功能的半乳糖基转移酶,负责将1、2号半乳糖分别连接至4号庚糖;pcgA、pcgB、pcgC、pcgD形成磷酸胆碱(PCho)合成操纵子,协同将PCho转移至半乳糖残基。此外,部分1型血清型菌株,如X-73株的外核心寡糖还含有连接于1号半乳糖、2号半乳糖的磷酸乙醇胺残基(图2中用虚线表示),但连接该基团所需的酶和基因目前尚不清楚[3,28]。血清型14与血清型1具有相同的外核心寡糖基因簇,唯一的区别是血清型14的pcgA基因存在19个碱基对的缺失,理论上这会导致外核心寡糖缺失2个PCho基团[21],然而有趣的是,相比血清型1的外核心寡糖结构,血清型14还缺失2号半乳糖基团。同样地,人为构建的VP161(血清型1)pcgC基因突变株也缺失2号半乳糖基团和2个PCho基团[12],这表明gatA基因的作用依赖于PCho基团的完整性。当将相应的有功能的基因(pcgC、pcgA)分别回补至VP161pcgC突变株和血清型14 P2225株后,这两种菌株均可表达与血清型1 VP161株相同的的外核心寡糖结构[12,21]。可见,单一基因的突变会造成外核心寡糖结构上的巨大差异。
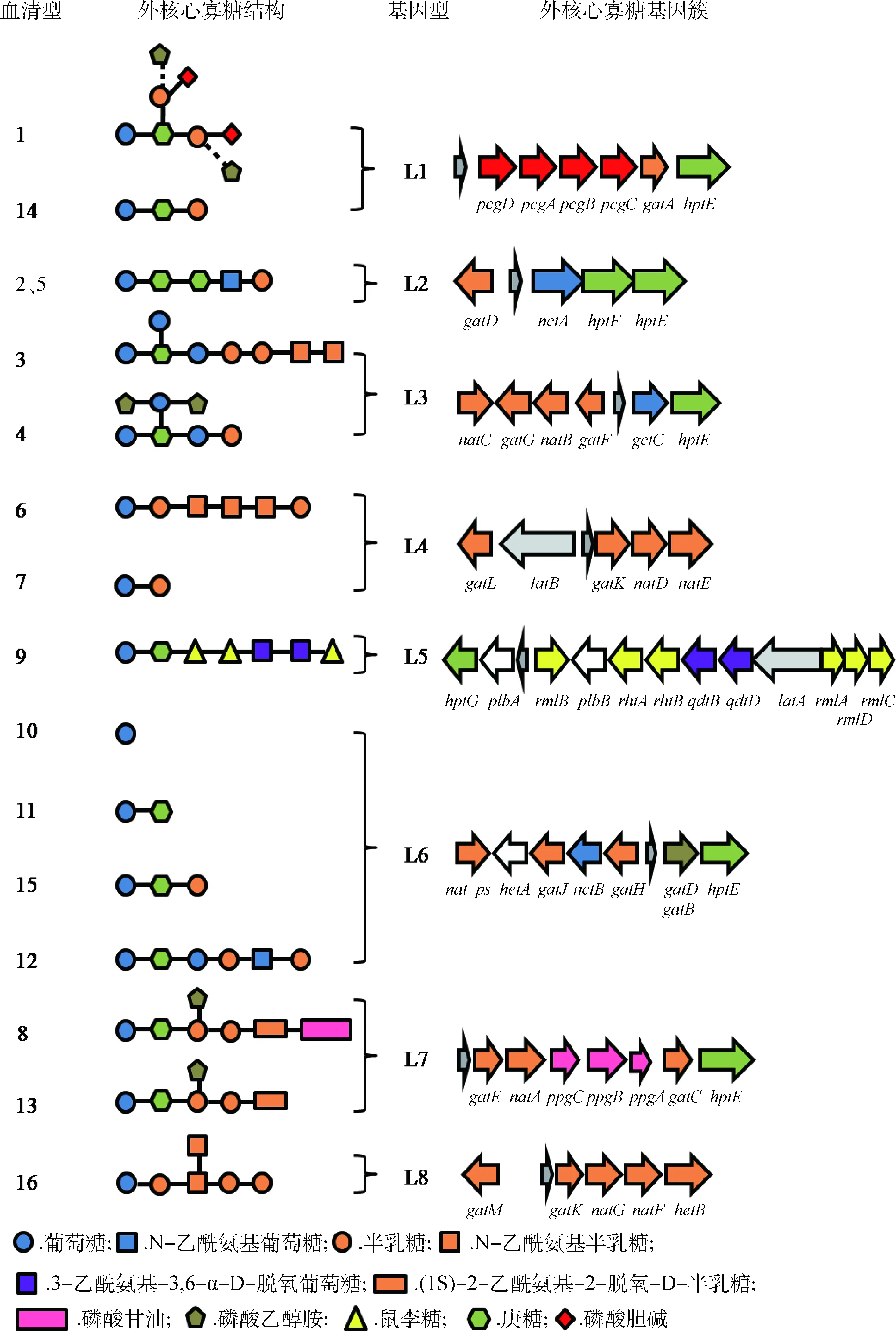
图2 外核心寡糖的化学结构及调控基因[30]Fig.2 The structures and required enzyme genes of the Pasteurella multocida LPS outer core structures [30]
血清型2、5的外核心寡糖基因簇属L2型,包括4个糖基转移酶基因,其中hptF、nctA、gatD基因仅存在于L2基因型中,为这两个血清型独有[20]。每个转移酶的功能是通过将相应基因异源回补至VP161gatA突变株中并通过结构解析而鉴定的。血清型2、5的外核心寡糖结构相同,均由L-α-D-庚糖—D-α-D-庚糖—β-葡萄糖酰胺—β-D-半乳糖组成。而两者LPS的唯一区别是血清型5内核心寡糖含有连接于2号庚糖的磷酸乙醇胺基团。基因测序发现,血清型2 M1404株的lpt_3基因无法表达。将有功能的lpt_3基因回补至M1404,回补株产生了与血清型5一样的LPS结构,即包含连接于2号庚糖的磷酸乙醇胺基团[4],这表明连接于2号庚糖的磷酸乙醇胺基团对血清型2、5 LPS的分型具有重要的意义。
在已知血清型3 Pm70株全基因组序列的基础上[29],通过对血清型3 P1059株,血清型4 P1662株的LPS进行定点突变和结构分析,确认合成了血清型3、4外核心寡糖所需的几乎所有的糖基转移酶及其编码基因(除2号N-乙酰氨基半乳糖的转移酶外)[22]。通过鉴定属于L3基因型的23种菌株的外核心寡糖结构,人们发现L3中至少存在6种结构形式的外核心寡糖,它们具有长度不一的糖链[22]。例如血清型3 Pm70株会表达完整的外核心寡糖糖链,而血清型3 P1052株几乎不表达最末端的2号N-乙酰氨基半乳糖。然而,由于没有遗传学证据表明基因型3部分表达短糖链菌株的外核心寡糖基因簇发生了突变,并且转移2号N-乙酰氨基半乳糖基团的酶的功能不明确。因此,基因型3外核心寡糖糖链长度变化较大的原因尚未得到合理的解释。相比于血清型3,血清型4外核心寡糖糖链长度较短,血清型4 P1662株糖链仅延伸至1号半乳糖基团,氨基酸测序发现P1662株gatG基因翻译产物存在8个氨基酸的改变,这使得P1662株2号半乳糖转移酶失活从而造成外核心寡糖糖链长度减短。
与其他大多数血清型不同,血清型6、7、16外核心寡糖的第一个糖(连接于内核心寡糖的1号葡萄糖)不是庚糖,而是半乳糖,并且这三种血清型外核心寡糖基因簇中不含有庚糖转移酶基因[26]。通过质谱检测和基因测序发现,血清型7natD和natE基因发生了突变,这可能导致了血清型7外核心寡糖糖链较血清型6缺少了一段四糖链:N-乙酰氨基半乳糖—N-乙酰氨基半乳糖—N-乙酰氨基半乳糖—半乳糖。血清型16外核心寡糖基因簇L8较为特殊,通过与其他血清型基因簇比对发现,L8型hetB基因与L4型natE基因在3′端具有94%的一致性,L8型gatM基因与L3型gatG、natB基因具有69%以上的一致性,人们推测L8型菌株可能是由L3、L4型菌株杂交而形成的[26]。血清型9的外核心寡糖基因簇(L5型)含有两个较为罕见的糖,即鼠李糖和3-乙酰氨基-3,6-α-D-脱氧葡萄糖,且这两种糖仅存在于血清型9的外核心寡糖[23]。
血清型8、13外核心寡糖合成所需大部分基因及其功能已经明确(除2-乙酰氨基-2-脱氧-D-半乳糖和甘油磷酸的转移酶基因外)。同血清型8外核心寡糖糖链相比,血清型13外核心寡糖缺失了链末端的甘油磷酸基团,目前推测是由于合成甘油磷酸的ppgA、ppgB、ppgC基因中一个或多个基因发生突变所致[24]。此外,血清型10、11、12、15的外核心寡糖同属L6,类似地,由于外核心寡糖基因簇中调控糖基转移酶的nat_ps、hetA、gatJ、nctB等基因发生了突变或缺失,这4种血清型表达异质性的外核心寡糖结构,甚至血清型10不含有外核心寡糖结构[25]。
3 脂多糖与毒力
同其他革兰阴性菌的LPS一样,多杀性巴氏杆菌LPS具有内毒素活性,接种荚膜抗原B型菌的LPS后,水牛出现了典型的出血性败血症[31]。人们最早意识到LPS与细菌毒力相关是源于血清型12菌株的galE突变株在小鼠上完全减毒,GalE介导LPS组成成分UDP-半乳糖和UDP-葡萄糖的转换[32]。而验证LPS与细菌毒力相关性的直接证据是两个多杀性巴氏杆菌信号标签诱变(signature-tagged mutagenesis,STM)文库。第一个STM文库的构建是将Tn5转座子应用于致牛肺炎的TF5菌株上实现的,其中一个突变株在小鼠上的毒力显著下降,序列分析证实突变发生于1个LPS合成相关的糖基转移酶基因[33],后来证实该突变基因为血清型3外核心寡糖基因簇中的gatG[29]。第二个STM文库的构建是将Tn916转座子应用于致禽霍乱的VP161菌株上实现的,突变发生于内核心寡糖相关基因的hptD突变株在鸡上完全减毒,然而在小鼠上减毒不明显,这表明LPS与毒力的关系在不同宿主上具有差异性[34]。随着LPS合成相关基因的揭示[35],人们进一步定向突变多个基因,发现LPS糖链的细微改变都有可能降低细菌的毒力,如仅仅缺失外核心寡糖PCho残基会显著降低VP161菌株对抗菌肽fowlicidin-1的抵抗力[12];缺失内核心寡糖3号庚糖会导致1号葡萄糖的合成受阻并可显著降低菌株在鸡上的毒力[36]。在明确了血清型1 VP161株LPS合成相关的绝大部分基因的基础上,人们对内、外核心寡糖合成基因(pcgC、gatA、hptE、gctB、gctA、hptC)进行了突变,敏感性试验发现这些突变株对抗菌肽fowlicidin-1抵抗力的下降程度与LPS糖链的改变程度基本呈正相关[37]。综上所述,多杀性巴氏杆菌LPS在细菌致病过程中发挥着重要的作用。
4 脂多糖与免疫
前期研究表明,多杀性巴氏杆菌LPS具有良好的免疫原性,免疫后产生特异性抗体能够保护动物免受同源菌株的感染[38-40]。近期研究发现,基于血清型3菌株研制的疫苗免疫动物后能使动物产生针对血清型4菌株的交叉免疫保护力,反之亦然[4];类似的,血清型5菌株的特异性抗体能够抵抗血清型2菌株的感染[41]。这种交叉免疫保护的发生可能与LPS结构相关,血清型3和血清型4具有相似的LPS结构[22],而血清型2和血清型5具有几乎一致的LPS结构[20]。此外,多杀性巴氏杆菌灭活苗免疫动物后,能够为鸡提供保护力,而缺乏外核心寡糖的巴氏杆菌灭活苗则无法提供保护[42]。其次,研究发现来源于鸡、山羊、水牛的多杀性巴氏杆菌的LPS存在于保守的B-细胞表位和T-细胞表位[43]。以上结果表明了LPS是多杀性巴氏杆菌的保护性抗原,其在疫苗研究领域具有重要的研究价值。
5 问题与展望
多杀性巴氏杆菌能够造成多种动物的巴氏杆菌病,对世界畜禽业的发展造成了重大的经济损失,尽管如此,多杀性巴氏杆菌的致病机制还十分不清楚。LPS是多杀性巴氏杆菌细胞膜的重要组分,研究其化学结构、合成基因有利于了解血清型划分的分子基础,建立新型的血清型鉴定方法及推动流行病学的发展。在这个基础上,通过靶向LPS合成基因构建多种突变株则有利于解析LPS的作用机制,即化学结构与细菌毒力的关系,推动多杀性巴氏杆菌致病机制的研究。近期一种新型的鉴定血清型的PCR方法被建立,与传统方法相比,这种方法更为准确、易操作,为流行病学调查提供了便利[30]。同时,研究发现LPS结构与细菌抵抗抗菌肽的能力、细菌毒力密不可分,甚至结构的细微改变(如PCho基团的缺失)便会显著影响细菌对抗菌肽的敏感性,然而其中的作用机制还不清楚,加之此部分研究主要集中于血清型1菌株中,因而扩大血清型范围,解析LPS合成相关的所有基因与细菌毒力的关系,以及多杀性巴氏杆菌表达两种内核心寡糖的原因应成为未来研究的重要内容。此外,研究已证实一些全局调控基因参与LPS合成相关基因的表达调控,然而调控表达的生物学意义,即相关基因的调控表达是否改变了LPS的结构,以及修饰的结构对细菌的毒力有何影响尚不清楚,因而我们仍需通过筛选全局调控基因调控子、质谱分析、构建相应基因突变株等手段来解决这一重要的科学问题。
疫苗是疾病防控最经济、有效的手段。LPS具有良好的免疫原性,其特异性抗体可介导针对同源菌株和LPS结构相似菌株的免疫保护,因而LPS应成为多杀性巴氏杆菌疫苗研究的重要研究对象。基于沙门菌的研究证实LPS的结构与免疫原性、免疫保护也有着密切的联系,然而此部分研究尚未在多杀性巴氏杆菌上开展。因而,通过调控LPS合成相关基因,筛选低毒力、高免疫原性的LPS结构,以及解析相应结构与免疫保护之间的关联应成为未来疫苗研究的重要内容。
综上所述,LPS是多杀性巴氏杆菌细胞膜的重要组分,内核心寡糖具有A、B两种型并具有保守性;外核心寡糖具有多样性,某些血清型共享外核心寡糖基因簇,具有十分相似的外核心寡糖糖链。16种血清型内、外核心寡糖化学结构和合成基因的揭示使我们认识到LPS的生物学合成过程,并知晓LPS结构对细菌的毒力有着重要的影响,并将有助于人们基于LPS结构开发新型多杀性巴氏杆菌疫苗。
[1]WILSON B A,HO M.Pasteurellamultocida:from zoonosis to cellular microbiology[J].ClinMicrobiolRev,2013,26(3):631-655.
[2]GYLES C L,PRESCOTT J F,SONGER J G,et al.Pathogenesis of bacterial infections in animals[M].John Wiley & Sons,2011.
[3]HARPER M,BOYCE J D,ADLER B.The key surface components ofPasteurellamultocida:capsule and lipopolysaccharide[J].CurrTopMicrobiolImmunol,2012,361:39-51.
[4]HARPER M,COX A D,ADLER B,et al.Pasteurellamultocidalipopolysaccharide:The long and the short of it[J].VetMicrobiol, 2011,153(1):109-115.
[5]KATOCH S,SHARMA M,PATIL R,et al.Invitroandinvivopathogenicity studies ofPasteurellamultocidastrains harbouring different ompA[J].VetResCommun,2014,38(3):183-191.
[6]SIEGERT P,SCHMIDT G,PAPATHEODOROU P,et al.Pasteurellamultocidatoxin prevents osteoblast differentiation by transactivation of the MAP-Kinase cascade via the Gα q/11-p63RhoGEF-RhoA Axis[J].PLoSPathog,2013,9(5):e1003385.
[7]STEEN J A,STEEN J A,HARRISON P,et al.Fisis essential for capsule production inPasteurellamultocidaand regulates expression of other important virulence factors[J].PLoSPathog,2010,6(2):e1000750.
[8]BAGCHI A.Structural characterization ofFis—A transcriptional regulator from pathogenicPasteurellamultocidaessential for expression of virulence factors[J].Gene,2015,554(2):249-253.
[9]XIAO K,LIU Q,LIU X,et al.Identification of the avianPasteurellamultocidaphoPgene and evaluation of the effects ofphoPdeletion on virulence and immunogenicity[J].IntJMolSci,2015,17(1):12.
[10]MÉGROZ M,KLEIFELD O,WRIGHT A,et al.The RNA-binding chaperoneHfqis an important global regulator of gene expression in Pasteurella multocida and plays a crucial role in production of a number of virulence factors including hyaluronic acid capsule[J].InfectImmun,2016,84(5):1361-1370.
[11]WHITFIELD C,TRENT M S.Biosynthesis and export of bacterial lipopolysaccharides[J].AnnuRevBiochem,2014,83:99-128.
[12]HARPER M,COX A,MICHAEL F S,et al.Decoration ofPasteurellamultocidalipopolysaccharide with phosphocholine is important for virulence[J].JBacteriol,2007,189(20):7384-7391.
[13]PARK B S,LEE J O.Recognition of lipopolysaccharide pattern by TLR4 complexes[J].ExpMolMed,2013,45(12):e66.
[14]ANWAR M A,CHOI S.Gram-negative marine bacteria:Structural features of lipopolysaccharides and their relevance for economically important diseases[J].MarDrugs,2014,12(5):2485-2514.
[15]HEDDLESTON K,GALLAGHER J,REBERS P.Fowl cholera:gel diffusion precipitin test for serotypingPasteurellamultocidafrom avian species[J].AvianDis,1972:925-936.
[16]BROGDEN K,RHOADES K,HEDDLESTON K.A new serotype ofPasteurellamultocidaassociated with fowl cholera[J].AvianDis,1978,22(1):185-190.
[17]MICHAEL F S,VINOGRADOV E,COX A D.Structural analyses of the core oligosaccharide from the lipopolysaccharide of bovine and ovine strains ofMannheimiahaemolyticaserotype 2[J].CarbohydrRes,2011,346(11):1333-1336.
[18]HARPER M,COX A D,MICHAEL F S,et al.Natural selection in the chicken host identifies 3-deoxy-D-manno-octulosonic acid kinase residues essential for phosphorylation ofPasteurellamultocidalipopolysaccharide[J].InfectImmun,2010,78(9):3669-3677.
[19]HARPER M,BOYCE J D,COX A D,et al.Pasteurellamultocidaexpresses two lipopolysaccharide glycoforms simultaneously,but only a single form is required for virulence:identification of two acceptor-specific heptosyl I transferases[J].InfectImmun,2007,75(8):3885-3893.
[20]MICHAEL F S,HARPER M,PARNAS H,et al.Structural and genetic basis for the serological differentiation ofPasteurellamultocidaHeddleston serotypes 2 and 5[J].JBacteriol,2009,191(22):6950-6959.
[21]HARPER M,MICHAEL F S,JOHN M,et al.PasteurellamultocidaHeddleston serovars 1 and 14 express different lipopolysaccharide structures but share the same lipopolysaccharide biosynthesis outer core locus[J].VetMicrobiol,2011,150(3):289-296.
[22]HARPER M,MICHAEL F S,JOHN M,et al.PasteurellamultocidaHeddleston serovar 3 and 4 strains share a common lipopolysaccharide biosynthesis locus but display both inter-and intrastrain lipopolysaccharide heterogeneity[J].JBacteriol,2013,195(21):4854-4864.
[23]HARPER M,MICHAEL F S,VINOGRADOV E,et al.Characterization of the lipopolysaccharide fromPasteurellamultocidaHeddleston serovar 9:Identification of a proposed bi-functional dTDP-3-acetamido-3,6-dideoxy-α-d-glucose biosynthesis enzyme[J].Glycobiology,2012,22(3):332-344.
[24]HARPER M,ST MICHAEL F,VINOGRADOV E,et al.Structure and biosynthetic locus of the lipopolysaccharide outer core produced byPasteurellamultocidaserovars 8 and 13 and the identification of a novel phospho-glycero moiety[J].Glycobiology,2013,23(3):286-294.
[25]HARPER M,MICHAEL F S,JOHN M,et al.Structural analysis of lipopolysaccharide produced by Heddleston serovars 10,11,12 and 15 and the identification of a newPasteurellamultocidalipopolysaccharide outer core biosynthesis locus,L6[J].Glycobiology,2014,24(7):649-659.
[26]HARPER M,ST MICHAEL F,STEEN J A,et al.Characterization of the lipopolysaccharide produced byPasteurellamultocidaserovars 6,7 and 16:Identification of lipopolysaccharide genotypes L4 and L8[J].Glycobiology,2015,25(3):294-302.
[27]HARPER M,JOHN M,TURNI C,et al.Development of a rapid multiplex PCR to genotypePasteurellamultocidastrains using the lipopolysaccharide outer core biosynthesis locus[J].JClinMicrobiol,2014,53(2):477-485.
[28]MICHAEL F S,LI J,COX A D.Structural analysis of the core oligosaccharide fromPasteurellamultocidastrain X73[J].CarbohydrRes,2005,340(6):1253-1257.
[29]MICHAEL F S,VINOGRADOV E,LI J,et al.Structural analysis of the lipopolysaccharide fromPasteurellamultocidagenome strain Pm70 and identification of the putative lipopolysaccharide glycosyltransferases[J].Glycobiology,2005,15(4):323-333.
[30]AHMAD T A,RAMMAH S S,SHEWEITA S A,et al.Development of immunization trials againstPasteurellamultocida[J].Vaccine,2014,32(8):909-917.
[31]CHUNG E L T,ABDULLAH F F J,IBRAHIM H H,et al.Clinico-pathology,hematology and biochemistry responses in buffaloes towardsPasteurellamultocidatype B:2 immunogen lipopolysaccharide via oral and intravenous routes of infection[J].MicrobPathog,2016,91:141-154.
[32]DE HENESTROSA A R F,BADIOLA I,SACO M,et al.Importance of thegalEgene on the virulence ofPasteurellamultocida[J].FEMSMicrobiolLett,1997,154(2):311-316.
[33]FULLER T E,KENNEDY M J,LOWERY D E.Identification ofPasteurellamultocidavirulence genes in a septicemic mouse model using signature-tagged mutagenesis[J].MicrobPathog,2000,29(1):25-38.
[34]HARPER M,BOYCE J D,WILKIE I W,et al.Signature-tagged mutagenesis ofPasteurellamultocidaidentifies mutants displaying differential virulence characteristics in mice and chickens[J].InfectImmun,2003,71(9):5440-5446.
[35]ASKI H S,TABATABAEI M.Occurrence of virulence-associated genes inPasteurellamultocidaisolates obtained from different hosts[J].MicrobPathog,2016,96:52-57.
[36]HARPER M,COX A D,MICHAEL F S,et al.A heptosyltransferase mutant ofPasteurellamultocidaproduces a truncated lipopolysaccharide structure and is attenuated in virulence[J].InfectImmun,2004,72(6):3436-3443.
[37]BOYCE J D,HARPER M,MICHAEL F S,et al.Identification of novel glycosyltransferases required for assembly of thePasteurellamultocidaA:1 lipopolysaccharide and their involvement in virulence[J].InfectImmun,2009,77(4):1532-1542.
[38]SUTHERLAND A,DAVIES R,MURRAY J.An experimental anti-idiotype vaccine mimicking lipopolysaccharide gives protection againstPasteurellamultocidatype A infection in mice[J].FEMSImmunolMedMicrobiol,1993,7(2):105-110.
[39]CORBEIL L,STRAYER D,SKALETSKY E,et al.Immunity to pasteurellosis in compromised rabbits[J].AmJVetRes,1983,44(5):845-850.
[40]MUNIANDY N,LOVE D N,MUKKUR T.Immunogenicity of purified lipopolysaccharide or protein-oligosaccharide conjugates ofPasteurellamultocidatype 6:B in mice[J].CompImmunolMicrobiolInfectDis,1998,21(4):257-279.
[41]SHAH N,JACOBS A,DE GRAAF F.Safety and efficacy of an oil-adjuvant vaccine against haemorrhagic septicaemia in buffalo calves:cross-protection between the serotypes B:2,5 and E:2,5[J].VetRec,2001,149(19):583-587.
[42]HARPER M,JOHN M,EDMUNDS M,et al.Protective efficacy afforded by livePasteurellamultocidavaccines in chickens is independent of lipopolysaccharide outer core structure[J].Vaccine,2016,34(14):1696-1703.
[43]GHAFFAR A,TARIQ A.In-silico analysis ofPasteurellamultocidato identify common epitopes between fowl,goat and buffalo[J].Gene,2016,580(1):58-66.
(编辑白永平)
Research Progress in the Lipopolysaccharide ofPasteurellamultocida
HUA Rui-qi1,ZHAO Xin-xin1,2,3*,CHENG An-chun1,2,3*
(1.InstituteofPreventiveVeterinaryMedicine,CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu611130,China;2.AvianDiseaseResearchCenter,CollegeofVeterinaryMedicine,SichuanAgriculturalUniversity,Chengdu611130,China;3.KeyLaboratoryofAnimalDiseaseandHumanHealthofSichuanProvince,SichuanAgriculturalUniversity,Chengdu611130,China)
Pasteurellamultocida(P.multocida),a Gram-negative cocco-bacillus,facultative anaerobic bacterium,is the causative agent of serious diseases in a wide range of animals.Lipopolysaccharide (LPS) is an important virulence factor,and is also a major immune protective antigen ofP.multocidawhich is currently classified into 16 Heddleston serovars based on LPS.Unlike the other Gram-negative pathogens,P.multocidaLPS is only made up of lipid A and core oligosaccharide,lacking an O-antigen.Recently,chemical structures and biosynthesis genes of 16 Heddleston serovars LPS have been determined by using mass spectrometry and gene sequencing.The inner core structures are highly conserved among different serovars,and genes required for the assembly of the inner core are located in several regions of the genome.In contrast,the outer core structures are distinct,and genes required for the biosythesis of the outer core structures are clustered in a single locus between the conserved genespriAandfpg.Some LPS serovars genetically have relationship each other,sharing the same outer core biosythesis locus,but producing different LPS molecules due to mutations within glycosyltransferase genes.Furthermore,LPS structures ofP.multocidaare related to bacterial virulence.Here,we summarize LPS structures,biosythesis genes and the relationships between LPS and bacterial virulence inP.multocida.
Pasteurellamultocida;lipopolysaccharide;chemical structures;biosynthesis genes;virulence
10.11843/j.issn.0366-6964.2016.10.003
2016-05-20
国家现代农业(水禽)产业技术体系专项(CARS-43-8);四川省应用基础计划项目(2015JY0244)
华瑞其(1994-),男,江苏常州人,本科生,动物医学专业,主要从事鸭源多杀性巴氏杆菌核心寡糖合成基因与细菌生物学特性的研究, E-mail:Huaruiqi379@163.com
赵新新:Tel: 86-028-86291905,E-mail:xxinzhao@163.com;程安春:chenganchun@vip.163.com
R378.6
A
0366-6964(2016)10-1961-08
