狐狸MC1R基因编码区c.40A>C和c.41C>T相邻变异研究
2016-11-08徐桂利张文香段玲欣巩元芳葛慕湘刘谢荣王书朋果新苓刘铮铸
徐桂利,张文香,段玲欣,巩元芳*,葛慕湘,刘谢荣,王书朋,果新苓,刘铮铸*
(1.河北科技师范学院动物科技学院,秦皇岛 066004; 2.河北东光县农业局,东光 061600)
狐狸MC1R基因编码区c.40A>C和c.41C>T相邻变异研究
徐桂利1,张文香1,段玲欣1,巩元芳1*,葛慕湘1,刘谢荣1,王书朋2,果新苓2,刘铮铸1*
(1.河北科技师范学院动物科技学院,秦皇岛 066004; 2.河北东光县农业局,东光 061600)
为了检测狐狸MC1R基因多态性及其与毛色表型的相关性,本研究采集两个狐属12种毛色共计163只狐狸的皮肤组织样,利用PCR扩增和产物直接测序的方法获得狐狸MC1R基因1 054 bp长的核苷酸序列,并进行了SNPs筛查。用PopGen32和SHEsis软件对突变位点进行了群体遗传学分析,用PANTHER软件评估了突变对基因产生的功能影响,用SPSS二元变量相关统计方法分析了多态位点与毛色表型间的相关性。结果表明,狐狸MC1R基因编码区40(c.40A>C)和41 位点(c.41C>T)存在2 个相邻错义突变,导致其编码的第14位氨基酸发生了变异:当第40 位点为A时,氨基酸由苏氨酸(Thr)转变为异亮氨酸(Ile);当第40 位点为C时,氨基酸由脯氨酸(Pro)转变为亮氨酸(Leu)。北极狐属狐在41 位点基因型全部为TT型,而狐属狐大部分个体均为CC型,不存在TT型,推测该位点可能是区分狐狸属间的一个重要功能位点。PANTHER预测获知第41 位点突变导致的氨基酸替换(p.Pro14Leu)对MC1R功能有显著影响。SPSS二元变量相关分析结果表明,41 位点多态性与狐狸毛色表型存在显著低度相关性,推测狐狸MC1R基因编码区第41位点可能是参与其毛色形成的一个相对重要功能位点。
狐狸;MC1R基因;40和41位点;多态性;毛色
毛色是动物表型的一种,对于狐狸来说毛色是衡量其毛皮经济价值的一个重要指标。动物的毛色是由黑色素基因控制的。黑色素主要包括两大类:一类为真黑色素,另一类为褐黑色素,随着黑色素的种类和含量不同,动物毛发的颜色也会发生相应变化,真黑色素和褐黑色素所含比例大小决定了毛色的深浅程度[1]。目前,世界上人工饲养的狐狸大约有40多种不同色型,分类学上归属于两个属:狐属(Vulpes)和北极狐属(Alopex)[2-3]。
有关狐狸黑素皮质素受体1(Melanocortin 1 receptor,MC1R)基因多态性及其与毛色表型的相关性研究很少,目前仅有少量报道[4-5]。D.I.Våge等[4]1997年报道,MC1R基因编码区373位点的突变(c.373T>C)能引起狐属狐银黑色毛的产生,该课题组2005年又发现MC1R基因编码区13和839两个位点的错义突变(c.13G>T和c.839T>G)可阻滞蓝色北极狐冬季蓝色被毛的表达[5]。近年来,国内外有关人类和哺乳动物MC1R基因多态性与毛色表型的相关性研究较多,但大多数都是针对基因单个位点的突变与毛色表型的相关性研究,J.S.Palmer等[6]和E.E.Bashmakova等[7]均报道,人类MC1R基因编码蛋白151、160和294(Arg151Cys、Arg160Trp和Asp294His)的变异与红发有关。M.Abitbol等[8]报道驴MC1R基因编码区629位点的一个单碱基突变(c.629T>C)与红色毛有很强的相关性。李洪涛等[9]报道哈萨克羊MC1R基因218位点突变(T218A)对黑色毛有显性作用。郭多等[10]报道家犬MC1R基因编码第306位氨基酸的密码子存在一个由CGA到TGA的终止突变,使MC1R基因的翻译终止,导致黄色毛的形成。有关两个相邻位点的变异及其与动物毛色表型的相关性研究目前鲜有报道。
鉴于以上研究背景,本研究拟采用PCR扩增和产物直接测序的方法,分析MC1R基因的多态性及其与狐狸毛色表型的相关性。研究结果将为探明MC1R基因调控狐狸毛色机理以及在生产上培育出满足人类需求的更多彩色狐狸奠定分子理论基础。
1 材料与方法
1.1试验动物
本研究所用163只成年狐狸来自河北省秦皇岛市昌黎县金岛“狐、貉、貂育种场”,其中赤狐18只、银黑狐28只、白银狐14只、巧克力狐9只、黑理石狐6只、红理石狐5只、银十字狐11只、金十字狐2只、琥珀狐5只、日晖狐2只、蓝色北极狐47只、白色北极狐16只,其中蓝色北极狐和白色北极狐归属于北极狐属,其余毛色狐狸均归属于狐属。
样品采集:11月底至12月初,从受试狐狸体侧无菌手术采集1 cm2左右的皮肤组织块,去毛,投至已灭菌的1.5 mL离心管中,然后将离心管迅速投入液氮中冷冻并置于-80 ℃冰箱保存,备用。
1.2基因组DNA的提取
基因组DNA的提取采用传统的酚—氯仿抽提法[11],TE溶解,-20 ℃冻存。
1.3引物设计和PCR扩增
根据GenBank数据库中登载的赤狐MC1R基因序列(序列号:X90844),用Primer3(http://www.genome.wi.mit.edu/cgibin/primer/primer3-www.cgi)设计扩增产物包含整个编码区、大小为1 055 bp的1对引物,其上游序列为:5′-GAACTG-AGCGAGACACCTGA-3′,下游序列:5′-ATCACC-ACCTCCCTTTGCCCA-3′。引物由上海生工生物工程技术服务有限公司合成。
PCR扩增反应体系为50 μL:基因组DNA 1 μL(75 ng·μL-1),10×LA PCR Buffer Ⅱ(Mg2+Plus)5 μL,2.5 mmol·L-1dNTPs 8 μL,上游引物(20 μmol·L-1)1 μL,下游引物(20 μmol·L-1)1 μL,TaKaRa LATaq®聚合酶(5 U·μL-1)0.5 μL,灭菌dH2O 33.5 μL。
PCR 反应条件:94 ℃预变性5 min;94 ℃变性45 s,64 ℃退火45 s,72 ℃延伸1 min,30个循环;72 ℃总延伸10 min。扩增产物经1.5%的琼脂糖凝胶电泳并在凝胶自动成像仪上检测。
1.4PCR产物回收、测序
对于效果良好且量足够的扩增产物,回收纯化后,由上海生工生物技术服务有限公司进行测序。
1.5SNPs筛查及多态性分析
将163个不同毛色狐狸个体MC1R基因所得序列与网上登载的赤狐相应序列(X90844)用BioEdit (v7.0.5.2)[12]和DNAMAN(5.2.2.0)软件进行比对及相似性分析。变异位点的等位基因、基因型以及单倍型及其频率的分析,分别用PopGen32(version 1.31)[13]和SHEsis软件[14]计算完成。
1.6功能预测
编码区突变对基因产生的功能影响采用PANTHER软件[15-16]进行评估。该软件根据已知功能蛋白质家族多条序列的比对信息,分析蛋白质家族中不同位置氨基酸发生变化时,对蛋白质功能产生的影响程度。可能产生的影响用特定位置取代进化保守值(Substitution position-specific evolutionaryconservation score,subPSEC)来衡量,该指标进一步表述为异义替换SNP 对蛋白质功能损害的概率(Pdeleterious)。subPSEC值或Pdeleterious越小(即越是趋向负值方向)表明越有可能对蛋白质功能产生损害。
1.7统计分析
利用SPSS16.0软件中二元变量相关分析法统计分析狐狸MC1R基因多态位点与毛色表型的相关性。
2 结 果
2.1PCR扩增结果
利用所设计的引物,以其中1只供试银黑狐基因组DNA为模板进行PCR扩增,结果见图1。
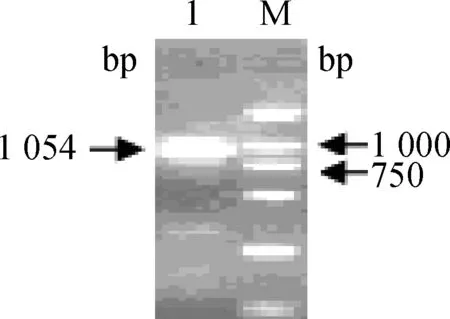
1.PCR产物;M.DNA 相对分子质量标准1.PCR product;M.DNA marker DL 2000图1 狐狸MC1R基因的PCR扩增Fig.1 Agarose gel electrophoretogram of fox MC1R PCR product (1 054 bp)
从图1可以看出,PCR条带接近于1 000 bp,且整齐、清晰、亮度也较好,初步说明扩增产物就是预期的目的条带。
2.2测序结果分析
将以上银黑狐的扩增产物回收纯化后委托上海生工生物技术服务有限公司进行双向测序,测序结果经BioEdit(v7.0.5.2)和DNAMAN(5.2.2.0)拼接整理,获得1 054 bp长的一段核苷酸序列,该序列与GenBank上登载的赤狐MC1R基因相应序列比对后,相似性高达99.53%,说明所得序列就是银黑狐MC1R基因的序列。进一步分析获知该序列包括5′UTR区54 bp、编码区954 bp和3′UTR区46 bp。
2.3SNPs筛查及分析
以上所得银黑狐序列加上剩余162只狐狸的PCR产物测序后,用BioEdit(v7.0.5.2)软件进行比对分析,发现编码区第40(c.40A>C)和41位点(c.41C>T)存在2个相邻的错义突变,导致其编码的第14位氨基酸的变异:当第40 位点为A时,氨基酸由苏氨酸(Thr)转变为异亮氨酸(Ile),当第40 位点为C时,氨基酸由脯氨酸(Pro)转变为亮氨酸(Leu)。另外,对于第40位点,狐属狐(包括赤狐、银黑狐等10种毛色狐)存在3种基因型:AA、AC和CC,而北极狐属狐(包括蓝色北极狐和白色北极狐2种毛色狐)只有CC 一种基因型。对于第41位点,狐属狐(包括赤狐、银黑狐等10种毛色狐)存在2种基因型:CC和CT型,而北极狐属狐(包括蓝色北极狐和白色北极狐2种毛色狐)只有TT 一种基因型。两位点基因型的分布和变异情况见表1和图2。
2.4突变位点群体遗传学分析
利用PopGen32(version 1.31)和SHEsis软件对163只受试狐狸MC1R基因编码区第40和41相邻突变位点等位基因和基因型频率进行了计算(表2),同时对两位点进行了单倍型的构建(表3)。由表2可知,两位点C等位基因的频率都较高,分别为0.855和0.524。由表3可知,两位点共构建3种单倍型:H1(AC)、H2(CC)和H3(CT),其中H2和H3的频率较高,分别为0.380和0.476,为优势单倍型。
表1不同毛色狐狸MC1R基因编码区第40和41位点的基因型变异
Table 1Identified genetic variations in 12 fox sub-populations with different coat color patterns
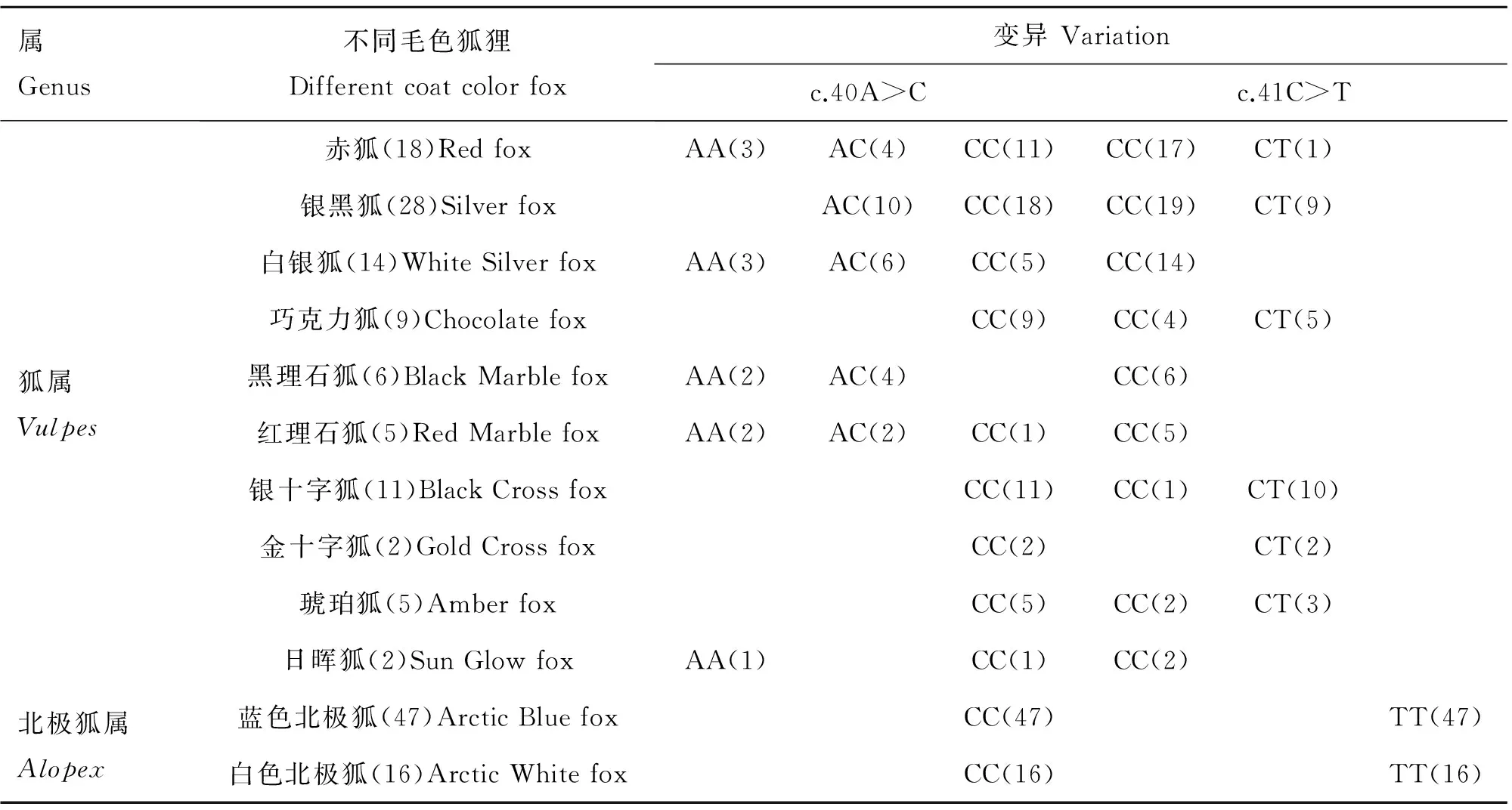
属Genus不同毛色狐狸Differentcoatcolorfox变异Variationc.40A>Cc.41C>T狐属Vulpes赤狐(18)RedfoxAA(3)AC(4)CC(11)CC(17)CT(1)银黑狐(28)SilverfoxAC(10)CC(18)CC(19)CT(9)白银狐(14)WhiteSilverfoxAA(3)AC(6)CC(5)CC(14)巧克力狐(9)ChocolatefoxCC(9)CC(4)CT(5)黑理石狐(6)BlackMarblefoxAA(2)AC(4)CC(6)红理石狐(5)RedMarblefoxAA(2)AC(2)CC(1)CC(5)银十字狐(11)BlackCrossfoxCC(11)CC(1)CT(10)金十字狐(2)GoldCrossfoxCC(2)CT(2)琥珀狐(5)AmberfoxCC(5)CC(2)CT(3)日晖狐(2)SunGlowfoxAA(1)CC(1)CC(2)北极狐属Alopex蓝色北极狐(47)ArcticBluefoxCC(47)TT(47)白色北极狐(16)ArcticWhitefoxCC(16)TT(16)
表2狐狸MC1R基因编码区第40和41相邻突变位点的等位基因和基因型频率
Table 2Frequencies of genotypes and alleles at 40 and 41 sites in coding region of foxMC1Rgene
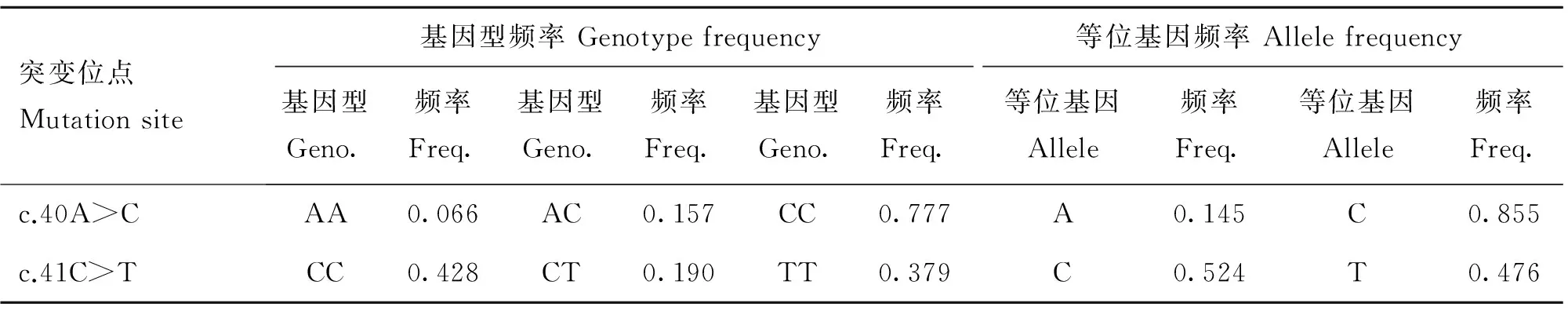
突变位点Mutationsite基因型频率Genotypefrequency等位基因频率Allelefrequency基因型Geno.频率Freq.基因型Geno.频率Freq.基因型Geno.频率Freq.等位基因Allele频率Freq.等位基因Allele频率Freq.c.40A>CAA0.066AC0.157CC0.777A0.145C0.855c.41C>TCC0.428CT0.190TT0.379C0.524T0.476
表3狐狸MC1R基因编码区第40和41相邻突变位点单倍型频率
Table 3Haplotype frequencies ofMC1Rgene covering the 2 polymorphic sites in foxes
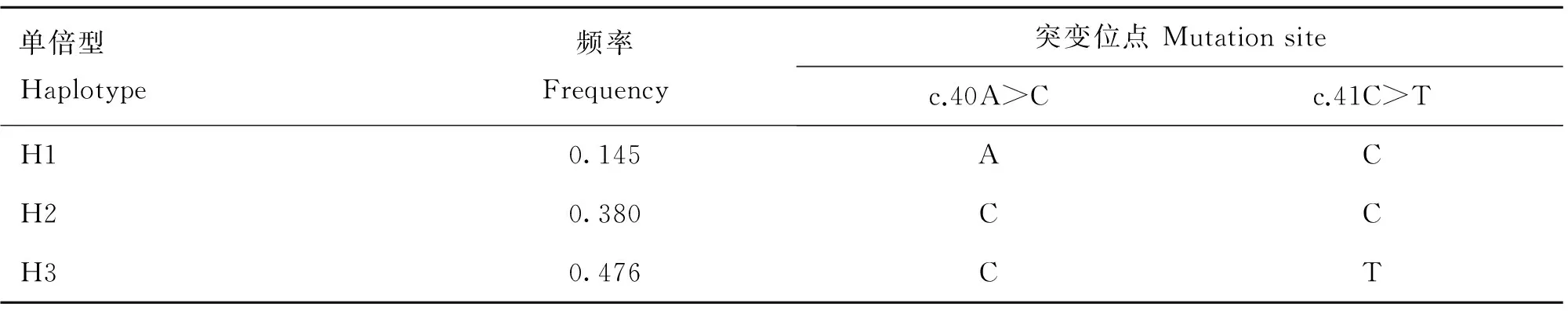
单倍型Haplotype频率Frequency突变位点Mutationsitec.40A>Cc.41C>TH10.145ACH20.380CCH30.476CT
2.5编码区40和41相邻突变位点对MC1R功能的影响
为了推测MC1R基因编码区第40和41位点突变对蛋白功能的影响,用PANTHER软件对比了与其进化相关的蛋白质中特定位点发生突变时对蛋白质功能的影响程度,由此得到功能损伤的似然值(表4)。subPSEC值是特定位置的野生型和突变型氨基酸的概率比值的负对数,该值在0(中性的)~-10(极可能对蛋白质功能有害)之间连续变化[17]。
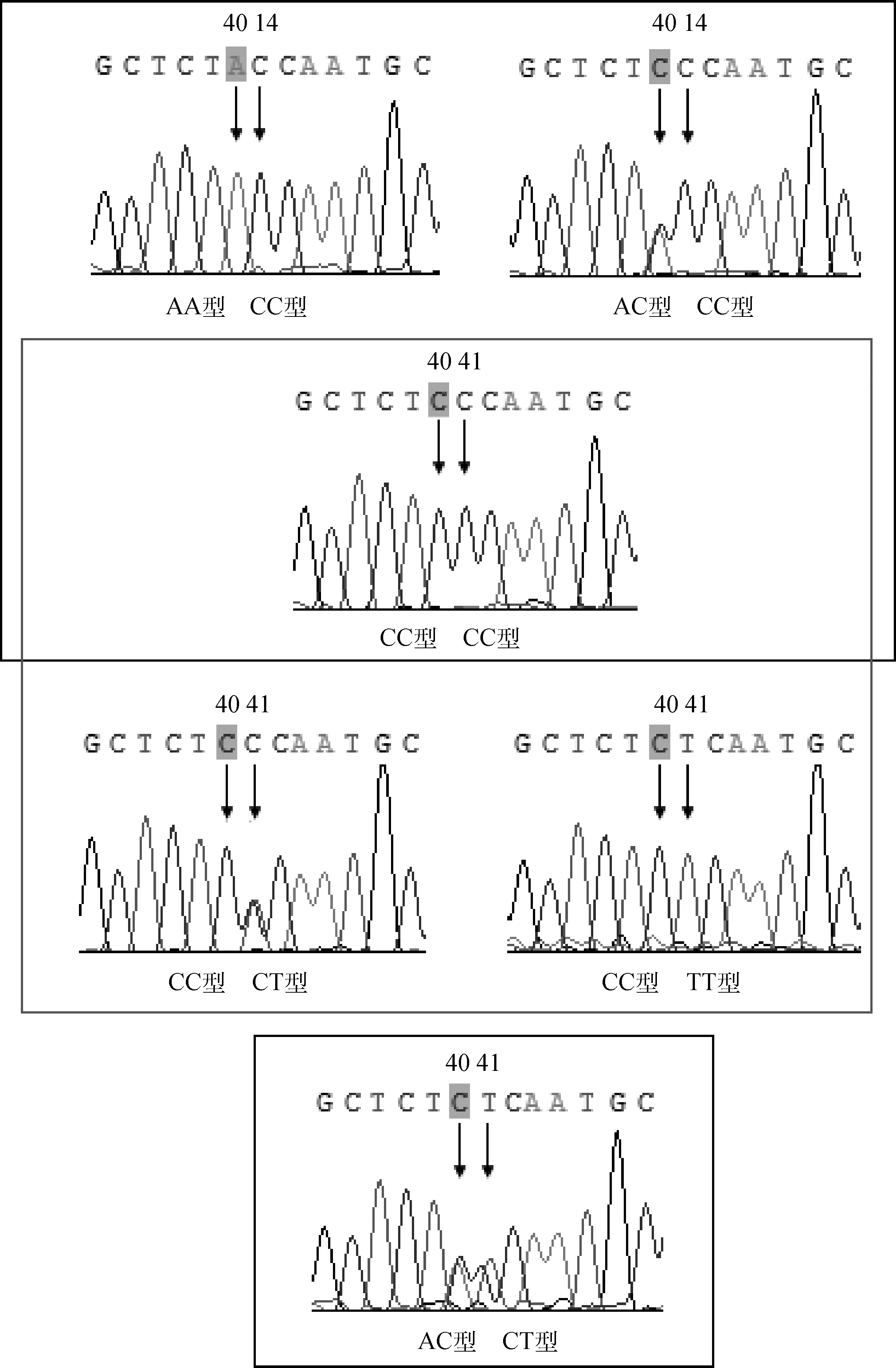
图2 狐狸MC1R基因编码区40和41位点的突变Fig.2 The mutation of 40 and 41 sites in coding region of fox MC1R gene
表4MC1R第14位氨基酸变异的subPSEC和Pdeleterious值
Table 4The subPSEC andPdeleteriousscores of the 14th amino acid substitution

核苷酸变异Nucleotidevariation40位点41位点氨基酸变异AminoacidvariationssubPSEC值subPSECscoresPdeleterious值Pdeleteriousscores40位点为A时c.41C>Tp.Thr14Ile-1.625940.2019740位点为C时c.41C>Tp.Pro14Leu-4.204460.76932
2.6统计分析结果
通过SPSS二元变量相关分析得出狐狸MC1R基因编码区第40位点基因型与毛色表型之间的相关系数(r)为-0.050,二者不具相关性,P=0.455,无统计学意义。第41位点基因型与毛色表型之间的相关系数(r)为-0.359,二者具低度相关,P= 0.000,说明二者有显著相关性(表5)。
表5MC1R基因第40和41 位点变异与毛色表型的相关分析结果
Table 5The correlation analysis between genotype at 40 and 41 sites and coat color
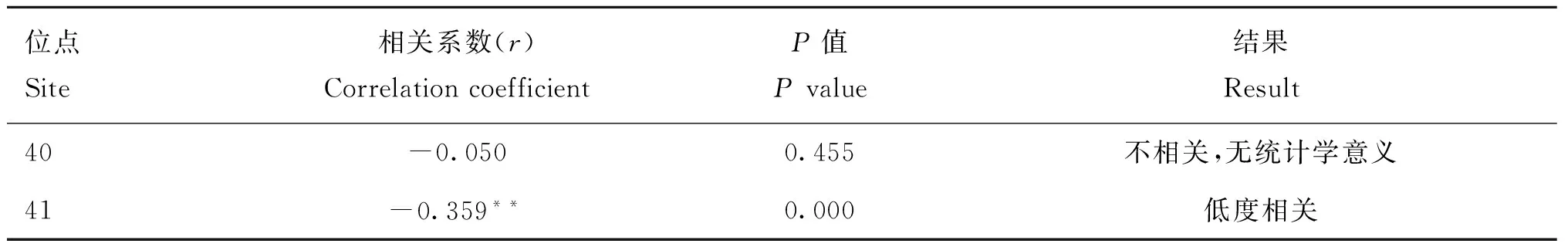
位点Site相关系数(r)CorrelationcoefficientP值Pvalue结果Result40-0.0500.455不相关,无统计学意义41-0.359**0.000低度相关
|r|<0.3为不相关;0.3≤|r|<0.5为低度相关;0.5≤|r|<0.8为中度相关;0.8≤|r|<1为高度相关。P<0.05时,两个变量间相关性显著;当P<0.01时,两个变量间相关性非常显著,P>0.05 时,两个变量间没有显著的相关性[18]
|r|<0.3 indicate no correlation;0.3≤|r|<0.5 indicate low correlation;0.5≤|r|<0.8 indicate moderate correlation;0.8≤|r|<1 indicate high correlation.P<0.05 indicate significant correlation;P<0.01 indicate extremely significant correlation;P>0.05 indicate no significant correlation
3 讨 论
近年来,随着人们对化工染料污染的担忧和崇尚自然风潮的兴起,绿色、天然、环保、优质毛皮动物产品已成为广大生产者与消费者的追求目标。因此,创制并选育天然彩色毛皮动物新品种,将成为现代畜牧业发展的紧迫任务,而探明毛皮动物彩色绒毛分子遗传机制是实现上述目标的重要理论基础。狐狸是一种重要的毛皮动物,其与家犬均归属于犬科,有关家犬MC1R基因的相关研究已有大量报道,并已证实该基因与其毛色有关[19-21],但有关狐狸MC1R基因的相关研究则相对较少。J.M.Newton等[19-20]发现家犬MC1R蛋白的90和306位点变异(S90G和R306ter)分别与其黑/棕和红/黄毛色相关。D.L.Dreger等[21]发现家犬MC1R蛋白的78位点变异(p.Gly78Val)与Saluki和Afghan Hound家犬的毛色有关。以上研究都是针对单碱基突变与毛色的相关性研究。本研究分析了狐属和北极狐属12种毛色共计163只狐狸MC1R基因编码区序列,在第40和41位点发现了2个相邻的错义突变:c.40A>C和c.41C>T。当40位点为A时,导致其编码的第14位氨基酸发生苏氨酸向异亮氨酸的转变(p.Thr14Ile);当40位点为C时,导致第14位氨基酸发生脯氨酸向亮氨酸的转变(p.Pro14Leu),这一结果与J.Nowacka-Woszuk等[22]的研究结果相一致。J.Nowacka-Woszuk等[22]在分析家犬、赤狐、北极狐和貉MC1R基因编码区的变异时,也发现了赤狐编码区第40和41位点的变异,但由于其缺乏表型记录没有分析两位点与毛色表型的相关性。本研究中,北极狐属狐MC1R基因编码区第41位点只有TT一种基因型,而狐属狐则有CC和CT 2种基因型,不存在TT基因型,推测该位点可能是区分狐狸属间的一个重要功能位点。群体遗传分析表明,对于40位点,C为优势等位基因(0.855),单倍型H2(CC,0.380)和H3(CT,0.476)为优势单倍型,说明大部分狐狸40位点均为C等位基因。通过PANTHER软件功能预测,当40位点为C时,p.Pro14Leu处的subPSEC和Pdeleterious值分别是-4.204 46和0.769 32,表明该处氨基酸替换对MC1R功能有重要影响。SPSS二元变量统计分析结果表明,狐狸MC1R基因编码区第41位点多态性与毛色表型存在显著低度相关性,推测第41位点可能是参与毛色形成的一个相对重要功能位点。
4 结 论
本研究采用PCR扩增和产物直接测序的方法获得了狐属和北极狐属共计163只不同毛色狐狸MC1R基因的编码区序列,在第40和41位点发现2个相邻错义突变(c.40A>C和c.41C>T)。群体遗传分析表明,狐狸MC1R基因编码区41位点可能是区分狐狸属间的一个重要功能位点。PANTHER软件功能预测41位点突变(c.41C>T)导致的氨基酸替换(p.Pro14Leu)对MC1R功能有重要影响。SPSS二元变量统计分析结果进一步表明,41位点多态性与狐狸毛色表型存在显著相关性。
[1]BENNETT D C,LAMOREUX M L.The color loci of mice-a genet iccentury[J].PigmentCellRes,2003,16(4):333-344.
[2]马泽芳,崔凯.貂狐貉实用养殖技术[M].北京:中国农业出版社,2014.
MA Z F,CUI K.Practical breeding techniques of mink,fox and raccoon dog[M].Beijing:China Agriculture Press,2014.(in Chinese)
[3]佟煜仁,张志明.毛皮动物毛色遗传及繁育新技术[M].北京:金盾出版社,2009.
TONG Y R,ZHANG Z M.New technology for coat color genetics and breeding of fur animal[M].Beijing:Jindun Press,2009.(in Chinese)
[4]VÅGE D I,LU D,KLUNGLAND H,et al.A non-epistatic interaction of agouti and extension in the fox,Vulpesvulpes[J].NatGenet,1997,15(3):311-315.
[5]VÅGE D I,FUGLEI E,SNIPSTAD K,et al.Two cysteine substitutions in the MC1R generate the blue variant of the Arctic fox (Alopexlagopus) and prevent expression of the white winter coat[J].Peptides,2005,26(10):1814-1817.
[6]PALMER J S,DUFFY D L,BOX N F,et al.Melanocortin-1 receptor polymorphisms and risk of melanoma:is the association explained solely by pigmentation phenotype?[J].AmJHumGenet,2000,66(1):176-186.
[7]BASHMAKOVA E E,KRASITSKAYA V V,BONDAR A A,et al.Bioluminescent assay to detect melanocortin-1 receptor (MC1R) polymorphisms (R160W,R151C,and D294H)[J].MolBiol(Mosk),2015,49(6):953-958.
[8]ABITBOL M,LEGRAND R,TIRET L.A missense mutation in melanocortin 1 receptor is associated with the red coat colour in donkeys[J].AnimGenet,2014,45(6):878-880.
[9]李洪涛,曾献存,张文祥,等.哈萨克绵羊MC1R和ASIP基因多态性及表达量与被毛颜色表型相关性的研究[J].畜牧兽医学报,2013,44(3):366-375.
LI H T,ZENG X C,ZHANG W X,et al.Analysis of the relationship between polymorphism/mRNA expression levels ofMC1RandASIPand coat color phenotype in Kazakh sheep[J].ActaVeterinariaetZootechnicaSinica,2013,44(3):366-375.(in Chinese)
[10]郭多,巴彩凤,苏玉虹,等.犬MC1R基因R306ter与毛色性状相关性研究[J].中国实验动物学报,2004,12(2):100-102.
GUO D,BA C F,SU Y H,et al.Study on the relationship between r306ter loci in mc1r gene and coat color trait in dogs[J].ActaLaboratoriumAnimalisScientiaSinica,2004,12(2):100-102.(in Chinese)
[11]SAMBROOK J,FRITSCH E F,MANIATIS T.Molecular cloning[M].New York:Cold Spring Habor Laboratory Press,1989.
[12]HALL T A.BioEdit:A user-friendly biological sequences alignment editor and analysis program for Windows 95/98/NT[J].NucleicAcidsSympSer,1999,41:95-98.
[13]YEH F C,YANG R C,BOYLE T.POPGENE version 1.31:Microsoft Windows-based freeware for population genetic analysis-Quick User Guide[M].University of Alberta and Centre for International Forestry Research.Edmonton,AB Canada,1999:1-28.
[14]SHI Y Y,HE L.SHEsis,a powerful software platform for analyses of linkage disequilibrium,haplotype construction,and genetic association at polymorphism loci[J].CellRes,2005,15(2):97-98.
[15]BRUNHAM L R,SINGARAJA R R,PAPE T D,et al.Accurate prediction of the functional significance of single nucleotide polymorphisms and mutations in the ABCA1 gene[J].PLoSGenet,2005,1(6):e83.
[16]THOMAS P D,KEJARIWAL A,GUO N,et al.Applications for protein sequence-function evolution data:mRNA/protein expression analysis and coding SNP scoring tools[J].NucleicAcidsRes,34 (Web Server issue):W645-650.
[17]苗永旺,吴桂生,王磊,等.黑色素皮质素受体1 基因对水牛毛色遗传的影响[J].中国科学C辑:生命科学,2009,39(12):1155-1161.
MIAO Y W,WU G S,WANG L,et al.The role of MC1R gene in buffalo coat color[J].ScienceinChina(SeriesC:LifeSciences),2009,39(12):1155-1161.(in Chinese)
[18]孙逸敏.利用SPSS软件分析变量间的相关性[J].新疆教育学院学报,2007,23(2):120-123.
SUN Y M.Using SPSS software to analyze the correlation between variables[J].JournalofXinjiangEducationInstitute,2007,23(2):120-123.(in Chinese)
[19]NEWTON J M,WILKIE A L,HE L,et al.Melanocortin 1 receptor variation in the domestic dog[J].MammGenome,2000,11(1):24-30.
[20]WANG G D,CHENG L G,FAN R X,et al.Signature of balancing selection at the MC1R gene in Kunming dog populations[J].PLoSOne,2013,8(2):e55469.
[21]DREGER D L,SCHMUTZ S M.A new mutation in MC1R explains a coat color phenotype in 2 "old" breeds:Saluki and Afghan hound[J].JHered,2010,101(5):644-649.
[22]NOWACKA-WOSZUK J,SALAMON S,GORNA A,et al.Missense polymorphisms in the MC1R gene of dog,red fox,arctic fox and Chinese raccon dog[J].JAnimBreedGenet,2013,130(2):136-141.
(编辑郭云雁)
Study on Adjacent Variation of c.40A>C and c.41C>T of FoxMC1RGene in Different Populations
XU Gui-li1,ZHANG Wen-xiang1,DUAN Ling-xin1,GONG Yuan-fang1*,GE Mu-xiang1,LIU Xie-rong1,WANG Shu-peng2,GUO Xin-ling2,LIU Zheng-zhu1*
(1.CollegeofAnimalScienceandTechnology,HebeiNormalUniversityofScience&Technology,Qinhuangdao066004,China;2.AgricultureBureauofDongguangCountyinHebeiProvince,Dongguang061600,China)
In order to detect the relationship between polymorphism ofMC1Rgene and coat color in fox,a total of 163 skin samples of 12 coat color foxes were collected.The nucleotide sequence (1 054 bp) of foxMC1Rgene were obtained by the method of PCR and direct sequencing,and the polymorphism were analyzed.The population genetics were analyzed using PopGen32 and SHEsis softwares.The effect of mutations on the function ofMC1Rgene was evaluated using PANTHER software.The relationships between the variable sites and coat color were analyzed by the statistical methods of SPSS bivarate correlation analysis.Two adjacent missense mutations (c.40A>C and c.41C>T) were found in the coding region of foxMC1Rgene,which resulted in codon change of p.Thr14Ile or p.Pro14Leu.When 40 site was A,it led to the substitution between threonine (Thr) and isoleucine (Ile).When 40 site was C,it led to the substitution between proline (Pro) and leucine (Leu).All the genotypes of two coat color foxes belonging toAlopexwere TT.However,the genotypes of most coat color foxes belonging toVulpeswere CC.It was supposed that 41 site was important in distinguishingAlopexandVulpes.The in silico functional analysis showed that the amino acid substitution at p.Pro14Leu had significant impact on the function of MC1R.The statistical analysis showed the polymorphism of 41 site had significant low correlation with the fox coat color.The results indicate that SNP c.41C>T in the coding region of theMC1Rgene is probably associated with the coat color in fox.
fox;MC1Rgene;40 and 41 sites;polymorphism;coat color
10.11843/j.issn.0366-6964.2016.10.010
2016-02-24
国家自然科学基金(31272412);河北省自然科学基金(C2013407101;C2016407114);河北省高等学校创新团队领军人才培育计划(LJRC004);河北科技师范学院科学研究基金(1)
徐桂利(1986-),男,山东临沂人,硕士生,主要从事动物分子遗传育种研究,E-mail:296881485@163.com
巩元芳,教授,E-mail:gyfkeyan@163.com;刘铮铸,教授,E-mail:liuzhengzhu@163.com
S829.9;S813.3
A
0366-6964(2016)10-2020-07
