成熟前后水牛卵母细胞蛋白质组的初步研究
2016-11-08陈凌声代小丽徐永茹陆凤花蒋建荣石德顺李湘萍
陈凌声,代小丽,徐永茹,罗 婵,陆凤花,蒋建荣,石德顺,徐 平,李湘萍*
(1.广西大学亚热带农业生物资源保护与利用国家重点实验室,南宁 530005; 2.军事医学科学院放射与辐射医学研究所,国家蛋白质科学中心 (北京),北京蛋白质组研究中心,蛋白质组学国家重点实验室,北京 102206)
成熟前后水牛卵母细胞蛋白质组的初步研究
陈凌声1,2,代小丽1,徐永茹1,2,罗婵1,陆凤花1,蒋建荣1,石德顺1,徐平2,李湘萍1*
(1.广西大学亚热带农业生物资源保护与利用国家重点实验室,南宁 530005; 2.军事医学科学院放射与辐射医学研究所,国家蛋白质科学中心 (北京),北京蛋白质组研究中心,蛋白质组学国家重点实验室,北京 102206)
应用聚丙烯酰胺凝胶电泳联合反相液相色谱-串联质谱(RP-LC-MS/MS)蛋白质组学技术,研究GV期和MII期水牛卵母细胞蛋白质组,以期为揭示水牛卵母细胞体外成熟分子机理、筛选与卵母细胞成熟质量相关蛋白质奠定理论基础。从GV期和MII期水牛卵母细胞中分别鉴定到647和570种蛋白质(FDR<1%)。其中,鉴定相同蛋白质414种;GV期和MII期卵母细胞特有鉴定蛋白质分别为233种和156种。通过谱图计数法获得鉴定蛋白质的半定量信息,从GV期和MII期水牛卵母细胞中筛选到9种高丰度蛋白质。其中8种为相同蛋白质,包括穹窿体蛋白、谷胱苷肽S-转移酶M3、蛋白精氨酸脱亚氨酶6、过氧化物氧化还原酶2、二磷核苷酸激酶B、动力蛋白轻链1、醛糖还原酶、类甘油醛-3-三磷酸脱氢酶同源物2等。热激蛋白90α和谷胱甘肽S-转移酶P分别为GV期和MII期水牛卵母细胞特有的高丰度蛋白质,这些蛋白质可能与水牛卵母细胞成熟过程密切相关。GO(Gene Ontology)和KEGG分析显示,鉴定相同蛋白质主要集中在丙酮酸盐代谢、三羧酸循环(TCA)、糖酵解/糖原生成、磷酸戊糖途径等能量代谢通路,提示水牛卵母细胞成熟过程中可能需要维持高的能量代谢水平,以保证卵母细胞减数分裂的完成。GV期细胞特有鉴定蛋白质主要集中在氧化磷酸化、核糖体以及蛋白酶体等KEGG通路,表明GV期卵母细胞可能具有高的氧化磷酸化和蛋白合成水平,蛋白酶体在推动水牛卵母细胞成熟进程中可能发挥重要作用。MII期细胞特有鉴定蛋白质主要集中在DNA复制和氨基糖、核苷糖代谢等KEGG通路,提示水牛卵母细胞可能在为后续的受精过程和早期卵裂进行遗传物质的准备。综上表明,成熟前后水牛卵母细胞蛋白质表达模式,为进一步深入了解水牛卵母细胞成熟分子机理奠定理论基础。
水牛;体外成熟;卵母细胞;蛋白质组
哺乳动物卵母细胞体外成熟(IVM)可为体外受精、胚胎生产和动物克隆等胚胎工程技术提供大量可用的卵母细胞。卵母细胞的成熟质量直接影响卵母细胞受精率,早期胚胎的存活,妊娠的维持,甚至胎儿的发育[1]。然而,目前体外成熟卵母细胞的发育潜能、成熟率和囊胚发育率均远低于体内成熟的卵母细胞[2],这与体外成熟条件下,卵母细胞核质成熟不同步、胞质成熟不充分和不完善的体外成熟体系密切相关[1]。从基因表达和蛋白质调控水平研究卵母细胞的成熟机理,将有助于优化卵母细胞体外培养体系,提高体外成熟效率和胚胎生产效率。
近年来,功能基因组学技术已被广泛应用于包括小鼠[3-4]、猪[5]、牛[6-7]等物种的基因功能研究,使得人们对哺乳动物卵母细胞成熟、早期胚胎发育的分子机理有了更多的认识,鉴定了一系列可作为反映卵母细胞发育潜能的标志性因子。然而研究发现,卵母细胞的mRNA丰度与蛋白质表达水平相关性较低。卵母细胞内大量母源性mRNA未被聚腺苷酸化而不翻译为蛋白质[8]。此外,一些蛋白质存在多种不同亚型,并通过复杂的翻译后修饰调控执行各种功能[9]。蛋白质组学是以细胞、组织中表达的全部蛋白质为研究对象,系统揭示蛋白质结构、功能,蛋白质表达动态变化。因此,开展哺乳动物卵母细胞蛋白质组研究对于认识卵母细胞成熟的分子机制具有十分重要的意义。目前,哺乳动物卵母细胞/胚胎蛋白质组学的研究已陆续在小鼠[10-11]、猪[12]和牛[13]等物种展开。研究内容包括成熟前后卵母细胞差异表达蛋白质组比较,卵母细胞母源性蛋白质组的鉴定,以及不同发育时期胚胎蛋白质表达模式等。刘振方[14]采用双向电泳(2DE)结合质谱技术鉴定了成熟前、后水牛卵母细胞蛋白质组,仅鉴定到8个蛋白质,这与2DE技术存在分辨率差,操作繁琐等诸多不足有关。陈富美等[15]应用LC-MS/MS技术,从水牛卵母细胞中成功鉴定到574种蛋白质。但该报道的研究对象为GV期和MII期混合细胞,所构建的蛋白质组表达谱为两个时期卵母细胞表达蛋白质的整合,对于两个时期细胞独立的蛋白质表达谱,以及这些蛋白在细胞生长特定时期中所执行的功能并不清楚。
无标记定量对不同状态的样本单独进行质谱鉴定。由于其操作简便,耗费成本低,不受样品数量、条件的限制,同时克服了标记定量技术在对多个样本进行相对定量比较的不足,日益受到研究者的广泛关注和应用。目前,无标记定量方法根据其定量原理的不同可分为两种:第一种是基于离子流色谱峰(Extracted ion current,XIC)的定量方法。根据肽段母离子的质荷比提取不同保留时间下的相应同位素峰簇的信号强度,构建XIC,并根据XIC计算出肽段的丰度表征。第二种是基于谱图计数法(Spectral counting,SC)。根据蛋白质的丰度与其对应的肽段被质谱检测到的频率成正比的原理,将一个蛋白质对应的鉴定谱图数(Peptide spectrum match,PSM)定义为蛋白质的相对丰度[16]。
本研究应用一维聚丙烯酰胺凝胶电泳结合LC-MS/MS的蛋白质组学技术,构建了体外成熟的水牛卵母细胞蛋白质组表达谱。通过谱图计数法获得鉴定蛋白的半定量信息,筛选获得成熟前后水牛卵母细胞中高丰度表达蛋白,同时借助生物信息学工具对鉴定到的蛋白进行功能注释和KEGG信号通路分析,为促进水牛卵母细胞体外成熟的分子机制研究奠定良好的理论基础。
1 材料与方法
1.1水牛卵母细胞采集
水牛卵巢取自广西南宁市屠宰场。共收集到315个卵巢,卵巢用75%酒精消毒,25 ℃生理盐水清洗干净。用注射器抽取卵巢表面直径为2~6 mm卵泡中的卵母细胞。
成熟前卵母细胞(GV期)的采集:从卵泡抽吸出的液体中,挑取出卵母细胞形态规则,细胞质均匀,具有3层或3层以上卵丘颗粒细胞包被的卵丘-卵母细胞复合体。洗卵液(TCM-199,5 mmol·L-1NaHCO3,15 mmol·L-1NaCl,5 mmol·L-1HEPES,2% 新生犊牛血清)漂洗数次后,用移液枪反复吹打去除包被的卵丘细胞。卵母细胞置于预冷的PBS清洗数次,-80 ℃保存备用。共收集到GV期细胞522个。
成熟后卵母细胞(MII期)的收集:挑取卵母细胞形态规则,细胞质均匀,具有3层及3层以上卵丘颗粒细胞包被的卵丘-卵母细胞复合体,洗卵液漂洗数次后,转移至含有成熟培养液(TCM-199,26.2 mmol·L-1NaHCO3,5 mmol·L-1HEPES,60 mg·L-1青霉素,100 mg·L-1链霉素,0.1 mg·L-1促卵泡素,5% 发情牛血清)的玻璃平皿,在38.5 ℃,5% CO2和最大饱和湿度的培养箱中成熟培养22~24 h。挑取细胞质均匀,具有3层以上完整卵丘颗粒细胞层包被,排出第一极体的卵母细胞[17]。去除包被卵丘颗粒细胞的卵母细胞置于预冷的PBS清洗数次,-80 ℃保存备用。共收集到MII期细胞545个。
1.2卵母细胞蛋白质提取及电泳分离
卵母细胞样品中加入裂解液(8 mmol·L-1尿素,50 mmol·L-1碳酸氢铵(NH4HCO3))后,使用涡旋振荡仪器涡旋1 min,然后冰上静置30 s,反复此操作15次。4 ℃,13 300 r·min-1离心3 min,收集上清。样品浓度通过BCA方法定量并进行10% SDS-PAGE分离。
1.3酶解样品
电泳结束后,切取目的条带并制成小胶粒,脱色液(50 mmol·L-1NH4HCO,乙腈(ACN),按1∶1比例配制)脱至无色,加入乙腈脱水,旋转蒸发干燥。按照胰酶∶蛋白质比为1∶50的比例加入浓度为13 ng·μL-1胰蛋白酶液,37 ℃培养箱孵育14~16 h。蛋白酶解结束后,加入蛋白抽提液(5% 甲酸(FA),50% ACN)抽提,肽段溶液样品旋转蒸发干燥,-80 ℃保存备用。
1.4质谱检测
采用LTQ-Oribitrap Velos进行质谱检测。流动相A(0.1% ACN)溶解多肽样品,自动上样,梯度洗脱。质谱检测参数:一级质谱扫描为300~1 600 m·z-1,喷雾电压2 kV,二级质谱扫描模式为碰撞诱导解离模式,35%归一化碰撞能量。质谱鉴定数据搜索软件为SorcererTM-SEQUEST®(Version 4.0.4 build,Sage-N Reasearch,Inc.),数据库为NCBIBostaurus蛋白数据库(20 131 213、24、210个编码基因)。
1.5生物信息学分析
利用DAVID (https://david.ncifcrf.gov/home.jsp)分析工具对鉴定蛋白进行Gene Ontology(GO)功能注释和KEGG pathway分析。
2 结 果
2.1成熟前后水牛卵母细胞蛋白SDS-PAGE分离
按照1.2方法分别提取GV期和MII期卵母细胞总蛋白,BCA方法测定蛋白浓度,分别取10 μg蛋白质样品进行SDS-PAGE分离。结果显示,分子量为20~220 ku,蛋白样品得到有效分离,蛋白条带清晰,两组样品蛋白带型基本一致(图1)。
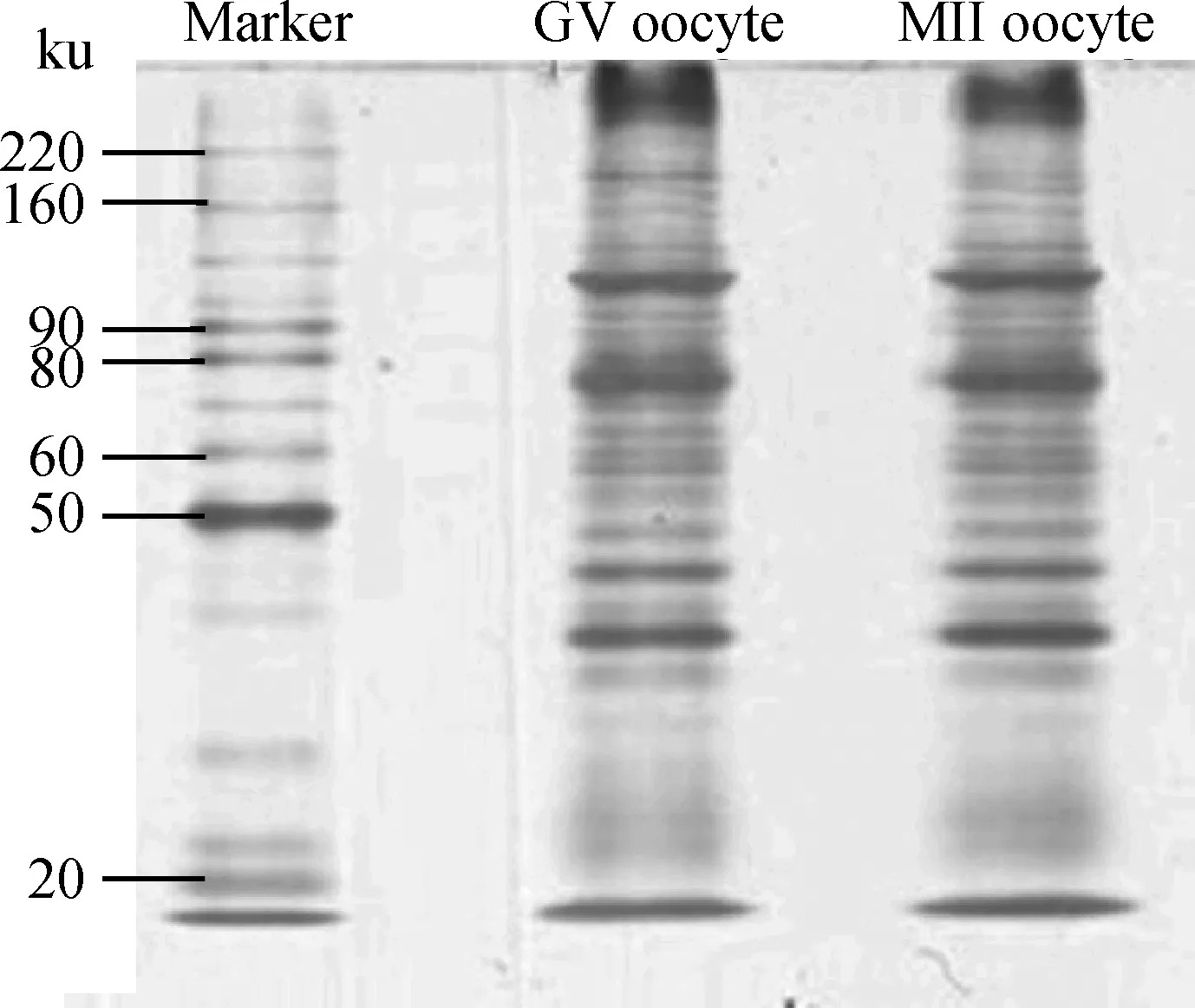
图1 GV期和MII期水牛卵母细胞总蛋白的SDS-PAGE分析Fig.1 SDS-PAGE profile of total protein from GV and MII stage buffalo oocyte
2.2LC-MS/MS鉴定
蛋白样品经SDS-PAGE分离后,采用胶内消化方法获得肽段样品后进行LC-MS/MS鉴定。总离子流(Total ion chromatography,TIC)图显示成熟前后样品质谱检测的信号强度均达到E8级别(图2)。数据库搜库结果如表1所示,从GV期水牛卵母细胞共鉴定到7 494张二级谱图,鉴定蛋白647种,双肽段匹配蛋白313种,占总鉴定蛋白的48%。成熟后水牛卵母细胞共鉴定到6 710张二级谱图,鉴定蛋白570种,双肽段匹配蛋白278种,占总鉴定蛋白的48.6%。成熟前后水牛卵母细胞相同鉴定蛋白414种,占两种细胞鉴定蛋白总数的51.6%。成熟前卵母细胞特有鉴定蛋白233种,成熟后卵母细胞特有鉴定蛋白156种(图3)。
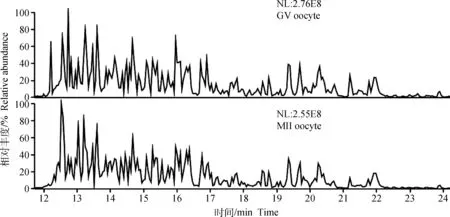
图2 GV期和MII 期水牛卵母细胞的LC-MS/MS总离子流图Fig.2 Total ion chromatography of GV and MII stage buffalo oocyte by LC-MS/MS
表1GV期、MII期水牛卵母细胞蛋白质LC-MS/MS鉴定
Table 1Overview of proteins identified from GV and MII stage buffalo oocytes by LC-MS/MS
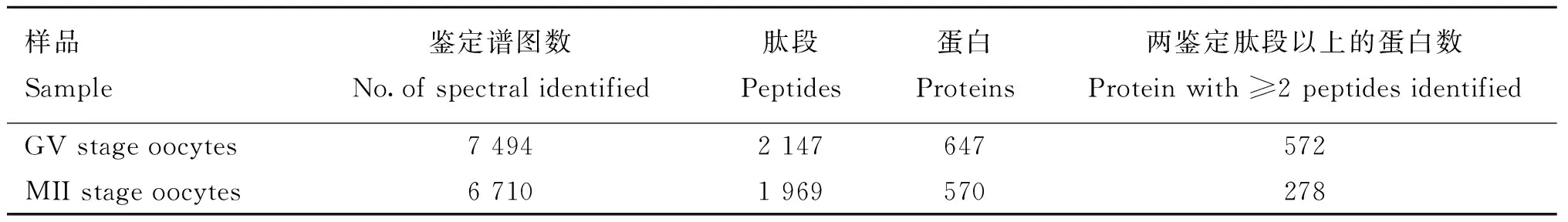
样品Sample鉴定谱图数No.ofspectralidentified肽段Peptides蛋白Proteins两鉴定肽段以上的蛋白数Proteinwith≥2peptidesidentifiedGVstageoocytes74942147647572MIIstageoocytes67101969570278
2.3鉴定蛋白的GO分析
根据GO数据库第3级的注释结果,414种相同鉴定蛋白,在蛋白转运、氧化应激、蛋白定位、骨架蛋白组装、受精等生物学进程显著富集。GV期水牛卵母细胞233种特有鉴定蛋白,显著富集的生物学进程包括前体代谢物及能量产生、转运、蛋白定位建立等。MII期水牛卵母细胞131种特有鉴定蛋白,在蛋白质定位、蛋白质转运等生物学进程显著富集(图4)。
2.4KEGG pathway分析
如图5A所示,相同鉴定蛋白在丙酮酸盐代谢、糖酵解/糖原生成、TCA循环、和磷酸戊糖途径等21条KEGG 信号通路显著富集。表明能量代谢在水牛卵母细胞成熟过程中可能起着重要的作用。GV期水牛卵母细胞特有鉴定蛋白在氧化磷酸化、核糖体及蛋白酶体等KEGG 信号通路显著富集。表明水牛GV期卵母细胞中具有高的ATP产生速率,ATP含量的提高可能为卵母细胞的生长、蛋白合成等提供能量来源。此外,水牛卵母细胞在生长阶段可能需要高的蛋白质合成水平,为随后的减数分裂成熟过程做准备。MII期水牛卵母细胞特有鉴定蛋白在DNA复制和氨基糖、核苷糖代谢信号通路显著富集(图5B)。表明卵母细胞可能在为随后的受精过程和早期胚胎发育做准备。
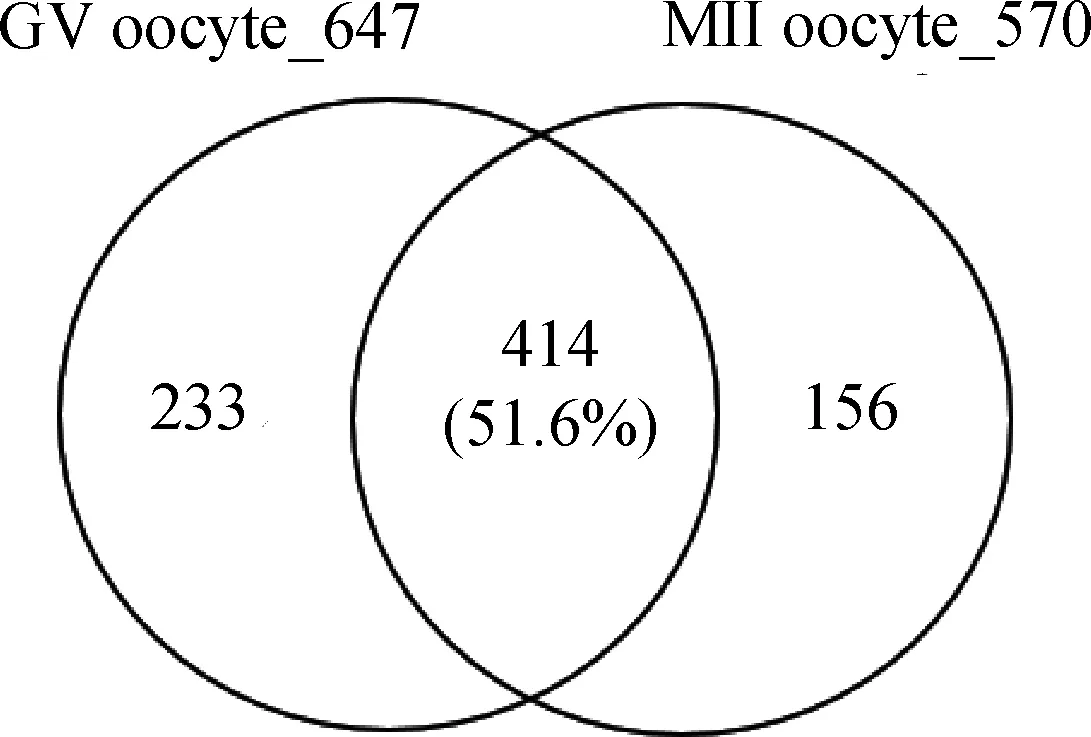
图3 GV期、MII期水牛卵母细胞蛋白鉴定维恩图Fig.3 Venny diagrams represent the identified proteins from GV and MII stage buffalo oocytes
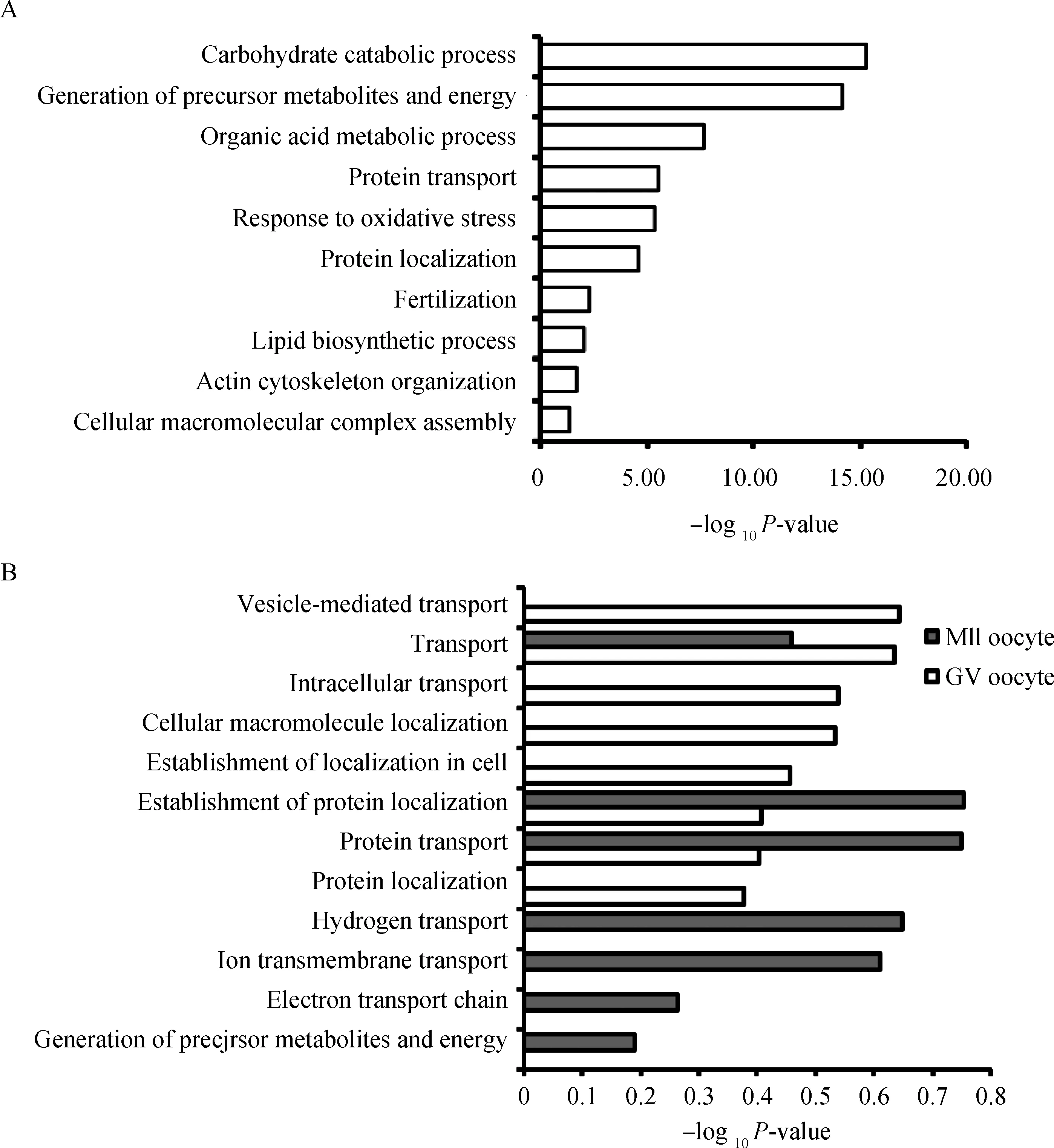
A.相同蛋白生物学进程注释;B.特有蛋白生物学进程注释A.Biological process categories of common protein;B.Biological process categories of unique protein图4 GV期和MII期水牛卵母细胞相同、特有蛋白的生物学进程分类Fig.4 Biological process categories of common and unique proteins from GV and MII stage buffalo oocyte identified by LC-MS/MS
2.5成熟前后水牛卵母细胞高丰度表达蛋白质
通过谱图计数法(Spectral counting,SC)计算鉴定蛋白质的相对丰度。由于内参蛋白在细胞中的表达较为恒定且其表达丰度相对较高,本研究以β-actin作为高丰度表达蛋白质的参照蛋白。从成熟前、后的水牛卵母细胞中均分别筛选到9种高丰度表达蛋白质,其中8种为相同鉴定蛋白质,包括穹窿体蛋白(MVP)、谷胱苷肽S-转移酶M3(GSTM3)、蛋白精氨酸脱亚氨酶6(PADI6)、过氧化物氧化还原酶2(PRDX2)、二磷核苷酸激酶B(NME2)、动力蛋白轻链1(DYNLL1)、醛糖还原酶(AKR1B1)、类甘油醛-3-三磷酸脱氢酶同源物2。而热激蛋白90α(HSP90α)和谷胱甘肽S-转移酶P(GSTP1)分别为成熟前、后卵母细胞特有的高丰度蛋白质(表2)。
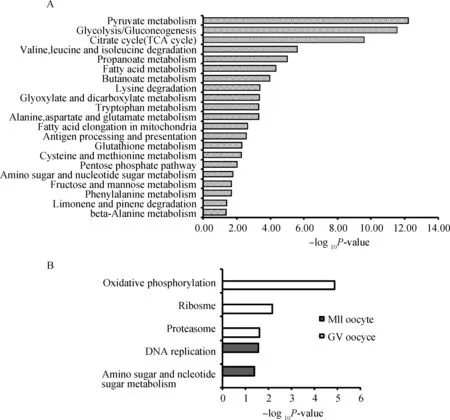
A.相同蛋白KEGG 信号通路分析;B.GV期和MII期水牛卵母细胞特有蛋白KEGG信号通路分析A.KEGG pathway analysis of common proteins;B.KEGG pathway analysis of unique proteins图5 KEGG pathway分析Fig.5 KEGG pathway analysis
3 讨 论
本研究应用一维SDS-PAGE结合LC-MS/MS的蛋白质组学鉴定技术,建立了GV期和MII期水牛卵母细胞蛋白质组表达谱。分别从成熟前、后的水牛卵母细胞中鉴定到648和572种蛋白质。与刘振芳[14]和陈富美[15]等报道的水牛卵母细胞蛋白质组研究相比,笔者也鉴定到了一些在其数据集中已报道的蛋白,如MVP,血清白蛋白前体(ALB),α-2-HS-糖蛋白前体(AHSG),跨膜结构域蛋白2前体EMP24(TMED2),透明带精子结合蛋白2(ZP2),透明带精子结合蛋白3(ZP3),透明带精子结合蛋白4(ZP4),核质蛋白(NPM2),热休克同族蛋白71(HSC71),热激蛋白60(HSP60)和B淋巴细胞210L(BCL210L)。此外,还鉴定到了一些原来未报道的蛋白,这些蛋白已被证实在其他物种卵母细胞成熟过程中发挥重要的母源性蛋白作用,如Nlrp5/Mater,合子阻滞蛋白(Zar1),骨形态生成蛋白(BMP15)和生长分化因子9(GDF9)等。
根据谱图计数的方法获得蛋白质的半定量信息,以内参蛋白为高丰度表达蛋白的参照蛋白。从成熟前、后的水牛卵母细胞中分别筛选出9种高丰度表达蛋白质,其中8种为相同的蛋白,提示这些高丰度表达的蛋白在卵母细胞成熟过程中可能起重要作用。PADI6属于肽酰基脱亚氨酶家族,仅在卵母细胞和早期胚胎中高丰度表达[18]。PADI6已被证实是一种重要的母源性效应蛋白,对于早期胚胎发育是必需的[19]。P.Yurttas等[20]研究发现,PADI6基因失活导致雌性小鼠不孕,而敲除PADI6基因可导致小鼠胚胎发育阻滞在2-细胞期。此外,PADI6对于含有核糖体和核糖体组件的细胞质网格结构的形成和维持是必需的,而后者在卵母细胞和早期胚胎发育过程中发挥重要作用[21]。此前,S.F.Wang等[22]通过蛋白质组学技术发现PADI6蛋白在成熟前、后的小鼠卵母细胞中均高丰度表达。DYNLL1是一种分子马达,可将ATP高能磷酸键的化学能转化为机械能,主要参与细胞的有丝分裂、染色体分离、mRNA定位和囊泡转运[23]。S.E.Racedo等[24]研究发现,可发育到囊胚阶段的牛卵母细胞DYNLL1具有较高的mRNA表达水平,提示DYNLL1可能与卵母细胞的发育潜能有关。此外,DYNLL还被证实作为调控基因参与牛卵泡和早期胚胎的发生[25]。
表2GV期和MII期水牛卵母细胞高丰度表达蛋白质
Table 2List of high-abundance proteins of GV and MII stage buffalo oocytes
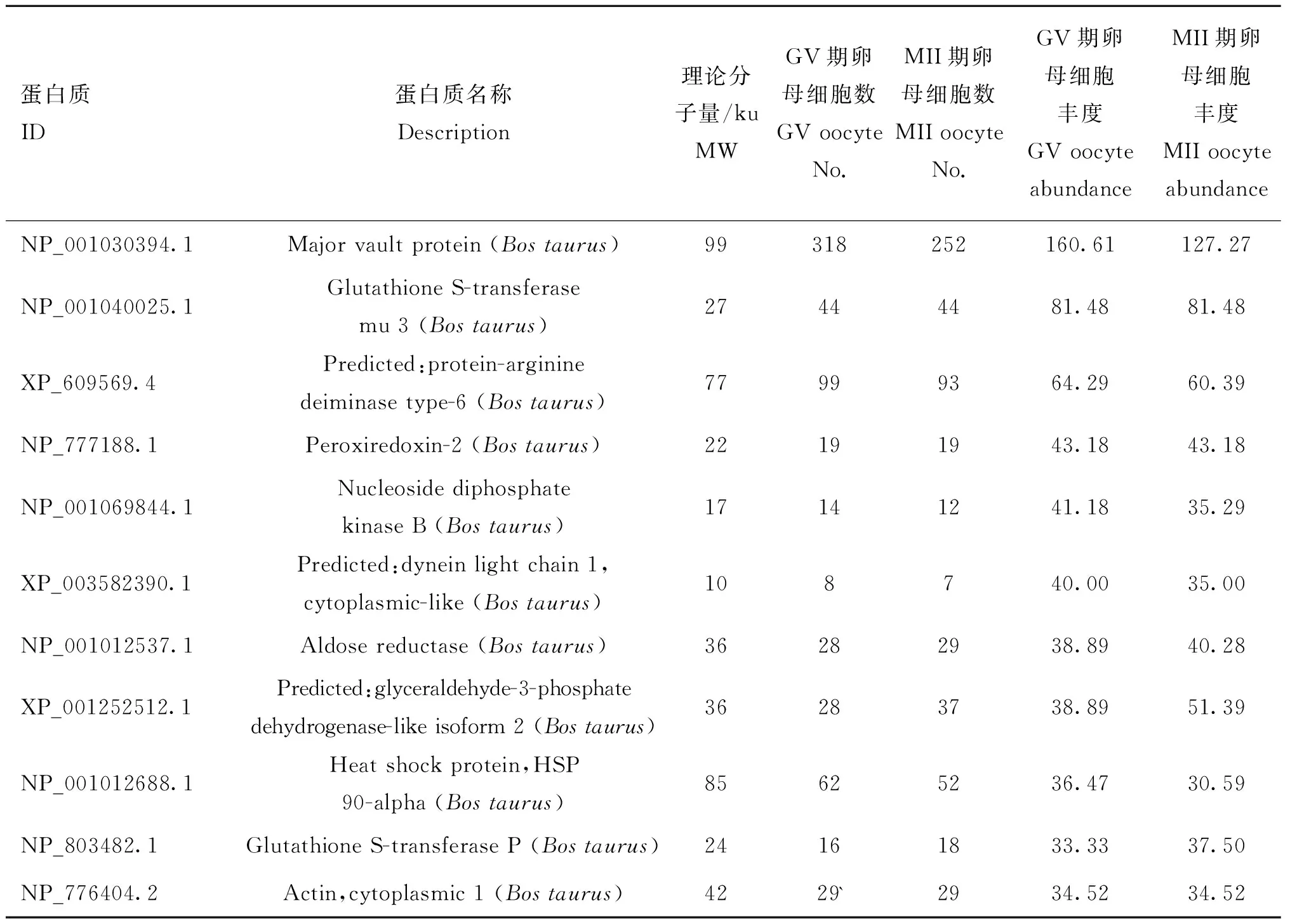
蛋白质ID蛋白质名称Description理论分子量/kuMWGV期卵母细胞数GVoocyteNo.MII期卵母细胞数MIIoocyteNo.GV期卵母细胞丰度GVoocyteabundanceMII期卵母细胞丰度MIIoocyteabundanceNP_001030394.1Majorvaultprotein(Bostaurus)99318252160.61127.27NP_001040025.1GlutathioneS-transferasemu3(Bostaurus)27444481.4881.48XP_609569.4Predicted:protein-argininedeiminasetype-6(Bostaurus)77999364.2960.39NP_777188.1Peroxiredoxin-2(Bostaurus)22191943.1843.18NP_001069844.1NucleosidediphosphatekinaseB(Bostaurus)17141241.1835.29XP_003582390.1Predicted:dyneinlightchain1,cytoplasmic-like(Bostaurus)108740.0035.00NP_001012537.1Aldosereductase(Bostaurus)36282938.8940.28XP_001252512.1Predicted:glyceraldehyde-3-phosphatedehydrogenase-likeisoform2(Bostaurus)36283738.8951.39NP_001012688.1Heatshockprotein,HSP90-alpha(Bostaurus)85625236.4730.59NP_803482.1GlutathioneS-transferaseP(Bostaurus)24161833.3337.50NP_776404.2Actin,cytoplasmic1(Bostaurus)4229`2934.5234.52
HSP90α属于热休克蛋白家族,作为一种分子伴侣,参与蛋白质的折叠、组装和转运等过程,具有应激保护作用[26]。小鼠中,HSP90α受热休克因子蛋白1(HSF1)调控,在卵母细胞减数分裂过程中起重要作用[27]。敲除HSF1导致卵母细胞中HSP90α表达受到抑制,卵母细胞生长表现生发泡破裂(GVBD)延迟,MI(Metaphase I)期部分受阻以及不对称分裂缺陷[28]。本研究中,HSP90α是GV期水牛卵母细胞中唯一特有的高丰度蛋白,表明该蛋白在GV期生长过程中可能扮演重要角色。
过氧化物酶(Peroxiredoxin,PRDXs)和谷胱甘肽转移酶(GSTs)在卵母细胞中均为中高丰度表达的抗氧化蛋白,参与细胞内氧化还原调控、抗氧化应激和细胞内信号转导[29]。PRDX2是过氧化物酶家族的一员,主要定位于细胞质,发挥保护蛋白和脂质抗氧化损伤和抗凋亡功能,参与细胞分化与增殖[28]。研究发现,成熟前后的牛卵母细胞和早期胚胎中均可检测到PRDX2的表达[30]。小鼠中,PRDX2在GV期和MII期卵母细胞中均高水平表达,MII期后表达水平开始下降。此外,研究表明PRDX2可能通过NFKB和IKB的作用在保护卵丘细胞免受活性氧簇(ROS)损伤过程中发挥重要作用[31]。GSTM3和GSTP1均属于GSTs家族,具有较强的抗氧化应激的功能,在保护机体免受致癌性化学物质的损坏中发挥重要作用,它们可以解除许多致癌剂的活性代谢物的毒性[28]。林雍峰等[28]报道显示,GSTM3在绵羊卵母细胞中高丰度表达,并且在成熟过程中表达量明显增加。表明GSTM3可能在绵羊卵母细胞成熟过程中发挥抗氧化和解毒作用。本研究中,PRDX2、PRDX2和GSTP1等这些抗氧化蛋白在成熟前后的水牛卵母细胞中具有较高的表达丰度,表明在水牛卵母细胞成熟过程中的抗氧化应激作用可能主要由这些蛋白来承担。
4 结 论
本研究应用一维SDS-PAGE结合LC-MS/MS的蛋白质组学方法筛选到在GV期和MII期水牛卵母细胞中高丰度表达的蛋白,这些蛋白主要参与抗氧化应激、转运等过程,提示这些蛋白在水牛卵母细胞体外成熟过程中可能起关键作用。通过生物信息学分析发现,水牛卵母细胞从GV~MII期过程中有很多蛋白参与能量代谢的过程,表明维持高的能量代谢水平是卵母细胞减数分裂成熟完成的保证。能量代谢可能在水牛卵母细胞过程中发挥重要作用。GV期水牛卵母细胞可能具有高的氧化磷酸化和蛋白合成水平,蛋白酶体在推动水牛卵母细胞生长进程中可能发挥重要作用。MII期水牛卵母细胞可能具有高的DNA复制水平,提示卵母细胞可能在为随后的受精过程和早期卵裂进行遗传物质准备。
[1]KRISHER R L.The effect of oocyte quality on development[J].JAnimSci,2004,82:E14-E23.
[2]DOMINKO T,FIRST N L.Timing of meiotic progression in bovine oocytes and its effect on early embryo development[J].MolReprodDev,1997,47(4):456-467.
[3]PAN H,O'BRIEN M J,WIGGLESWORTH K,et al.Transcript profiling during mouse oocyte development and the effect of gonadotropin priming and developmentinvitro[J].DevBiol,2005,286(2):493-506.
[4]HAMATANI T,CARTER M G,SHAROV A A,et al.Dynamics of global gene expression changes during mouse preimplantation development[J].DevCell,2004,6(1):117-131.
[5]PACZKOWSKI M,YUAN Y,FLEMING-WADDELL J,et al.Alterations in the transcriptome of porcine oocytes derived from prepubertal and cyclic females is associated with developmental potential[J].JAnimSci,2011,89(11):3561-3571.
[6]DALBI S-TRAN R,MERMILLOD P.Use of heterologous complementary DNA array screening to analyze bovine oocyte transcriptome and its evolution duringinvitromaturation[J].BiolReprod,2003,68(1):252-261.
[7]KATZ-JAFFE M,MCCALLIE B,PREIS K,et al.Transcriptome analysis ofinvivoandinvitromatured bovine MII oocytes[J].Theriogenology,2009,71(6):939-946.
[8]RICHTER J D.Translational control during early development[J].Bioessays,1991,13(4):179-183.
[9]陈凌声,徐平,石德顺,等.哺乳动物卵母细胞及早期胚胎蛋白质组学研究进展[J].生物工程学报,2014,30(7):1018-1025.
CHEN L S,XU P,SHI D S,et al.Progress in porteomics of mammalian oocyte and early embryo[J].ChineseJournalofBiotechnology,2014,30(7):1018-1025.(in Chinese)
[10]VITALE A M,CALVERT M E,MALLAVARAPU M,et al.Proteomic profiling of murine oocyte maturation[J].MolReprodDev,2007,74(5):608-616.
[11]MA M,GUO X,WANG F,et al.Protein expression profile of the mouse metaphase-II oocyte[J].JProteomeRes,2008,7(11):4821-4830.
[12]ELLEDEROVA Z,HALADA P,MAN P,et al.Protein patterns of pig oocytes duringinvitromaturation[J].BiolReprod,2004,71(5):1533-1539.
[13]DEUTSCH D R,FROÖHLICH T,OTTE K A,et al.Stage-specific proteome signatures in early bovine embryo development[J].JProteomeRes,2014,13(10):4363-4376.
[14]刘振方.水牛卵母细胞及卵泡液蛋白质组的初步研究[D].南宁:广西大学,2012.
LIU Z F.Preliminary studies on the proteomics of buffalo oocytes and follicular fluid[D].Nanning:Guangxi University,2012.(in Chinese)
[15]陈富美,付强,王焕景,等.利用TMT标记结合2DLC-MS/MS技术对水牛卵母细胞体外成熟前后差异蛋白质组的分析[J].基因组学与应用生物学,2015,4(9):1880-1886.
CHEN F M,FU Q,WANG H J,et al.Comparative analysis of proteomics by TMT-coupled 2D LC-MS/MS at buffalo oocytes before and after maturationinvitro[J].GenomicsandAppliedBiology,2015,4(9):1880-1886.(in Chinese)
[16]常乘,朱云平.基于质谱的定量蛋白质组学策略和方法研究进展[J].中国科学:生命科学,2015,45(5):425-438.
CHANG C,ZHU Y P.Strategies and algorithmas for quantitative proteomics based on mass spectrometry[J].ScienceinChina(SeriesC),2015,45(5):425-438.(in Chinese)
[17]孙洪亮,Scriptaid对水牛体细胞克隆效率的影响及其相关分子机理的研究[D].南宁:广西大学,2014.
SUN H L.Studies related to effects of scriptaid on buffalo somiatic cell cloning efficiency and its molucular mechanisms[D].Nanning:Guangxi University,2014.(in Chinese)
[18]ZHANG J,DAI J,ZHAO E,et al.cDNA cloning,gene organization and expression analysis of human peptidylarginine deiminase type VI[J].ActaBiochimPol,2004,51(4):1051-1058.
[19]CAO S,GUO X,ZHOU Z,et al.Comparative proteomic analysis of proteins involved in oocyte meiotic maturation in mice[J].MolReprodDev,2012,79(6):413-422.
[20]YURTTAS P,VITALE A M,FITZHENRY R J,et al.Role for PADI6 and the cytoplasmic lattices in ribosomal storage in oocytes and translational control in the early mouse embryo[J].Development,2008,135(15):2627-2636.
[21]YURTTAS P,MORENCY E,COONROD S A.Use of proteomics to identify highly abundant maternal factors that drive the egg-to-embryo transition[J].Reproduction,2010,139(5):809-823.
[22]WANG S F,KOU Z H,JING Z Y,et al.Proteome of mouse oocytes at different developmental stages[J].PNatlAcadSciUSA,2010,107(41):17639-17644.
[23]KING S M.The dynein microtubule motor[J].BBA-MolCellRes,2000,1496(1):60-75.
[24]RACEDO S E,WRENZYCKI C,HERRMANN D,et al.Effects of follicle size and stages of maturation on mRNA expression in bovineinvitromatured oocytes[J].MolReprodDev,2008,75(1):17-25.
[25]GHANEM OSMAN MOHAMED N.Molecular genetic analysis of bovine oocytes with different developmental potentials[D].Bonn: University of Bonn,2009.
[26]NECKERS L,IVY S P.Heat shock protein 90[J].CurrOpinOncol,2003,15(6):419-424.
[27]METCHAT A,ÅKERFELT M,BIERKAMP C,et al.Mammalian heat shock factor 1 is essential for oocyte meiosis and directly regulates Hsp90α expression[J].JBiolChem,2009,284(14):9521-9528.
[28]林雍峰.绵羊卵母细胞差异蛋白质组学研究[D].兰州:甘肃农业大学,2011.
LIN Y F.Comparative proteomics analysis of mature and immatrue ovine oocyts[D].Lanzhou:Gansu Agriculture University,2011.(in Chinese)
[29]KIM J,KIM J S,JEON Y J,et al.Identification of maturation and protein synthesis related proteins from porcine oocytes duringinvitromaturation[J].ProteomeSci,2011,9(1):1-12.
[30]LEYENS G,KNOOPS B,DONNAY I.Expression of peroxiredoxins in bovine oocytes and embryos producedinvitro[J].MolReprodDev,2004,69(3):243-251.
[31]YANG S,LUO A,HAO X,et al.Peroxiredoxin 2 inhibits granulosa cell apoptosis during follicle atresia through the NFKB pathway in mice[J].BiolReprod,2011,84(6):1182-1189.
(编辑程金华)
Proteomics Analysis of Immature and Mature Buffalo Oocytes
CHEN Ling-sheng1,2,DAI Xiao-li1,XU Yong-ru1,2,LUO Chan1,LU Feng-hua1,JIANG Jian-rong1,SHI De-shun1,XU Ping2,LI Xiang-ping1*
(1.StateKeyLaboratoryforConservationandUtilizationofSubtropicalAgro-Bioresources,GuangxiUniversity,Nanning530005,China;2.BeijingInstituteofRadiationMedicine,AcademyofMilitaryMedicalSciences,NationalCenterforProteinSciences(Beijing),BeijingProteomeResearchCenter,StateKeyLaboratoryofProteomics,Beijing102206,China)
To reveal the molecular mechanism underlyinginvitromaturation of the buffalo oocyte and select the proteins associated with the oocyte maturation quality,sodium dodecyl sulfate polyacrylamide gel electrophoresis coupled to reverse-phase liquid chromatography tandem mass spectrometry (RP-LC-MS/MS) proteomics technology were applied to identify the buffalo oocyte proteome at germinal vesicle (GV) stage and metaphase II (MII) stages.In total,647 and 570 proteins (FDR<1%) were identified from GV and MII stage buffalo oocytes,respectively.Among them,414 proteins were common identified,233 and 156 proteins were uniquely identified,respectively.The semi-quantitative information of the identified proteins was obtained using spectral counting method.Nine high abundance proteins were identified from GV and MII stage buffalo oocytes,eight of which were common proteins,including MVP,GATM3,PADI6,PRDX2,NE2,DYNLL1,AKR1B1 and LOC786101.HSP90α and GSTP1 were unique high abundance proteins identified in GV and MII stage buffalo oocytes,respectively.It indicated that they might be closely related to buffalo oocyte maturation.Results of GO (Gene Ontology) and KEGG analysis showed that these common identified proteins involved in metabolism pathways,such as pyruvate metabolism,glycolysis,tricarboxylic acid cycle (TCA),and pentose phosphate pathway,etc,which suggested that high metabolism level was needed to complete meiotic maturation in buffalo oocytes.Proteins involved in oxidative phosphorylation,ribosome,and proteasome pathway were uniquely identified in GV stage oocytes,indicating that high level of oxidative phosphorylation and protein synthesis might exist in GV stage oocyte,and the proteasome pathway might be essential for the maturation progression of buffalo oocytes.Proteins involved in DNA replication,amino sugar and nucleotide sugar metabolism pathway were uniquely identified in MII stage oocytes,demonstrating that the oocytes might need to prepare genetic material for the fertilization and early cleavage divisions.Overall,above results revealed the protein expression profile of buffalo oocytes before and after maturation,they are useful to understand the molecular mechanisms underlying buffalo oocyte maturation.
buffalo;invitromaturation;oocyte;proteome
10.11843/j.issn.0366-6964.2016.10.008
2016-04-07
广西自然科学基金项目(2012GXNSFCB053002;2014GXNSFAA118099;2014GXNSFAA118084);国家自然科学基金项目(31560632)
陈凌声(1983-),女,广西北海人,博士,主要从事哺乳动物卵母细胞/胚胎蛋白质组学研究,E-mail:chenlingsheng2016@163.com,Tel:0771-3239202
李湘萍,研究员,E-mail:xiangpingli@163.com
S823.8+3.3
A
0366-6964(2016)10-2003-09
