TC1和β⁃catenin在舌鳞状细胞癌中的表达及意义
2016-09-05白琳琳陈松岩张秀鹏徐洪涛王恩华
白琳琳,张 黎,陈松岩,张秀鹏,徐洪涛,王恩华
(1.中国医科大学基础医学院病理学教研室,沈阳110001;2.沈阳二四二医院病理科,沈阳110034)
TC1和β⁃catenin在舌鳞状细胞癌中的表达及意义
白琳琳1,2,张黎1,陈松岩1,张秀鹏1,徐洪涛1,王恩华1
(1.中国医科大学基础医学院病理学教研室,沈阳110001;2.沈阳二四二医院病理科,沈阳110034)
目的探讨甲状腺癌1(TC1)与β-catenin在舌鳞状细胞癌(OTSCC)组织中的表达及相关性,并分析其与临床病理因素的相关性.方法应用免疫组织化学的方法检测TC1、β-catenin在100例OTSCC中的表达.应用χ2检验、Fisher确切概率法、似然比检验和Spearman相关检验分析β-catenin与TC1表达水平的相关性,以及与OTSCC临床病理因素的相关性.结果TC1在所有的OTSCC病例中均有不同程度的表达,而在正常舌部鳞状上皮组织中呈阴性或弱阳性表达.TC1的高表达与OTSCC的低分化程度(P=0.040)和高TNM分期(P<0.001)相关,并与β-catenin的表达相关(r=0.368,P<0.001).β-catenin的异常表达与OTSCC的低分化(P=0.023)相关.结论OTSCC普遍存在TC1的高表达.TC1的表达与β-catenin的表达及OTSCC的恶性进展呈正相关.高水平的TC1表达可能通过增强Wnt信号通路的活性促进OTSCC的进展.
甲状腺癌1;C8Orf4;β-catenin;舌鳞状细胞癌
网络出版地址
甲状腺癌1(thyroid cancer 1,TC1,C8Ofr4)是近年新发现的含106个氨基酸的蛋白质,最初通过乳头状甲状腺癌及其周围正常甲状腺组织之间的消减杂交克隆获得[1].研究显示,TC1参与多种恶性肿瘤的发展,如甲状腺癌[1]、胃癌[2]、乳腺癌[3]、肺癌[4]和卵巢癌[5].TC1的促肿瘤作用可能与其能够上调β-catenin的转录激活作用及活化Wnt/β-catenin信号传导通路的靶基因转录有关.但TC1在口腔鳞癌中的表达机制和临床病理意义还不清楚.因此,本研究检测了TC1和β-catenin在口腔舌鳞状细胞癌(ora1 tongue squamous ce11 carcinoma,OTSCC)中的表达情况,旨在探讨TC1与β-catenin的关系及二者与OTSCC临床病理因素的相关性.
1 材料与方法
1.1研究对象
随机选取2007-2013年间在中国医科大学附属第一医院接受手术患者的OTSCC标本100例.年龄35~80岁,中位年龄56岁.男56例,女44例.根据世界卫生组织的分类系统(2005),通过显微镜观察HE染色的切片确定组织学诊断和分级.其中,高分化74例,中分化16例,低分化10例,有淋巴结转移9例.根据国际抗癌联盟的TNM分期系统,Ⅰ期41例,Ⅱ期46例,Ⅲ期13例.
1.2免疫组织化学染色
切除的组织标本均经10%中性甲醛固定24 h,石蜡包埋,4 μm厚连续切片,脱蜡,脱水,pH6柠檬酸缓冲液中高压抗原修复1.5 min.滴加1∶200稀释的兔抗TC1多克隆抗体(ab133885,Abcam公司)、鼠抗β-catenin单克隆抗体(610154;BD生物技术公司),4℃孵育过夜.采用免疫组织化学SP法检测抗体.以PBS代替一抗作阴性对照.
免疫组化染色评估:所有切片由2位病理医师在不了解病例资料的情况下进行盲法阅片和评分.每张切片随机选取5个高倍视野(X400),每个视野计数100个肿瘤细胞.TC1、β-catenin主要在OTSCC的细胞质中表达,染色强度阴性、弱阳性、中等阳性和强阳性分别记为0、1、2和3分.同时,计算每例阳性染色细胞的百分比.百分比<25%、25%~ <50%、50%~<75%和≥75%分别记为1、2、3和4分.将2个分值相乘,根据最终得分,将0、≤6、≥8者分别评为阴性、低表达、高表达.
1.3统计学分析
采用χ2检验、Fisher确切概率法和似然比检验β-catenin、TC1与OTSCC临床病理因素的相关性;采用Spearman相关分析检验β-catenin与TC1表达水平的相关性.P<0.05为差异有统计学意义.
2 结果
2.1TC1的表达与OTSCC的低分化程度和高TNM分期相关
在100例OTSCC中均可观察到细胞质中TC1的表达.TC1在79例中呈高表达(79/100,79.0%),但在舌部的正常鳞状上皮组织中却是弱阳性或阴性表达(图1).TC1的高表达与OTSCC的低分化程度(P=0.040)和高TNM分期(P<0.001)相关.但TC1的表达与患者的性别(P=0.268)、年龄(P=0.057)和淋巴转移状态(P=0.198)不相关(表1).

图1 TC1在OTSCC组织中的表达SPX200Fig.1The expression of TC1 in OTSCC SPX200
2.2β-catenin的表达与OTSCC的低分化相关
在舌部的正常鳞状上皮组织中,β-catenin在细胞膜上呈高表达,但在大多数OTSCC中,β-catenin的细胞膜表达为弱阳性或阴性.β-catenin在62例OTSCC的细胞质中异常表达,在其他38例OTSCC中呈阴性表达(图2).β-catenin的细胞质表达与OTSCC的低分化相关(P=0.023),与患者的性别(P=0.166)、年龄(P=0.556)、TNM分期(P=0.058)和淋巴转移状态(P=0.331)无相关性(表1).
2.3TC1的高表达与β-catenin的异常表达相关
进一步研究OTSCC中TC1的表达与β-catenin之间的相关性,结果发现:β-catenin细胞质表达的病例中有90.32%(56/62)同时显示了TC1高表达;而βcatenin细胞质高表达的病例中仅有1例为TC1低表达.统计结果表明,TC1与β-catenin能够协同表达,二者呈显著正相关(r=0.368,P<0.001)(表2).
3 讨论
Wnt/β-catenin信号通路在包括口腔组织在内的多种细胞和组织的发生、增生、再生和分化中起重要作用[6].Wnt/β-catenin信号通路激活的关键是βcatenin在细胞核内的蓄积和转录激活.β-catenin的异常表达可见于多种肿瘤,如肝癌、结肠癌、肺癌等,与肿瘤的发生和进展密切相关[7~11].本研究结果也证实OTSCC组织中存在β-catenin的蓄积,并发现β-catenin的异常蓄积与OTSCC的低分化程度相关.表明Wnt/β-catenin信号通路的激活与口腔癌的发生和发展密切相关[6,12,13].

图2 β⁃catenin在OTSCC组织中的表达SPX 200Fig.2 The expression of β⁃catenin in OTSCC SPX 200
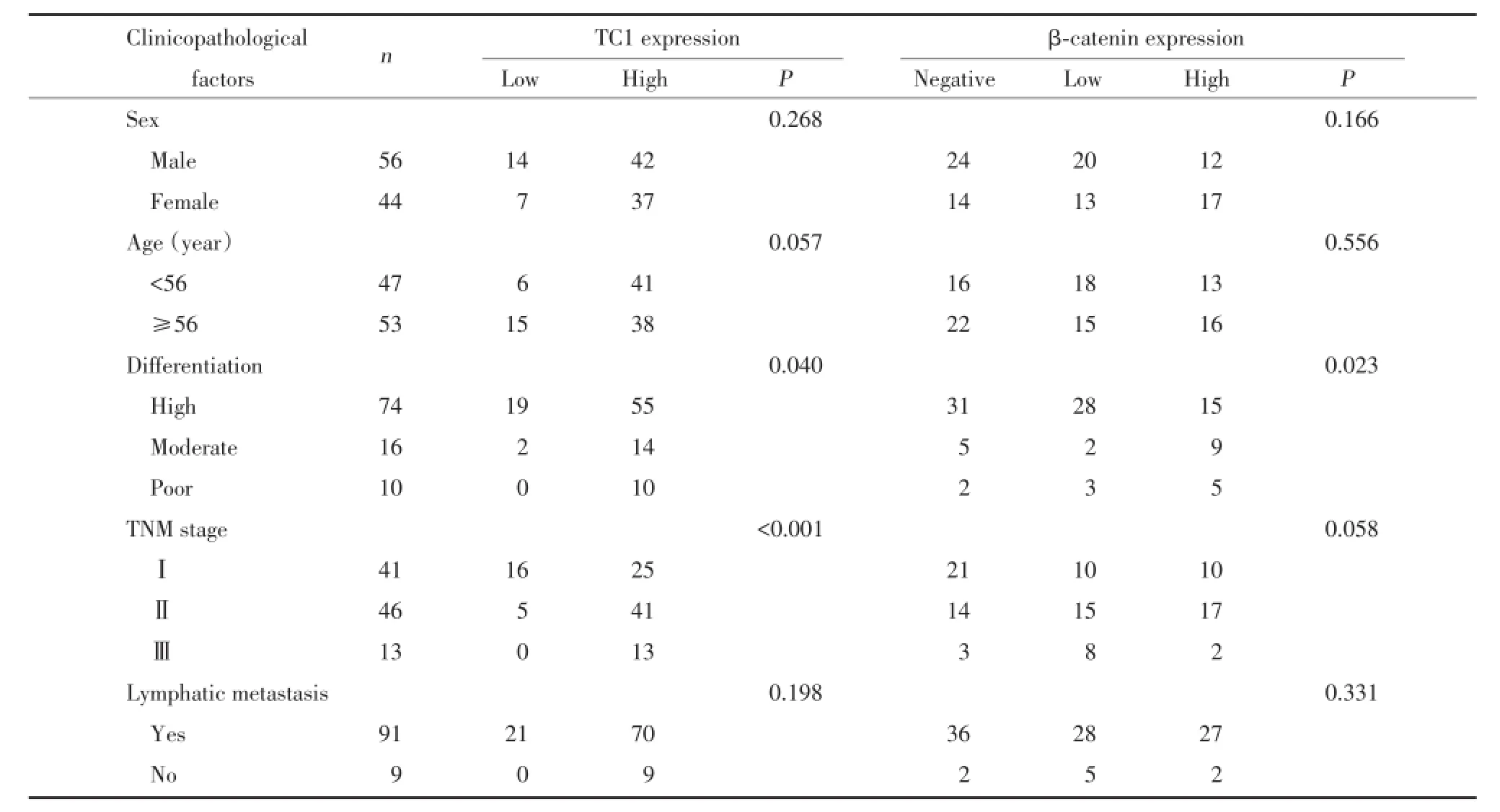
表1 TC1和β⁃catenin在OTSCC中的表达Tab.1 The expressions o f TC1 and β⁃catenin in OTSCC

表2 OTSCC中TC⁃1与β⁃catenin表达的相关性Tab.2 The correlation be tween the exp ression o f TC1 and β⁃catenin in OTSCC
TC1是新发现的Wnt/β-catenin信号通路的调控因子.TC1可以竞争性地解除Chibby对β-catenin的抑制作用,上调β-catenin的转录激活作用,促进Wnt靶基因的表达[4].TC1的异常表达可见于甲状腺癌[1]、胃癌[2]、乳腺癌[3]、肺癌[4]以及卵巢癌[5]等许多肿瘤中,在肿瘤的发生和发展中发挥着重要作用.目前,许多口腔鳞癌的研究焦点都集中于β-catenin的异常蓄积方面[13],而TC1在口腔鳞癌中的表达和功能尚不清楚.本研究检测了TC1在OTSCC中的表达情况,发现TC1的高表达与OTSCC的低分化和高TNM分期有关.表明TC1的表达在OTSCC的恶性转化和进展过程中都发挥了重要作用.进一步研究发现,OTSCC中TC1的高表达与β-catenin的异常细胞质蓄积呈正相关,即TC1与β-catenin在OTSCC中能够协同表达.提示TC1可通过上调βcatenin的转录活性激活Wnt信号通路的靶基因转录,从而促进OTSCC的进展.
综上所述,TC1的高表达是OTSCC的普遍现象.TC1的高表达与β-catenin的表达和OTSCC的恶性进展呈正相关.TC1的高表达可能通过增强Wnt信号通路的活性来促进OTSCC的进展.深入研究TC1在口腔鳞癌中发挥的作用和分子机制将有助于阐明口腔鳞癌的发生和进展机制,并为临床基因靶向治疗提供潜在靶点和理论基础.
[1]Sunde M,McGrath KC,Young L,et a1.TC-1 is a nove1 tumorigenic and native1y disordered protein associated with thyroid cancer[J]. Cancer Res,2004,64(8):2766-2773.
[2]Kim B,Koo H,Yang S,et a1.TC1(C8orf4)corre1ates with Wnt/betacatenin target genes and aggressive bio1ogica1 behavior in gastric cancer[J].C1in Cancer Res,2006,12(11 Pt 1):3541-3548.
[3]Yang ZQ,Moffa AB,Haddad R,et a1.Transforming properties of TC-1 in human breast cancer:interaction with FGFR2 and beta-catenin signa1ing pathways[J].Int J Cancer,2007,121(6):1265-1273.
[4]Su K,Huang L,Li W,et a1.TC-1(c8orf4)enhances aggressive bio-1ogic behavior in 1ung cancer through the Wnt/β-catenin pathway [J].J Surg Res,2013,185(1):255-263.DOI:10.1016/j. jss.2013.05.075.
[5]Xu HT,Liu Y,Liu SL,et a1.TC-1(C8orf4)expression is corre1ated with differentiation in ovarian carcinomas and might distinguish metastatic ovarian from metastatic co1orecta1 carcinomas[J].Virchows Arch,2013,462(3):281-287.DOI:10.1007/s00428-013-1375-7.
[6]Liu F,Mi11ar SE.Wnt/beta-catenin signa1ing in ora1 tissue deve1opment and disease[J].J Dent Res,2010,89(4):318-330.DOI: 10.1177/0022034510363373.
[7]Pez F,Lopez A,Kim M,et a1.Wnt signa1ing and hepatocarcinogenesis:mo1ecu1ar targets for the deve1opment of innovative anticancer drugs[J].J Hepato1,2013,59(5):1107-1117.DOI:10.1016/j. jhep.2013.07.001.
[8]Krausova M,Korinek V.Wnt signa1ing in adu1t intestina1 stem ce11s and cancer[J].Ce11 Signa1,2014,26(3):570-579.DOI:10.1016/j. ce11sig.2013.11.032.
[9]Xi Y,Chen Y.Wnt signa1ing pathway:imp1ications for therapy in 1ung cancer and bone metastasis[J].Cancer Lett,2014,353(1): 8-16.DOI:10.1016/j.can1et.2014.07.010.
[10]Xie XM,Zhang ZY,Yang LH,et a1.Aberrant hypermethy1ation and reduced expression of disab1ed-2 promote the deve1opment of 1ung cancers[J].Int J Onco1,2013,43(5):1636-1642.DOI: 10.3892/ijo.2013.2084.
[11]Xu HT,Xie XM,Li QC,et a1.Atona1 homo1og 1 expression in 1ung cancer corre1ates with inhibitors of the Wnt pathway as we11 as the differentiation and primary tumor stage[J].APMIS,2013,121(2): 111-119.DOI:10.1111/j.1600-0463.2012.02946.x.
[12]Noguti J,DE Moura CF,Hossaka TA,et a1.The ro1e of canonica1 WNT signa1ing pathway in ora1 carcinogenesis:a comprehensive review[J].Anticancer Res,2012,32(3):873-878.
[13]Gonzá1ez-Mo1es MA,Ruiz-Ávi1a I,Gi1-Montoya JA,et a1.βcatenin in ora1 cancer:an update on current know1edge[J].Ora1 Onco1,2014,50(9):818-824.DOI:10.1016/j.ora1onco1ogy.2014.06.005.
(编辑王又冬)
Expressionsof TC1andβ-catenin in Oral Tongue Squamous Cell Carcinomasand Their Significance
BAILin-1in1,2,ZHANGLi1,CHENSong-yan1,ZHANGXiu-peng1,XUHong-tao1,WANGEn-hua1
(1.Department of Patho1ogy,Co11ege of Basic Medica1 Sciences,China Medica1 University,Shenyang 110001,China;2.Department of Patho1ogy,Hospita1 of Shenyang242,Shenyang110034,China)
Objective To examine the expressions and corre1ations of TC1 and β-catenin in ora1 tongue squamous ce11 carcinomas(OTSCCs), and their re1ationships with the c1inic patho1ogica1 parameters of OTSCCs.M ethods The expressions of TC1 and β-catenin were examined in 100 cases of OTSCCs using immunohistochemistry.Results The expression of TC1 was observed in a11 cases of OTSCCs,but was negative or weak in norma1 squamous epithe1ia1 tissues of tongue.The high expression of TC1 was corre1ated with the poor differentiation(P=0.040)and advanced TNM stage(P<0.001).The expression of TC1 was corre1ated with the abnorma1 expression of β-catenin(corre1ation coefficient=0.368,P< 0.001).The abnorma1 expression of β-catenin was corre1ated with the poor differentiation(P=0.023)in OTSCCs.Conclusion The high expression of TC1 was common in OTSCCs,and positive1y corre1ated with the expression of β-catenin and the progression of OTSCCs.The high 1eve1 of TC1mightpromotetheprogressionofOTSCCsbyenhancing theactivityofWntsigna1ingpathway.
thyroid cancer 1;C80Of4;β-catenin;ora1 tongue squamous ce11 carcinomas
R361
A
0258-4646(2016)03-0193-04
10.12007/j.issn.0258-4646.2016.03.001
国家自然科学基金(81372497);辽宁省高等学校优秀人才支持计划(LR2015067)
白琳琳(1986-),女,医师,本科.
徐洪涛,E-mai1:htxu77@163.com
2015-10-08
网络出版时间:
