结缔组织生长因子对类风湿关节炎成纤维样滑膜细胞增殖的影响
2016-09-05段宏梅吴春玲刘海娜肖卫国
丁 爽,方 芳,段宏梅,吴春玲,刘海娜,肖卫国
(中国医科大学附属第一医院风湿免疫科,沈阳110001)
结缔组织生长因子对类风湿关节炎成纤维样滑膜细胞增殖的影响
丁爽,方芳,段宏梅,吴春玲,刘海娜,肖卫国
(中国医科大学附属第一医院风湿免疫科,沈阳110001)
目的观察结缔组织生长因子(CTGF)对体外培养的类风湿关节炎成纤维样滑膜细胞(FLS)增殖的影响,探索CTGF在类风湿关节炎滑膜病变中的可能作用机制.方法体外培养FLS并用免疫组化法鉴定.加入不同浓度的外源性CTGF[0 ng/ mL(对照组),5,10,25,50 ng/mL],用3H-TdR掺入法检测对FLS增殖的影响.特异性细胞信号通路阻断剂预处理后,探讨CTGF对FLS作用的可能机制.结果体外培养FLS,经光镜观察及免疫组化鉴定符合成纤维样滑膜细胞特征.CTGF 10,25,50 ng/ mL组细胞增殖随CTGF浓度上升而增加,且与对照组比较差异具有统计学意义(P<0.01);但CTGF 25 ng/mL组与50 ng/mL组间差异无统计学意义(P>0.05).特异性的信号通路阻断剂分别阻断NF-κB信号通路、PI-3激酶信号通路、p38 MAPK信号通路和ERK-1/2信号通路,只有PD98059组FLS增殖较CTGF 25 ng/mL组有明显差异(P<0.05).结论外源性CTGF可以促进体外培养的FLS增殖,并且在一定浓度范围内呈现浓度依赖性.这种促进增殖的作用很可能是通过活化ERK-1/2信号通路完成的.
结缔组织生长因子;成纤维样滑膜细胞;增殖
网络出版地址
类风湿关节炎(rheujnatoid arthritis,RA)是一种常见的以关节滑膜慢性炎性病变为主要表现的自身免疫性疾病,其病理特征主要表现为滑膜组织异常增生、炎性细胞浸润、新生微血管形成.研究[1]表明,RA患者滑膜衬里层有4~10层细胞,是正常人关节滑膜衬里层细胞的4~5倍,滑膜细胞的异常增生形成了类似肿瘤样结构的血管翳,侵蚀软骨与骨,最终导致了关节破坏.目前认为滑膜细胞增生与滑膜细胞的增殖、凋亡失衡有关,其中成纤维样滑膜细胞(fibrob1ast-1ike synoviocytes,FLS)被认为是引起滑膜增生的主要细胞.FLS分泌高水平促炎性细胞因子、化学趋化因子、基质蛋白降解酶等,持续刺激滑膜细胞,作用于滑膜信号转导途径的不同部位,引起细胞内蛋白激酶的持续激活,导致滑膜信号转导异常以及滑膜细胞的增殖与凋亡失衡[2],引起关节的炎症和破坏.
在病理情况下,结缔组织生长因子(connectivetissue growth factor,CTGF)特异性地在间充质来源的细胞中高表达,参与多种增生性或纤维化性疾病的发生、发展.有研究表明它具有促进细胞增殖[3],促进胶原合成、调节细胞外基质基因的表达[3],促进细胞表型转化等生物学效应[4].
本研究在对外源性CTGF刺激FLS增殖进行观察的同时,以特异性信号分子阻断剂作为干预手段,探讨CTGF促FLS增殖的信号转导机制,为进一步揭示CTGF在RA滑膜病变时中的作用机制提供实验依据.
1 材料与方法
1.1组织标本与试剂
组织标本取材于中国医科大学附属第一医院骨科,经关节镜滑膜切除术后的3例RA患者滑膜组织,患者的诊断均符合1987年美国风湿病学会(ARA)修订的RA的诊断标准.所有标本取得均获得受试者知情同意.试剂主要包括:重组人CTGF (rhCTGF,PeProtechEC公司),3H-胸腺嘧啶核苷(3HTdR,中国原子能科学研究院),胎牛血清(FCS)、DEME(高糖)培养基(Hye1one公司),胰蛋白酶、胶原酶Ⅲ、EDTA(Difco公司),SABC免疫组化试剂盒(武汉博士德生物工程公司),DAB显色试剂盒(武汉博士德生物工程公司),PDTC、LY294002、SB203580、PD98059(碧云天生物技术研究所).
1.2方法
1.2.1RA FLS分离和培养:无菌获取滑膜组织,尽量剔除脂肪及纤维组织,磷酸盐缓冲液(PBS)冲洗2~3遍,去除血污,反复剪切成约1 mmX1 mmX1 mm的细小组织块,置于无菌培养皿中,加入胶原酶Ⅲ(2 mg/mL)37℃消化2~4 h,200目纱网过滤后,离心,去除脂肪及杂质,加入达氏修正液(DMEM),分装于培养瓶内,置于37℃5%CO2孵箱内培养24 h后更换培养液,待滑膜细胞80%汇合成片,消化传代,实验用3~7代细胞.
1.2.2FLS鉴别:将细胞悬液加入24孔板内(孔内预先置直径10 mm的圆玻片),密度为2X104/mL,培养箱中培养48 h,弃上清,甲醇-20℃固定15 min.洗涤圆玻片,待干燥后用于免疫组织化学.滴加一抗鼠抗人Vimentin单克隆抗体及鼠抗人CD68单克隆抗体,置湿盒内4℃孵育过夜,并设空白对照组(无一抗,加PBS).PBS振洗3 minX3次,滴加生物素羊抗鼠IgG,37℃孵育20 min,PBS振洗3 minX3次,滴加SP,37℃孵育20 min,PBS振洗3 minX3次,DAB显色,苏木素复染,明胶甘油封片剂封片,倒置显微镜下观察照相.
1.2.3FLS增殖实验:3H-TdR掺人法测定DNA合成.传代细胞以2X103/孔接种于96孔板,每孔加200 μL含10%FBS的DMEM培养液,37℃、5%CO2培养箱孵育12 h后弃培养基,用含rhCTGF终浓度分别为0 ng/mL(对照组),5,10,25,50 ng/mL的10% FBS-DMEM继续培养24 h,将3H-TdR(1 μCi/孔)加入培养液,继续培养18 h.然后用质量浓度为2.5%的胰蛋白酶消化并转移至玻璃纤维滤纸上,依次用等渗盐水,体积分数10%的三氯醋酸、无水乙醇冲洗、固定,干燥后加闪烁液,用Beckman液体闪烁液, β计数仪检测每分钟计数(counts per minute,CPM)值.
1.2.4信号通路阻断实验:传代细胞以2X103/孔接种于96孔板,每孔加200 μL含10%FBS的DMEM培养液,37℃、5%CO2培养箱孵育12 h后弃培养基,分别加入4 μmo1/L PDTC(NF-κB信号通路阻断剂, PDTC组)、20 μmo1/L LY294002(PI-3激酶信号通路阻断剂,LY294002组)、10 μmo1/L SB203580(p38 MAPK信号通路阻断剂,SB203580组)、1 μmo1/L PD98059(ERK-1/2信号通路阻断剂,PD98059组) 30 min后,加入浓度为25 ng/mL的rhCTGF,作用24 h,3H-TdR掺人法检测细胞增殖.
1.3统计学分析
采用Graphpad prism 5.0进行作图和分析.计量资料以±s表示,2组计量资料的比较采用t检验,多组之间计量资料的比较采用one-way ANOVA法,多组之间的两两比较采用Bonferroni法.P< 0.05为差异有统计学意义.
2 结果
2.1光镜下观察RA FLS形态
光镜下观察RA FLS可见细胞形态成长梭形,排列较为不规则,符合成纤维样细胞的形态学特点.见图1、图2.
2.2RA FLS鉴定
免疫组化染色后显微镜下观察细胞,可见RA FLS胞质内抗vimentin抗体阳性,见图3.免疫组化染色后显微镜下观察细胞,可见RA FLS胞质内抗CD68抗体阴性,见图4.抗vimentin抗体阳性及抗CD68抗体阴性,符合FLS的特征.
2.3CTGF对FLS增殖的影响
结果显示,对照组,CTGF 5、10、25、50 ng/mL各浓度组3H-TdR掺入值(CPM/孔)分别为1 969.7± 62.0、2 143.7±117.9、3 630.7±351.9、5 011.0±351.6、5 510.0±738.0.CTGF10、25、50 ng/mL各组细胞增殖随CTGF浓度上升而增加,且与对照组比较差异具有统计学意义(P<0.01);但25 ng/mL与50 ng/mL CTGF组间差异无统计学意义(P>0.05).提示CTGF能够刺激FLS增殖,并且在一定浓度范围内呈现浓度依赖性.
2.4CTGF促进FLS增殖的信号传导途径
在25 ng/mL CTGF刺激FLS 24 h后(CTGF组) CPM达4 911±301.1,而对照组为2 047±247.7,2者差异具有统计学意义(P<0.01).在25 ng/m L CTGF刺激前分别加入4 μmo1/L PDTC(PDTC组)、20 μ mo1/L LY2940029(LY2940029组)、10 μ mo1/L SB203580(SB203580组),1 μ mo1/L PD98059 (PD98059)进行预处理后各组的CPM分别为4 058± 521.2、4 107±553.8、3 733±760.2、3 142±395.9.与CTGF组比较,PD98059组CPM差异具有统计学意义(P<0.05);而PDTC组、LY2940029组、SB203580组与CTGF组比较差异均无统计学意义(P>0.05),提示CTGF可能通过ERK-1/2信号通路的活化发挥促进FLS增殖的作用.
3 讨论
炎性细胞浸润、滑膜组织增生、血管翳形成,最终侵蚀软骨及软骨下骨,造成关节破坏和畸形为RA发病的主要病理特征.控制关节局部的滑膜病变已成为改变RA预后的关键环节之一.RA患者的滑膜衬里层通常有2种主要的细胞类型,分别为A型细胞(巨噬细胞样细胞)和B型细胞(成纤维样细胞),前者来自于骨髓的单核/巨噬细胞,后者主要来源于局部细胞的增殖.这些细胞不仅在数量上异常增多,而且在功能上处于异常活跃状态,它们可以表达多种黏附分子、促炎性细胞因子、趋化因子,促进炎性反应的发生和血管翳的形成[2],同时还可产生多种蛋白酶,降解细胞外基质成分和软骨蛋白多糖,导致软骨和骨组织结构破坏.因此阻止滑膜细胞的增生和活化对控制RA的发病和病情进展有重要的意义[1].
CTGF是一种富含半胱氨酸的生长调节因子,是CCN蛋白家族成员之一.近年来的研究[5,6]显示CTGF成为一种新型的炎性调节因子.Wang等[7]发现CTGF能够调节RA患者基质金属蛋白酶(matrixmeta11oproteinase,MMP)的表达.Nozawa等[8]的研究表明拮抗CTGF能够阻止大鼠胶原蛋白诱导性关节炎的发展.我们在较早的研究[9]中发现RA患者的血清CTGF水平高于健康对照组,且在病情高度活动的RA患者血清中的CTGF水平明显高于疾病中低度活动组.以上研究结果提示CTGF可能参与了RA的发生和发展.有文献[10]报道CTGF能促进体外培养的皮肤和角膜成纤维细胞的增生.
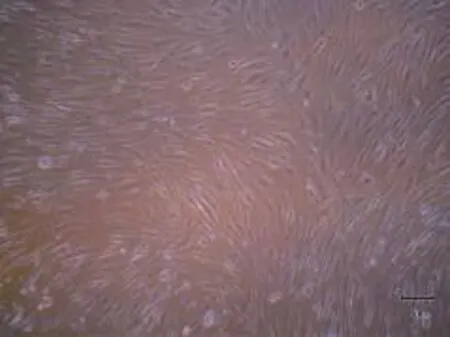
图1 光镜下观察RA FLS x100Fig.1 RA FLS observed under light m icroscope x100
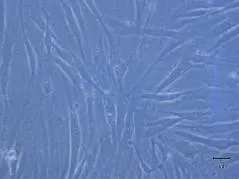
图2 光镜下观察RA FLS x200Fig.2 RA FLS observed unde r light m icroscope x200

图3 FLS胞质vim entin(+)X 400Fig.3 Vimentin staining in FLS endochylema(+)X 400

图4 FLS胞质CD68(-)X 400Fig.4 CD68 sta ining in FLS endochylema(-)X 400
我们预实验已经发现RA患者关节滑液中的CTGF浓度大约在10~40 ng/mL,因此我们选择0~50 ng/mL的浓度范围进行增殖实验.在本次研究中我们通过3H-TdR掺人实验证实了外源性CTGF对RA FLS的促增殖作用,发现5 ng/mL CTGF对FLS无明显促进增殖的作用;10、25、50 ng/mL CTGF组细胞增殖随CTGF浓度上升而增加,与对照组比较有统计学差异(P<0.05);而25 ng/m L与50 ng/mL CTGF组间比较无统计学差异(P>0.05).提示这种促增殖效应在一定范围内有剂量依赖性.
细胞内信号转导通路间存着复杂的交叉对话,细胞增殖可能与多条信号通路的活化有关.为了探讨CTGF促进FLS增殖的具体机制,笔者用特异性的信号通路阻断剂PDTC、LY294002、SB203580、PD98059分别阻断NF-κB信号通路、PI-3激酶信号通路、p38 MAPK信号通路和ERK-1/2信号通路,结果发现只有PD98059组FLS增殖较CTGF组有明显差异(P<0.05),提示CTGF很可能是通过ERK-1/2信号通路的活化发挥促进FLS增殖的作用.这与以往CTGF通过ERK1/2信号通路促进皮肤和角膜成纤维细胞、软骨细胞、血管内皮细胞及肾小球系膜细胞增殖的报道一致[10,11],提示CTGF可能具有促间充质来源细胞增殖的共性.
关于滑膜组织增生与癌基因和凋亡相关基因的关系已有研究报道[12~14],本研究结果显示CTGF蛋白介导RA滑膜增殖、促进FLS增殖的作用很可能是通过ERK-1/2信号通路活化实现的.但关于CTGF如何促进滑膜细胞增殖及其调控机制尚待进一步研究.
[1]Coo1es FA,Isaacs JD.Pathophysio1ogy of rheumatoid arthritis[J]. Curr Opin Rheumato1,2011,23(3):233-240.
[2]Bartok B,Firestein GS.Fibrob1ast-1ike synoviocytes:key effector ce11s in rheumatoid arthritis[J].Immuno1 Rev,2010,233(1): 233-255.
[3]Jun JI,Lau LF.Taking aim at the extrace11u1ar matrix:CCN proteins as emerging therapeutic targets[J].Nat Rev Drug Discov,2011,10 (12):945-963.
[4]Katsube K,Sakamoto K,Tamamura Y,et a1.Ro1e of CCN,avertebrate specific gene fami1y,in deve1opment[J].Dev Growth Differ, 2009,51(1):55-67.
[5]Ku1ar L,Pakradouni J,Kitabgi P,et a1.The CCN fami1y:a newc1ass of inf1ammation modu1ators[J].Biochimie,2011,93(3):377-388.
[6]Charrier A,Chen R,Kemper S,et a1.Regu1ation of pancreaticinf1ammation by connective tissue growth factor(CTGF/CCN2)[J]. Immuno1ogy,2014,141(4):564-576.
[7]Wang JG,Ruan J,Li CY,et a1.Connective tissue growth factor,aregu1ator re1ated with 10-hydroxy-2-decenoic acid down-regu1ate MMPs in rheumatoid arthritis[J].Rheumato1 Int,2012,32(9): 2791-2799.
[8]Nozawa K,Fujishiro M,Kawasaki M,et a1.Inhibition of connectivetissue growth factor ame1iorates disease in a murine mode1 of rheumatoidarthritis[J].Arthritis Rheum,2013,65(6):1477-1486.
[9]丁爽,段宏梅,方芳,等.类风湿性关节炎患者血清中结缔组织生长因子水平分析[J].细胞与分子免疫学杂志,2015,31(1): 97-99.
[10]Radhakrishnan SS,B1a1ock TD,Robinson PM,et a1.Effect of connectivetissue growth factor on protein kinase expression and activity in humancornea1 fibrob1asts[J].Invest Ophtha1mo1 Vis Sci, 2012,53(13):8076-8085.
[11]Huang HC,Yang M,Li JZ,et a1.Connective tissue growth factor promotes the pro1iferation of myofibrob1ast through Erk-1/2 signa1-ing pathway[J].Zhonghua Yi Xue Za Zhi,2005,85(19): 1322-1326.
[12]Sano H,Eng1eka K,Mathern P,et a1.Coexpression of phosphotyrosine-containing proteins,p1ate1et derived growth factor-B,and fibrob1ast growth factor-1 in situ in synovia1 tissues of patients with rheumatoid arthritis and Lewis rats with ad juvant or streptococca1 ce11 wa11 arthritis[J].J C1in Invest,1993,91(2):553-565.
[13]Shiozawa S,Shiozawa K,Tanaka Y,et a1.Human epiderma1 growth factor for the stratification of synovia1 1ining 1ayer and neovascu1arisation in rheumatoid arthritis[J].Ann Rheum Dis,1989,48(10): 820-828.
[14]Fire A,Xu S,Montgomery MK,et a1.Potent and specific genetic interference by doub1e-stranded RNA in caenorhabditis e1egans[J]. Nature,1998,391(2):806-811.
(编辑武玉欣)
EffectofConnective TissueGrow th Factor on Proliferation of Fibroblast-likeSynoviocytesof Rheumatoid Arthritis
DINGShuang,FANGFang,DUANHong-mei,WUChun-1ing,LIUHai-na,XIAOWei-guo
(DepartmentofRheumato1ogyand Immuno1ogy,The FirstHospita1,ChinaMedica1University,Shenyang110001,China)
Objective To investigate the in vitroeffectofconnectivetissuegrowth factor(CTGF)on thepro1iferationof fibrob1ast-1ikesynoviocytes (FLS)of rheumatoid arthritis(RA),and exp1ore the potentia1 signa1 transduction mechanisms of CTGF-induced FLS pro1iferation.Methods FLS were cu1tured in vitro and identified by immunohistochemica1 method.FLS pro1iferation was measured by thymidine incorporation after exogenous CTGF stimu1ation with different concentrations(0,5,10,25,50 ng/mL).After specific ce11u1ar signa1ing pathway b1ockers pretreatment of cu1tured FLS,observe theeffectsofCTGFon FLSpro1iferation by thymidine incorporation.Results Ce11scu1tured in vitrowere comp1iedwith the FLScharacteristics by optica1 microscopy and immunohistochemica1 identification.The pro1iferation of FLS was gradua11y increased as the concentration of CTGF e1evating from 10 ng/mL to 50 ng/mL,which were significant1y higher than the contro1 group(P<0.01).However,no significant difference was observed between FLS cu1tured with 25 ng/mL CTGF and those cu1tured with 50 ng/mL CTGF(P>0.05).Inhibition of ERK-1/2 by PD98059 significant1y suppressed CTGF-mediated FLS pro1iferation(P<0.05).Conclusion CTGF induced a pro1iferative response in FLS,and this action is1ike1ydependenton theactivationofERK-1/2signa1pathway.
connective tissue growth factor;fibrob1ast-1ike synoviocytes;pro1iferation
R593.22
A
0258-4646(2016)03-0205-04
10.12007/j.issn.0258-4646.2016.03.004
辽宁省医学高峰建设工程专项经费项目任务实施方案(2010006)
丁爽(1981-),女,讲师,博士.
肖卫国,E-mai1:XOnet5670@163.com
2015-10-19
网络出版时间:
