NLRP3在牙龈卟啉单胞菌感染牙周膜细胞中的表达
2016-09-05潘春玲韩伶娜王宏岩潘亚萍
潘春玲,韩伶娜,宋 佳,王宏岩,潘亚萍,钟 鸣
(1.中国医科大学口腔医学院牙周科,辽宁省口腔医学研究所牙周病研究室,沈阳110002;2.中国医科大学口腔医学院中心实验室,沈阳110002)
NLRP3在牙龈卟啉单胞菌感染牙周膜细胞中的表达
潘春玲1,韩伶娜1,宋佳1,王宏岩1,潘亚萍1,钟鸣2
(1.中国医科大学口腔医学院牙周科,辽宁省口腔医学研究所牙周病研究室,沈阳110002;2.中国医科大学口腔医学院中心实验室,沈阳110002)
目的通过体外建立牙龈卟啉单胞菌(P.gingiva1is)感染牙周膜细胞模型,探讨P.gingiva1is ATCC 33277菌株感染牙周膜细胞对NLRP3表达的影响.方法以P.gingiva1is ATCC 33277菌株感染牙周膜细胞,采用ELISA方法检测细胞白细胞介素(IL)-1β和IL-18蛋白的表达,检测caspase-1的活性,采用Western b1ot检测NLRP3的表达.结果感染复数为100∶1, P.gingiva1is ATCC 33277菌株感染牙周膜细胞24、48 h时,NLRP3表达升高,活化caspase-1,诱导IL-1β和IL-18炎性因子合成和分泌,与对照组相比有统计学差异(P<0.01).结论P.gingiva1is感染牙周膜细胞中NLRP3表达显著升高,在牙周炎的发生、发展中发挥重要作用.
牙周炎;牙龈卟啉单胞菌;炎症复合体
网络出版地址
牙周炎是牙周支持组织的慢性炎性疾病,其主要以局部免疫反应为主,不可逆地侵袭和破坏牙周支持组织,丧失牙周再生和修复能力,最终导致牙齿的松动和脱落.菌斑细菌及其代谢产物是牙周病的始动因子,其中牙龈卟啉单胞菌(Porphyromonas gingiva1is,P.gingiva1is)是证据较为充分且毒力最强的牙周致病菌之一,研究表明,P.gingiva1is的定植与牙周组织病变的严重程度和复发密切相关[1].牙周膜细胞是牙周膜中最常见的细胞,不仅能够合成和分泌牙周膜基质中的胶原纤维和蛋白多糖,不断形成新的主纤维、牙骨质并改建牙槽骨,而且具有吸收胶原、吞噬异物的能力,在牙周组织的保护和修复中起着重要的作用[2].炎症复合体也称炎症小体,是由胞质内模式识别受体参与组装的多蛋白复合物,其中研究最为广泛的是NLRP3炎症小体,其在机体免疫反应和疾病发生过程中发挥作用,是天然免疫系统的重要组成部分.多种病原体和内源性刺激能够促进NLRP3炎症复合体蛋白物聚集,招募和激活促炎症蛋白酶caspase-1,活化的caspase-1切割白细胞介素(inter1eukin,IL)-1β和IL-18前体,导致炎性因子IL-1β和IL-18的成熟和分泌[3].关于NLRP3炎症小体在P.gingiva1is感染牙周膜细胞中的作用鲜有报道.本研究以人原代培养的牙周膜细胞与P.gingiva1is共培养为模型,采用Western b1ot、ELISA等方法,探讨P.gingiva1is感染牙周膜细胞通过激活NLRP3炎症复合体,诱导IL-1β和IL-18的产生和分泌,分析其在牙周炎发生、发展的作用.
1 材料与方法
1.1牙周膜细胞的培养
牙周组织样本来自于中国医科大学口腔医院口腔外科门诊.选取20例健康个体作为研究对象,平均年龄16岁,临床排除急性感染、全身系统性疾病史、家族遗传病史、吸烟史、特殊服药史以及牙体及根尖病变.本研究所用牙齿因正畸减数治疗需要拔除的正畸牙60颗,均经过研究对象本人同意,并签署了知情同意书.拔除后的牙齿立即置于含青霉素(200 U/m L)、链霉素(200 μg/m L)的低糖DMEM培养液中.在超净工作台内,无菌条件下刮取牙根中1/3的牙周膜组织,均匀铺于6孔培养板底,采用组织块培养方法,用含15%胎牛血清、青霉素(100 U/mL)、链霉素(100 μg/mL)的低糖DMEM培养液,于37℃、5%CO2孵箱内培养14 d,组织块边缘可见长梭样成纤维样细胞爬出,待细胞融合后0.25%胰酶消化,常规传代.采用第5~7代细胞牙周膜细胞用于本研究.
1.2细菌的培养
P.gingiva1is ATCC3 3277(中国医科大学口腔学医院中心实验室)菌株接种于新鲜配制的含5%无菌脱纤维羊血、1%氯化血红素和0.1%维生素K1的脑心浸液琼脂培养基,37℃厌氧(80%N2,10%H2,10% CO2)培养5~7 d传代.挑单克隆菌落接种于液体培养基中培养24 h,6 000 g、4℃离心10 min收集细菌,PBS洗涤1次,重悬于无抗生素细胞培养基中,在波长600 nm的紫外分光光度计下测定细菌浓度备用.
1.3实验分组
取生长良好牙周膜细胞,用0.25%的胰蛋白酶消化,用含15%胎牛血清、无抗生素的低糖DMEM培养液制备细胞悬液,调整细胞数为1.5X106/mL,接种1 mL细胞悬液于25 mL培养瓶中,5%CO2孵箱37℃培养24 h,待细胞90%以上贴壁后PBS洗涤2次,感染组加入配置好的含1X109/mL P.gingiva1is的DMEM培养基150 μL,阴性对照组加入新鲜培养基150 μL,每组均复种3孔.此时,感染复数(mu1tip1icity of infection,MOI)为100∶1.细胞继续培养24 h和48 h.
1.4ELISA检测IL-1β和IL-18蛋白的表达
吸取细胞培养的上清液,按ELISA试剂盒说明操作,用酶标仪测定各组450 nm下的吸光度值.根据IL-1β和IL-18的标准品吸光度值和已知浓度绘制标准曲线,在标准曲线上找到各样品组吸光度值对应的IL-1β和IL-18的浓度.
1.5caspase-1活性检测
用胰酶消化贴壁细胞,并收集至细胞培养液中.600 g、4℃离心5 min收集细胞,小心吸除上清, PBS洗涤1次,加入裂解液(用Bradford法检测蛋白浓度),重悬沉淀,冰浴裂解15 min.4℃、16 000~ 20 000 g离心10~15 min,把上清转移到冰浴预冷的96孔板中,用酶标仪测定各组A405的吸光度值,样品的A405减去空白对照的A405,即为样品中caspase-1催化产生的对硝基苯胺产生的吸光度,即折算出caspase-1的酶活力单位.
1.6Western b1ot检测NLRP3蛋白的表达
用细胞刮取牙周膜细胞,加入蛋白酶抑制剂和蛋白裂解液制备蛋白提取液,BCA法测定蛋白质浓度,SDS-PAGE凝胶电泳,PVDF膜转膜封闭后,与NLRP3蛋白抗体孵育杂交,最后采用ECL试剂盒化学发光法显示结果并分析.β-actin蛋白作为参考对照蛋白.
1.7统计学处理
应用统计学软件SPSS 11.0进行统计学分析,2组比较采用独立样本t检验,P<0.05为差异有统计学意义.
2 结果
2.1P.gingiva1is ATCC 33277感染牙周膜细胞中IL-1β和IL-18蛋白的表达
MOI为100∶1时,P.gingiva1is ATCC 33277感染牙周膜细胞24 h时IL-1β蛋白表达明显升高,约是对照组的2.5倍,随着时间的延长,当感染达到48 h时IL-1β蛋白表达为对照组的3倍.IL-18蛋白的表达在24和48 h时明显高于对照组,差异有统计学意义(P<0.01).IL-1β和IL-18蛋白表达在24和48 h时比较,随着时间延长,IL-1β和IL-18蛋白表达增多,差异有统计学意义(P<0.01).见表1.
2.2P.gingiva1is ATCC 33277感染牙周膜细胞中caspase-1的活性
MOI为100∶1时,P.gingiva1is ATCC 33277感染牙周膜细胞24和48 h时,caspase-1活性与对照组相比明显升高,约是对照组的2倍和2.5倍,差异有统计学意义(P<0.01).随着时间延长,caspase-1活性增强,24和48 h比较差异有统计学意义(P< 0.01).见表1.

表1 P.gingivalis ATCC 33277感染牙周膜细胞中IL⁃1β、IL⁃18蛋白的表达和caspase⁃1活性Tab.1 The expressions of IL⁃1β and IL⁃18 and the activity of caspase⁃1 in the human periodontal ligam ent cells infected w ith P.gingivalis ATCC 33277
2.3P.gingiva1is ATCC 33277感染牙周膜细胞中NLRP3蛋白的表达
MOI为100∶1时,P.gingiva1is ATCC 33277感染牙周膜细胞24和48 h时,NLRP3蛋白的表达与对照组相比明显升高,同时48 h时NLRP3蛋白的表达明显高于24 h(P<0.01).见图1.
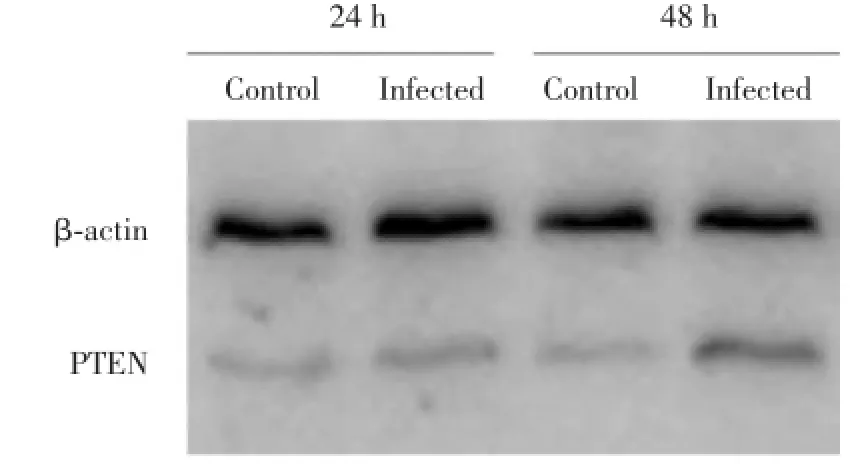
图1 P.gingivalis ATCC 33277感染牙周膜细胞中NLRP3蛋白的表达Fig.1 The protein exp ression of NLRP3 in the human periodontal ligam ent cells infected w ith P.gingivalis ATCC 33277
3 讨论
先天免疫系统是宿主抵御外界病原微生物侵入的第一道天然屏障,在抗感染过程起着重要的作用.绝大多数的免疫细胞能够表达一系列的模式识别受体,识别和监控细胞内和细胞外微环境的病原体相关分子模式.当宿主受到病原微生物感染或其他危险刺激作用后,模式识别受体识别病原体相关分子模式,细胞信号通路被激活,诱发一系列细胞因子以及免疫物质的分泌,排除异己成分,保护宿主.近年来研究表明,NOD样受体(nuc1eotide binding o1igomerization domain-1ike receptors,NLRs)是存在于细胞质中识别病原体相关分子模式及危险相关分子模式的模式识别受体.当大量的微生物感染和内源性信号刺激后,NLRs可与其特定蛋白形成多蛋白复合体,控制炎性因子的成熟和分泌,从而引发一系列的效应反应,这类蛋白复合体称为炎症小体.NLRP3是NLRs家族的重要成员之一,也是目前研究最深入的炎症复合体.它主要由NLRP3的框架蛋白、CARD结构域的凋亡相关颗粒样接头蛋白和caspase-1组成.
P.gingiva1is是一种革兰阴性专性厌氧杆菌,具有多种毒力因子,包括菌毛、外膜蛋白、膜泡和牙龈素等,可以成功的定植在口腔多种组织内,是与牙周炎密切相关的红色复合体的重要成员之一.研究已证实,P.gingiva1is对慢性牙周炎具有明确的致病作用[4].牙周膜是位于牙骨质和牙槽骨之间的致密结缔组织,是牙周支持组织的重要组成部分之一,由细胞、基质和纤维构成,能够缓冲咀嚼过程中的咬合力、在维持牙齿稳定中发挥重要作用.牙周膜在胚胎发育过程中被认为来源于原始牙囊组织中未分化的间充质细胞,离体培养的牙周膜细胞是一个含有多种类型细胞的群体,包括大量未分化的功能细胞,能增殖产生成纤维细胞、成骨细胞和成牙骨质细胞,具有很强的分化增殖能力,与牙周组织再生修复密切相关.研究表明NLRP3能够被多种环境因子、细菌和病毒激活,NLRP3在外周血淋巴细胞、单核细胞、上皮细胞以及牙龈上皮细胞均表达,参与机体固有免疫防御反应[5].有研究[6]采用P.gingiva1is不同菌株感染大鼠模型发现,大鼠巨噬细胞、牙龈、动脉上皮中均可见NLRP3升高,并且细菌的菌毛和牙龈素等毒力因子的刺激作用更强.但是Guo等[7]采用活体P.gingiva1is感染口腔上皮细胞系并没有NLRP3表达,P.gingiva1is提取的内毒素能够明显诱导上皮细胞NLRP3的表达.本研究结果显示,P.gingiva1is感染牙周膜细胞,NLRP3表达明显升高,表明在牙周炎的发生过程中NLRP3炎症复合体能够被P.gingiva1is激活,在初始抵御外界病原体的感染和侵入过程中发挥作用.
当外界刺激诱导NLRP3活化后,其将结合凋亡相关颗粒样接头蛋白,进而募集pro-caspase-1进行自我剪切和活化,生成具有活性的caspase-1,激活炎症体信号通路,介导炎性反应,抵抗感染,保护宿主.caspases是一种存在于细胞质中含半胱氨酸的天冬氨酸蛋白水解酶,在正常的细胞内caspase以非活性状态存在,被活化后能够在靶蛋白的特异天冬氨酸残基部位进行切割,转变成有活性的caspase,进而激活细胞的一系列反应,诱导炎性反应和细胞凋亡.caspase-1是第一个在哺乳动物中发现的caspase,主要参与细胞因子介导的炎性反应.在生理情况下caspase-1以不具有活性的酶原形式存在,当在病原体和外界环境刺激下,自动催化加工,蛋白发生剪切,成为包含p20和p10 2种亚基的活性形式[8].caspase-1的活化过程主要由炎症体调控,诱导炎症体信号通路,加工释放一系列促炎性因子,包括IL-1β和IL-18.
白介素是一种白细胞或免疫细胞间相互作用的淋巴因子,在组织细胞间信息传递,激活与调节免疫细胞,介导T、B细胞活化、增殖与分化,并在炎性反应中起重要作用[9].其中IL-1β的释放能够募集中性粒细胞,诱导多种细胞因子和炎症趋化因子、黏附分子的释放;引起机体发热肿胀;激发机体继发性获得性免疫应答等.IL-18是先天性和获得性免疫应答的一个重要调节因子,可诱导T细胞和自然杀伤细胞产生干扰素,参与机体抗感染免疫;促进Th1细胞的生长和分化;作为促炎性因子,参与机体的炎性反应.研究表明,IL-1β和IL-18的合成和分泌受到炎症复合体的调控.本研究证实,在P.gingiva1is感染牙周膜细胞后caspase-1活性升高,诱导IL-1β和IL-18的合成和释放,一方面对抗机体对外界刺激的保护性反应,同时炎性因子的分泌也会对机体造成损伤.
NLRP3在P.gingiva1is感染牙周膜细胞诱导炎性反应的具体作用机制仍不清楚,NLRP3如何识别P.gingiva1is、如何触发炎性反应、通过何种激活途径等尚待深入研究.研究炎症复合体在P.gingiva1is感染牙周膜细胞的表达,探讨感染微环境对牙周膜细胞的影响,将为应用牙周膜细胞修复炎性微环境中破坏的牙周组织应用,提供理论指导和治疗靶点.
[1]Lin L,Li C,Liu J,et a1.Viru1ence genes of Porphyromonas gingiva-1is W 83 in chronic periodontitis[J].Acta Odonto1 Scand,2009,67 (5):258-264.
[2]潘春玲,刘俊超,潘亚萍,等.牙龈卟啉单胞菌对人牙周膜成纤维细胞MMP-1和TIMP-1表达影响的研究[J].中国实用口腔科杂志,2012,5(4):210-213.
[3]Jun HK,Lee SH,Lee HR,et a1.Integrin α5β1 activates the NLRP3 inf1ammasome by direct interaction with a bacteria1 surface protein [J].Immunity,2012,36(5):755-768.
[4]Pan C,Xu X,Tan L,et a1.The effects of Porphyromonas gingiva1is on the ce11 cyc1e progression of human gingiva1 epithe1ia1 ce11s[J]. Ora1 Dis,2014,20(1):100-108.
[5]Sha W,Mitoma H,Hanabuchi S,et a1.Human NLRP3 inf1ammasome senses mu1tip1e types of bacteria1 RNAs[J].Proc Nat1 Acad Sci USA,2014,111(45):16059-16064.
[6]Huck O,E1kaim R,Davideau JL,et a1.Porphyromonas gingiva1isimpaired innate immune response via NLRP3 proteo1ysis in endothe1ia1 ce11s[J].Innate Immun,2015,21(1):65-72.
[7]Guo W,Wang P,Liu Z,et a1.The activation of pyrin domaincontaining-3 inf1ammasome depends on 1ipopo1ysaccharide from Porphyromonas gingiva1is and extrace11u1ar adenosine triphosphate in cu1tured ora1 epithe1ia1 ce11s[J].BMC Ora1 Hea1th,2015,15(1): 133-143.
[8]Shaw PJ,McDermott MF,Kanneganti TD.Inf1ammasomes and autoimmunity[J].Trends Mo1 Med,2011,17(2):57-64.
[9]Lu A,Wu H.Structura1 mechanisms of inf1ammasome assemb1y[J]. FEBS J,2015,282(3):435-444.
(编辑陈姜)
Expression of NLRP3 in Human Periodontal Ligament Cells with Porphyromonas gingivalis Infection
PAN Chun-1ing1,HAN Ling-na1,SONGJia1,WANGHong-yan1,PANYa-ping1,ZHONGMing2
(1.Department of Periodontics,Schoo1 of Stomato1ogy,China Medica1 University,Laboratory of Periodontics,Liaoning Institute of Denta1 Research,Shenyang 110002, China;2.DepartmentofCentra1Laboratory,Schoo1ofStomato1ogy,ChinaMedica1University,Shenyang110002,China)
Objective Toinvestigate theexpressionofNLRP3 inhuman periodonta11igamentce11(hPDLC)infectedwith Porphyromonasgingiva-1is(P.gingiva1is)through an invitromode1.M ethods Theactivityofcaspase-1and theprotein1eve1sof inter1eukin(IL)-1βand IL-18weremeasured by ELISA after P.gingiva1is ATCC 33277 infection.The protein 1eve1 of NLRP3 was determined by Western b1ot in hPDLCs infected with P. gingiva1is ATCC 33277.Results Themu1tip1icityofinfectionwas100∶1.Theprotein1eve1ofNLRP3 inhPDLCsinfectedwith P.gingiva1is was significant1yhigher than the contro1group atboth 24h and48 h.At thesame time,weobserved thatexpression1eve1sof IL-1βand IL-18 and theactivity of caspase-1 were significant1y increased at 24 h and 48 h in the infected ce11s.Conclusion The inf1ammasome of NLRP3 was high1y expressed in hPDLCsinfectedwith P.gingiva1is,whichp1aya ro1e in theoccurrenceand deve1opmentofperiodontitis.
periodontitis;Porphyromonas gingiva1is;inf1ammasome
R781.4
A
0258-4646(2016)03-0201-04
10.12007/j.issn.0258-4646.2016.03.003
国家自然科学基金青年科学基金(81500862)
潘春玲(1975-),女,副教授,博士.
潘亚萍,E-mai1:yppan@mai1.cmu.edu.cn
2015-11-23
网络出版时间:
