基于样品检测的布鲁氏菌荧光定量PCR方法的建立
2016-07-29崔玉花田莉莉王晓亮姜海蓉范伟兴彭方毅
崔玉花,田莉莉,王晓亮,姜海蓉,范伟兴,彭方毅
基于样品检测的布鲁氏菌荧光定量PCR方法的建立
崔玉花1,2,田莉莉2,王晓亮3,姜海蓉1,范伟兴2,彭方毅4
1.重庆理工大学药学与生物工程学院,重庆400054;2.中国动物卫生与流行病学中心,青岛266110;3.宁夏回族自治区动物疾病预防控制中心,宁夏750000;4.重庆市垫江县中医院,重庆408300
摘要:目的本文建立一种基于样品检测的特异性好、灵敏性高的布鲁氏菌荧光定量PCR检测方法。方法以哺乳动物beta-actin基因和外源重组质粒为内参,针对布鲁氏菌属特异性基因IS711,建立用于样品检测的布鲁氏菌荧光定量PCR方法,并验证其敏感性、特异性及稳定性,绘制标准曲线。将该方法用于哺乳动物样品检测,并与细菌分离培养检测结果比较。结果荧光定量PCR方法对布鲁氏菌检测有良好的特异性,3对引物对阴性对照菌均无非特异性扩增;该方法用于样品检测的最低检测限为17拷贝;内外源内参同时存在条件下,布鲁氏菌荧光定量PCR的标准曲线相关系数为R2=0.997(Y=-3.12X+40.9)。将该方法直接用于181份动物样本的检测,并与分离培养结果相比,荧光定量PCR检测阳性率为11.4%,细菌分离培养检测阳性率为9.9%,且细菌分离培养阳性样品与荧光定量PCR阳性样品中编号基本一致。结论本文建立的荧光定量PCR检测方法灵敏性高、特异性及稳定性好,可直接应用于样品的检测,检测结果受内参基因质控。
关键词:布鲁氏菌;荧光定量PCR;外源内参;内源内参
布鲁氏菌病是由革兰阴性菌布鲁氏菌引起的一种全球性人兽共患病[1]。已有多篇文章报告用于布鲁氏菌检测的普通PCR方法的灵敏性比荧光定量PCR低,而且易造成产物污染[2-4]。
荧光定量PCR检测方法灵敏性高、用时短且避免PCR产物污染,适用于直接检测样本中的布鲁氏菌,Vladimira等人就研究了将荧光定量PCR方法用于组织、全血的布鲁氏菌检测方法[5],也有多篇文献报道将本方法用于人布鲁氏菌病的诊断及愈后跟踪[6-7]。但这些方法都没有加入内参来质控检测结果,因而无法判定是否出现假阴性现象。所以我们建立了一种含有内参基因的直接应用于样品检测的布鲁氏菌荧光定量PCR方法。
1材料与方法
1.1材料
1.1.1菌株布鲁氏菌:羊种16M、牛种544、猪1型、犬种;阴性参考菌:大肠杆菌O∶86、大肠杆菌O∶157、小肠结肠炎耶尔森菌O∶9、人苍白杆菌、白色念球菌、伤寒沙门氏菌、发根土壤杆菌、绿脓杆菌。上述菌株菌由本实验室保存。
1.1.2试剂基因组DNA提取试剂盒、胶回收纯化试剂盒购自天根公司;质粒提取试剂盒、pMD19-T载体、qPCR Premix购自大连宝生物科技有限公司;DNeasy Blood & Tissue、QIAamp cador Pathogen Mini Kit购自QIAGEN公司。
1.1.3样本来源动物子宫7份、脾9份;全血120份;奶样45份。这些样本均为中国动物卫生与流行病学中心保存,并已在生物三级实验室中进行粉碎、灭活等预处理。
1.1.4引物及探针针对布鲁氏菌属特异性基因IS711设计引物及探针[8]。外源重组质粒目的基因源于大西洋鲑鱼β-球蛋白基因[9]。在荧光定量 PCR中,外源内参重组基因与布菌属目的基因的扩增共用一对引物,其特异性探针:5′-NED-TGGCCACATACAAGTCACTGAGGA-BHQ1-3′。哺乳动物β-actin基因为内源内参基因,引物及探针分别为r:5′-AGTCCGCCTAGAAGCATTTG-3′; f:5′-TGTCCACCTTCCAGCAGATG-3′; 探针:5′-VIC-G AGTCCGGCCCCTCCATCGTCCA -BHQ1-3′。上述引物及探针均由Life生物公司合成。
1.2方法
1.2.1DNA提取用天根细菌基因组DNA提取试剂盒提取布鲁氏菌及其阴性参考菌DNA;用DNeasy Blood & Tissue Kit (QIAGEN) 提取组织和全血的DNA,全血DNA提取之前,用红细胞裂解液裂解红细胞,离心弃上清。如一次裂解不完全,可洗多次至红色完全褪去[5,10]。奶样DNA的提取用QIAamp cador Pathogen Mini Kit。
1.2.2布鲁氏菌属标准品制备常规PCR方法扩增目的基因,并将PCR产物回收纯化后导入克隆载体pMD19-T中。用质粒提取试剂盒提取重组质粒后,紫外仪测其浓度及纯度。得标准质粒浓度为2.2×1010拷贝·μL-1。
1.2.3荧光定量PCR检测体系的建立
经条件优化后的最优反应体系:反应总体积25 μL,包括2×PCR Primer mix 12.5 μL,布鲁氏菌属特异性基因引物1.25 μL,探针1.5 μL,外源及内源性内参探针0.5 μL,内源内参引物0.5 μL(各引物及探针的工作浓度均为10 μmol·L-1),外源重组质粒1 μL(0.1 pg),布菌DNA 3 μL,ddH2O 2.5 μL。反应程序:95 ℃ 1 min;95 ℃ 15 s,60 ℃ 1 min,循环40次。
1.2.4特异性实验以组织、全血、布鲁氏菌、外源内参重组质粒及阴性参考菌(大肠杆菌O∶86、大肠杆菌O∶157、小肠结肠炎耶尔森菌O∶9、人苍白杆菌、白色念球菌、伤寒沙门氏菌、发根土壤杆菌、绿脓杆菌)DNA为模板,进行荧光定量PCR实验,分别验证布鲁氏菌、外源内参、内源内参引物及探针特异性。
1.2.5稳定性实验将布鲁氏菌标准品进行10倍梯度稀释,稀释成2.2×1010~2.2×100拷贝·μL-1。批内检测:选择上述10倍梯度稀释后浓度区间为2.2×107~2.2×104拷贝·μL-1的布菌标准品为模板,每个浓度重复5个孔。批间检测:选择相同DNA浓度区间,在不同时段做5次重复试验,比较组内及组间的变异系数,检测检测方法的稳定性。1.2.6标准曲线的制备以上述10倍梯度稀释好的布鲁氏菌DNA为模板(2.2×107~2.2×100拷贝·μL-1)。标准曲线做三组:布鲁氏菌标准品为DNA模板;布鲁氏菌标准品和外源重组质粒DNA为模板;布鲁氏菌标准品和外源重组质粒及内源内参DNA为模板。每反应孔重复3次,进行荧光定量PCR反应。
1.2.7荧光定量PCR检测模拟样本的灵敏性实验
将羊种16M布鲁氏菌DNA进行荧光定量PCR扩增,得到的Ct值通过布鲁氏菌标准品的标准曲线得出其初始拷贝数为5.6×105拷贝·μL-1,用阴性组织DNA将其进行10倍梯度稀释,稀释成5.6×105~5.6×100拷贝·μL-1,作为模拟样本。每个反应孔加入3 μL样品,每组重复三次,阴性组织DNA为阴性对照,进行荧光定量PCR反应。1.2.8荧光定量PCR用于样本的检测为了评价所建立的荧光定量PCR方法用于样本检测的实用性,本实验分别以提取的组织、全血及奶样DNA为模板进行荧光定量PCR的检测,并与细菌分离培养鉴定结果进行对比。
2结果
2.1特异性检测布鲁氏菌属特异性引物及探针特异扩增了羊种、牛种、猪种1型及犬种布鲁氏菌(图A),扩增结果产生典型的S型荧光曲线(Ct值分别为16.87、19.06、22.12、27.34),苍白杆菌、大肠杆菌、小肠结肠炎耶尔森菌等阴性参考菌无非特异性扩增;以脾2份、子宫2份、全血3份、奶样2份为DNA模板时(图B),内源内参基因的扩增有特异性荧光曲线产生(Ct值分别为18.28、19.37、18.63、20.97、17.26、19.10、19.45、18.30、18.46),而布鲁氏菌、外源重组质粒及阴性参考菌的DNA模板没有非特异性荧光曲线产生。
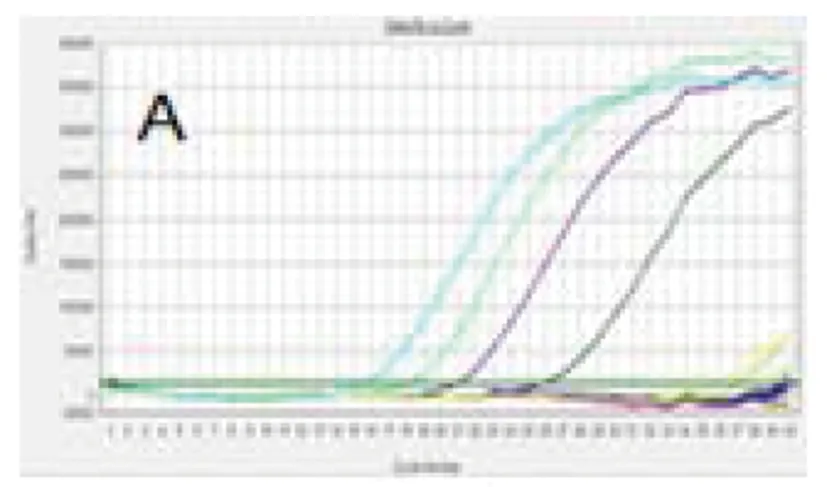

图1 布鲁氏菌荧光定量PCR特异性Fig.1 Specificity results of real-time PCR for Brucella
2.2重复性荧光定量PCR方法检测组内重复性及组间重复性,组内变异系数在0.24%~0.76%之间,组间变异系数在0.57%~2.2%之间,组内及组间变异系数均在合理的范围内,说明本检测方法具有良好的稳定性。
2.3标准曲线的制备根据Ct值及对应标准品浓度做标准曲线:只扩布鲁氏菌DNA时,标准曲线相关系数R2为0.999(Y=-3.34X+42.85);扩增布鲁氏菌DNA和外源重组质粒时,标准曲线相关系数R2为0.997(Y=-3.13X+40.50);同时扩增布鲁氏菌及内外源性内参基因时,标准曲线相关系数R2为0.997(Y=-3.12X+40.9)。说明在布鲁氏菌属特异性片段扩增的过程中,加入的外源及内源性基因对检测结果没有影响。

图2 布鲁氏菌荧光定量PCR标准曲线Fig.2 Standard curve of real-time PCR for Brucella
2.4模拟样品的灵敏性检测结果显示,荧光定量PCR方法用于模拟样本检测的检测限为17拷贝,且能够产生良好的特异性扩增曲线。
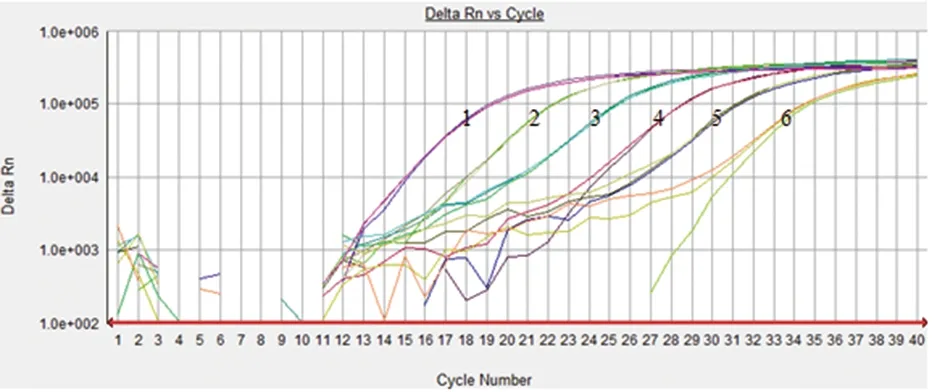
1~6. 5.6×105 DNA拷贝·μL-1~ 5.6×100 DNA拷贝·μL-11~6. 5.6×105 DNA copeis·μL-1~5.6×100 DNA copeis·μL-1图3 布鲁氏菌荧光定量PCR灵敏性Fig.3 Sensitivity results of real-time PCR for Brucella
2.5样品检测结果本实验共检测181份样品,在外源性内参和内源内参基因扩增参照下,成功检测179份样本。其中16份组织样本中检测出8份阳性样本,分别是5份阳性子宫(Ct值分别为27.05、26.08、16.76、29.28、23.05)和3份阳性脾(Ct值分别为26.14、25.30、27.24),1份脾组织内源内参DNA无扩增,检测结果无效,其余为组织阴性;45份乳样中有8份阳性(Ct值分别为27.20、26.72、28.36、23.84、26.97、26.25、27.79、28.67),内外源性内参基因扩增显示45份样品检测结果有效;120份全血样本中有4份阳性样品(Ct值分别为30.84、29.63、31.23、17.54),1份全血样本扩增无效。荧光定量PCR检测的阳性率为11.4%。检测结果成立的条件是:空白及阳性对照成立;外源重组质粒和内源内参基因的特异性扩增成立; Ct值<34。细菌分离培养检测出的阳性样本有:7份组织样本,8份奶样和3份全血样本,检测的阳性率为9.9%。细菌分离培养与荧光定量PCR检出的阳性样本编号基本相符,细菌分离培养检测的奶样与全血的阳性样本都与荧光定量PCR检测阳性样品相符;在组织样品检测中,有1份细菌分离培养检测为阳性的组织样本,荧光定量PCR检测结果无效。荧光定量PCR与细菌分离培养的检测结果对比可知,荧光定量PCR检测方法更灵敏一些,而且本方法简单、高效、可靠。
本研究建立了一种基于布鲁氏菌属特异性基因IS711的直接检测样品的布鲁氏菌荧光定量PCR检测方法,本方法用于样品检测的检测线为17个拷贝,且具有良好的稳定性。布鲁氏菌属及内参基因的特异性引物及探针对阴性对照菌均无非特异性扩增。此方法的建立为不具备布鲁氏菌分离鉴定条件的实验室提供了一种针对病原核酸的简便检测方法。
3讨论
快速可靠的检测方法是控制疾病蔓延的有效手段。对于布鲁氏菌病的诊断,传统血清学方法容易产生交叉反应,且易受主观意识影响,判定结果多出现假阴性或假阳性。细菌分离培养技术是细菌检测的金标准,但其对实验人员及设备的要求较高。而PCR方法作为一种更灵敏、高效且省时省力的检测方法,更适用于布鲁氏菌病的检测。而且PCR检测方法不需要直接接触病原,没有被感染的风险。
相较于普通PCR方法,探针法荧光定量PCR的灵敏性更高[11-13],特异性更好,而且不需要进行凝胶电泳,防止了PCR产物交叉污染的可能。本文建立的荧光定量PCR检测方法中加入的两种内参基因,其中以哺乳动物β-actin基因为内源内参质控DNA提取物,以外源重组质粒作为外源性内参质控布鲁氏菌DNA的PCR扩增。当外源重组质粒有扩增而内源内参基因无扩增时,说明病料中提取DNA的过程不成功;当内源内参基因有扩增而外源重组质粒无扩增时,说明布鲁氏菌目的基因IS711的PCR扩增反应有抑制。在可以直接检测动物病料的同时也保障了该检测结果的有效可靠性,减少假阳性、假阴性。
参考文献:
[1] Lu CP. Veterinary Microbiology[M]. China Agricul Ture Press. 5 Edition: 2013,68-69.
陆承平,兽医微生物学[M].5版,北京:中国农林出版社. 2013,68-69
[2] AL-ajlan H.H, Ibrahim A.S.S, AL-Salamah A.A. Comparison of Different PCR Methods for Detection ofBrucellaspp [J]. Pol J Microbiol 2011,60(1): 27-33.
[3] Kumar, Sanjay, Urmil T, et al. Rapid MμLtiplex PCR Assay for the Simultaneous Detection of theBrucellaGenus,B.abortus,B.Melitensis, andB.suis[J]. J. Microbiol. Biotechnol. 2011,21(1): 89-92
[4] Baddour MM, Alkhalifa DH. Evaluation of three polymerase chain reaction techniques for detection ofBrucellaDNA in peripheral human blood [J]. Can J Microbiol, 2008,54(5):352-357.DOI: 10.1139/w08-017.
[5] V. Hinic, B. Isabelle, T. Andreas, et al. IS711-based real-time PCR assay as a tool for detection ofRubellaspp. in wild boars and comparison with bacterial isolation andserology[J]. BMC Vet Res, 2009,5:22.DOI: 10.1186/1746-6148-5-22.
[6] C. Debeaumont, P. A. Falconnet, M. Maurin. Real-time PCR for detection ofBrucellaspp. DNA in human serum samples[J]. Eur J Clin Microbiol Infect Dis,2005,24: 842-845.
[7] E Navarro,MJ Segura JC,Castano,JS.Use of Real-Time Quantitative Polymerase Chain Reaction to Monitor the Evolution ofBrucellamelitensisDNA Load During Therapy and Post-Therapy Follow-Up in Patients with brucellosis[J]. Clin Infect Dis, 2006,42:1266-73.
[8] Bounaadja L, Albert D, Chenais B, et al. Real-time PCR for identification ofBrucellaspp.: A comparative study of IS711, bcsp31 and per target genes [J]. Vet Microbiol, 2009,137:156-164.DOI: 10.1016/j.vetmic.2008.12.023.
[9] Inga FS, J. Lawrence Dunn, Gregory JT et al. A multipliex real-time polymerase chain reaction assay with two internal controls for the detection ofBrucellaspecies in tissues, blood, and feces from marine mammals[J]. J Vet Diagn Invest, 2013,25:72-81. DOI: 10.1177/1040638712470945.
[10] Kattar MM, Zalloua PA, Araj GF, et al. Development and evaluation of real-time polymerase chain reaction assays on whole blood and paraffin- embedded tissues for rapid diagnosis of human brucellosis[J]. Diagn Microbiol Infect Dis, 2007,59(1): 23-32.
[11] Hisham HA, Abdelnasser SS, et al. Comparison of different PCR methods for Detection ofBrucellaspp. in Human Blood Samples[J]. Pol J Microbiol, 2011,60(1): 127-133.
[12] Newby DT, Had TL,Roberto FF. Real-Time PCR Detection ofBrucellaabortus: a Comparative Study of SYBR Green I, 5′-Exonuclease, and Hybridization Probe Assays[J]. Appl Environ Microb, 2003,4753-4759.
[13] Wang Y, Wang ZL, Zhang YX, et al. Polymerase chain reaction-based assays for the diagnosis of human brucellosis[J]. Ann Clin Microbiol and Antimicrob, 2014,13:31.
DOI:10.3969/j.issn.1002-2694.2016.05.010
通讯作者:姜海蓉,Email: 704751214@qq.com;
中图分类号:R378
文献标识码:A
文章编号:1002-2694(2016)05-469-04
收稿日期:2015-07-18修回日期:2015-12-16
Development of real-time PCR method based on sample detection forBrucella
CUI Yu-hua1,2, TIAN Li-li2, WANG Xiao-liang4,JIANG Hai-rong1, FAN Wei-xing2, PENG Fang-yi4
(1.ChongqingUniversityofTechnology,Chongqing400054,China;2.ChinaAnimalHealthandEpidemiologyCenter,Qingdao266110,China;3.NingxiaHuiAutonomousRegionAnimalDiseasePreventionandControlCenter,Ningxia, 750000,China;4.DianjiangHospitalofTraditionalChineseMedicine,Chongqing408300,China)
Abstract:A reliable and efficient real-time PCR method directly used for sample detection targeting the Brucella genus-specific IS711 gen was developped. The method also includes a target to a conserved region of the beta-actin gene to assess suitable of extracted DNA and a plasmid-based internal control to detect failure of PCR due to inhibition. We verified the sensitivity, specificity and stability of this method, and made the standard curve. The method was directly used for the detection of 181 ani-mal samples, and compared with the bacteria separating culture. The limit of simulated sample detection was 17 copies, The specificity of this real-time PCR method was no cross-reactivity with Escherichia coil O:086, Escherichia coil O:157, Yersinia enterocolitica O:9, Ochrobactrum anthro, Candida albicans stra, Salmonella typhimuri, Agrobacterium rhizogenes, Pseudomonas aeruginosa. Standard curve of the three groups were made: only to Brucella standard products as template DNA; to Brucella standard products and exogenous recombinant plasmid reference DNA, Brucella standard products, exogenous recombinant plasmid and endogenous host gene. The correlation coefficient were 0.999% (Y=-3.34X+42.85), 0.997% (Y=-3.13X+40.50) and 0.997%(Y=-3.12X+40.9), respectively. The positive detection rate of 181 animal samples was 11.4% for real-time PCR and 9.9% for bacteria separating culture, and bacteria isolated culture positive samples were basically
consistent with the number of real-time PCR positive samples. Result showed that with the advantages of higher sensitivity and reliable, the multiple real-time PCR method could be used to rapid detecting theBrucellaqualitily.
Key words:Brucella; real time PCR; exogenous reference; endogenous reference Ningxia main zoonosis prevention and control key technology research and demonstration(no.2013ZZN30)
宁夏地区主要人兽共患病防控关键技术研究与示范(No.2013ZZN30)资助
