猪带绦虫胰岛素受体TsIR-4810的鉴定及LBD区表达
2016-07-29魏艳玲郭爱疆刘光学张少华侯俊玲骆学农
魏艳玲,郭爱疆,2,刘光学,杨 锐,张少华,侯俊玲,骆学农,2
猪带绦虫胰岛素受体TsIR-4810的鉴定及LBD区表达
魏艳玲1,郭爱疆1,2,刘光学1,杨锐1,张少华1,侯俊玲1,骆学农1,2
1. 中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,农业部兽医公共卫生重点开放实验室,甘肃省动物寄生虫病重点实验室,兰州730046;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州225009
摘要:目的克隆鉴定猪带绦虫胰岛素受体TsIR-4810基因,并表达其LBD 区。方法设计猪带绦虫胰岛素受体TsIR-4810特异性引物,并分段进行RT-PCR扩增。TsIR-4810的完整ORF序列经BLAST同源比对,SMART预测其结构域,SWISS-MODEL同源建模,并用PhyML构建系统发育树。将TsIR-4810的LBD区克隆至pET-30a中进行诱导表达,表达产物经SDS-PAGE和Western-blot鉴定。结果获得的目的基因完整的ORF为4 920 bp,其编码蛋白的氨基酸序列与其他生物的胰岛素受体一样,具有相对保守的分泌信号肽、受体L1和L2结构域、FnⅢ结构域、跨膜区和受体酪氨酸激酶域。构建的LBD重组菌株诱导表达了63 ku的目的蛋白,与预期大小相符,且主要以包涵体形式存在。结论TsIR-4810为猪带绦虫胰岛素受体基因,其LBD区的成功表达,将为开展基于胰岛素受体LBD区的新型疫苗和药物奠定基础。
关键词:猪带绦虫;胰岛素受体;鉴定;LBD;表达
猪带绦虫(Taeniasolium)是重要的人兽共患寄生虫病[1-2]。胰岛素信号通路作为非常古老的信号传导途径[3-4],在控制细胞生长及代谢调控中发挥重要作用,并且可以影响细胞与外界环境的相互作用。最新研究表明,寄生蠕虫不仅存在胰岛素(样)多肽(ILPs),而且还存在与哺乳动物同源性很高的胰岛素受体(IR)及下游分子,并可利用宿主胰岛素调节自身代谢和生长发育。日本血吸虫[5]、曼氏血吸虫[6]及棘球绦虫[7-8]等寄生蠕虫均存在IR。酵母双杂交试验也证实,血吸虫和棘球绦虫的IRs可与人胰岛素发生相互作用,从而调节虫体的葡萄糖代谢和生长发育。血吸虫胰岛素受体疫苗的相关研究表明[9],利用受体的胰岛素结合区免疫宿主可以达到抑制虫体生长发育的目的。You[10]用日本血吸虫胰岛素受体的配体结合区(SjLD2)免疫的小鼠攻击感染血吸虫尾蚴后,粪便中的虫卵数明显减少,成虫发育迟缓,小鼠肝脏的肉芽肿强度明显降低。
本文克隆鉴定了猪带绦虫胰岛素受体基因TsIR-4810,对其配体结合结构域 (ligand binding domain,LBD)进行了表达,为进一步研究其生物学功能奠定基础。
1材料与方法
1.1实验虫株、菌株及主要试剂猪带绦虫成虫节片由本实验室保存;pMD18-T克隆载体、rTaqDNA聚合酶、DL2000 DNA marker、RACE试剂盒等均购自宝生物工程(大连)有限公司;原核表达载体pET-30a (+)由本实验室保存;大肠杆菌感受态细胞Dpα、BL21购于北京全式金生物技术有限公司;Trizol试剂购于Invitrogen公司;反转录试剂盒购于罗氏公司。
1.2猪带绦虫TsIR-4810的克隆根据我们完成的猪带绦虫全基因组数据,设计如下两对特异性引物(F1:5′-ATGTCGACGCATCATAATCAT-3′,R1:5′-CGATTCATCCGTAGCGTGACGCTAT-3′;F2:5′-CGAGGAATTGCAGAATAGCGTCA-3′,R2:5′-TCAACGCGAGAGTGGAGGTTCTAC-3′),以对TsIR-4810的完整ORF进行分段扩增。
按照Trizol试剂的操作说明提取猪带绦虫总 RNA,按 Prime Script Reverse Transcriptase反转录试剂盒操作步骤合成cDNA第一链,用TsIR-4810特异性引物F1/R1和F2/R2分别进行PCR扩增。回收的PCR产物连接到pMD18-T载体,转化入大肠杆菌感受态细胞Dpα,挑取单克隆菌落进行PCR鉴定,阳性克隆送生工生物工程(上海)股份有限公司测序。
1.3TsIR-4810的序列分析与鉴定将获得的两段序列进行拼接,Blast进行相似性搜索;通过SMART对其进行结构域预测;利用MAFFT (-auto)进行序列比对,用ProtTest软件选择进化模型,并根据模型 (WAG+I+G+F),以最大似然法(PhyML软件)建立系统进化树(自展检验重复100次)。用在线软件PredictProtein和SWISS-MODEL预测其二级及3D结构。
1.4TsIR-4810配体结合结构域(LBD)的表达
1.4.1引物的设计针对TsIR-4810的LBD区设计引物,截去其信号肽序列,引入BamH I、XhoI酶切位点(下划线部分为酶切位点)。引物由生工生物工程股份有限公司合成。F3:5′-CGCGGATCCGTCGCGACAGAGAATGGCTGTGCTT-3′,F4:5′-CCGCTCGAGCGATTCATCCGTAGCGTGACGCTAT-3′。
1.4.2表达载体的构建以测序正确的质粒为模板,用上述表达引物PCR扩增获得LBD序列。回收纯化的目的片段和原核表达载体pET-30a(+)分别用BamH I和XhoI双酶切,回收酶切产物,16 ℃连接过夜。转化BL21感受态细胞,双酶切和PCR鉴定为阳性的克隆,送生工生物工程(上海)股份有限公司测序。
1.4.3重组菌株的诱导表达取携带pET-TsIR-LBD阳性质粒的BL21菌液,按1∶100接种于K+的2×YT培养基液中,37 ℃,220 r/min培养至OD600nm=0.6~0.8,加入IPTG至终浓度为0.3 mmol/L ,继续培养6 h,SDS-PAGE电泳,检测目的蛋白的表达情况。
1.5表达产物的Western-blot检测收集菌体,经反复冻融及超声波处理后,按照Invitrogen公司镍琼脂糖凝胶FF操作说明纯化目的蛋白。将纯化后的样品进行SDS-PAGE电泳,用半干电转仪在23 V恒压下转印30 min,于5%脱脂奶粉4℃封闭过夜;加入1∶2 000倍稀释的His抗体,室温振荡孵育1.5 h;PBST充分洗涤后,加入兔抗鼠IgG(1∶20 000倍稀释),室温下振荡孵育1 h;加入DAB显色。
2结果
2.1猪带绦虫TsIR-4810的鉴定
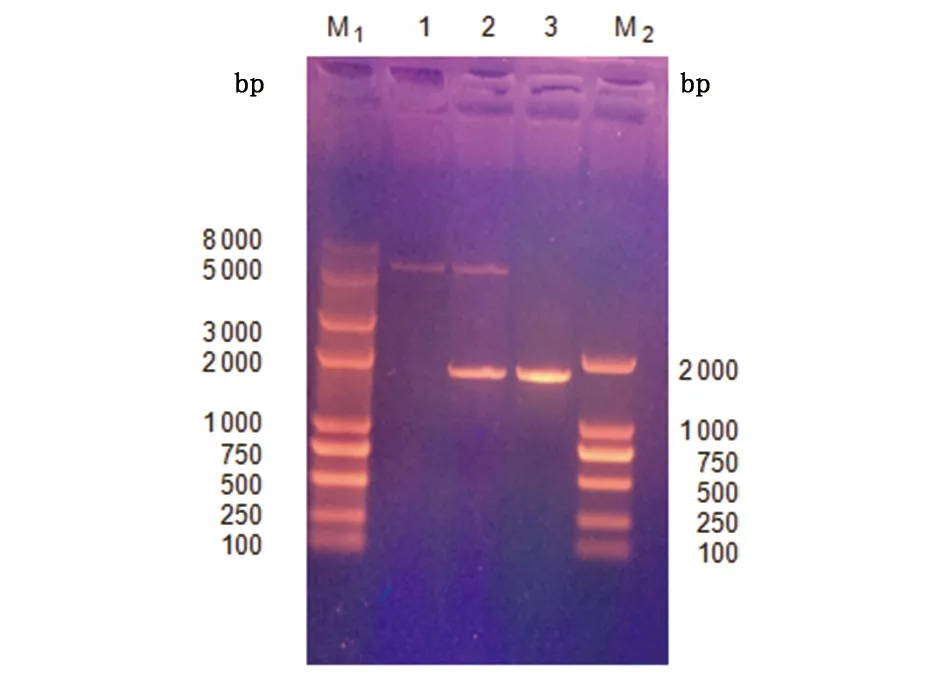
2.1.1TsIR-4810的克隆及序列分析PCR产物电泳(图1)及测序结果显示,两段目的序列的长度分别为1 753 bp和3 234 bp,拼接后TsIR-4810的ORF全长为4 920 bp。

1:TsIR-4810-1;2:TsIR-4810-2;M:DNA标志物1:Amplification of TsIR-4810-1;2:Amplification of TsIR-4810 -2;M:DNA Maker图1 猪带绦虫TsIR-4810的分段PCR扩增Fig.1 Amplification of TsIR-4810 fragment
2.1.2蛋白的结构域及系统进化Blast比对显示,TsIR-4810与细粒棘球绦虫和多房棘球绦虫胰
岛素受体2核苷酸和氨基酸的同源性均在80%以上,而与其他物种的胰岛素受体I核苷酸和氨基酸的相似性均在40%左右。与人、血吸虫、秀丽杆线虫、果蝇、棘球绦虫胰岛素受体的氨基酸序列比对表明,TsIR-4810与所比较的物种胰岛素受体一样,均具有相对保守的结构域,包括分泌信号肽、受体L1(58-179aa)和L2(405-519aa)结构域、FnⅢ结构域(553-690aa,705-945aa,1026-1162aa)、跨膜区(1182-1204aa)、受体酪氨酸激酶(1245-1571aa)区等。胰岛素受体配体结合结构域(LBD)的氨基酸序列比较表明,该区有17个半胱氨酸(Cys)和11个亮氨酸(Leu)残基在所有物种间完全一致,说明这些位点非常保守。从构建的胰岛素受体家族成员系统发育树可以看出,绦虫和吸虫的两条胰岛素受体可以明显的聚为两类(IR1和IR2),而TsIR-4810与EmIR-1和SjIR-1聚在一起,说明他们间亲缘关系较近。
2.1.3TsIR 蛋白二级结构及3D结构预测预测显示,TsIR-4810二级结构中α-螺旋(H)占27.5%,β-折叠(E)占14.8%,无规则卷曲(L)占57.7%。TsIR-4810 LBD结构域的3D模型与人的IR-LBD空间结构相似,均呈倒“V”型布局。V型的一条臂由L1结构域、富半胱氨酸结构域和L2结构域组成,另一个臂由部分FnⅢ结构域构成。
2.2TsIR-4810 LBD重组质粒的构建及鉴定重组质粒pET-TsIR-LBD经BamH I和XhoI双酶切,得到6 000 bp左右载体条带和1 687 bp左右的目的条带(图2)。说明TsIR-4810 LBD片段成功插入表达载体中。测序结果表明,TsIR-4810 LBD片段长度为1 687 bp,编码562个氨基酸。
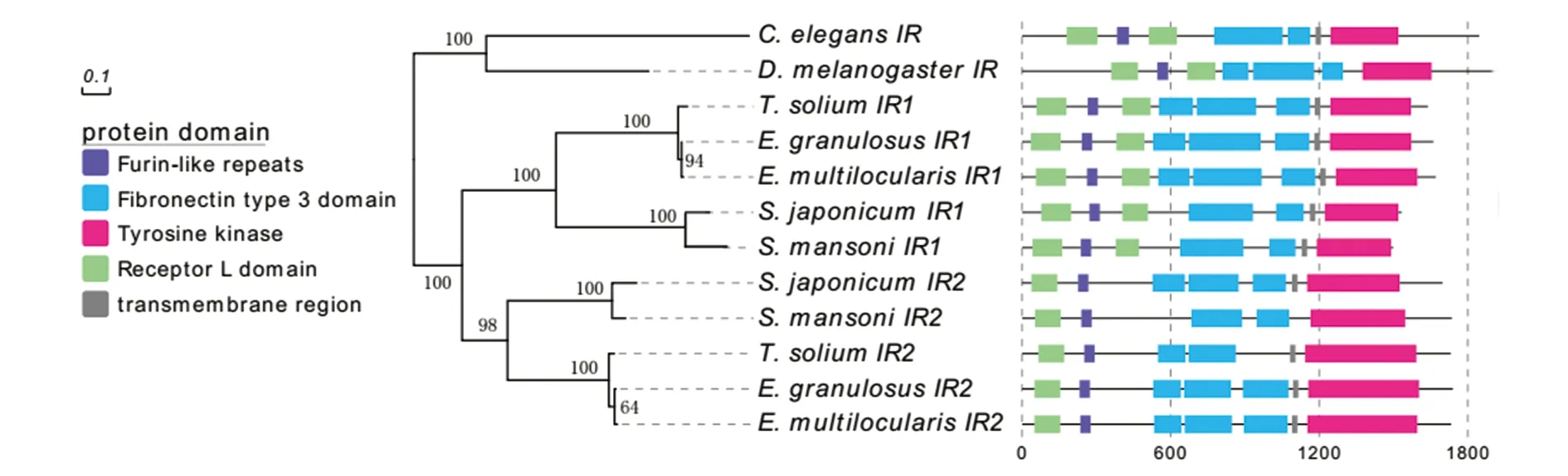
C.elegans:秀丽隐杆线虫Caenorhabditis elegans;D.melanogaster:果蝇Drosophila melanogaster;T.solium:猪带绦虫Taenia solium;E.granulosus:细粒棘球绦虫Echinococcus granulosus;E.mmultilocularis:多房棘球绦虫Echinococcus multilocularis;S.japonicum:日本血吸虫Schistosoma japonicum;S.mansoni:曼氏血吸虫Schistosoma mansoni;IR:胰岛素受体Insulin receptor图2 不同物种IR基因的结构域及系统进化分析Fig.2 Phylogenetic analysis of IR from different species
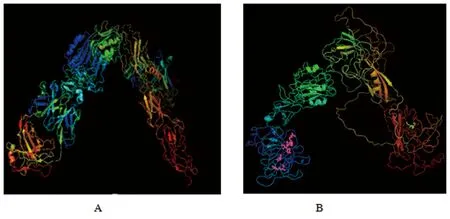
A:人胰岛素; B:猪带绦虫胰岛素受体TsIR-4810A:HIR; B:TsIR-4810图3 TsIR-4810与HIR的3D结构比较Fig.3 3D structural comparison of HIR and TsIR-4810
2.3重组蛋白的表达及鉴定SDS-PAGE结果表明,在2×YT培养基中于30 ℃、IPTG终浓度0.3 mmol/L 的条件下诱导6 h,重组蛋白的表达量达到最大值。重组蛋白的分子质量约为63 ku,与理论推导值相一致。诱导表达的菌体经超声波处理后的上清和沉淀分别进行SDS-PAGE电泳,结果目的蛋白90%以包涵体形式存在。Western-blot分析表明,目的蛋白可与抗His标签的抗体反应。
M:DNA标志物;1:pET-TsIR-LBD质粒;2:pET-TsIR-LBD双酶切产物;3:TsIR-LBD的PCR产物;M:DNA Maker;1:recombinant plasmid pET-TsIR-LBD;2:identification of pET-TsIR-LBD3:product of TsIR-LBD图4 重组质粒pET-TsIR-LBD的双酶切鉴定Fig.4 Identification of the recombinant plasmid pET-TsIR-LBD

M :蛋白质分子质量标准;1:沉淀;2:上清;3:pET-30a对照M:Protein molecular weight marker;1:Supernatant after ultrasonic disruption;2:Pellets after ultrasonic disruption;3:pET-30a vector control图5 重组蛋白pET-TsIR-LBD的表达(A)和Western-blot分析(B)Fig.5 Expression(A)and Western-blot analysis of the recombinant protein pET-TsIR-LBD
3讨论
TsIR-4810的全长为4 920 bp,以β亚基跨膜区为界,分为胞内和胞外两部分。胞外结构域包括: 富含亮氨酸的L1和L2 结构域、一个位于L1和L2之间富含Cys的结构域和3个类纤连蛋白(FnⅢ)结构域。TsIR-4810的LBD区与其他胰岛素受体2(IR2)相比,多一个受体L2结构域和一个FnⅢ结构域,而这正好与血吸虫和棘球绦虫的胰岛素受体1(IR1)的结构特征相似。说明TsIR-4810可能是猪带绦虫胰岛素受体1(TsIR1),这也许正与我们发现的猪带绦虫存在两个胰岛素样基因(ILP7748和ILP7750)相吻合,即每种胰岛素可能对应一种胰岛素受体,不同的受体可能承担不同的功能。TsIR-4810与猪带绦虫另一个受体TsIR-1316相比,虽然多出一个L2结构域和一个FnⅢ结构域,但TsIR4810在1221-1224aa缺失胰岛素受体底物(IRS)结合的NPXY序列。而棘球绦虫的EmIR1和EgIR1在1134位均有NPXY的保守序列。结构决定其功能,根据这一特征推测TsIR-4810在功能上可能与EmIR2、EgIR2更为相似。绦虫胰岛素受体2都缺失NPXY序列,暗示这两个受体在进化过程中可能发生了功能分化。线性动物门和节肢动物门仅有一条胰岛素受体,而绦虫和吸虫都存在两条胰岛素样受体,绦虫和吸虫祖先这种独特的IR进化模式推测与其寄生生活相关。通过对TsIR-4810磷酸化位点的分析预测,发现其可能的蛋白激酶磷酸化位点有Tyr16个、Thr23个、Ser71个,具有典型的胰岛素受体酪氨酸激酶结构域 (TKD)。三级结构预测表明,尽管TsIR-4810与人的胰岛素间氨基酸序列差异较大,但TsIR-4810还是具有胰岛素受体保守的倒“V”型空间结构。氨基酸序列比对、二级结构和三级结构预测和系统进化分析均证明,TsIR4810为猪带绦虫的胰岛素受体基因。
You[10]等的研究表明,胰岛素受体或配体结合区可作为疫苗或药物靶标预防寄生蠕虫病。既然胰岛素能够通过与其受体结合调节虫体的生长、发育,那么是否可以用药物或抗体阻断或封闭宿主胰岛素的作用,从而达到抑制虫体生长发育的目的。鉴于血吸虫胰岛素受体重组LBD疫苗的成功尝试,本研究针对猪带绦虫TsIR-4810的LBD区设计引物,在大肠杆菌中进行了成功表达。通过表达条件的优化,获得了目的蛋白的高效表达。为进一步研究LBD抗体体外抑制猪囊尾蚴的葡萄糖吸收和胰岛素受体的磷酸化,探索以TsIR-4810 LBD为重组抗原疫苗的免疫效果奠定了基础。
参考文献:
[1] Ito A,Wandra T,Subahar R,et al.Recent advances in basic and applied science for the control of taeniasis/cysticercosis in Asia[J].Southeast Asian J Trop Med Public Health,2002,33:79-82.
[2] Eddi C,Nari A,Amanfu W.Taenia solium cysticercosis/taeniosis:potential linkage with FAO activities[J].Acta Tropica,2003,87(1):145-148.DOI:10.1016/S001-706X(03)0037-8.
[3] Ito A,Urbani C,Qiu J,et al.Control of echinococcosis and cysticercosis:a public health challenge to international cooperation in China[J].Acta Tropica,2003,86(1):3-17.DOI:10.1016/S0001-706X(02)00269-3.
[4] Santiago R,Gaunt TR, Day IN.Molecular genetics of human growth hormone,insulin-like growth factors and their pathways in common disease[J].Hum Genet,2007,122(1):1-21.DOI:10.1007/s00439-007-0378-3.
[5] De Meyts P,Whitaaker J.Structural biology of insulin and IGF1 receptor:implications for drug design[J].Nat Rev Drug Discov,2002,1(10):769-783.DOI:10.1038/nrd917.
[6] You H,Zhang W,Jones MK,et al.Cloning and characterisation ofSchistosomajaponicuminsulin receptors[J].PLoS One,2010,5(3):e9868.DOI: 10.1371/journal.pone.0009868.
[7] Khayath N,Vicogne J,Ahier A,et al.Diversification of the insulin receptor family in the helminth parasiteSchistosomamansoni[J].Febs J,2007,274(3):659-676.DOI:10.1111/j.1742-4658.2006.05610.x
[8] Konrad C,Kroner A,Spiliotis M,et al.Identification and molecular characterisation of a gene encoding a member of the insulin receptor family inEchinococcusmultilocularis[J].Int J Parasitol,33:301-312.DOI:10.1016/S0020-7519(02)00265-5.
[9] You H,Gobert GN,Duke MG,et al.The insulin receptor is a transmission blocking veterinary vaccine target for zoonoticSchistosomajaponicum[J].Int J Parasitol,2012,42(9):801-807.DOI:10.1016/j.ijpara.2012.06.002
[10] You H,Zhang W,Moertel L et al.Transcriptional profiles of adult male and femaleSchistosomajaponicumin response to insulin reveal increased expression of genes involved in growth and development [J].International Journal Parasitology,2009,39(14):1551-1559.DOI: 10.1016/j.ijpara.2009.06.006.
DOI:10.3969/j.issn.1002-2694.2016.05.005
通讯作者:骆学农,Email:luoxuenong@caas.cn
中图分类号:R383
文献标识码:A
文章编号:1002-2694(2016)05-442-05
Corresponding author:Luo Xue-nong,Email: luoxuenong@caas.cn
收稿日期:2015-11-21修回日期:2016-03-18
Identification and characterisation ofTaeniasoliuminsulin receptor TsIR-4810 and expression of the ligand binding domain
WEI Yan-ling, GUO Ai-jiang, LIU Guang-xue,YANG Rui,ZHANG Shao-hua, HOU Jun-ling, LUO Xue-nong
(1.StateKeyLaboratoryofVeterinaryEtiologicalBiology/KeyLaboratoryofVeterinaryPublicHealth,MinistryofAgriculture/KeyLaboratoryofVeterinaryParasitologyofGansuProvince/LanzhouVeterinaryResearchInstitute,ChineseAcademyofAgriculturalSciences,Lanzhou730046;2.JiangsuCo-innovationCenterforPreventionandControlofImportantAnimalInfectiousDiseasesandZoonoses,Yangzhou225009,China)
Abstract:Taenia solium insulin receptor 4810 (TsIR-4810) was identified, and its ligand binding domain (LBD) was cloned and expressed in the present study. Two pairs of specific primers were designed and used to amplify overlapping segments of the complete TsIR-4810 receptor gene. The complete ORF was confirmed by sequencing. Homology analysis of TsIR-4810 gene was conducted using BLAST and the domain of its encoding protein was predicted by SMART software. Tertiary structure for TsIR-4810 was predicted by SWISS-MODEL. Phylogenetic analysis was performed using PhyML. LBD fragment of TsIR-4810 gene was cloned into the PET-30a vector and expressed after induction with IPTG. The expressed product was identified by SDS-PAGE and Western-blot analysis.The full length cDNA of TsIR-4810 was 4 920 bp. The comprehensive analyses of its amino acid sequence revealed the peptide showed the common features shared by other members of the insulin family, including an insulin-like motif, signal sequence and conserved domain of tyrosine kinase family. The recombinant protein was successfully expressed in E. coli BL21 (DE3) and the molecular mass of the protein was estimated to be 63 kDa. Western
blotting with anti-His antibody revealed a specific reactivity with recombinant protein and showed the successful expression in the prokaryotic system. The results showed that TsIR-4810 identified was insulin receptor from T. solium, providing the foundation for further studies on its physiological function and development of new vaccines and biological drugs.
Key words:Taenia solium; insulin receptor;identification; ligand binding domain; expression Supported by the National Natural Science Foundation for China (No.31372433)
国家自然科学基金项目(No.31372433)资助
