木聚糖酶Xyn43A基因在大肠杆菌及毕赤酵母中的表达比较
2016-07-21周晨妍刘振华王丹丹李同彪朱新术王燕
周晨妍,刘振华,王丹丹,2,李同彪,朱新术,王燕
1(新乡医学院 生命科学技术学院,合成生物学改造工程与应用实验室,河南 新乡,453003)2(新乡医学院 三全学院,河南 新乡,453003)
木聚糖酶Xyn43A基因在大肠杆菌及毕赤酵母中的表达比较
周晨妍1*,刘振华1,王丹丹1,2,李同彪1,朱新术1,王燕1
1(新乡医学院 生命科学技术学院,合成生物学改造工程与应用实验室,河南 新乡,453003)2(新乡医学院 三全学院,河南 新乡,453003)
摘要根据木聚糖酶Xyn43A基因序列,设计特异性引物,以pMD18-T-Xyn43A重组质粒为模板克隆Xyn43A成熟肽基因,将该基因分别克隆到大肠杆菌表达载体pET-28a和毕赤酵母表达载体pPIC9K中,分别在大肠杆菌BL21及毕赤酵母GS115中表达。重组酶在大肠杆菌中胞内表达,比酶活力可达61.43 U/mg。重组酶在毕赤酵母中分泌表达,比酶活力可达145.24 U/mg。酶学性质显示,BL21-Xyn43A、GS115-Xyn43A重组酶最适温度、pH相同均为45 ℃、pH 5.0。GS115-Xyn43A温度稳定性、pH稳定性均优于BL21-Xyn43A。
关键词黑曲霉;木聚糖酶;大肠杆菌;毕赤酵母;表达
木聚糖是自然界中广泛存在的一种多糖,它的降解需要多种酶的共同参与,木聚糖酶是其中十分重要的一类酶[1],目前已广泛应用于工业生产中[2-3]。很多微生物,例如:芽孢杆菌、酵母菌、曲霉、青霉、镰刀菌等都可产生木聚糖酶[4-5]。木聚糖酶种类很多,分布于糖基水解酶GH5,7,8,10,11,16,43,52及62多个家族,目前报道的木聚糖酶主要归属于GH10和GH11两大家族[6-8],其他家族的木聚糖酶报道偏少。
我们在前期的研究过程中从实验室保藏的黑曲霉(Aspergillusniger)XZ-3S中克隆出木聚糖酶Xyn43A基因,并对其进行了详细的生物信息学分析,研究发现它属于糖基水解酶GH43家族,是一种新的木聚糖酶基因,Genbank登录号为JQ700383[9]。本研究将Xyn43A基因在大肠杆菌及毕赤酵母中表达,并对重组酶的酶学性质进行了初步研究,以期对该酶更好的结构与功能研究奠定基础。
1材料与方法
1.1菌株、质粒与试剂
黑曲霉(Aspergillusniger)XZ-3S,大肠杆菌(Escherichiacoli)JM109、DH5α、BL21(DE3),由作者所在实验室保存;pMD18-T-Xyn43A重组质粒,由作者所在实验室构建保存;原核表达质粒pET-28a,购自Novagen公司;真核表达质粒pPIC9K及毕赤酵母(Pichiapastoris)GS115,购自Invitrogen公司;DNA聚合酶、限制性内切酶、连接酶、IPTG、X-gal,购自TaKaRa公司;氨苄青霉素(Amp)、卡那霉素(Kan),购自Sangon公司;胶回收试剂盒、质粒提取试剂盒,购自Sangon公司;DNA Marker,购自MBI公司;溴化乙锭(Ethidium bromide),购自Amresco公司;酵母粉、蛋白胨、琼脂糖,购自BBI公司;G418、无氨基酵母氮源(YNB),购自Amresco公司;桦木木聚糖购自Sigma公司;其他生化试剂均为国产或进口分析纯产品。
1.2培养基
大肠杆菌用LB培养基培养,具体配方见参考文献[10]。毕赤酵母培养所用YPD、MD、BMGY、BMMY培养基的配方参照Invitrogen公司的毕赤酵母操作手册。
1.3目的基因的克隆及重组表达载体的构建
根据实验室已克隆得到的木聚糖酶Xyn43A基因序列(Genbank:JQ700383)以及原核表达载体pET-28a、真核表达载体pPIC9K的多克隆位点,设计以下3条引物:
Y1:5′- CCGGAATTCAATCCCGTCTTCCCCGGCT-3′(EcoRⅠ酶切位点);
Y2:5′- CCCAAGCTTCTACGATAAAGTCCTCCCCT-3′(Hind Ⅲ酶切位点);
Z1:5′- ATAAGAATGCGGCCGCCTACGATAC ̄G ̄A ̄T ̄A ̄A ̄A ̄G ̄T ̄C ̄CTCC -3′(NotⅠ),其中引物Y1、Y2扩增产物用于大肠杆菌重组表达载体的构建,引物Y1、Z1扩增产物用于毕赤酵母重组表达载体的构建。引物由苏州金唯智生物科技有限公司合成。
以pMD18-T-Xyn43A重组质粒为模板,分别以Y1/Y2,Y1/Z1为引物进行PCR扩增,扩增条件均为:94 ℃预变性2 min;94 ℃变性30 s,67 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。扩增产物回收后,与对应表达载体经双酶切、回收、连接。用于大肠杆菌表达的连接液转化E.coliJM109感受态细胞,用于毕赤酵母表达的连接液转化E.coliDH5α感受态细胞,转化液分别涂布含Kan和Amp的LB平板,阳性克隆子筛选后,提取质粒经酶切及PCR验证,最终获得重组质粒pET-28a-Xyn43A、pPIC9K-Xyn43A。
1.4目的酶的表达
1.4.1 目的酶在大肠杆菌中的表达
将重组质粒pET-28a-Xyn43A转化感受态大肠杆菌BL21(DE3)菌株,转化液涂布含Kan 100 μg/mL的LB平板,所得阳性克隆子定义为BL21-Xyn43A。同时以pET-28a空质粒转化BL21(DE3)所得BL21-pET-28a为对照菌株。将目的菌株及对照菌株的过夜液体培养物,分别按1∶50的接种量接于30 mL含Kan的LB培养基中,230 r/min振荡培养3 h,待A600值达到0.6左右时,分别加入IPTG至终浓度为2.5 mmol/L,28 ℃诱导培养3 h。
1.4.2目的酶在毕赤酵母中的表达
重组质粒pPIC9K-Xyn43A经SalⅠ酶切线性化后,电泳回收目的片段,参照Invitrogen公司操作手册,电击转化毕赤酵母GS115。转化液涂布MD平板,筛选出的阳性克隆子经不同G418浓度的YPD平板初筛,摇瓶复筛,最后获得1株重组木聚糖酶产量较高的菌株,记作GS115-Xyn43A。pPIC9K空载体经上述同步操作,经G418浓度梯度YPD平板筛选获得的对照菌株记作GS115-pPI。分别挑取GS115-Xyn43A和GS115-pPI菌落,接种于含有30 mL BMGY培养基的250 mL的三角瓶中,30 ℃,250 r/min培养至A600值为6.0左右,三角瓶静置30 min,待菌体沉降后,倾去上清,沉淀菌体转接入20 mL BMMY培养基,继续培养诱导表达120 h,期间每24 h补加100%甲醇至终浓度为2.25%。
1.5重组酶的纯化
1.5.1大肠杆菌重组酶的纯化
将重组大肠杆菌培养液10 000 r/min,离心10 min,菌体沉淀用10 mL磷酸氢二钠-柠檬酸缓冲液(pH 5.0)悬浮,冰水浴中超声波破碎菌体(超声条件:功率400 W,间隔5 s,工作5 s,超声40次),超声破碎液,12 000 r/min,离心10 min,上清液即为重组酶粗酶液。重组酶纯化采用镍金属螯合层析柱,具体方法参见文献[10],纯化后样品检测用SDS-PAGE电泳(5%浓缩胶和12%分离胶)。
1.5.2毕赤酵母重组酶的纯化
将重组酵母培养液,3 000 r/min,离心10 min,取发酵上清液聚乙二醇浓缩,透析,后经Sephadex G-75纯化,纯化后样品检测用SDS-PAGE电泳(5%浓缩胶和12%分离胶)。
1.6重组酶活力及蛋白浓度的测定
木聚糖酶活力测定,采用DNS法,具体参见文献[11]。酶活力单位(U)定义:以0.5%桦木木聚糖为底物,在45 ℃、pH 5.0条件下,以每分钟产生1 μmol还原糖所需的酶量为1U。
蛋白浓度测定采用Bradford法[12],标准蛋白为牛血清白蛋白。
本论文重组酶活力采用比酶活力表示,比活力(U/mg)为酶活力与蛋白浓度的比值。
1.7重组酶酶学性质的测定与比较
测定重组酶的最适作用温度、pH值及温度、pH值对重组酶稳定性的影响,具体方法参见文献[13]。在每一组性质的测定中,以比酶活力最高值为100%计算各因素的相对酶活力。
1.8数据的统计学分析
每个实验进行3次重复,取其平均值,最终实验数据均用Excel办公软件和SPSS11.0软件进行处理,并绘制出相应的变化曲线。
2 结果与分析
2.1目的基因的克隆及重组表达载体的构建

M-DNA Marker;1-pPIC9K-Xyn43A双酶切产物;2-Y1/Z1引物PCR扩增产物;3-pET28a-Xyn43A双酶切产物;4-Y1/Y2引物PCR扩增产物图1 重组表达载体的PCR和酶切验证Fig.1 Verification of recombinant plasmids by PCR and restriction analysis
以pMD18-T-Xyn43A重组质粒为模板,以Y1/Y2为引物PCR扩增的目的条带及以Y1/Z1为引物扩增的目的条带(电泳图谱未显示)大小均与理论值相符。将目的条带割胶回收后与pET-28a、pPIC9K分别酶切、回收、连接,连接液分别转化指定感受态细胞后,经抗生素平板筛选的阳性克隆子,提取质粒经酶切与PCR验证(图1),最终获得重组质粒pET-28a-Xyn43A、pPIC9K-Xyn43A。
2.2目的酶在大肠杆菌中的表达及纯化
pET-28a-Xyn43A重组质粒转化大肠杆菌,诱导表达后重组木聚糖酶比酶活力可达61.43 U/mg。诱导表达后的菌体细胞经1×SDS上样液煮沸裂解后,进行SDS-PAGE电泳(图2a)。重组质粒在分子质量34.5 kDa处有明显条带(图2a泳道2),而未诱导的重组菌、诱导的对照菌株及未诱导的对照菌株均未检测到目的条带(图2a泳道3、4、5)。以低分子质量标准蛋白为标准,凝胶电泳经计算机扫描,依据蛋白条带染色的强度,利用Quantity One凝胶分析软件定量分析显示,诱导3 h,目的蛋白表达量占细菌总蛋白量的11.3%。
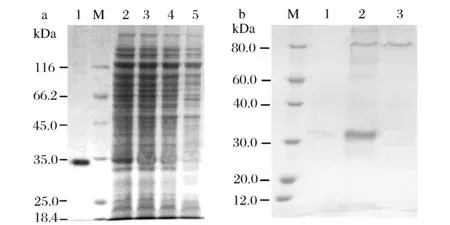
(a)M-蛋白质Marker;1-BL21-Xyn43A重组酶纯化后;2-BL21-Xyn43A/IPTG;3-BL21-Xyn43A/未IPTG;4-BL21-pET/IPTG;5- BL21-pET/未IPTG;(b) M-蛋白质Marker;1-GS115-Xyn43A重组酶纯化后;2-甲醇诱导GS115-Xyn43A重组菌发酵上清液;3-甲醇诱导GS115-pPI对照菌发酵上清液图2 SDS-PAGE电泳检测表达产物Fig.2 Detection of expression products by SDS-PAGE
重组酶分子质量略大于Xyn43A基因理论预测分子量33.47 kDa[9],这主要是由于我们表达用的Xyn43A基因为Xyn43A的成熟肽基因,没有起始密码子,表达过程中利用了pET-28a的ATG密码子,因此表达的外源蛋白融合进了一段pET-28a序列所编码的长度为36个氨基酸的肽段。重组酶经镍柱纯化后(图2a泳道1),可用于后续酶学性质的测定。
2.3目的酶在毕赤酵母中的表达及纯化
重组菌GS115-Xyn43A经诱导培养后,在发酵上清液中检测到木聚糖酶活性,木聚糖酶比酶活力可达145.24 U/mg,在同样条件下诱导培养的对照菌株GS115-pPI发酵上清液检测不到木聚糖酶活性。SDS-PAGE电泳图谱中重组菌GS115-Xyn43A发酵上清液目的位置相较对照菌株GS115-pPI发酵上清液显示出特异性蛋白条带(图2b泳道2、3)。Quantity One凝胶分析软件定量分析显示,重组菌GS115-Xyn43A诱导120 h,目标蛋白表达量占分泌蛋白总量的88.3%。
重组菌GS115-Xyn43A发酵液纯化后进行SDS-PAGE电泳(图2b泳道1),在33.5 kDa位置出现单一蛋白条带,与理论分子质量基本相符。电泳检测重组酶纯度满足后续酶学性质测定的要求。
2.4重组酶酶学性质的测定与比较
重组酶Xyn43A在大肠杆菌及毕赤酵母中表达后的最适温度均为45 ℃(图3)。

图3 重组酶的最适作用温度Fig.3 The optimal temperature of the recombinant enzymes
经毕赤酵母表达的重组酶GS115-Xyn43A温度稳定性明显好于大肠杆菌表达的重组酶BL21-Xyn43A(图4)。在50 ℃保温不同时间,GS115-Xyn43A酶活力变化不大;而BL21-Xyn43A在该温度下仅保温10 min,酶活力就下降到初始酶活力的22%。在55 ℃保温25 min,GS115-Xyn43A酶活力为初始酶活力的55%,同等条件下BL21-Xyn43A酶活力就下降到初始酶活力的11.5%。
重组酶Xyn43A在大肠杆菌及毕赤酵母中表达后的最适pH均为pH 5.0(图5)。pH稳定性曲线显示,GS115-Xyn43A在pH 3.5~pH 8.0的范围内保持60%的相对酶活力,此范围略宽于BL21-Xyn43A的pH 4.0~pH 7.0(图6)。

图5 重组酶的最适作用pHFig.5 The optimal pH of the recombinant enzymes
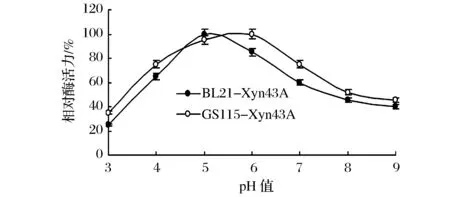
图6 重组酶的pH稳定性Fig.6 pH stability of the recombinant enzymes
3讨论
木聚糖酶作为一种重要的酶制剂,近年来,研究者对其进行了大量研究,研究重点已经从传统的发酵产酶菌株发展转向为通过各种分子生物学技术将木聚糖酶在异源的宿主细胞中进行表达。木聚糖酶基因在原核细胞中的表达以大肠杆菌研究最多[14]。大肠杆菌繁殖速度快,是相对理想的宿主细胞,但是由于其是原核生物,细胞外存在细胞壁,必须先将细胞壁破碎后才能将目的蛋白释放出来,而真核细胞克服了原核细胞的这一缺点,能够将表达的目的蛋白分泌到细胞外。能够表达木聚糖酶的真核细胞以酿酒酵母和毕赤酵母作为代表[15],毕赤酵母表达系统简单,含有强的启动子,有利于外源基因在体内的高效表达。
本研究对A.nigerXZ-3S来源的一GH43家族木聚糖酶基因Xyn43A进行了大肠杆菌原核表达及毕赤酵母真核表达研究,Xyn43A在两种表达体系中均获得异源活性表达。重组酶纯化后酶学性质的差异,可能是由于毕赤酵母表达真核蛋白具有翻译后修饰功能,而大肠杆菌作为原核生物不具备这种功能所致。
参考文献
[1]ZHANG H M,LI J F,WANG J Q,et al.Determinants for the improved thermostability of a mesophilic family 11 xylanase predicted by computational methods[J].Biotechnology for Biofuels,2014,7(1): 1-10.
[2]叶杭,张文昌,邹长连,等.木聚糖酶对稻草青贮饲料品质的影响[J].中国农学通报,2015,31(11):45-49.
[3]漆雯雯,高超,何生,等.小麦型日粮添加重组葡聚糖酶和木聚糖酶对蛋鸡产蛋性能和蛋品质的影响[J].中国饲料,2015(6):21-24.
[4]宫晓,郑喜群,刘晓兰,等.脉孢霉固体发酵产木聚糖酶的条件研究[J].粮食与饲料工业,2015(6):51-55.
[5]赵联正,谢占玲,赵朋.一种新的镰刀菌Q7-31木聚糖酶Xyn9的分离纯化鉴定及酶学特性[J].江苏农业科学,2015,43(5):42-45.
[6]林源清,张光亚.G/11木聚糖酶最适pH值的预测及其与氨基酸位置的关系[J].华侨大学学报(自然科学版),2014,35(3):316-320.
[7]龚燕燕,朱天地,殷欣,等.糖苷水解酶第10家族真菌木聚糖酶保守区及进化关系的分析[J].中国生物制品学杂志,2014,27(1):46-51.
[8]HENRISSAT B,BAIROCH A.Updating the sequence-based classification of glycosyl hydrolases[J].Biochemical Journal,1996,316(2):695-696.
[9]周晨妍,王燕,朱新术,等.黑曲霉木聚糖酶Xyn43A基因的克隆和生物信息学分析[J].生物技术,2015,25(3):217-222,237.
[10]付冠华,刘振华,王丹丹,等.黑曲霉木聚糖酶(xynZF-2)基因克隆、表达及酶学性质分析[J].中国酿造,2012,31(11):78-82.
[11]TAN Z B,TANG C D,WU M C,et al.Exploration of disulfide bridge and N-glycosylation contributing to high thermostability of a hybrid xylanase[J].Protein and Peptide Letters,2014,21(9):657-662.
[12]BRADFORD M M.A rapid sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Annual Biochemistry,1976,72:248-254.
[13]周晨妍,王武,邬敏辰.突变木聚糖酶基因xynIIC*在毕赤酵母中的表达及酶学性质研究[J].食品与发酵工业,2009,35(10):19-22.
[14]王丹丹,周晨妍,付冠华.木聚糖酶基因克隆和表达的研究进展[J].中国生物制品学杂志,2013,26(8):1 193-1 196.
[15]杨梦华,李 颖,关国华.江正强极端耐热木聚糖酶基因在大肠杆菌和毕赤酵母中的高效表达[J].微生物学报,2005,45(2):236-240.
Expression of xylanaseXyn43Agene inEscherichiacoliandPichiapastoris
ZHOU Chen-yan1*,LIU Zhen-hua1,WANG Dan-dan1,2,LI Tong-biao1,ZHU Xin-shu1,WANG Yan1
1(Synthetic Biology Remaking Engineering and Application Laboratory,School of Life Science and Technology, Xinxiang Medical University, Xinxiang 453003, China)2(School of Sanquan, Xinxiang Medical University, Xinxiang 453003, China)
ABSTRACTThe gene of Xyn43A mature peptide was amplified with a template of the recombinant plasmid pMD18-T-xyn43A and specific primers designed according to the cDNA sequence of Xyn43A from Aspergillus niger XZ-3S. It was respectively inserted into vectors of pET-28a and pPIC9K and then transformed to Escherichia coli BL21 (DE3) and Pichia pastoris GS115, respectively. The recombinant xylanase was expressed in the cytoplasm of E. coli, and the specific activity of the recombinant enzyme was 61.43 U/mg. The enzyme was extracellular secretion in P. pastoris, and its specific activity was 145.24 U/mg. The optimum temperatures and pH values of BL21-Xyn43A and GS115-Xyn43A were both 45 ℃ and pH 5.0. The temperature stability and pH stability of GS115-Xyn43A were better than those of BL21-Xyn43A.
Key wordsAspergillus niger; xylanase; Escherichia coli; Pichia pastoris; expression
DOI:10.13995/j.cnki.11-1802/ts.201606003
基金项目:河南省科技攻关计划项目(162102210118);河南省教育厅科学技术研究重点项目(13A180861);河南省高等学校青年骨干教师资助计划项目(2011GGJS-125);新乡医学院科研项目培育基金(2013ZD113)
收稿日期:2016-01-16,改回日期:2016-03-03
第一作者:博士,副教授(本文通讯作者,E-mail:zhouchenyan2008@163.com)。
