匍枝根霉淀粉发酵产纤维素酶的条件研究
2016-07-21周若飞汤斌李松阚清华
周若飞,汤斌,李松,阚清华
(安徽工程大学 微生物发酵安徽省工程技术研究中心,安徽 芜湖,241000)
匍枝根霉淀粉发酵产纤维素酶的条件研究
周若飞,汤斌*,李松,阚清华
(安徽工程大学 微生物发酵安徽省工程技术研究中心,安徽 芜湖,241000)
摘要以匍枝根霉TP-02(Rhizopus stolonifer TP-02)为出发菌株,首次利用淀粉水解液为主要碳源,快速合成纤维素酶。从碳源、氮源、培养温度、初始pH、装液量和接种量等方面研究该菌株的产酶条件。获得最佳培养基和培养条件为:10%淀粉水解液,麸皮浸出汁5%,NH4Cl 0.5%,KH2PO40.5%,MgSO4·7H2O 0.4%,CaCl2 0.4%,酵母粉0.6%;发酵温度30 ℃,装液量80 mL/(250 mL),初始pH 5.0,接种量8%。通过摇瓶实验优化培养基和培养条件后,获得滤纸酶活为9.66 IU/mL。研究中进一步利用该培养基在5 L发酵罐中发酵至60 h时酶活达到最大值,其中滤纸酶活、外切酶活、内切酶活和β-葡萄糖苷酶分别为16.51、15.39、11.48和6.17 IU/mL。与以往纤维素类物质为碳源发酵产纤维素酶相比,淀粉水解液发酵获得的纤维素酶酶系组成有了较大的变化,特别是关键的外切酶活有了大幅度提高,而发酵时间缩短了将近1倍。
关键词匍枝根霉;淀粉水解液;发酵;纤维素酶
纤维素酶己在食品、医药、饲料、造纸和生物质能源等工业领域得到广泛的应用[1-2],但仍受限于居高不下的生产成本问题,主要表现为以下两个方面:其一,纤维素酶产生菌株的发酵酶活力相对较低,一直是大规模生产急需解决的问题,也是长期制约纤维素酶大量生产并限制其应用的主要因素[3];其二,目前使用的丝状真菌由于菌种特性和培养条件等因素使得纤维素酶发酵时间普遍较长,成本过高。因此,在目前纤维素酶的发酵生产和研究领域中,选择廉价易得的发酵碳源并大幅降低发酵时间依然是快速降低纤维素酶发酵成本的有效途径之一。已报道的可发酵产纤维素酶的碳源主要有工业纤维素、麦麸、农作物秸秆及乳糖等。自然界中,很多丝状真菌能利用这些碳源很好地产纤维素酶,且分泌的纤维素酶酶系完全,然而发酵时间长一直无法解决[4-5]。
目前研究纤维素类碳源发酵产纤维素酶比较多,真菌利用淀粉发酵产纤维素酶报道比较少[6-7]。本文以匍枝根霉为研究对象,滤纸酶活为主要考量目标,首次利用淀粉水解液作为主要碳源,研究淀粉水解液发酵产纤维素酶的条件,寻找出一种适合匍枝根霉利用淀粉水解液发酵产纤维素酶的工艺条件。
1材料与方法
1.1材料与仪器
1.1.1菌种
匍枝根霉TP-02(RhizopusstoloniferTP-02),本实验室从黄山生态林中采集并分离出1株高产纤维素酶菌种。
1.1.2培养基
(1)种子培养基(10%麸皮浸出汁):称取100 g麸皮,加入800 mL蒸馏水煮沸30 min,4层纱布过滤,定容至1 000 mL。
(2)20%淀粉水解液:称取200 g玉米淀粉放入1 000 mL烧杯中,加入800 mL蒸馏水和6 g高温α-淀粉酶,60 ℃水浴酶解30 min,定容至1 000 mL。
(3)液体发酵培养基:取500 mL 20%淀粉水解液和500 mL 10%麸皮浸出汁混匀后分别加入NH4Cl 0.5%,KH2PO40.5%,MgSO4·7H20 0.4%,CaCl20.4%,酵母粉0.6%,PEG4000 0.02%,微量元素液0.000 2%。
1.1.3试剂
分析纯微晶纤维素,水杨苷,购自上海生物工程有限公司;羧甲基纤维素钠,购自国药集团化学试剂有限公司;玉米淀粉,购自成武大地玉米开发有限公司;细菌高温α-淀粉酶(40 000 U/mg),购自山东龙元生物工程有限公司;双圈牌定量滤纸,购自杭州沃华滤纸有限公司;其他试剂均为国产分析纯。
1.1.4主要仪器和设备
QHZ-123B组合式全温度振荡培养箱; BIOTECH-5BG-15JSA-3000PLC 自动发酵罐;723可见分光光度计。
1.2实验方法
1.2.1种子活化
将超低温(-80 ℃)保存的菌种划线接种到PDA斜面上,于30 ℃恒温培养3 d。
1.2.2种子制备及发酵
用无菌水洗下培养3 d斜面上的孢子,并稀释至每毫升孢子浓度为108个,接入100 mL种子液中培养24 h后,按10% 接种量吸取种子液到80 mL产酶培养基中,每隔6 h取样并测发酵液相关酶活。每组3个平行,每个平行重复测定3次。以上培养条件均为200 r/min、30 ℃恒温振荡培养。
1.2.3酶活测定
粗酶液的制备:培养发酵12 h后,用移液器每隔6 h从产酶培养基中取1 mL酶液于1.5 mL离心管中,5 000 r/min离心10 min,取上清液用柠檬酸-柠檬酸钠缓冲液(0.05 mol/L,pH 4.8)进行适当稀释,用于测酶活。
滤纸酶活的测定:国际纯粹与应用化学联合会(International Union of Pure and Applied Chemistry,IUPAC)推荐的标准方法[8]测定。
CMC酶活的测定:以CMC为底物,采用文献[9]的方法测定。
CBH酶活的测定:以微晶纤维素为底物,采用文献[10]的方法测定。
β-葡萄糖苷酶酶活的测定:以水杨苷为底物,采用文献[11]的方法测定。
1.2.4碳氮源对产纤维素酶的影响
将匍枝根霉种子液以10%接种量接种到不同淀粉水解液的培养基中,研究主要碳源淀粉水解液对产纤维素酶的影响;以10%的接种量接种到含有0.4%的单一氮源(硫酸铵、氯化铵、硝酸铵、硝酸钾、尿素)培养基中,考察单一氮源对产纤维素酶的影响;再以10%的接种量接种到含有0.5%的不同有机氮源(蛋白胨、酵母粉、牛肉浸膏、酵母浸膏,豆饼粉)的复合氮源培养基中,研究复合氮源对产纤维素酶的影响。在此基础上,设计正交实验研究碳氮源对产纤维素酶的影响。菌株在上述条件下自然pH,装液量为80 mL,培养温度为30 ℃,200 r/min恒温摇床培养54 h,分别测定其滤纸酶活。
1.2.5培养条件对产纤维素酶的影响
以10%的接种量接种到80 mL产酶液体发酵培养基中,于不同培养温度26、28、30、32、34 ℃发酵产纤维素酶,研究培养温度对菌株产纤维素酶的影响;分别以2%、4%、6%、8%、10%的接种量接种到80 mL产酶发酵培养基中,于30 ℃恒温摇床培养,研究接种量对菌株产纤维素酶的影响;以10%的接种量接种到80 mL酶培养基中,调节培养基pH分别为3.0、3.5、4.0、4.5、5.0、5.5,于30 ℃恒温摇床培养,研究初始pH对产酶的影响;以10%的接种量接种不同体积(40、60、80、100、120 mL)的产酶培养基中,于30 ℃恒温摇床培养,考察装液量对产纤维素酶的影响;菌株在上述条件下于200 r/min恒温摇床振荡培养66 h。
1.2.6优化后的培养基上罐发酵产纤维素酶
在上述摇瓶发酵的基础上,进一步研究上罐发酵的产纤维素酶情况。在5 L发酵罐中,装液量为3.2 L,接种量为8%,发酵温度为30 ℃,pH为5.0,溶氧控制为25%左右发酵产纤维素酶,发酵12 h后每隔6 h取样测定发酵液的纤维素酶酶活。通过测定培养基优化后上罐发酵酶活力变化情况,确定此发酵培养基产酶效果及酶系配比。
2结果与分析
2.1碳氮源对产酶的影响
2.1.1淀粉水解液对产酶的影响
利用高温α-淀粉酶水解淀粉得到淀粉水解液作为主要碳源,发酵产纤维素酶,并分别从淀粉百分比、加酶量、水解温度与水解时间4个方面进行优化,结果如图1所示。确定淀粉百分比为10%、加酶量为0.3%、水解温度为60 ℃,水解时间为30 min,得到的淀粉水解液最适合发酵产纤维素酶。

A-不同水解时间,淀粉含量为15%,加酶量为0.2%,水解温度为70 ℃;B-不同加酶量,淀粉含量为15%,水解时间为30 min,水解温度为70 ℃;C-不同水解温度,淀粉含量为15%,加酶量为0.3%,水解时间为30 min;D-不同淀粉含量:加酶量为0.3%,水解时间为30 min,水解温度为60 ℃。图1 不同淀粉水解液对产酶的影响Fig.1 Effect of different starch hydrolyzate on enzyme production
2.1.2单一氮源对产纤维素酶的影响
由图2可知,相对于其他氮源,氯化铵为氮源时滤纸酶活最高,因此选择氯化铵作为无机氮源。

图2 氮源对产酶的影响Fig.2 Effect of different nitrogen on enzyme production
2.1.3复合氮源对产酶的影响
由图3可知,在0.4%的氯化铵无机氮源基础上添加0.5%的酵母粉有机氮源获得滤纸酶活最高,故选择添加0.5%的酵母粉。

图3 有机氮源对产酶的影响Fig.3 Effect of different organic nitrogen on enzyme production
2.1.4碳氮源正交实验
正交实验L9(33)设计见表1。
由实验结果可知,淀粉水解液、氯化铵、酵母粉对匍枝根霉产纤维素能力依次是淀粉水解液>氯化铵>酵母粉,即碳源淀粉水解液浓度对酶活影响最大,其次是氮源氯化铵浓度,最后是氮源酵母粉浓度。故选择酶活力最高的培养条件,即淀粉水解液10%、氯化铵0.5%、酵母粉0.6%。方差结果显示,其中碳源对匍枝根霉发酵产纤维素酶影响显著(P<0.05)(见表3)。

表1 正交实验设计
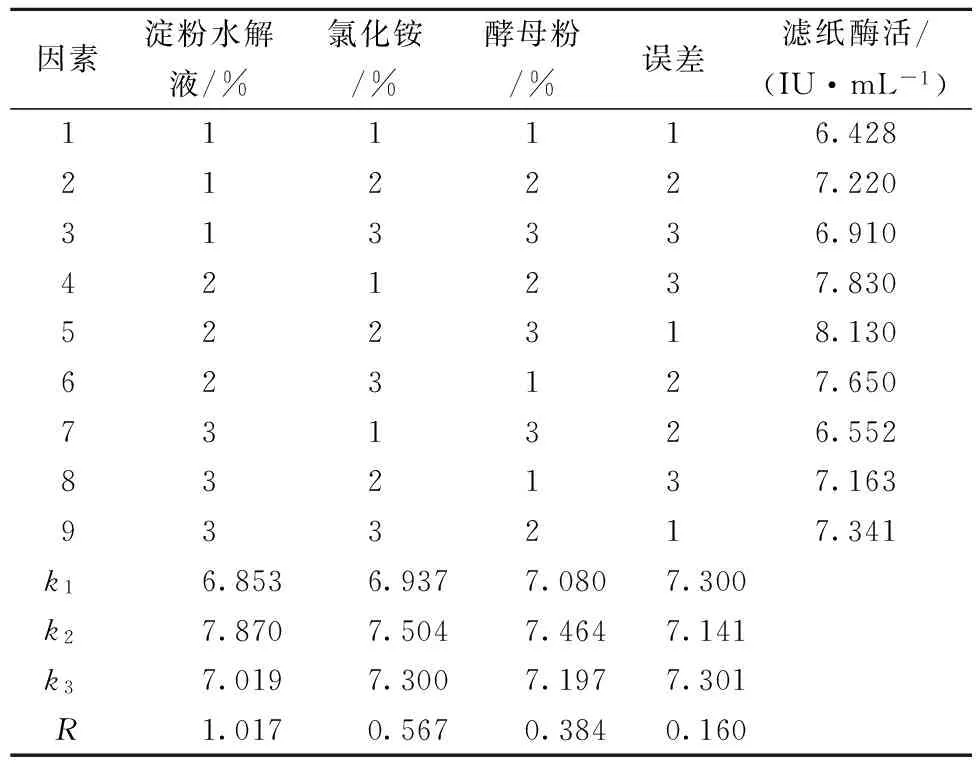
表2 正交实验结果

表3 实验结果方差分析
2.2发酵条件对产酶的影响
2.2.1温度对产酶的影响
由图4可知纤维素酶的合成与培养温度有较大的关系,在较低温度26 ℃时,由于菌株生长缓慢,酶活高峰期延长且酶活力比较低。当培养温度为30 ℃时,菌丝体旺盛生长,酶分泌增多,酶活力增大,54 h时滤纸酶活达8.12 IU/mL。但若温度持续升高,可能造成了菌株过早老化,酶分泌量减少,酶活力逐渐降低。
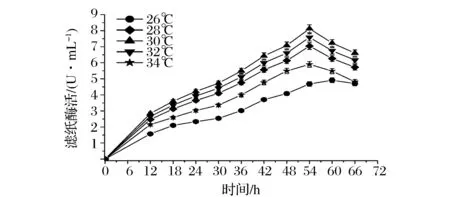
图4 不同温度对纤维素酶合成的影响Fig.4 Effects of different temperatures on cellulose production
2.2.2接种量对产酶的影响
由图5可知,接种量对产纤维素酶效果影响较为明显,接种量为2%时,生长缓慢,酶活最高点延迟且酶活力较小,当到接种量为8%时,产酶水平达到峰值,滤纸酶活为8.83 IU/mL,当接种量超过8%以后,产酶水平有所下降。

图5 不同接种量对纤维素酶合成的影响Fig.5 Effects of different inoculum size on cellulose production
2.2.3初始pH对产酶的影响
从图6可以看出在pH 3.0~5.0,随着pH的提高,滤纸酶活不断增加,pH 5.0时达9.05 IU/mL。pH超过5.0之后,产酶水平开始下降。

图6 不同pH对纤维素酶合成的影响Fig.6 Effects of different pH on cellulose production
2.2.4装液量对产酶的影响
由图7可知,随着装液量的增加,滤纸酶活逐渐上升,由于匍枝根霉发酵过程中耗氧比较快,当装液量超过80 mL,产酶水平不升反降,这是由于供氧不足,不利于匍枝根霉的生长与产酶。结果表明,250 mL三角瓶中装入80 mL培养基能获得最佳的产酶效果,滤纸酶活达9.66 IU/mL。

图7 装液量对纤维素酶合成的影响Fig.7 Effects of liquid on cellulose production
2.35 L罐发酵产纤维素酶
由图8可知,相比摇瓶,上罐在60 h时酶活达到最高点,FPA,CBH,CMC,BG分别为16.51,15.39,11.48,6.17 IU/mL,相对优化前分别提高了54.8%,53.9%,47.5%,48.1%,可见通过对产酶条件的研究,使得匍枝根霉可以利用酶解淀粉作为主要碳源发酵,高效合成纤维素酶。于其他丝状真菌发酵产纤维素酶情况相比较,匍枝根霉利用淀粉水解液发酵产纤维素酶在酶活力没有减少的前提下,发酵时间大大缩短。

图8 纤维素酶酶活发酵过程变化曲线Fig.8 Cellulase activity curve of the fermentation process
3讨论
通过对匍枝根霉淀粉发酵产纤维素酶培养基的优化,得到最适产酶的培养基和培养条件如下:10%淀粉水解液(水解温度60 ℃、水解时间30 min、加酶量0.3%、淀粉10%),麸皮浸出汁5%,NH4Cl 0.5%,KH2PO40.5%,MgSO4·7H2O 0.4%,CaCl20.4%,酵母粉0.6%, PEG4000 0.02%,微量元素液0.000 2%,发酵温度30 ℃,装液量80 mL,初始pH 5.0,接种量8%,摇瓶发酵54 h后获得滤纸酶活为9.66 IU/mL。该条件下匍枝根霉具有良好的产纤维素酶能力,分泌的酶系也比较完全且发酵时间缩短,5 L发酵罐发酵60 h时纤维素酶酶活达到最大值,获得滤纸酶活,外切酶活,内切酶活,β-葡萄糖苷酶分别为16.51,15.39,11.48,6.17 IU/mL。
本文首次利用淀粉发酵匍枝根霉产纤维素酶,与以往的利用纤维素直接诱导产纤维素酶有较大区别。目前关于纤维素诱导产纤维素酶研究比较多,普遍认为纤维二糖有诱导产纤维素酶的作用,然而酶解淀粉快速高效合成纤维素酶没有相关报道,其诱导机理也有待进一步研究。与匍枝根霉稻草诱导产酶相比,利用淀粉水解液发酵所获得的纤维素酶酶系配比发生了较大变化。其中,滤纸酶活提高了25.5%,内切酶活虽然有所下降,但关键的外切酶活提高了近28倍,β-葡萄糖苷酶活变化不大[7],其酶系组成变得更加合理。另外,匍枝根霉利用稻草发酵需要84 h达到酶活最高点,而酶解淀粉发酵只需要60 h,由此可见利用淀粉发酵能大大缩短发酵时间,并有效提高纤维素酶总酶活和酶解效率,具有良好的应用前景。
参考文献
[1]余培铠, 刘刚, 栗荷天等.Thielaviaterrestris产纤维素酶液态发酵条件的优化 [J]. 食品与发酵工业, 2014, 40(1): 91-95.
[2]HU J, GOURLAY K, ARNTES V, et al. The accessible cellulose surface influences cellulase synergism during the hydrolysis of lignocellulosic substrates [J]. Chem SusChem, 2015, 8(5): 901-907.
[3]INOUE H, FUJII T, YOSHIMI M, et al. Construction of a starch-inducible homologous expression system to produce cellulolytic enzymes fromAcremoniumcellulolyticus[J]. Journal of Industrial Microbiology & Biotechnology, 2013, 40(8): 823-830.
[4]吴杨林. 里氏木霉产纤维素酶的条件优化[D]. 南京: 南京林业大学, 2013.
[5]张辉. 黑曲霉 HQ-1 产羧甲基纤维素酶的发酵条件优化 [J]. 酿酒科技, 2011 (5): 27-31.
[6]IGARASHI K, UCHIHASHI T, KOIVULA A, et al. Traffic jams reduce hydrolytic efficiency of cellulase on cellulose surface [J]. Science, 2011, 333(6 047): 1 279-1 282.
[7]汤斌, 许钟源, 李松,等. 匍枝根霉纤维素酶发酵条件优化及分批发酵动力学模型的构建[J]. 食品与发酵工业, 2014, 40(1): 85-90.
[8]GHOSE T K. Measurement of cellulase activities [J]. Pure Appl Chem, 1987, 59(2): 257-268.
[9]OGAWA K,TOYAMA H, TOYAMA N. Native cellulose hydrolyzing cellulose ofTrichodermareesei[J]. Fermentat Technol, 1982, 60(4):349-355.
[10]ZHANG Q,LO C M, JU L K. Factors affecting foaming behavior in cellulose fermentation byTrichodermareeseiRut C-30 [J]. Bioresource Technology,2007, 98(4):753-760.
[11]MANDELS M. Measurement of saccharifying cellulose [J]. Biotech Bioeng, 1976(6):21-23.
Studies on the fermentation conditions ofRhizopusstoloniferto produce cellulase by starch hydrolysate
ZHOU Ruo-fei,TANG Bin,LI Song,KAN Qing-hua
(Anhui Polytechnic University,Engineering Technololy Research Center of Anhui Microbial Fermentation,Wuhu 241000,China)
ABSTRACTStarch hydrolyzate was first utilized as the main carbon for Rhizopus stolonifer TP-02 to achieve a highly efficient production of cellulase. The fermentation conditions including carbon source, nitrogen source, temperature, initial pH, medium volume, and concentration of inoculum were optimized. The optimal medium and culture conditions were confirmed as follows: starch hydrolyzate of 10%, wheat bran extract of 5%, NH4Cl of 0.5%, KH2PO4 of 0.5%, MgSO4·7H2O of 0.4%, CaCl2 of 0.4%, yeast extract of 0.6%, fermentation temperature of 30 ℃, medium volume of 80 mL/ (250 mL), initial pH 5.0 and inoculation concentration of 10%. In the condition mentioned above, the filter paper activity could peak at 9.66 IU/mL. Enlarging the fermentation in a 5 L fermenter, the activity of cellulase reached the maximum value after 60 h. The activity of filter paper, exoglucanase, endoglucanase and β- glucosidase was 16.51 IU/mL, 15.39 IU/mL, 11.48 IU/mL and 6.17 IU/mL, respectively. Compared with conventional cellulose-based material as a carbon source for fermentation of cellulose enzyme, the composition of cellulase obtaining from fermentation of starch hydrolyzate had significant changes. Especially the critical exonuclease activity had greatly improved. The fermentation time had been nearly doubled shortened.
Key wordsRhizopus stolonifera; starch hydrolysate; fermentation; cellulose
DOI:10.13995/j.cnki.11-1802/ts.201606016
基金项目:国家自然科学基金项目(31270135)
收稿日期:2015-12-24,改回日期:2016-01-23
第一作者:硕士研究生(汤斌教授为通讯作者,E-mail:tangbin@ahpu.edu.cn)。
