过表达SOCS2体外抑制人肾小球系膜细胞炎症反应及纤维化的研究
2016-05-31周月宏沈静雪赵晓伟
周月宏,田 坚,沈静雪,赵晓伟
(沈阳医学院附属中心医院,辽宁 沈阳 110024)
论著
过表达SOCS2体外抑制人肾小球系膜细胞炎症反应及纤维化的研究
周月宏,田坚,沈静雪,赵晓伟
(沈阳医学院附属中心医院,辽宁 沈阳 110024)

[摘要]目的研究过表达SOCS2对人肾小球系膜细胞(HMCs)模型的影响及作用机制。方法通过腺病毒感染的方法使HMCs细胞模型中过表达SOCS2,实验分为正常糖培养组、感染SOCS2后正常糖培养组、感染空载体后正常糖培养组、高糖培养组、感染SOCS2后高糖培养组、感染空载体后高糖培养组。Western blot法检测各组细胞模型中JAK/STAT信号通路的活化情况及TGF-β、Ⅳ型胶原(Ⅳ-C)、纤维连接蛋白(FN)的表达量。ELISA方法检测各组细胞培养上清中IL-6、TNF-α表达水平。结果高糖诱导后的各组中p-JAK2、p-STAT3、TGF-β、Ⅳ-C、FN、IL-6、TNF-α的表达量均明显高于正常糖培养组(P均<0.05);感染SOCS2后高糖培养组中这些指标与高糖培养组相比均显著下降(P均<0.05),而与感染空载体后高糖培养组比较则差异无统计学意义(P均>0.05)。结论SOCS2通过抑制JAK/STAT信号通路来降低HMCs细胞模型中纤维化相关蛋白TGF-β、Ⅳ-C、FN及炎性因子IL-6、TNF-α的表达。
[关键词]SOCS2;糖尿病肾病;JAK/STAT;人肾小球系膜细胞
糖尿病肾病(Diabetic nephropathy,DN)是糖尿病引起的严重和危害性最大的一种慢性并发症,其发病机制目前尚不明确,多数学者认为DN是多种因素作用的结果,其中包括血流动力学因素、代谢因素、炎症因素、氧化应激因素及遗传因素等[1]。肾小球基底膜增厚、细胞外基质的扩张、肾小管间质纤维化是DN典型的病理改变。肾小球系膜细胞作为DN的主要效应细胞,是肾小球内产生炎性因子及细胞外基质的主要固有细胞,在DN的发病进程中具有重要的作用。因此,有效抑制肾小球系膜细胞细胞外基质过度生成和抗炎治疗[2]对防止DN具有重要意义。近年来关于细胞因子信号转导抑制因子(suppressor of cytokine signaling,SOCS)抑制细胞因子信号转导的机制研究已取得重大进展,特别是对JAK/STAT信号通路的负反馈作用已被多项研究证实。JAK/STAT信号通路已被证实与多种肾脏疾病的足细胞、肾小球血管内皮细胞、系膜细胞、肾小管上皮细胞以及炎症相关细胞的病理改变密切相关[3]。SOCS家族成员中,关于SOCS1和SOCS3对DN的保护作用已经有报道[1,4]。而SOCS2是否对DN具有保护作用尚不清楚。本课题组前期研究结果已证实SOCS2参与糖尿病大鼠早期发病过程,并证明SOCS2在糖尿病发病早期表达下调,过表达SOCS2对STZ诱导的DN大鼠具有保护作用[5]。因此本部分进行体外研究,观察肾小球系膜细胞中过表达SOCS2是否可以抑制高糖诱导的JAK2/STAT信号途径的活化,进而调控下游基因TGF-β、Ⅳ型胶原(Ⅳ-C)、纤维连接蛋白(FN)及IL-6、TNF-α的表达,从而抑制肾脏组织的炎症反应及纤维化反应,以明确SOCS2对细胞模型保护作用的机制。
1实验资料
1.1材料人肾小球系膜细胞(HMCs)、SOCS2、Ⅳ-C、p-JAK2、JAK2、p-STAT3及STAT3抗体购于沈阳万类生物科技有限公司;TGF-β抗体购于美国Santa Cruz公司;胎牛血清购于美国Hyclone公司;FN抗体购于武汉博士德生物工程公司;DMEM低糖培养基购于美国Gibco公司;Polybrene购于美国sigma公司;SOCS2腺病毒套装购买于恒生物科技(上海)有限公司。PMSF、BCA蛋白浓度测定试剂盒、一抗二抗去除液、羊抗兔IgG-HRP、NP-40裂解液购于碧云天生物技术研究所;β-actin和辣根过氧化物酶标记的鼠单克隆抗体购于康成生物工程有限公司;ECL发光液(碧云天生物技术研究所)。人IL-6 和TNF-α ELISA试剂盒购于武汉博士德生物工程公司。
1.2方法实验分为6组:正常糖培养组(CG组)正常培养,感染SOCS2后正常糖培养组(CG+Ad-SOCS2组)是在感染SOCS2后继续正常糖培养,感染空载体后正常糖培养组(CG+Ad-null组)是在感染空载体后继续在正常糖中培养,高糖培养组(HG组)采用高糖培养,感染SOCS2后高糖培养组(HG+Ad-SOCS2组)是在感染SOCS2后改为高糖培养,感染空载体后高糖培养组(HG+Ad-null组)是在感染空载体后改为高糖培养。
1.2.1HMCs细胞培养HMCs细胞用正常糖培养液(将0.9 g甘露醇溶解在200 mL含有10%胎牛血清、1%青链霉素的DMEM培养基中,过滤后使用,浓度即为5.5 mmol/L D-葡萄糖+24.5 mmol/L D-甘露醇)培养至密度为90%左右,PBS清洗。弃上清,加入适当体积的0.25%胰酶消化细胞,待细胞变圆后,轻轻拍打瓶壁侧面,并加入正常培养基终止反应。用5 mL枪头吹打细胞瓶内各处细胞,15 mL试管收集混合液,800 r/min离心3 min。去上清,进行细胞计数,按实验内容接种细胞,将培养瓶置于37 ℃、5% CO2的培养箱内培养。一般HMCs的接种密度为1∶2,生长2~3 d传代。
1.2.2HMCs细胞高糖处理细胞培养至密度为70%左右,用PBS清洗2次。弃去上清后,PBS清洗1次,加入高糖培养基(将0.9 g葡萄糖溶解在200 mL含有10%胎牛血清、1%青链霉素的DMEM培养基中,过滤后使用,浓度即为30 mmol/L D-葡萄糖)。
1.2.3腺病毒感染HMCs细胞将HMCs细胞接种于6孔板中,置37 ℃、5% CO2的培养箱内培养过夜,24 h后进行感染,细胞密度一般在70%。更换含有8 g/mL Polybrene的新鲜培养基(加入Polybrene可以提高病毒的感染效率),在目的细胞和对照细胞中分别用移液器加入计算好的病毒液(病毒数与细胞数比值为10∶1)。加完病毒后置于37 ℃、5% CO2培养箱内孵育过夜。24 h后将含有腺病毒的培养液更换成正常培养液或高糖培养液,37 ℃、5% CO2继续培养24 h。
1.3检测项目
1.3.1Western blot法检测各组细胞模型中JAK/STAT信号通路的活化情况及TGF-β、Ⅳ-C、FN的表达量收集细胞,用NP-40裂解液(含1%PMSF)裂解细胞,离心后取上清,用BCA法测定蛋白浓度,同时加5×上样缓冲液,煮沸变性5 min,-80 ℃保存备用。本实验的上样体积20 μL,含40 μg蛋白。最后加入5 μL蛋白Marker电泳,半干转至PVDF膜,5%脱脂奶粉室温封闭1.5 h,随后用特异性抗体将膜4 ℃孵育过夜,再以相应的二抗(1∶5 000)孵育2 h。免疫复合物使用ECL法检测。蛋白条带使用Gel-Pro-Analyzer软件分析条带灰度值,实验重复3次。
1.3.2ELISA方法检测各组细胞培养上清中IL-6、TNF-α表达水平将细胞培养液1 000 r/min离心5 min,收集上清,后续操作按ELISA试剂盒说明书进行,在酶标仪450 nm波长处,以空白对照孔调零,直接测定其吸光值(A),并由标准曲线公式换算成各蛋白的浓度值,实验重复3次。
1.4统计学方法实验数据应用SPSS 17.0统计软件进行分析,采用均数±标准差方式表示,组间的差异比较采用T检验,P<0.05表示差异有统计学意义。
2结果
2.1各组HMCs细胞SOCS2蛋白表达情况HG+Ad-SOCS 2组、HG+Ad-null组、HG组HMCs细胞SOCS2蛋白表达量分别为0.634±0.012,0.241±0.009,0.242±0.011,HG+Ad-SOCS2组明显高于其他2组(P均<0.05),HG组和HG+Ad-null组比较差异无统计学意义;CG+Ad-SOCS2组、CG+Ad-null组、CG组HMCs细胞SOCS2蛋白表达量分别为0.443±0.009,0.152±0.013,0.166±0.019,CG+Ad-SOCS2组明显高于其他2组(P均<0.05),CG组和CG+Ad-null组比较差异无统计学意义。但高糖培养基培养的3组细胞对应正常培养基培养的3组细胞SOCS2 蛋白表达水平均明显提高(P均<0.05)。Western blot检测各组细胞SOCS2蛋白表达情况见图1。
2.2各组HMCs细胞中TGF-β、Ⅳ-C及FN蛋白表达情况高糖培养后的各组中TGF-β、IV-C及FN表达水平均明显高于正常糖培养各组(P均<0.05),HG-Ad-SOCS2组各指标表达水平均明显低于HG-Ad-null组和HG组(P均<0.05),HG-Ad-null组和HG组各指标表达水平比较差异无统计学意义(P均>0.05),正常糖培养各组各指标表达水平比较差异亦无统计学意义(P均>0.05)。见图2及表1。
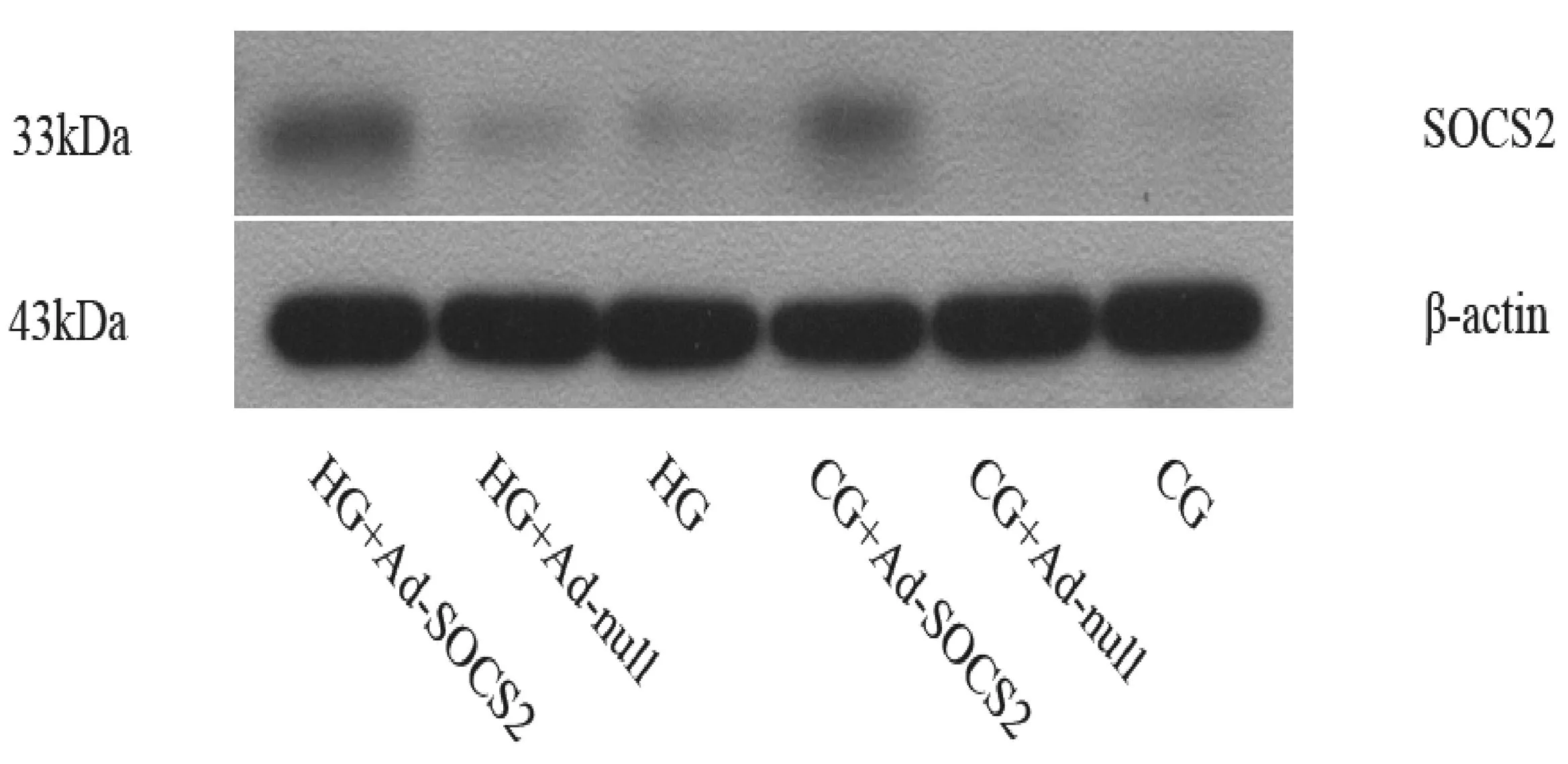
图1 Western blot检测各组细胞SOCS2蛋白表达情况
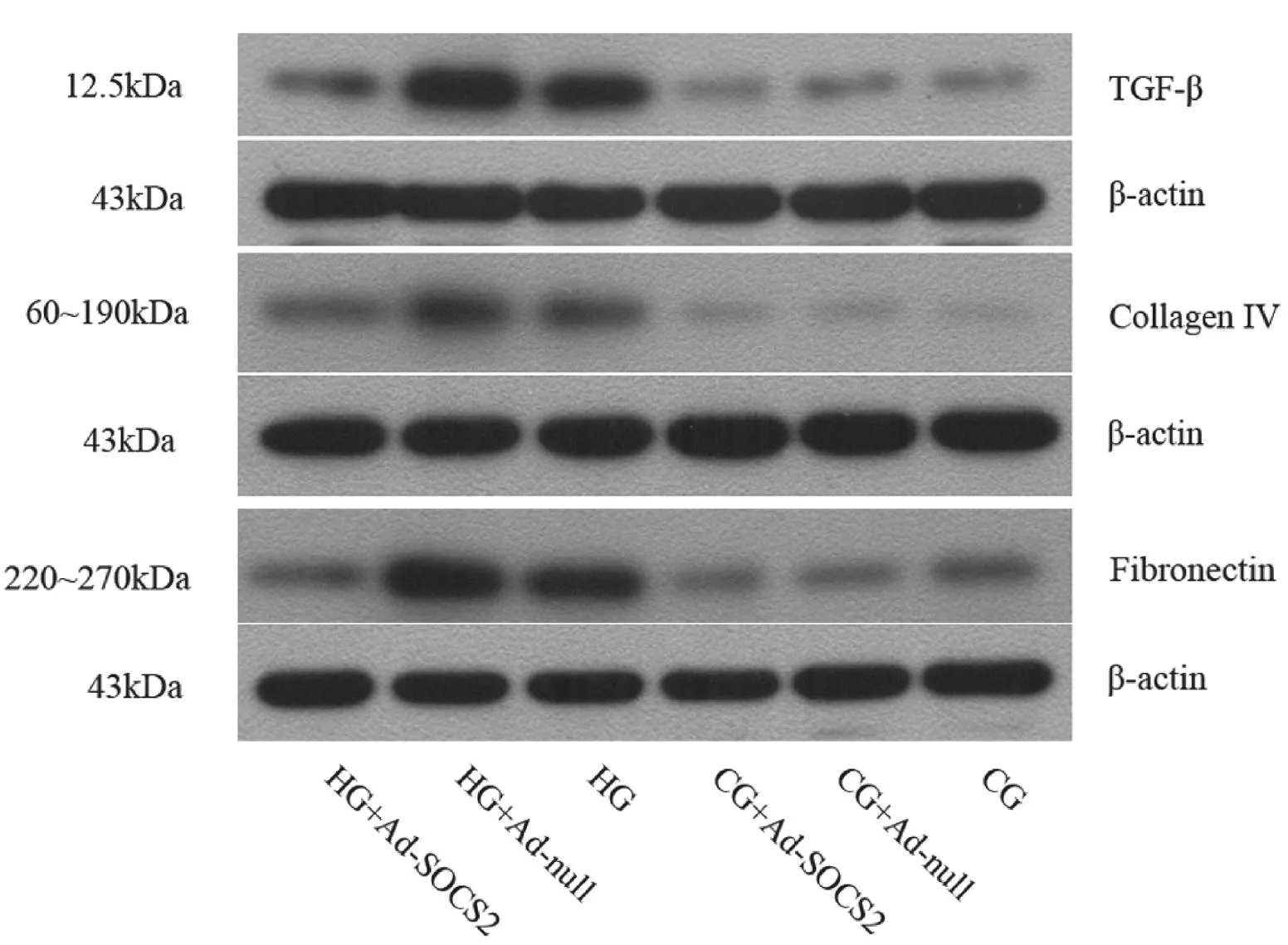
图2 Western blot检测各组细胞中TGF-β、Ⅳ-C及FN表达情况
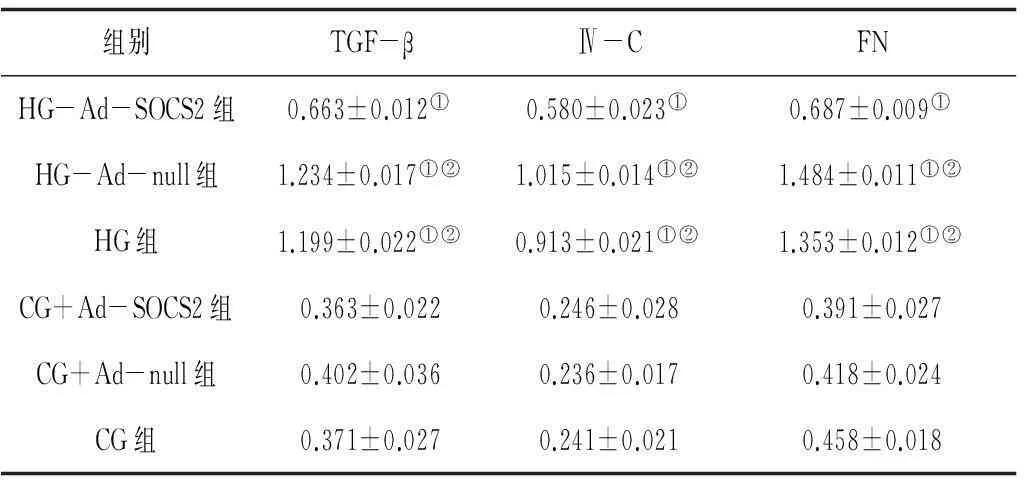
组别TGF-βⅣ-CFNHG-Ad-SOCS2组0.663±0.012①0.580±0.023①0.687±0.009①HG-Ad-null组1.234±0.017①②1.015±0.014①②1.484±0.011①②HG组1.199±0.022①②0.913±0.021①②1.353±0.012①②CG+Ad-SOCS2组0.363±0.0220.246±0.0280.391±0.027CG+Ad-null组0.402±0.0360.236±0.0170.418±0.024CG组0.371±0.0270.241±0.0210.458±0.018
注:①与CG组比较,P<0.05;②与HG-Ad-SOCS2组比较,P<0.05。
2.3各组HMCs细胞培养上清中IL-6和TNF-α表达水平比较高糖培养后的各组中TNF-α和IL-6表达水平均明
显高于正常糖培养各组(P均<0.05),HG-Ad-SOCS2组各指标表达水平均明显低于HG-Ad-null组和HG组(P均<0.05),HG-Ad-null组和HG组各指标表达水平比较差异无统计学意义(P均>0.05),正常糖培养各组各指标表达水平比较差异亦无统计学意义(P均>0.05)。见表2。
表2 各组HMCs细胞培养上清中IL-6 和TNF-α表达
注:①与CG组比较,P<0.05; ②与HG-Ad-SOCS2组比较,P<0.05。
2.4各组HMCs细胞中JAK/STAT信号通路活化情况各组细胞间总JAK2、STAT3表达水平比较差异无统计学意义;高糖培养后的各组中p-JAK2、p-STAT3蛋白表达水平均明显高于正常糖培养各组(P均<0.05),HG-Ad-SOCS2组各指标表达水平均明显低于HG-Ad-null组和HG组(P均<0.05),HG-Ad-null组和HG组各指标表达水平比较差异无统计学意义(P均>0.05),正常糖培养各组各指标表达水平比较差异亦无统计学意义(P均>0.05)。见图3及表3。
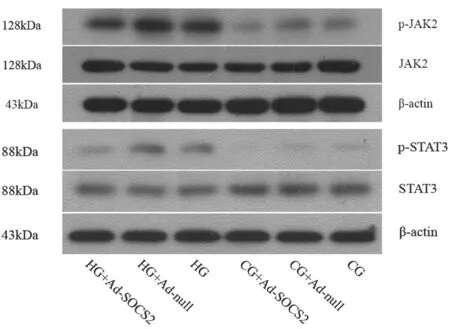
图3 Western blot检测各组细胞中JAK、STAT及
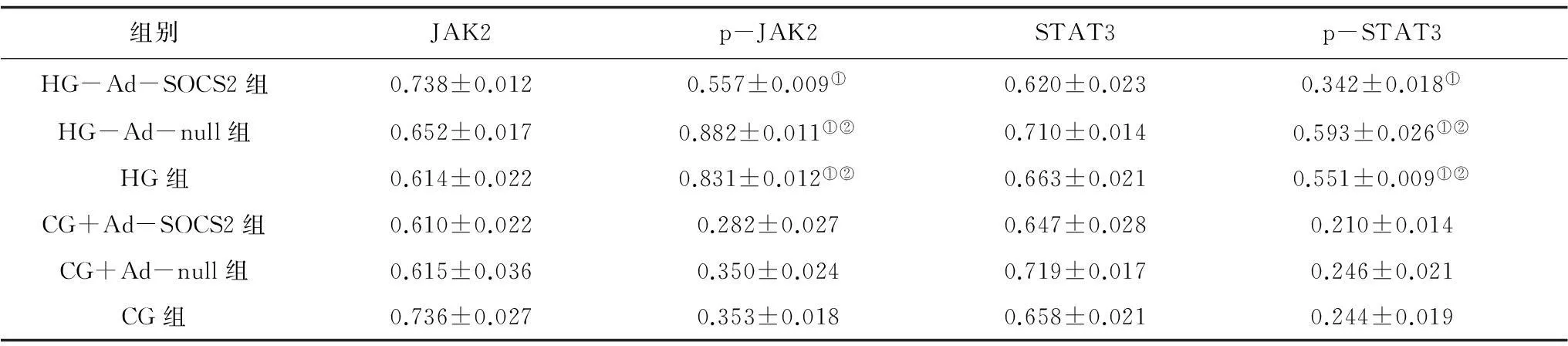
组别JAK2p-JAK2STAT3p-STAT3HG-Ad-SOCS2组0.738±0.0120.557±0.009①0.620±0.0230.342±0.018①HG-Ad-null组0.652±0.0170.882±0.011①②0.710±0.0140.593±0.026①②HG组0.614±0.0220.831±0.012①②0.663±0.0210.551±0.009①②CG+Ad-SOCS2组0.610±0.0220.282±0.0270.647±0.0280.210±0.014CG+Ad-null组0.615±0.0360.350±0.0240.719±0.0170.246±0.021CG组0.736±0.0270.353±0.0180.658±0.0210.244±0.019
注:①与CG组比较,P<0.05;②与HG-Ad-SOCS2组比较,P<0.05。
3讨论
SOCS家族是一类对细胞因子信号转导起负性调控,从而抑制其信号转导的蛋白分子。研究证实SOCS参与癌症、肝纤维化、肾脏纤维化和各种炎症反应等多种疾病[6-8]。SOCS主要通过JAK/STAT信号转导通路的负性调节作用抑制相关细胞因子的信号转导,从而参与了多种疾病生理与病理的发生、发展过程。JAK/STAT与多种肾脏疾病所联系的足细胞、肾小球血管内皮细胞、系膜细胞、肾小管上皮细胞以及炎症相关细胞的病理改变密切相关。目前对于SOCS家族的研究多集中于SOCS1和SOCS3。研究表明,肾小球系膜细胞、内皮细胞及肾小管细胞中均有SOCS蛋白的表达[9]。在STZ诱导的糖尿病大鼠模型中检测到SOCS1和SOCS3的高表达,体外研究表明过表达SOCS1和SOCS3可以抑制高糖诱导的MCP-1、IL-6、TGF-β、IV-C、FN等的表达,且在体内过表达SOCS1和SOCS3可以减轻肾脏损伤(包括基底膜增厚、纤维化和巨噬细胞浸润等),改善肾脏功能,证实SOCS1和SOCS3在DN的发展进程中具有保护作用[10]。此外,肾小球系膜细胞中过表达SOCS1可以抑制高糖诱导的JAK2/STAT信号途径的活化,从而抑制TGF-β和FN的合成[11]。在肿瘤中,SOCS2能抑制JAK2的激活以及JAK2与STAT3的结合,SOCS2的过表达对阻止STAT3的激活及抑制c-Src所影响的细胞毒性[12]。有研究表明SOCS2在STZ诱导的糖尿病大鼠肾脏中表达量下调,体外研究显示胰岛素可以诱导肾小球系膜细胞中SOCS2表达量增加,且上调的SOCS2可以抑制IGF-1诱导的ERK1/2的激活,从而抑制Ⅳ-C的合成[9]。但SOCS2与DN的关系尚未明确。
在DN的早期发病阶段,炎性应答主要是单核/巨噬细胞的浸润,聚集到肾脏的单核细胞活化后会增殖为巨噬细胞,巨噬细胞会诱导炎性细胞因子如TNF-α、IL-6等的产生。因此,一系列的炎症因子如IL-1、IL-6、IL-8、TNF-α等在DN中的表达量都会增加[13],并且这些因子与尿液中微量白蛋白的产生和DN的进展密切相关[14]。TNF-α的增加可直接对肾小球和肾小管造成损伤,从而引起蛋白尿的产生,同时也可以促进ICAM-1的表达。IL-6可调节黏附分子及其他细胞因子如TNF-α的表达,进而促进炎症反应,血管内皮损伤可使TNF-α释放增加,而TNF-α又促进IL-6的释放增加,两者协同作用,形成免疫复合物沉积于血管内皮造成血栓形成,加速肾脏的损害。而TGF-β是高血糖以及一些导致肾脏损伤的生化因素的重要递质,与DN肾脏细胞的增殖、肾小球肥大等密切相关,同时也与肾间质的纤维化有关[15-16]。肾小球基底膜的胶原成分中最重要的是Ⅳ-C,它是典型的基质胶原,可由活化的肾小球系膜细胞、上皮细胞、内皮细胞及肾小管上皮细胞等合成和分泌。所以, Ⅳ-C合成和降解平衡的失调是导致DN肾小球病理改变的主要因素之一[17]。FN是重要的细胞外基质组成成分,正常情况下其由系膜细胞产生,病理状态下系膜细胞大量表达FN等细胞外基质成分。
本研究通过腺病毒感染成功构建了过表达SOCS2的HMCs细胞模型,且腺病毒基因组自身并没有影响细胞内SOCS2的表达;高糖处理的3组细胞对应正常糖培养的3组细胞,SOCS2的表达均上调,再次验证了SOCS2参与高糖处理HMCs细胞的反应。高糖培养后的各组中TGF-β、Ⅳ-C、FN、TNF-α、IL-6及p-JAK2、p-STAT3蛋白表达水均明显高于正常糖培养各组,HG-Ad-SOCS2组各指标表达水平均明显低于HG-Ad-null组和HG组,HG-Ad-null组和HG组各指标表达水平比较差异无统计学意义,正常糖培养各组各指标表达水平比较差异亦无统计学意义。提示高糖诱导的HMCs细胞模型中,纤维化相关蛋白表达量、炎症因子水平显著升高,JAK/STAT信号通路被激活,而SOCS2的过表达可以使纤维化相关蛋白表达量、炎症因子水平显著降低,且可抑制JAK/STAT信号通路的激活。这说明与SOCS1和SOCS3相同,SOCS2能通过抑制JAK/STAT信号通路及其调控的炎症因子及纤维化相关蛋白的活化与表达,从而对DN的进展起到延缓作用,为DN的药物治疗找到了新的靶点,同时也为该病的防控提供了理论依据。
[参考文献]
[1]Ortiz-Munoz G,Lopez-Parra V,Lopez-Franco O,et al. Suppressors of cytokine signaling abrogate diabetic nephropathy[J]. J Am Soc Nephrol,2010, 21(5):763-772
[2]Impellizzeri D,Esposito E,Attley J,et al. Targeting inflammation: new therapeutic approaches in Chronic Kidney Disease (CKD)[J]. Pharmacol Res,2014,81:91-102
[3]Kisseleva T,Bhattacharya S,Braunstein J,et al. Signaling through the JAK/STAT pathway, recent advances and future challenges[J]. Gene,2002,285(1/2):21-24
[4]Shi Y,Du C,Zhang Y,et al. Suppressor of cytokine signaling-1 ameliorates expression of MCP-1 in diabetic nephropathy[J]. Am J Nephrol,2010,31(5):380-388
[5]Zhou Y,Lv C,Wu C,et al. Suppressor of cytokine signaling (SOCS) 2 attenuates renal lesions in rats with diabetic nephropathy[J]. Acta Histochem,2014,116(5):981-988
[6]Inagaki-Ohara K,Kondo T,Ito M,et al. SOCS, inflammation, and cancer[J]. JAKSTAT,2013,2(3):e24053
[7]Cheng C,Huang C,Ma TT,et al. New surprises of suppressor of cytokine signalling in liver fibrosis[J]. Expert Opin Ther Targets,2014,18(4):415-426
[8]Gao A,Van Dyke TE. Role of suppressors of cytokine signaling 3 in bone inflammatory responses[J]. Front Immunol,2014,4:506
[9]Isshiki K,He Z,Maeno Y,et al. Insulin regulates SOCS2 expression and the mitogenic effect of IGF-1 in mesangial cells[J]. Kidney Int,2008,74(11):1434-1443
[10] Ortiz-Munoz G,Lopez-Parra V,Lopez-Franco O,et al. Suppressors of cytokine signaling abrogate diabetic nephropathy[J]. J Am Soc Nephrol,2010,21(5):763-772
[11] Shi Y,Zhang Y,Wang C,et al. Suppressor of cytokine signaling-1 reduces high glucose-induced TGF-beta1 and fibronectin synthesis in human mesangial cells[J]. FEBS Lett,2008,582(23/24):3484-3488
[12] Banibrata Sen,Shaohua Peng,Denise M,et al. STAT5A-mediated SOCS2 expression regulates Jak2 and STAT3 activity following c-Src inhibition in head and neck squamous carcinoma[J]. Clin Cancer Res,2012,18(1):127-139
[13] Oh DJ,Kim HR,Lee HR,et al. Proflie of human β-defensins 1, 2 and proinflammatory cytokines (TNF-α, IL-6) in patients with chronic Kidney disease[J]. Kidney Blood Press Res,2013,37(6):602-610
[14] Nvarro-Gonzalez JF,Mora-Fernandez C,et al. Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy[J]. Nat Rev Nephrol,2011,7(6):327-340
[15] Lai PB,Zhang L,Yang LY. Quercetin ameliorates diabetic nephropathy by reducing the expressions of transforming growth factor-β1 and connective tissue growth factor in streptozotocin-induced diabetic rats[J]. Ren Fail,2012,34(1):83-87
[16] Mori J,Patel VB,Ramprasath T,et al. Angiotensin 1-7 mediates renoprotection against diabetic nephropathy by reducing oxidative stress, inflammation and lipotoxicity[J]. Am J Physiol Renal Physiol,2014,306(8):F812-821
[17] Watanabe H,Sanada H,Shigetomi S,et al. Urinary excretion of type IV collagen as a specific indicator of the progression of diabetic nephropathy[J]. Nephron,2000,86(1):27-35
Study on the inhibition of overexpression of SOCS2 on inflammatory response and fibrosis of human glomerular mesangial cells in vitro
ZHOU Yuehong, TIAN Jian, SHEN Jingxue, ZHAO Xiaowei,
(The Center Hospital Affiliated to Shenyang Medical College, Shenyang 110024, China)
Abstract:Objective It is to explore the effect of overexpression of SOCS2 on inflammatory response and fibrosis of human glomerular mesangial cells(HMCs) in vitro. Methods The expression of SOCS2 in the cell model was expressed by the method of adenovirus infection,the cells were divided into CG group, CG+Ad-null group, CG+Ad-SOCS2 group, HG group, HG+Ad-null group, HG+Ad-SOCS2 group. The activation of JAK/STAT signaling pathway and the expression of Collagen IV, FN and TGF-β in the cell model of each group were detected by Western blot method. The expressions of IL-6 and TNF-α in culture supernatant of each group were detected by ELISA. Results Compared with CG group, the expressions of p-JAK2, P-STAT3, TGF-β, Collagen IV, FN,IL-6 and TNF-α were significantly increased in HG group, HG+Ad-null group and HG+Ad-SOCS2 group cells (P<0.01). And the expression of these factors in HG+Ad-SOCS2 group were significantly decreased compared with HG group(P<0.01), and those of HG+Ad-null group had no significant difference. Conclusion SOCS2 can reduce the expressions of fibrosis-related protein TGF-β, Collagen IV, FN and inflammatory cytokines IL-6 and TNF-α by inhibiting JAK/STAT signaling pathway in cell model.
Key words:SOCS2; diabetic nephropathy; JAK/STAT; glomerular mesangial cell
[收稿日期]2015-09-25
[中图分类号]R-33
[文献标识码]A
[文章编号]1008-8849(2016)04-0343-05
doi:10.3969/j.issn.1008-8849.2016.04.001
[基金项目]沈阳市科技计划基金项目(F13-220-9-10)
[作者简介]周月宏,女,博士,副主任医师,副教授,主要从事糖尿病及其相关并发症的研究。
