人肝癌相关抗原Cdc25C特异性多肽抗体的制备及其应用
2016-05-12陈承晓张琪惠李春梅田淋莫发荣北海市人民医院广西北海536000广西医科大学基础医学院
陈承晓,张琪惠,李春梅,田淋,莫发荣(北海市人民医院,广西北海536000;广西医科大学基础医学院)
·论著·
人肝癌相关抗原Cdc25C特异性多肽抗体的制备及其应用
陈承晓1,张琪惠2,李春梅2,田淋2,莫发荣2(1北海市人民医院,广西北海536000;2广西医科大学基础医学院)
摘要:目的制备抗人肝癌相关抗原Cdc25C特异性多肽抗体,为进一步研究Cdc25C的功能奠定基础。方法 通过生物信息学软件对人Cdc25C蛋白的抗原属性进行分析,综合考虑多肽的纯度、氨基酸组成、长度、亲水性和二级结构等,得到若干个同源性低、抗原性较高的候选多肽。多肽合成后与KLH佐剂偶联,免疫新西兰大白兔,制备相应的多克隆抗体。经ELISA和Western blotting方法鉴定其活性,并以免疫组化法检测多肽抗体的效果。结果多肽抗体的效价较高, 特异性强。以多肽抗体对重组表达的Cdc25C融合蛋白进行Western blotting鉴定,于73 kD附近有明显反应条带。以全蛋白的单克隆抗体和多肽抗体检测同一肝细胞癌癌旁组织,购买的Cdc25C单克隆抗体与制备的Cdc25C多肽多克隆抗体平均光密度分别为0.538±0.192、0.410±0.122,两者比较差异无统计学意义(t=0.109,P>0.05)。结论 成功制备抗人肝癌相关抗原Cdc25C特异性多肽抗体;筛选获得的候选多肽具有Cdc25C全蛋白一样的抗原性,制备的多肽抗体具有和针对Cdc25C全蛋白抗体一样的效果。
关键词:肝肿瘤;肝癌相关抗原;Cdc25C多肽;多克隆抗体
细胞周期蛋白Cdc25C在真核生物细胞有丝分裂中起重要调节作用,其与G2/M期检测点关键调控分子Cdc2/cyclin B的结合,决定细胞是否进入有丝分裂周期[1]。Cdc25C还是一个新的肿瘤相关抗原[2]。初步RT-PCR结果显示,Cdc25C在肝细胞癌中高表达(16/30)[3]。为深入研究Cdc25C的功能区域及其在肿瘤发病、诊断和临床免疫治疗中的作用,我们于2014年采用生物信息学方法筛选出同源性低、抗原性较高的Cdc25C多肽片段,采用固相多肽合成法合成多肽,用于免疫新西兰大白兔,制备相应的多克隆抗体。
1材料与方法
1.1材料肝细胞癌(HCC)癌旁组织来源于广西医科大学第一附属医院;完全弗氏佐剂(CFA)和不完全弗氏佐剂(IFA)购自Gibco BRL公司;Anti-Cdc25C antibody[E302]单克隆抗体购自英国Abcam公司;即用型免疫组化试剂盒和DAB试剂盒购自武汉博士德生物工程有限公司;辣根过氧化物酶标记抗兔二抗购自Rockland公司,新西兰大白兔(2.5 kg)、TMB试剂、ELISA试剂盒和Western blotting等试剂盒由南京金斯瑞公司提供。
1.2Cdc25C特异性多肽的设计和筛选为设计出能引起预期免疫效应的抗原多肽,通过Optimum AntigenTM设计工具,对Cdc25C蛋白的属性进行分析,以JW算法对抗原进行预测,保证抗原设计的合理性,综合考虑多肽的纯度、氨基酸组成、长度、亲水性和β-转角、β-折叠、α-螺旋等二级结构,得到若干个候选多肽片段。将之与特异性蛋白数据库进行比对,筛选出最能引起预期免疫效应,并能将同源效应和产生非特异性反应降低到最小的三个候选多肽,起始位点分别为64、185、407,抗原决定簇序列分别为ADLDETGHLDSSGLC、CYRSPSMPENLNRPR、PMHHQDHKTELLRC。
1.3多肽抗原合成采用9-氟甲氧羰固相合成法合成多肽片段。多肽经过纯化后,利用高效液相色谱法测定纯度,三个候选多肽纯度分别达到85.4%、89.6%、94.1%。为保证合成多肽的序列正确,我们对其进行了MS/MS质谱测序。测序结果显示三个多肽分子序列均正确无误。
1.4Cdc25C特异性多肽多克隆抗体的制备经马来酰亚胺基苯甲酸琥珀酰亚胺酯活化的钥孔戚血蓝素按1∶1的比例与纯化后的多肽孵育3 h进行偶联,之后转移到透析袋中,PBS浸泡除盐,4 ℃过夜后,得到多肽-血蓝蛋白化合物(免疫原)。取多肽-血蓝蛋白化合物200 μg溶于250 μL的PBS(0.1 mol/L pH 7.4 ),与等体积的完全弗氏佐剂充分混匀乳化后, 对新西兰大白兔皮下多点注射。以后以不完全弗氏佐剂取代完全弗氏佐剂,每2周免疫1次,共接种6次。每次免疫后的第 10~14天,从兔耳静脉采血测定抗体效价,直至获得满意的抗体效价,制备出相应的兔抗血清。
1.5Cac25C特异性多克隆抗体效价测定采用ELISA法检测Cdc25C特异性多肽多克隆抗体的效价,根据信噪比S/N>2.1(S/N=2为最小检出限)确定三个多肽抗体滴度。
1.6Cdc25C特异性多肽多克隆抗体的应用以购买英国Abcam公司的Anti-Cdc25C antibody[E302]单克隆抗体和制备的特异性多肽多克隆抗体对重组表达的TRx-His-Cdc25C融合蛋白进行Western blotting鉴定。采用免疫组化法,以购买的单克隆抗体与制备的多肽抗体检测同样的HCC癌旁组织,切片经病理图像分析系统拍照后用图像分析软件Image-pro plus 6.0获得阳性反应颗粒的平均光密度值(光密度值越高说明阳性反应越强,可进行定量分析)。
2结果
2.1多克隆抗体的效价三个候选多肽制备的多克隆抗体滴度分别达到1∶16 000、1∶16 000和1∶32 000。
2.2Cdc25C特异性多肽多克隆抗体的应用效果以购买的单克隆抗体(图1-A)和制备的特异性多肽多克隆抗体(图1-B)进行Western blotting检测,结果均在73 kD附近有明显反应条带(TRx-His相对分子质量约20 kD,Cdc25C相对分子质量约53 kD)。上述两种抗体在免疫组化染色中的平均光密度分别为0.538±0.192、0.410±0.122,两者比较差异无统计学意义(t=0.109,P>0.05)。制备的多肽多克隆抗体具有和针对Cdc25C全蛋白的单克隆抗体等同的效果,筛选出来的多肽能代表Cdc25C全蛋白的抗原性。
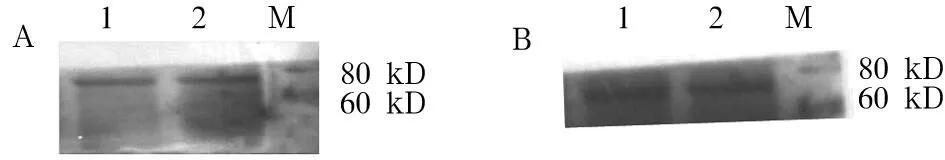
注:M为ProteinRulerTM ⅡMarker;1、2为原核表达的Cdc25C融合蛋白。
图1 Western blotting法检测Cdc25C抗体效果
3讨论
细胞周期蛋白Cdc25C或其剪接体在HCC、结肠癌、前列腺癌和黑色素瘤等多种恶性肿瘤组织或细胞株中过度表达,并参与G2/M检测点调控[4],G2/M检测点与肿瘤发生、应答相关,所以Cdc25C可能是肿瘤治疗的潜在靶点[5]。梁马可等[6]实验表明,Cdc25C在HCC组织、癌旁组织、正常肝脏组织表达阳性率分别为86.2%、45.8%、11.1%,三种组织中的表达差异均有统计学意义;Cdc25C在HCC 组织中的表达与HBsAg、肿瘤直径和肿瘤分化程度有关(P<0.05)。在肝癌细胞中,一种翻译控制肿瘤蛋白能促进Cdc25C的泛素化降解,从而引起周期蛋白激酶1的Tyr15位点去磷酸化的失败。使Cdk1活性下降从而引起有丝分裂的停滞,造成染色体畸形,而染色体畸形是肿瘤发展中的一个重要环节[7]。最近还有研究人员发现双氢青蒿素通过诱导p21、抑制cyclin B和蛋白Cdc25C,引起G2/M期阻滞,从而显著抑制体外、体内肝癌细胞生长[8]。
为进一步研究Cdc25C在细胞中的功能及其与肿瘤细胞恶性增殖的关系,开展抗体血清学检测、抗体制备及其相关的研究,开发和应用Cdc25C全蛋白抗原疫苗和肽表位疫苗,我们利用JW算法对Cdc25C的亲水性及抗原性分析,结果提示该蛋白抗原性较好, 其可能抗原表位主要在氨基端残基的部分区域。经过折叠可能性预测和同源性检索后,选取折叠可能性较低,同源性亦较低,同时亲水性与抗原性较高的64~78、185~199、407~421三个区域肽段,采用固相合成法合成多肽。为加强免疫原性,在其C末端加上谷氨酸和丝氨酸,然后与KLH偶联作为免疫原, 免疫新西兰大白兔制备了多克隆抗体。通过ELISA分析, 结果显示制备出的多克隆抗体滴度高,特异性好。
本实验制备的抗体是由多肽-血蓝蛋白复合物作为免疫原,激起免疫反应产生,包含了针对多肽、连接剂和载体蛋白的多克隆抗体。以该多克隆抗体对重组表达的Cdc25C融合蛋白进行Western blotting鉴定,于73 kD附近有明显反应条带,和前期研究[ 9]结果相符,说明其免疫原性是针对Cdc25C特异性多肽产生的。以全蛋白的单克隆抗体和多肽抗体检测同一HCC癌旁组织,阳性反应颗粒主要位于肝细胞的细胞质,两种抗体阳性染色结果经统计分析无统计学差异。我们筛选获得的候选多肽具有Cdc25C全蛋白一样的抗原性,制备的多肽抗体具有和针对Cdc25C全蛋白抗体一样的效果,此为进一步研究Cdc25C的功能区域奠定了基础。
参考文献:
[1] Perdiguero E, Nebreda AR. Regulation of Cdc25C activity during the meiotic G2/M transition[J]. Cell Cycle, 2004,3(6):733-737.
[2] Wang X, Zhao H, Xu Q, et al. HPtaa database-potential target genes for clinical diagnosis and immunotherapy of human carcinoma[J]. Nucleic Acids Res, 2006,34(Database issue):D607-D612.
[3] 莫发荣.细胞周期蛋白Cdc25C的研究[J].生命的化学,2010,30(6):889-892.
[4] Albert H, Santos S, Battaglia E, et al. Differential expression of CDC25 phosphatases splice variants in human breast cancer cells[J]. Clin Chem Lab Med, 2011,49(10):1707-1714.
[5] Wang Z, Trope CG, Flørenes VA, et al. Overexpression of CDC25B, CDC25C and phospho-CDC25C(Ser216) in vulvar squamous cell carcinomas are associated with malignant features and aggressive cancer phenotypes[J]. BMC Cancer, 2010,10:233.
[6] 梁马可,李仁锋,夏晓博,等.CDC25C蛋白和CLDN6蛋白在肝细胞癌中的表达及临床意义[J].河南医学研究,2013,22(6):807-811.
[7] Chan TH, Chen L, Liu M, et al. Translationally controlled tumor protein induces mitotic defects and chromosomemissegregation in hepatocellular carcinoma development[J]. Hepatology, 2012,55(2):491-505.
[8] Zhang CZ, Zhang H, Yun J, et al. Dihydroartemisinin exhibits antitumor activity toward hepatocellular carcinoma invitro and in vivo[J]. Biochem Pharmacol, 2012,83(9):1278-1289.
[9] 卓少元,陈承晓,钟卫干,等.人Cdc25C基因克隆及其原核表达载体的构建与表达[J].世界华人消化杂志,2014,22(15):2140-2144.
Preparation and application of human HCC-associated antigen Cdc25C specific peptide antibody
CHENChengxiao1,ZHANGQihui,LIChunmei,TIANLin,MOFarong
(1BeihaiPeople'sHospital,Beihai536000,China)
Abstract:ObjectiveTo prepare polyclonal antibody against human hepatocellular carcinoma (HCC)-associated antigen Cdc25C specific polypeptide, and to lay a foundation for further study of the function of Cdc25C. Methods The properties of Cdc25C protein antigen were analyzed by bioinformatics software. Several candidate partial peptides of low homology and high antigenicity were designed based on the purity, amino acid composition, length, hydrophilic and secondary structure. Three partial peptides of Cdc25C were synthesized. The synthesized peptide was then used to immunize after coupling with KLH. The activity of anti-Cdc25C antibody was analyzed by ELISA and Western blotting, and its effect was detected by immunohistochemistry. ResultsThe polypeptide antibody had high titer and specificity. The antibody identified against recombinant Cdc25C fusion protein by Western blotting, and the reaction bands appeared at 73 kD. We used the whole protein monoclonal antibody and peptide antibody to detect the same HCC cancer adjacent tissue, and its average optical density was 0.538±0.192 and 0.410±0.122, respectively, no significant difference was found between them (t=0.109, P>0.05). ConclusionPolyclonal antibody against human HCC-associated antigen Cdc25C specific polypeptide is successfully prepared. The candidate peptides obtained from the screening have the same antigenicity as Cdc25C whole protein, and the prepared polypeptide antibody has the same effect as the antibody against the Cdc25C whole protein.
Key words:liver neoplasms; hepatocellular carcinoma-associated antigen; Cdc25C polypeptide; polyclonal antibody
(收稿日期:2016-01-21)
中图分类号:R575
文献标志码:A
文章编号:1002-266X(2016)13-0001-03
doi:10.3969/j.issn.1002-266X.2016.13.001
通信作者简介:莫发荣(1972-),男,硕士,副教授,主要研究方向为肿瘤免疫。E-mail:farongmo@126.com
第一作者简介:陈承晓(1978-),女,硕士,助理实验师,主要研究方向为肿瘤免疫。E-mail:2494255044@qq.com
基金项目:国家自然科学基金资助项目(81160264)。
