低温贮藏南美白对虾特定腐败菌的分离鉴定及腐败能力分析
2016-05-09谢丽丹李蕾蕾王素英董世瑞
谢丽丹,李蕾蕾,王素英,董世瑞
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津,300400)
低温贮藏南美白对虾特定腐败菌的分离鉴定及腐败能力分析
谢丽丹,李蕾蕾,王素英*,董世瑞
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津,300400)
摘要为了分离鉴定南美白对虾在低温贮藏条件下的腐败菌并测定其腐败能力的大小,分别在4 ℃和-18 ℃的低温条件下贮藏南美白对虾,从中分离腐败菌,进行形态学观察和分子生物学鉴定,并将腐败菌接种至灭菌虾汁中进行分解蛋白质对比试验。结果表明,从南美白对虾中分离得到12株腐败菌,分别是Shewanella hafniensis,Acinetobacter johnsonii,Planoccoccus citreus,Bacillus cereus,Acinetobacter beijerinckii,Enterobacter hormaechei,Arthrobacter bergeri和Bacillus licheniformis,其中X1与X10可能为潜在新种或新属。南美白对虾优势腐败菌致腐能力研究结果显示:南美白对虾在冷藏条件下致腐能力强的优势腐败菌依次是Acinetobacter johnsonii,X1,Shewanella hafniensis和Acinetobacter beijerinckii;冻藏条件下致腐能力强的优势腐败菌依次是Planoccoccus citreus,Acinetobacter johnsonii,Shewanella hafniensis,Acinetobacter beijerinckii和X1。
关键词南美白对虾;低温贮藏;优势腐败菌;分离鉴定;腐败能力
众所周知鲜度是评判虾类水产品品质的最重要指标,没有进行任何保鲜处理的鲜虾,由于营养丰富、含水量高,极易被微生物污染而导致腐败变质。人们将生存能力强、繁殖快,且产生腐败臭味代谢产物的特定菌群称为优势腐败菌。相关研究表明,随着贮藏时间的增加,优势腐败菌在菌落总数中的比例不断增加[1]。因此找出新鲜水产品的优势腐败菌对控制其品质具有重要意义。
南美白对虾是当今养殖产量最高的三大虾类之一[2],因此在集中捕捞季节,常采用短期冷藏、长期冻藏的措施以实现销售的时空调节。温度是影响南美白对虾货架期的关键因素[3-5],但缺乏关于低温条件下造成南美白对虾腐败的细菌菌相构成、变化规律及腐败能力的系统报道。本文拟对冷藏和冻藏南美白对虾的主要腐败菌进行分离纯化,采用形态学特征、生理生化试验以及16S rRNA序列相结合的方法,对优势腐败菌进行鉴定,在此基础上测定其腐败能力,为延长南美白对虾的货架期,制定针对性较强的保鲜方案提供依据。
1材料与方法
1.1实验材料与仪器
鲜活南美白对虾,购自天津市南开区王顶堤水产批发市场,立即包装保活运输至实验室;
用于PCR扩增的全部试剂及扩增引物均从生工生物工程(上海)股份有限公司购买与合成;其它生物试剂购自北京奥博星生物技术有限公司。
UDK-159凯氏定氮仪,意大利VELP公司;MLS-3780高压灭菌锅,日本SANYO电器集团;SPX-150B-D型振荡培养箱,上海博迅实业有限公司医疗设备厂;PCR扩增仪,美国ABI公司;JY04S-3C凝胶成像系统,北京君意东方电泳设备有限公司。
1.2实验方法
1.2.1腐败菌的分离纯化及计数
用碎冰使鲜活南美白对虾休克,用清水洗净后沥干,随机分成2组,分别冷藏和冻藏,其中冷藏温度为4℃,冻藏温度为-18℃。定时取样采用有氧平板划线法[6]进行腐败菌的分离纯化和计数。
1.2.2腐败菌鉴定
肉眼观察菌落形态,革兰氏染色后镜检记录菌体的大小、形态、芽孢的有无。在此基础上采用酚/氯仿抽提法提取腐败菌基因组DNA[7-9],利用通用引物27F(AGAGTTTGATCCTGGCTCAG)和1492R(CTACGGCTACCTTGTTACGA)进行16S rRNA基因扩增,扩增产物由生工生物工程(上海)股份有限公司测序。将测序所得序列在韩国标准菌株EzTaxon-e数据库[10]中利用Identify程序进行同源性分析,采用软件Mega 6.0程序构建系统发育树。
1.2.3腐败能力测定
参照徐振伟[13-14]的方法制备无菌虾汁,将5 μL浓度为106CFU/mL的菌悬液加入到10 mL灭菌虾汁中,分别贮藏于4℃和-18℃,以未接种的虾汁为对照,定时取样,采用凯氏定氮法测定挥发性盐基氮(TVBN)[15-16],考马斯亮蓝法测定蛋白质含量[12]。同时利用三糖铁培养基中观察腐败菌的产硫化氢情况[11]。
2结果与分析
2.1腐败菌的形态及相关特征
根据菌落形态、个体形态及相关特征,对菌落进行归类并计数,发现在南美白对虾冷藏、冻藏过程中,在数量上占优势并与腐败有关的不同类型菌落共12种,其特征见表1和表2。

表1 南美白对虾腐败菌的菌落特征

表2 南美白对虾腐败菌的菌体形态及相关指标
2.2基于16S rRNA基因序列的腐败菌鉴定
通过腐败菌与相关标准菌株16S rRNA基因序列的同源性分析,根据同源性≥98%为同一种细菌的共识[17],结合形态特征等相关指标,对12株腐败菌进行鉴定,结果见表3。

表3 腐败菌的鉴定结果
从表3可知,引起南美白对虾腐败变质的12株细菌分别是哈夫尼希瓦氏菌(Shewanellahafniensis),约式不动杆菌(Acinetobacterjohnsonii),柠檬色动性球菌(Planoccoccuscitreus),蜡样芽孢杆菌(Bacilluscereus),拜氏不动杆菌(Acinetobacterbeijerinckii),霍氏肠杆菌(Enterobacterhormaechei),伯杰节杆菌(Arthrobacterbergeri)和地衣芽孢杆菌(Bacilluslicheniformis)。X1和X10虽与不动杆菌属的菌种亲缘关系最近,但同源性非常低,结合菌体形态和革兰氏染色结果,可以初步判断它们可能为潜在新种或新属。
2.3南美白对虾贮藏过程中腐败菌的变化规律

图1 南美白对虾冷藏及冻藏过程中腐败菌菌相的变化Fig.1 Thecomposition of bacteria during during cold storage ang frozen storage(注:X34为X3与X4共同计数,X712为X7与X12共同计数)
在南美白对虾低温贮藏货架期内,定时测定腐败菌的数量,探讨优势腐败菌随贮藏时间的变化规律。由图1和图2可知,鲜虾初始菌相中优势菌株为X1和Acinetobacterjohnsonii,次优势菌株为Shewanellahafniensis和Acinetobacterbeijerinckii,菌相的构成随贮藏温度的不同而发生不同的变化,其中冷藏过程中优势菌株Acinetobacterjohnsonii和次优势菌株Shewanellahafniensis所占比例逐渐上升,到货架期终点时,所占比例分别为34.3%和39.1%,成为主要优势菌,初始优势菌株X1、次优势菌株Acinetobacterbeijerinckii及其他菌株所占比例逐渐下降,到货架期终点,X1占比例从22%下降至11%,Acinetobacterbeijerinckii所占比例从17%下降至6.8%,剩余菌株合计所占比例为8.8%。与冷藏相比,冻藏过程中各菌株的比例变化更为复杂,其中X1 和Shewanellahafniensis呈现先增加后降低的趋势;Acinetobacterjohnsonii和Acinetobacterbeijerinckii呈现先下降后上升趋势; 其余菌株均呈下降趋势, 35 d时Bacilluslicheniformis未检出,42 d时Arthrobacterbergeri和X10未检出。到货架期终点菌种组成趋于简单,且优势菌株与初始菌相明显不同,数量最多的菌株为Acinetobacterjohnsonii和Planoccoccuscitreus,所占比例分别为30%和31%,次优菌株为X1,Acinetobacterbeijerinckii和Shewanellahafniensis所占比例分别为18%、14%和5%,其余菌株所占比例较低,仅为2%。
综上分析,由于不同腐败菌对低温冷害的敏感性不同,低温贮藏过程中耐低温性强的菌株数量所占比例逐渐增大,到货架期终点,冷藏条件下的数量优势菌株依次为Acinetobacterjohnsonii,X1,Shewanellahafniensis,Acinetobacterbeijerinckii,冻藏条件下,数量优势菌株依次为Planoccoccuscitreus,Shewanellahafniensis,Acinetobacterjohnsonii,Acinetobacterbeijerinckii,X1。
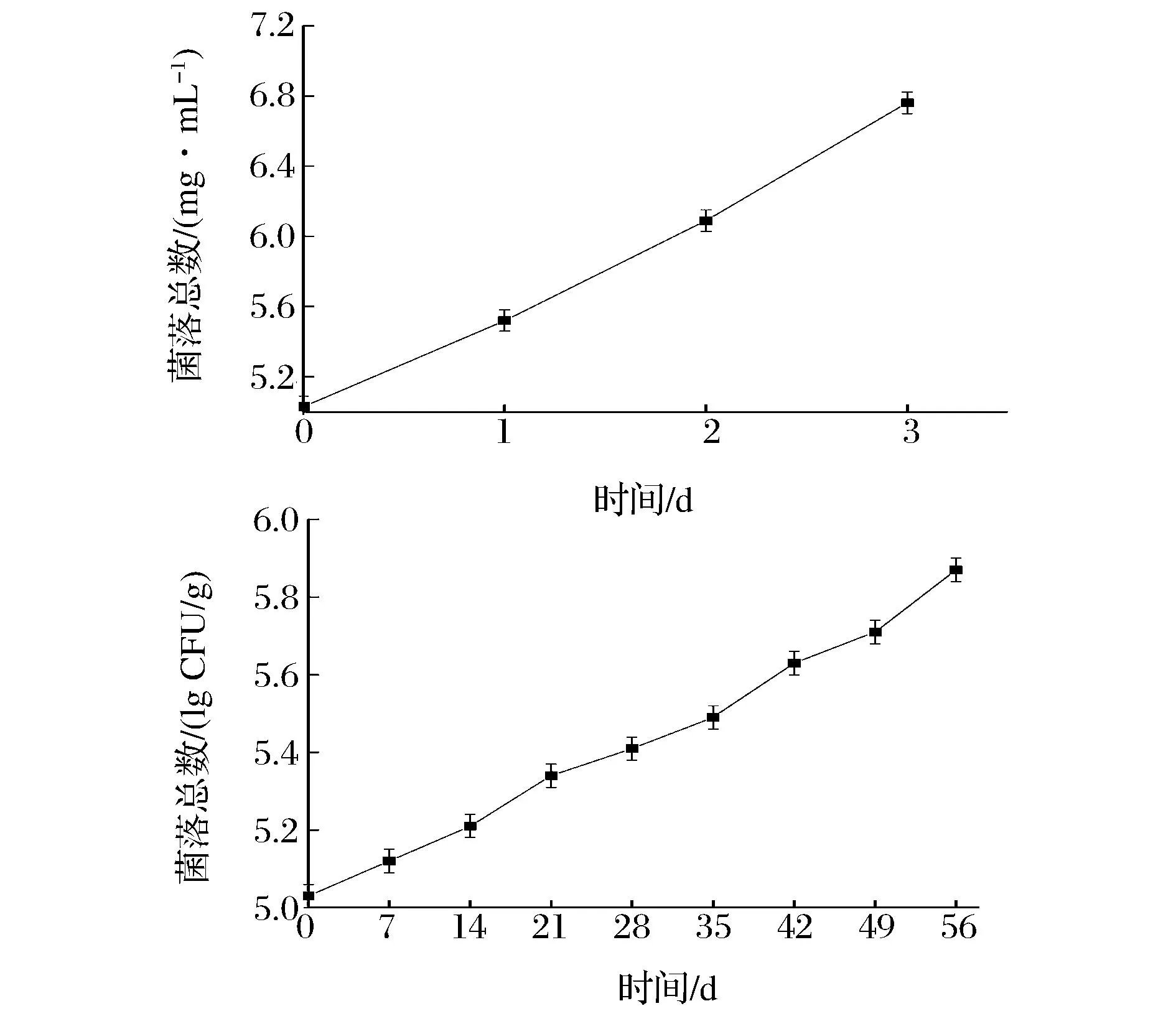
图2 南美白对虾冷藏及冻藏过程中腐败菌细菌总数的变化规律Fig.2 The change of the total number of spoilage bacteria of Penaeus vannamei during cold storage ang frozen storage
2.4腐败菌的致腐能力测定
将接种腐败菌的无菌虾汁置于4℃、-18℃保藏,定期取样测定挥发性盐基氮和蛋白质浓度,因在货架期内挥发性盐基氮呈上升趋势,蛋白质浓度呈下降趋势,所以用极差代表货架期内的发展趋势,并采用SPSS16.0软件对极差进行多重比较,显著性水平为P<0.01,结果见表4和表5。

表4 4℃条件下蛋白质浓度和挥发性盐基氮的多重比较
注:A,B,C,D,E,F,G,H为多重比较结果,同列标有不同大写字母者表示组间差异极显著(P<0.01), 标有相同大写字母者表示组间差异极不显著(P>0.01)。

表5 -18 ℃条件下蛋白质浓度和挥发性盐基氮的多重比较
注:A,B,C,D,E,F,G,H,I为多重比较结果,同列标有不同大写字母者表示组间差异极显著(P<0.01), 标有相同大写字母者表示组间差异极不显著(P>0.01)。
从表4和表5可以看出,在同一贮藏温度下,数量优势菌株产挥发性盐基氮和降解蛋白质的能力均显著高于非优势菌株(P<0.01),意味着数量优势菌株即为腐败优势菌株。对优势腐败菌来说,冷藏条件下,Shewanellahafniensis和Acinetobacterbeijerinckii的蛋白质浓度、挥发性盐基氮差异不显著(P>0.01),致腐能力相近,其他腐败优势菌之间均显著,致腐能力较强的菌株依次是Acinetobacterjohnsonii,X1,Shewanellahafniensis和Acinetobacterbeijerinckii;冻藏条件下,Acinetobacterbeijerinckii与X1的蛋白质浓度和挥发性盐基氮差异不显著(P>0.01),致腐能力相近,其他腐败优势菌之间均显著,致腐能力较强的菌株依次是Planoccoccuscitreus,Acinetobacterjohnsonii,Shewanellahafniensis,Acinetobacterbeijerinckii和X1。
为了进一步探讨不同贮藏温度下,优势腐败菌引起鲜虾腐败的时间进程,在不同时间点取样测定挥发性盐基氮和蛋白质浓度。从图3和图4可以看出,各腐败菌株降解蛋白质产挥发性氨基氮的时间进程基本一致,通过SPSS分析各菌株在同一时间内挥发性盐基氮和蛋白质浓度的变化,可知低温贮藏中,不同时间点测定各菌株的挥发性盐基氮和蛋白质浓度,彼此之间均存在显著差异(P<0.01),冷藏货架期内,Acinetobacterjohnsonii,Acinetobacterbeijerinckii降解蛋白质产挥发性盐基氮分别是最强和最弱,从第2天开始,Shewanellahafniensis的菌落总数优于X1,但X1的挥发性盐基氮比Shewanellahafniensis高,蛋白质浓度比Shewanellahafniensis低,进一步证明X1的致腐能力比Shewanellahafniensis强;冻藏货架期内,Planoccoccuscitreus的降解蛋白质产挥发性盐基氮最强,Acinetobacterjohnsonii次之,从第28天开始,Acinetobacterbeijerinckii和X1的菌落总数都分别大于Shewanellahafniensis,Shewanellahafniensis的挥发性盐基氮比Acinetobacterbeijerinckii和X1高,蛋白质浓度比Acinetobacterbeijerinckii和X1低,进一步证明Shewanellahafniensis的致腐能力比Acinetobacterbeijerinckii和X1强,与多重比较结果一致。
另外通过三糖铁培养基产硫化氢实验,发现南美白对虾低温贮藏过程中的12株腐败细菌,仅有优势腐败菌Shewanellahafniensis在冷藏1d时分解虾汁蛋白产生硫化氢,可见Shewanellahafniensis是鲜虾腐败产生不良气味的关键菌株。

图3 冷藏条件下降解蛋白质产挥发性盐基氮的时间进程Fig.3 The time process of the production of volatile base nitrogen and protein degradation during cold storage

图4 冻藏条件下降解蛋白质产挥发性盐基氮的时间进程Fig.4 The time process of the production of volatile base nitrogen and protein degradation during frozen storage
3结论
本实验采用定时取样,有氧平板分离纯化的方法,对冷藏和冻藏南美白对虾中的腐败菌进行分离纯化,获得纯菌株12株。根据形态、生理生化特征和16S rRNA基因序列对腐败菌进行鉴定,结果表明,12株腐败细菌分别为Shewanellahafniensis、Acinetobacterjohnsonii、Planoccoccuscitreus、Bacilluscereus、Acinetobacterbeijerinckii、Enterobacterhormaechei、Arthrobacterbergeri、Bacilluslicheniformis,另外X1和X10菌株可能为潜在的新属种。同时测定了低温贮藏过程中南美白对虾腐败菌的数量变化及优势菌株的致腐能力,发现在冷藏条件下,致腐能力最强的是Acinetobacterjohnsonii,其次分别是X1,Shewanellahafniensis,Acinetobacterbeijerinckii。冻藏条件下,致腐能力最强的是Planoccoccuscitreus,其次分别是Acinetobacterjohnsonii,Shewanellahafniensis,Acinetobacterbeijerinckii和X1。
参考文献
[1]曹荣,刘淇,殷邦忠.对虾冷藏过程中细菌菌相变化的研究[J].保鲜与加工, 2011,11(1):17-20.
[2]NIRMAL N P,BENJAKUL S.Effect of ferulic acid on inhibition of polyphenoloxidase and quality changes of Pacific white shrimp (Litopenaeusvannamei) during iced storage [J].Food chemistry,2009,116(1):323-331.
[3]DHARANEED H,SUBRAMANIAN, JANG YEOUNG-HWAN,et al.Dietary effect of rubus coreanus ethanolic extract on immune gene expression in white leg shrimp,Penaeusvannamei[J].Fish & Shellfish Immunology,2013,35(3):808-814.
[5]CRISALEJANDRA,FERNANDO.Effect of fasting on digestive gland lipase transcripts expression inPenaeusvannamei[J].Marine Genomics,2011,4(4):273-278.
[6]THOMAS A,MEEKIN M,THOMAS R.Shelf life prediction:status and future possibilities[J].Int J Food Microbiol,1996,6(33):65- 83.
[7]夏涵,府伟灵,陈鸣,等.快速提取细菌DNA方法的研究[J].现代预防医学,2005,32(5):571-573.
[8]朱飞舟,陈利玉,陈汉春,等.16S rRNA基因序列分析法鉴定病原细菌[J].中南大学学报(医学版),2013,(10):1 035-1 041.
[9]钱雪琴,张军,沈芳,等.Chelex-100法和碱性裂解法提取细菌DNA的比较[J].中国卫生检验杂志,2008,18(8):1 565-1 566.
[10]CHUN J,LEE J H,JUNG Y,et al.EzTaxon:a web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences[J].International Journal of Systematic and Evolutionary Microbiology,2007,57(1):2 259-2 261.
[11]叶日英,孙力军,王雅玲,等.凡纳滨对虾内源优势腐败菌的分离与鉴定[J].水产学报,2013,37(9):1426.
[12]李娟,张耀庭,曾伟,等.应用考马斯亮蓝法测定总蛋白含量[J].中国生物制品学杂志,2000,13(2):118-120.
[13]李学英,许钟,杨宪时,等.大黄鱼腐败菌腐败能力分析与特定腐败菌鉴别[J].上海海洋大学学报,2010,19(4):547-552.
[14]许振伟.冷藏鱼类腐败菌腐败能力分析[D].上海:上海海洋大学,2011.
[15]陈培基,李刘冬,黄珂,等.自动定氮仪测定水产品中的挥发性盐基氮[J].南方水产,2005,1(6):50-54.
[16]SANTIAGO P,AUBOURG,CARMEN G,et al.Quality assessment of sardines during storage by measurement of fluorescent compounds[J].Journal of Food Science,1997,62(2):295-299.
[17]杨霞,陈陆,王川庆,等.16S rRNA基因序列分析技术在细菌分类中应用的研究进展[J].西北农林科技大学学报(自然科学版),2008,36(2):55-60.
Isolation and identification of particular spoilage bacteria inPenaeusvannameistored
under low temperature and analysis on their spoilage ability
XIE Li-dan,LI Lei-lei,WANG Su-ying*,DONG Shi-rui
(Tianjin Key Laboratory of Food Biotechnology, College of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300400, China)
ABSTRACTIn order to isolate and identify Penaeus vannamei’s spoilage bacteria and measure their spoilage ability under low temperature storage conditions, the spoilage bacteria were separated from Penaeus vannamei stored under low temperature of 4 ℃ and -18 ℃. The isolated microbes were identified by morphological observation and molecular biology methods. A protein comparative test was carried out through inoculation of spoilage bacteria into sterilized shrimp juice. Results showed that 12 strains of spoilage bacteria were isolated from penaeus vannamei, including Shewanella hafniensis, Acinetobacter johnsonii, Planoccoccus citreus, Bacillus cereus, Acinetobacter beijerinckii, Enterobacter hormaechei, Arthrobacter bergeri, and Bacillus licheniformis, wherein X1 and X10 might be a potential new species or genus. Research on spoilage ability of dominant spoilage bacteria showed that the dominant spoilage bacteria with strong ability for putrefying penaeus vannamei during cold storage were Acinetobacter johnsonii, X1.Shewanella hafniensis and Acinetobacter beijerinckii, and those during frozen storage were Planoccoccus citreus, Acinetobacter johnsonii, Shewanella hafniensis,Acinetobacter beijerinckii, and X1.
Key wordsPenaeus vannamei;low temperature storage;dominant spoilage bacteria;isolation and identification;spoilage ability
收稿日期:2015-09-25,改回日期:2015-11-11
基金项目:国家自然科学基金项目(31270050);天津市高等学校创新团队(TD12-5049)
DOI:10.13995/j.cnki.11-1802/ts.201603012
第一作者:硕士研究生(王素英教授为通讯作者,E-mail:wsying@tjcu.edu.cn)。
