氮源对解脂耶氏酵母合成共轭亚油酸的影响
2016-05-09张白曦李敏陈海琴陈卫张灏
张白曦,李敏,陈海琴,陈卫, 2,张灏*
1(江南大学 食品学院,江苏 无锡,214122) 2(江南大学 食品科学与技术国家重点实验室,江苏 无锡,214122)
氮源对解脂耶氏酵母合成共轭亚油酸的影响
张白曦1,李敏1,陈海琴1,陈卫1, 2,张灏1*
1(江南大学 食品学院,江苏 无锡,214122)2(江南大学 食品科学与技术国家重点实验室,江苏 无锡,214122)
摘要为了提高解脂耶氏酵母重组菌株合成反-10,顺-12-共轭亚油酸的产量,以YNBDSa为发酵培养基进行摇瓶发酵,研究氮限制策略及氮源种类对菌株合成脂肪酶Lip2、亚油酸异构酶PAI及反-10, 顺-12-共轭亚油酸产量的影响。结果表明:高氮培养基更利于菌体生长以及产物的合成,反-10, 顺-12-共轭亚油酸产量达到4.3 g/L,是低氮培养基对应结果的8.6倍;采用有机氮为氮源时,Lip2酶活及PAI表达量显著高于无机氮的结果,反-10, 顺-12-共轭亚油酸产量最高达到4.6 g/L,是无机氮结果的46倍。
关键词解脂耶氏酵母;氮源;反-10, 顺-12-共轭亚油酸;产量
反-10,顺-12-共轭亚油酸(trans-10,cis-12-conjugated linoleic.acid, t10, c12-CLA)是一种十八碳的多不饱和脂肪酸,也是具有重要生理活性的共轭亚油酸(CLA)的两种异构体之一,具有抑制肿瘤细胞增殖、减少脂质积累及增强免疫力等生理功能[1]。目前,CLA的合成主要包括化学合成法和生物合成法。由于化学合成法得到的CLA异构体成分复杂,存在安全风险,使其在医药领域的应用受到限制[2]。生物合成法得到的异构体结构较单一、反应条件温和,因而得到越来越多的关注[3]。
本实验室通过基因工程手段构建出1株高产t10, c12-CLA的解脂耶氏酵母重组菌株(Yarrowia lipolytica CCFM-JU277-9),该菌在菌体细胞处于对数期中后期时启动外源基因亚油酸异构酶(PAI)的表达。亚油酸异构酶PAI不受底物的抑制,并且催化游离形式的亚油酸(LA)合成且只合成 t10, c12-CLA一种单体[4],为生物转化法合成单一t10, c12-CLA提供了可能性。由于Y.lipolytica自身合成的底物LA有限,而植物油中红花籽油LA的含量最高,约占总脂肪酸的80%。因此,本文采用红花籽油作为底物来源,通过Y.lipolytica自身合成并分泌的脂肪酶Lip2[5],将甘油三酯形式的红花籽油水解为游离脂肪酸形式,游离型LA进入Y.lipolytica细胞内,作为底物被PAI转化为t10, c12-CLA。
氮源含量与微生物脂质积累密切相关,而脂质含量的提高有利于t10, c12-CLA的合成积累。微生物一般是在培养基中碳源充足、另一种元素受限的情况下启动脂质积累,其中氮限制是调控微生物积累脂质最常用的方法[6]。氮源种类则与微生物中蛋白表达密切相关[5,7],而Lip2及外源蛋白PAI的表达量是影响Y.lipolytica合成t10, c12-CLA的重要因素。本文从氮限制策略以及氮源种类两方面研究其对Y.lipolytica合成t10, c12-CLA的影响机制,通过培养基优化进一步提高了Y.lipolytica合成t10, c12-CLA产量。
1材料与方法
1.1菌株
重组解脂耶氏酵母(YarrowialipolyticaCCFM-JU277-9),构建于本实验室,保藏于中国微生物菌株保藏管理委员会普通微生物中心,其保藏号为CCFM-JU277-9。
1.2培养基与培养方法
YNBDO培养基[8]:6.7 g/L无氨基酸酵母氮源,10.0 g/L葡萄糖,5.0 g/L,NH4Cl 0.1 g/L 尿嘧啶,2.0 g/L酪蛋白水解物,20 g/L 油酸。
YNBDSa发酵培养基:将YNBDO培养基中的油酸替换为红花籽油(SaO),其余成分及含量不变。
YN20BDSa发酵培养基:将YNBDSa培养基中的酪蛋白水解物增加到20.0 g/L。红花籽油在吐温-80水溶液中超声乳化,膜过滤灭菌待用,当葡萄糖基本耗尽时添加到发酵培养基。
Y.lipolyticaCCFM-JU277-9划线于YNBD平板培养基,并在YNBD液体培养基中活化,以1%的接种量接种到发酵培养基中,28 ℃、200 r/min培养至发酵结束。
1.3研究方法
1.3.1无脂质生物量的确定
发酵液于8 000 r/min离心15 min,收集菌体细胞,保留发酵上清液,用生理盐水洗涤菌体2次,洗涤后的液体与发酵上清液合并留作脂质提取,菌体重悬于生理盐水中预冻2 h,经冷冻干燥后称量干菌重m1,测定细胞中总脂质的质量m2,无脂质生物量即为m1-m2。
1.3.2葡萄糖含量的确定
根据葡萄糖测定试剂盒检测发酵液中葡萄糖含量,具体参照说明书。
1.3.3脂质提取及分析
发酵上清液和菌体细胞中脂质提取及甲酯化方法采用盐酸甲醇法,通过气相色谱定性定量分析,具体方法参照文献[9]。
1.3.4PAI表达量及Lip2酶活测定方法
取相同量菌体细胞,4 ℃环境下玻璃珠振荡破碎,10 000 r/min 离心10 min,上清液即为PAI粗酶液,通过Western Blot检测PAI表达量,具体检测方法参考文献[10]。
取等体积发酵液于10 000 r/min离心5 min,上清液即为Lip2脂肪酶粗酶液。根据碱式滴定法测定胞外Lip2脂肪酶酶活[11],操作如下:50 mmol/L、pH 8.0的Tris-HCl缓冲液5 mL,红花籽油与2%聚乙烯醇溶液体积比为1∶3的红花籽油乳化液4 mL,粗酶液1 mL,37 ℃、100 r/min振荡10 min,加入15 mL终止液。
37 ℃、pH8.0条件下,以每分钟粗酶液水解红花籽油乳化液生产1μmol 游离脂肪酸所需的酶量定义为1个酶活单位(U)。
2结果与分析
2.1氮限制策略对重组菌株合成t10, c12-CLA的影响
YNBDO培养基是Y.lipolytica ex novo脂质积累途径的常用培养基[8],其氮源含量较低,以便通过氮限制启动脂质积累。但由于重组Y.lipolytica是在菌体进入对数期中后期时启动PAI基因表达[4],此时需要大量的氮源存在,YNBDO培养基中氮含量不高,因而可能会影响异源蛋白的表达。因此,本文研究了氮限制培养基与非限制培养对重组菌株生长及t10, c12-CLA合成的影响。
结果如图1所示,重组菌株在YN20BDSa高氮培养基的生长延滞期明显缩短,发酵25 h左右葡萄糖基本耗尽,而低氮培养基在发酵35 h左右出现此现象。葡萄糖耗尽时添加红花籽油,重组Y.lipolytica菌株利用培养基中经Lip2脂肪酶水解得到的游离LA为碳源,出现了生长速率减慢二次生长期,一直持续到发酵结束。YN20BDSa高氮培养基最大生物量达到13.7 g/L,而YNBDSa低氮培养基为11.5 g/L。高氮培养基pH基本稳定在6.0左右,而低氮培养基的pH则发生较大的变化,在发酵20 h左右迅速降低,直至发酵42 h左右稳定在pH3.0。低氮培养基中pH的降低可能是重组Y.lipolytica产酸的作用。Y.lipolytica有较强的产酸能力,工业中已用于柠檬酸、异柠檬酸和酮戊二酸的生产[12]。
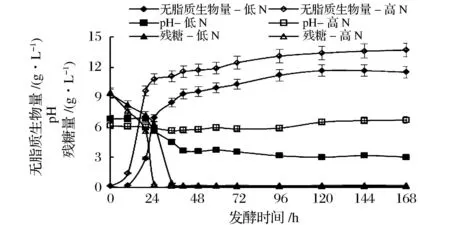
图1 重组Y. lipolytica在不同氮含量发酵培养基中生物量、pH、残糖量随发酵时间的变化Fig.1 Time-course variations in the biomass, pH and glucose concentration of recombinant Y. lipolytica in different nitrogen concentrations
一方面较低的氮含量可能影响了异源蛋白PAI的表达;另一方面较低的pH对PAI和Lip2脂肪酶的活性有抑制作用,降低了t10, c12-CLA的转化效率。结果如图2所示。
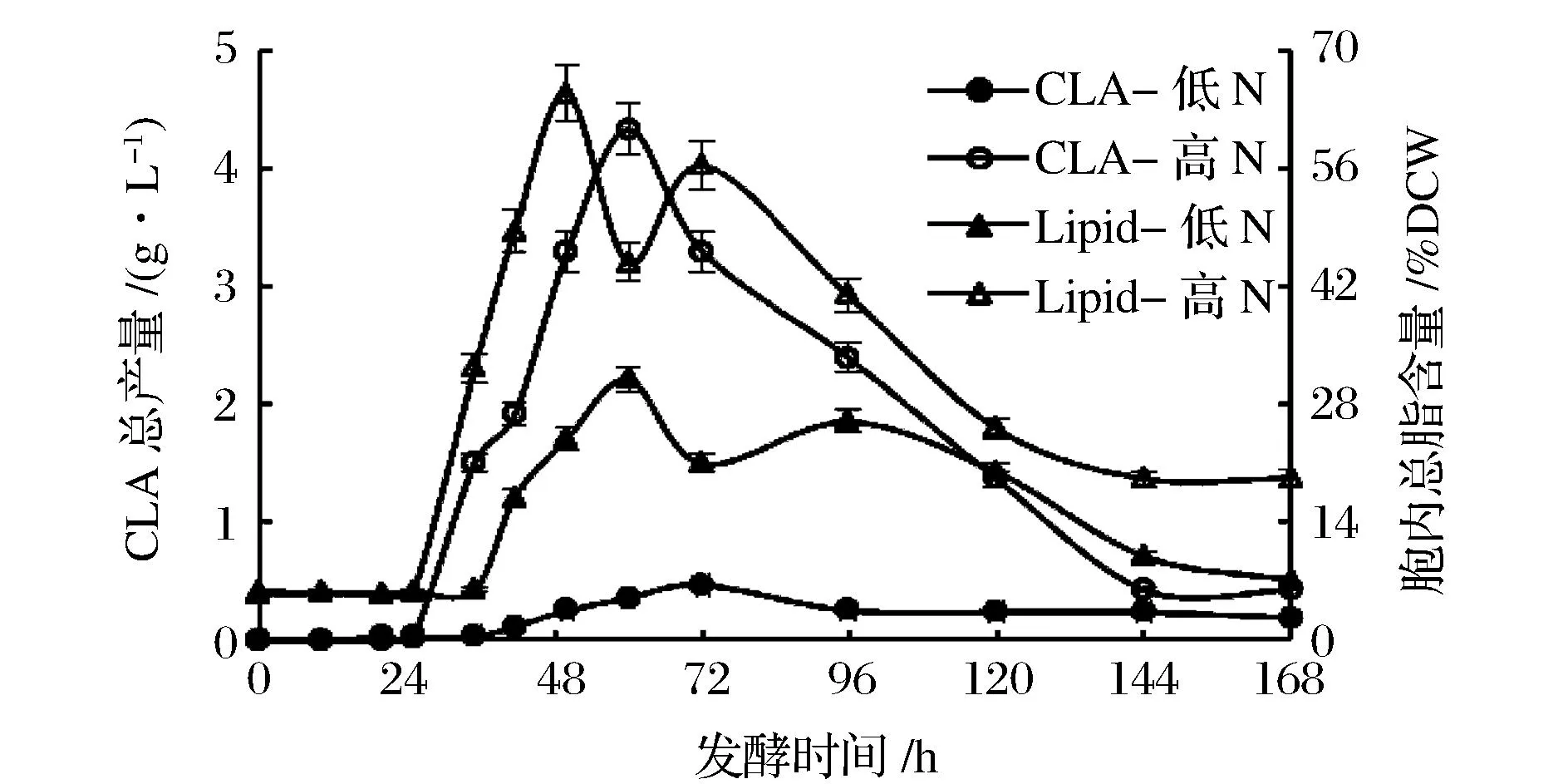
图2 Y. lipolytica在不同氮含量发酵培养基中CLA总产量及胞内总脂含量随发酵时间的变化Fig.2 Time-course variations in CLA production and lipid content of Y. lipolytica cultivated with different nitrogen concentrations
低氮条件培养时,t10, c12-CLA的总产量明显低于高氮培养的结果。氮限制培养基对应的胞内总脂含量也比高氮培养基低,并未实现通过氮限制达到脂质积累的目标。t10, c12-CLA产量随发酵时间的进行呈现先增加后降低的趋势,在低氮培养的72 h左右,t10, c12-CLA产量达到最高,为0.5 g/L,高氮培养发酵60 h左右,t10, c12-CLA产量达到最高为4.3 g/L,是低氮培养结果的8.6倍。
综上所述,氮限制策略并未实现脂质积累,提高目标产物产量的目的,非限制性培养基YN20BDSa更利于重组Y.lipolytica菌株生长、异源蛋白表达以及t10, c12-CLA的合成。
2.2氮源种类对重组菌株合成t10, c12-CLA的影响
分别用25 g/L的酪蛋白水解物、胰蛋白胨、牛肉浸膏、NH4Cl、NH4NO3和(NH4)2SO4替代YN20BDSa培养基中的氯化铵和酪蛋白水解物,研究有机氮源和无机氮源对重组Y.lipolytica产物合成的影响。
不同氮源对重组Y.lipolytica生物量的影响如图3所示,分别以3种有机氮为氮源进行培养时,菌体生物量相近,均在14.0 g/L左右,显著高于以3种无机氮为氮源时的结果,其生物量均低于9.0 g/L。WEETE研究表明,有机氮源是真菌生物细胞生长的最佳氮源[13]。
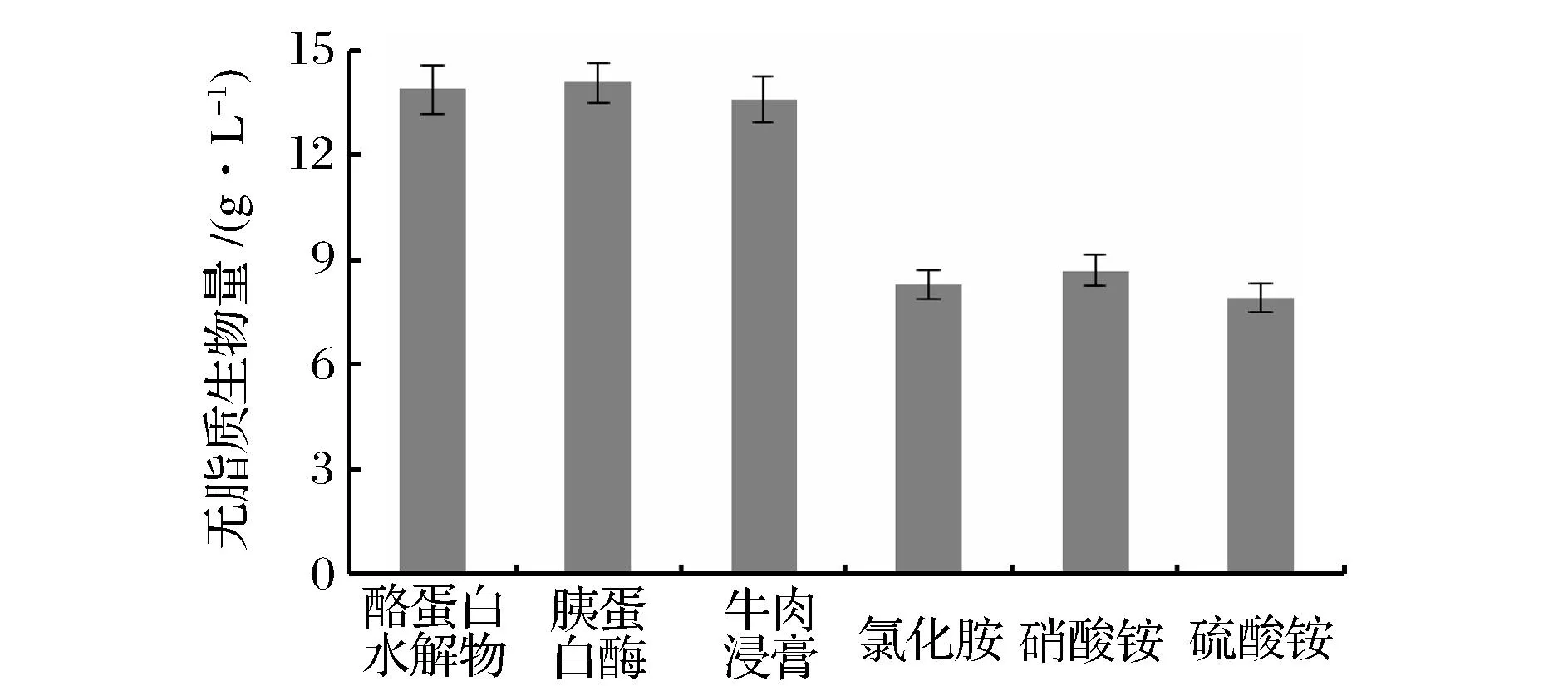
图3 不同氮源对重组Y. lipolytica生物量的影响Fig.3 Effects of different nitrogen sources on the biomass of recombinant Y. lipolytica
重组菌株合成t10, c12-CLA时,需要脂肪酶Lip2及亚油酸异构酶PAI的共同参与。不同氮源对Lip2及PAI的影响如图4所示,3种无机氮源培养基对应的Lip2酶活均在7.0 U/mL以下,3种有机氮源的Lip2酶活均在46.0 U/mL左右,是无机氮结果的6.5倍;而重组Y.lipolytica在有机氮源培养基中的PAI表达量也明显高于无机氮源的结果。推测导致以上结果的原因如下:首先,有机氮源含有丰富的蛋白质、多肽及游离氨基酸,特别是酪蛋白水解物含有18种游离氨基酸,可被重组Y.lipolytica直接吸收,用于合成细胞生长及t10, c12-CLA合成所需的各种蛋白质[14],利用效率高于无机氮源;其次,由于无机氮是以NH4+形式为菌体提供氮元素,有文献报道NH4+大量存在会抑制Y.lipolytica合成Lip2[15]。
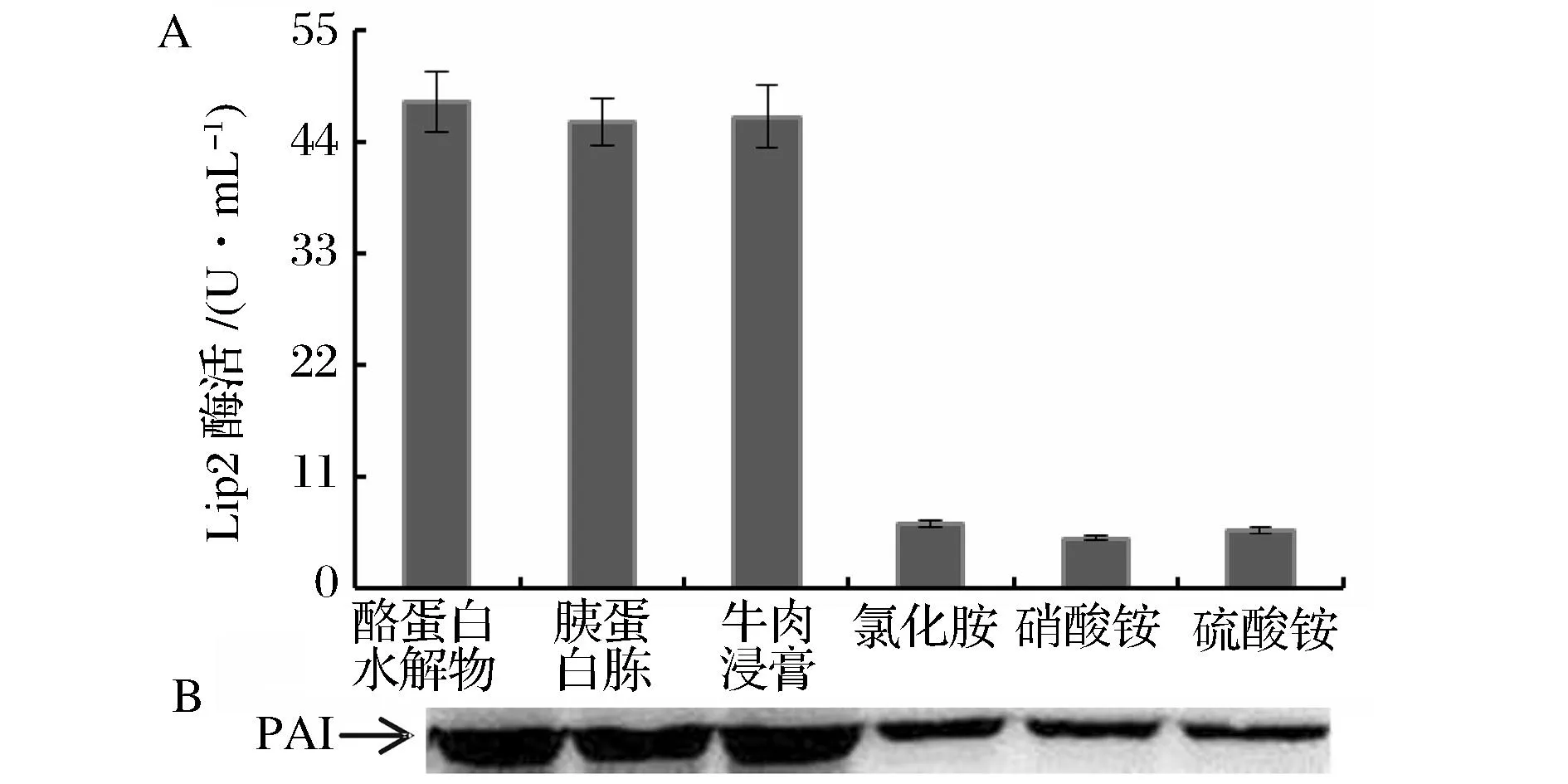
图4 不同氮源对重组Y. lipolytica Lip2酶活及PAI表达量的影响Fig.4 Effects of different nitrogen sources on Lip2 activity(A)and PAI expression(B)
如表1所示,不同氮源对产物t10, c12-CLA合成的影响与生物量、Lip2酶活及PAI表达量的结果一致。当以有机氮源进行培养时,发酵进行到60 h产物产量即达到最高值,比无机氮的最高产量出现时间提前12 h;3种有机氮源对应的t10, c12-CLA产量相似,均高于4.0 g/L,是无机氮结果的40倍。有机氮源与无机氮源的t10, c12-CLA产量差异如此悬殊是重组Y.lipolytica菌体生物量、Lip2酶活及PAI表达量协同作用的结果,菌体生长速度快、关键酶的表达量及酶活高,则产物合成效率高。
表1 不同氮源对重组Y. lipolytica CLA合成的影响
3结论
培养基中氮含量及氮源种类对Y.lipolytica重组菌株合成t10, c12-CLA 有明显的影响。氮限制培养基一方面抑制了异源蛋白PAI的表达,另一方面促使菌株合成有机酸,较低的pH对PAI和Lip2酶活有抑制作用,从而降低了t10, c12-CLA的转化效率;高氮培养基更利于菌株的生长以及t10, c12-CLA的合成,产物产量达到4.3 g/L,是氮限制结果的8.6倍。无机氮源抑制菌株中关键酶PAI及Lip2的合成,进而降低产物t10, c12-CLA的产量,因此确定有机氮为Y.lipolytica合成t10, c12-CLA的最适氮源,t10, c12-CLA的产量达到4.6 g/L,是无机氮源对应结果的46倍。
参考文献
[1]CHURRUCA I,FERNANDEZ-QUINTELA A,PORTILLO M P.Conjugated linoleic acid isomers:Differences in metabolism and biological effects[J].Biofactors,2009,35(1):105-111.
[2]严梅荣,顾华孝.共轭亚油酸合成方法的研究进展[J].中国油脂,2003,28 (7):40-42.
[3]周凌华,张灏,陈卫,等.生物合成共轭亚油酸菌种的筛选与鉴定 [J].无锡轻工大学学报,2004,23 (5):53-57.
[4]ZHANG Bai-xi,CHEN Hai-qin,LI Min,et al. Genetic engineering of Yarrowia lipolytica for enhanced production of trans-10, cis-12 conjugated linoleic acid[J].Microbial Cell Factories,2013,12:70.
[5]NAJJAR A,ROBERT S,GUERIN C,et al. Quantitative study of lipase secretion,extracellular lipolysis,and lipid storage in the yeast Yarrowia lipolytica grown in the presence of olive oil: analogies with lipolysis in humans [J].Applied Microbiology and Biotechnology,2011,89(6):1 947-1 962.
[6]PAPANIKOLAOU S, AGGELIS G. Lipid production by Yarrowia lipolytica growing on industrial glycerol in a single-stage continuous culture[J].Bioresource Technology,2002,82(1):43-49.
[7]KEBABCI O,CLHANGLR N.Comparison of three Yarrowia lipolytica strains for lipase production:NBRC1658,IFO 1195,and a local strain[J].Turkish Journal of Biology,2012,36:15-24.
[8]BEOPOULOS A,MROZOVA Z,THEVENIEAU F,et al. Control of lipid accumulation in the yeast Yarrowia lipolytica[J].Applied and Environmental Microbiology,2008,74(24):7 779-7 789.
[9]ZHANG Bai-xi,RONG Chun-chi,CHEN Hai-qin,et al. De novo synthesis of trans-10,cis-12 conjugated linoleic acid in oleaginous yeast Yarrowia Lipolytica[J].Microbial Cell Factories,2012,11:51.
[10]HORNUNG E,KRUEGER C,PERNSTICH C,et al. Production of (10E,12Z)-conjugated linoleic acid in yeast and tobacco seeds[J].Biochimica Et Biophysica Acta,2005,1 738(1-3):105-114.
[11]滕宏飞,王丹静,徐青,等.橄榄油乳化法测定脂肪酶活性的优化研究[J].食品工业,2011(6):80-83.
[12]FICKERS P,BENETTI P H,WACHE Y,et al. Hydrophobic substrate utilisation by the yeast Yarrowia lipolytica,and its potential applications[J].FEMS Yeast Research,2005,5(6-7):527-543.
[13]WEETE JD.Lipid biochemistry of fungi and other organisms[M].New York and London:Plenum Press,1980:97-111.
[14]FICKERS P,NICAUD J M,GAILLARDIN C,et al. Carbon and nitrogen sources modulate lipase production in the yeast Yarrowia lipolytica[J].Applied Microbiology,2004,96(4):742-749.
[15]GASMI N,AYED A,NICAUD J M,et al. Design of an efficient medium for heterologous protein production in Yarrowia lipolytica: case of human interferon alpha 2b[J].Microbial Cell Factories,2011,10:38.
Effects of nitrogen sources on the synthesis of conjugated linoleic acid byYarrowialipolytica
ZHANG Bai-xi1,LI Min1, CHEN Hai-qin1,CHEN Wei1,2,ZHANG Hao1*
1(School of Food Science and Technology, Jiangnan University, Wuxi 214122,China)2(State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi 214122,China)
ABSTRACTIn order to increase the yield of trans-10, cis-12-conjugated linoleic acid(t10, c12-CLA)in recombinant Yarrowia lipolytica, effects of nitrogen limitation strategy and different nitrogen sources on lipase (Lip2) activity, conjugated linoleic acid isomerase (PAI) expression and t10, c12-CLA production were investigated using flask fermentation with YNBDSa medium. The results indicated that high nitrogen concentration in medium was more conducive to the growth of recombinant yeast and production of t10, c12-CLA, and the yield of t10, c12-CLA reached 4.3 g/L, which was 8.6 times higher than that produced in nitrogen limitation medium. Organic nitrogen sources were more effective for the expression of PAI and Lip2. Yield of t10, c12-CLA was up to 4.6 g/L, which was 46-folds increase compared with inorganic nitrogen sources.
Key wordsYarrowia lipolitica; nitrogen sources; t10, c12-conjugated linoleic acid; yield
收稿日期:2015-10-29,改回日期:2015-12-02
基金项目:国家自然科学基金青年基金项目(31501457)
DOI:10.13995/j.cnki.11-1802/ts.201603002
第一作者:硕士研究生(张灏教授为通讯作者,E-mail:zhanghao@jiangnan.edu.cn)。
