羊乳中类胰岛素生长因子I的特性
2016-05-09侯院林张富新李龙柱于玲玲云丹雷飞燕
侯院林,张富新*,李龙柱,于玲玲,云丹,雷飞燕
1(陕西师范大学 食品工程与营养科学学院,陕西 西安,710062) 2(西安市碑林区食品药品监督管理局,陕西 西安,710000)
羊乳中类胰岛素生长因子I的特性
侯院林1,张富新1*,李龙柱2,于玲玲1,云丹1,雷飞燕1
1(陕西师范大学 食品工程与营养科学学院,陕西 西安,710062)2(西安市碑林区食品药品监督管理局,陕西 西安,710000)
摘要采用双抗体夹心酶联免疫法研究了温度、pH、紫外线以及金属离子等因素对羊乳中类胰岛素生长因子I(insulin-like grouth factor-I,IGF-I)浓度的影响。研究表明:羊乳中IGF-I在20 ℃时浓度最高,达到(29.91±0.91) ng/mL(P<0.05),在40 ℃时具有较高的热稳定性;IGF-I在pH=4时浓度最高,达到(28.53±1.11) ng/mL(P<0.05),在pH值为6~8时稳定性较高;紫外线照射会造成IGF-I的浓度显著降低(P<0.05)。Na+、Ca(2+)、Al(3+)、Zn(2+)等金属离子对IGF-I的浓度具有抑制作用,而Mg(2+)、Fe(2+)对IGF-I无明显影响,低浓度的Fe(3+)、Cu(2+)对IGF-I的浓度具有抑制作用,而高浓度的Fe(3+)、Cu(2+)对IGF-I具有激活作用。通过研究,评估温度、pH、紫外线以及金属离子对羊乳中IGF-I浓度的影响,为生产具有更高IGF-I浓度的功能活性羊乳产品提供依据和指导。
关键词羊乳;类胰岛素生长因子I;特性;双抗体夹心酶联免疫法
羊乳不仅含有人体所需的营养成分,同时还含有多种对人体有益的生物活性物质[1]。其中类胰岛素生长因子(insulin-like growth factor, IGF)是羊乳中生物活性物质的重要组成成分,具有重要的生理功能,对新生儿胃肠道的发育具有重要的生理作用[2-4]。羊乳中IGF主要以类胰岛素生长因子I(insulin-like growth factor-I, IGF-I)和类胰岛素生长因子II(Insulin-like growth factor-II, IGF-II)形式存在,其IGF-I浓度和生理活性远大于IGF-II[5]。IGF-I是由70个氨基酸组成的分子质量为7.6 kDa的单链多肽,pI为8.2,有3个二硫键,分别在6-48、47-52、18-61号位置[6-7]。IGF-I与胰岛素的结构相似,对糖尿病具有一定的辅助疗效[8]。现代医学表明,IGF-I对糖尿病人降血糖具有一定的作用。《本草纲目》中也记载羊奶有“治消渴”(治疗糖尿病)的作用。目前,有关IGF-I对哺乳动物的生理功能方面的研究报道较多[9-10],但对IGF-I在乳品加工过程中的变化报道较少。由于IGF-I易受pH、温度等环境变化影响,容易发生氧化、变性、聚集或沉淀反应等,而乳品加工过程中常伴随有均质、杀菌、喷雾干燥等工艺环节[11-13],会造成乳制品中的IGF-I浓度降低,严重削弱了乳制品的营养价值[14-15]。因此,本文对影响羊乳中IGF-I浓度的温度、pH、紫外线以及金属离子因素进行研究,评估加工过程对IGF-I浓度的影响,以便为进一步利用羊乳资源,生产具有更高IGF-I浓度的功能活性羊乳产品。
1材料与方法
1.1材料
羊乳:选用西北农林科技大学动物科技学院畜牧场健康萨能奶山羊,人工挤奶方式取样。为防止微生物污染,采样前用干净毛巾对乳房清洗,并弃去前3把乳(约30 mL),然后用预先灭菌的取样管采集挤奶中段的乳样。每只羊收集50 mL乳样,共收集20个乳样,然后人工混匀制成混合样,立即在-40 ℃下冷冻储存,需要用时在4 ℃的冰水混合浴中解冻备用。
试剂盒:山羊IGF-I酶联免疫试剂盒,购自美国R&D公司。
1.2主要设备
HDM-3000型数字控温电热套,江苏荣华仪器有限公司;雷磁pHS-3C型精密pH酸度计,上海精密科学仪器有限公司;TGL-16B型台式低温高速离心机,上海安亭科学仪器厂;GSP-9080MBE型隔水式恒温培养箱,上海博迅实业有限公司医疗设备厂;Multiskan Go型全波长酶标仪,美国热电公司;移液器(量程:0.5~10、10~100、100~1000 μL),德国Eppendorf公司。
1.3测定方法
1.3.1样品处理
样品处理按LORENZO CASTIGLIEGO[16]方法并加以改进。将冷冻的乳样在室温下缓慢解冻后,用移液器吸取1 mL乳样置于2 mL离心管中,在3 000 g下离心15 min脱脂,吸取400 μL的脱脂乳,加入40 μL 2 mol/L的HCl,充分混合,室温下静置30 min后,在4℃,10,000 g下离心30 min。吸取100 μL的上清液,添加264 μL的缓冲溶液(由11.7 mmol/L KH2PO4; 36.2 mmol/L Na2HPO4, 60 mmol/L Tris-base, 体积分数为0.07%的Tween 20, 250 ng/mL IGF-II组成),充分混合后,再在4℃,10,000 g下离心10 min,取上清液,用于试剂盒检测IGF-I浓度。
1.3.2IGF-I的检测
IGF-I浓度采用双抗体夹心酶联免疫(ELISA)试剂盒测定。将试剂盒在室温下平衡20 min后,取出试剂盒中板条。取10 μL处理后的乳样加入板条反应孔中,然后加入样品稀释液40 μL,再加入辣根过氧化物酶(HRP)标记的抗体液50 μL,用封板膜封住反应孔后,在37℃下保温60 min。保温结束后弃去反应孔中液体,将板条翻转,在滤纸上拍干。在反应后的反应孔中加入350 μL洗涤液,静置1 min后,弃去洗涤液,在滤纸上拍干,如此重复5次。在洗涤后的板条反应孔中加入底物A、B各50 μL,37℃避光保温15 min。最后在反应孔中加入终止液50 μL,15 min内在450 nm波长处测定各孔吸光度。每个样品重复3次。
1.3.3IGF-I浓度的计算
将山羊IGF-I酶联免疫试剂盒中浓度为10 ng/mL的IGF-I标准品用试剂盒中的标品稀释液依次稀释成浓度为0、0.625、1.25、2.5、5、10 ng/mL的溶液。用1.3.2方法检测不同浓度IGF-I标准品的吸光度,然后以浓度为横坐标(X),OD值为纵坐标(Y),绘制IGF-I标准曲线,计算线性回归方程(Y= 0.137 1X+ 0.017 2,R2= 0.991 8),按回归方程计算测试样品中IGF-I浓度。
1.3.4温度对IGF-I浓度影响的测定
将解冻后的混合乳样分别在20、40、60、80、100、121、135℃的恒温油浴中加热15 s后,冷却至室温,测定其IGF-I的浓度。
1.3.5IGF-I热稳定性的测定
将解冻后的混合乳样分别在40、60、80、100℃水浴中保温15、30、60、120 min,或在121、135℃的恒温油浴中保温15、30、60、180 s后,冷却至室温,测定其IGF-I浓度。
1.3.6pH对IGF-I浓度影响的测定
在25℃的条件下,用1 mol/L的HCl或1 mol/L的NaOH溶液将乳样的pH值分别调整到3、4、5、6、7、8、9、10,放置15 s后,测定其IGF-I的浓度。
1.3.7IGF-I pH稳定性的测定
在25℃的条件下,用1 mol/L的HCl或1 mol/L的NaOH溶液将乳样的pH值调整到3、4、5、6、7、8、9、10,然后分别放置15、30、60、120 min,测定其IGF-I的浓度。
1.3.8紫外线对羊乳IGF-I浓度的影响
将解冻后的混合乳样置于12 cm培养皿中,培养皿中的乳样高度为3 mm,在室温条件下,用波长为365 nm的4 W紫外灯在距离乳样50 cm处分别照射15、30、60、120 min,测定其IGF-I的浓度。
1.3.9金属离子对羊乳IGF-I浓度的影响
在解冻后的混合乳样中分别加入浓度为100 mmol/L的CaCl2、ZnCl2、NaCl、AlCl3、FeCl2、FeCl3、CuCl2、MgCl2溶液,使其在羊乳中金属离子的浓度分别达到1 mmol/L和5 mmol/L,在25 ℃下放置30 min后,测定IGF-I的浓度。
1.4数据处理
数据用DPS统计软件进行分析,并采用Duncan新复极差法进行显著性检验。
2结果与分析
2.1温度对IGF-I浓度的影响
温度对羊乳中IGF-I浓度的影响如图1所示。

图1 温度对羊乳中IGF-I质量浓度的影响Fig.1 Effects of temperature on IGF-I concentrations in goat milk
IGF-I的浓度随温度升高呈下降的趋势。当温度为20~80 ℃时,IGF-I的浓度下降较为缓慢,而当温度为80~135 ℃时,IGF-I浓度的下降速度较为迅速。20 ℃时,IGF-I浓度为(29.91 ±0.91) ng/mL,当温度达到135 ℃时,IGF-I的浓度仅为(24.64±0.87) ng/mL(P<0.05)。TAKUJI HIRAYAMA等人[17-24]研究了温度对牛乳中IGF-I活性的影响,乳中IGF-I的活性与其结构密切相关,IGF-I是一个分子质量为7.6 kDa的活性多肽,其结构中含有二硫键,热处理会引起多肽结构中二硫键的断裂,造成羊乳中IGF-I浓度的下降。
2.2IGF-I的热稳定性
羊乳IGF-I的浓度在40、60、80、100 ℃和121、135 ℃的热稳定性分别如图2-A、图2-B所示。

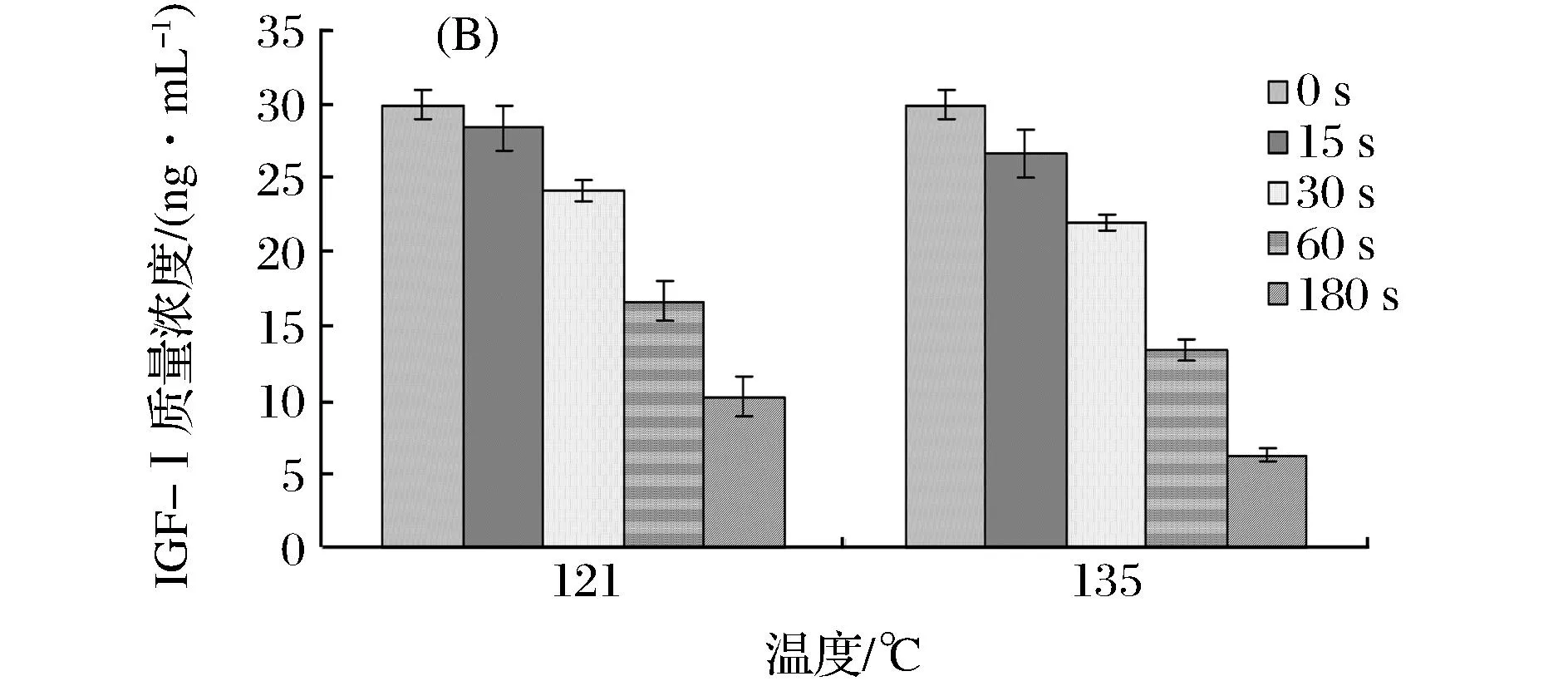
图2 IGF-I的热稳定性Fig.2 Heat stability of IGF-I in goat milk
从图2-A中可以看出,随着加热时间的延长,IGF-I的浓度均呈下降的趋势,但在不同温度下保温相同的时间,IGF-I的浓度下降程度有所差异,在40℃的保温过程中,前30 min,IGF-I的浓度下降不显著(P>0.05),而60 min时,IGF-I的浓度显著下降(P<0.05);在60℃的保温过程中,前15 min,IGF-I的浓度下降不显著(P>0.05);在80 ℃和100 ℃的保温过程中,从0~120 min,IGF-I的浓度始终呈显著下降趋势(P<0.05)。从图2-B中可以看出:在121℃的保温过程中,前15 s,IGF-I的浓度下降不显著(P>0.05),随后均呈显著下降趋势(P<0.05)。在135℃的保温过程中,IGF-I的浓度均呈显著下降趋势(P<0.05)。
由此可见,在同一保温过程中,在保温的开始和最后阶段,羊乳中IGF-I的浓度下降均较为缓慢,而在其中间阶段,其浓度下降较为迅速。在不同的保温过程中,保温时间相同时,保持的温度越高,IGF-I的浓度下降速度越快,其浓度越低。产生这种现象的原因是相比较于其他活性生长因子,IGF-I的二级结构中二硫键的数目较少。例如转化生长因子β2(transforming growth factor-β2,TGF-β2)含有9个二硫键,而IGF-I的二级结构中只含有3个二硫键,造成其对加热不太敏感。当刚开始保温时,IGF-I具有一定的热稳定性,其浓度下降较为缓慢,但在持续的保温过程中,特别是在高温环境中,IGF-I的热抵抗性迅速减弱,结构逐渐遭到破坏,致使其IGF-I浓度降低。
2.3pH对IGF-I浓度的影响
pH对羊乳中IGF-I浓度的影响如图3所示。
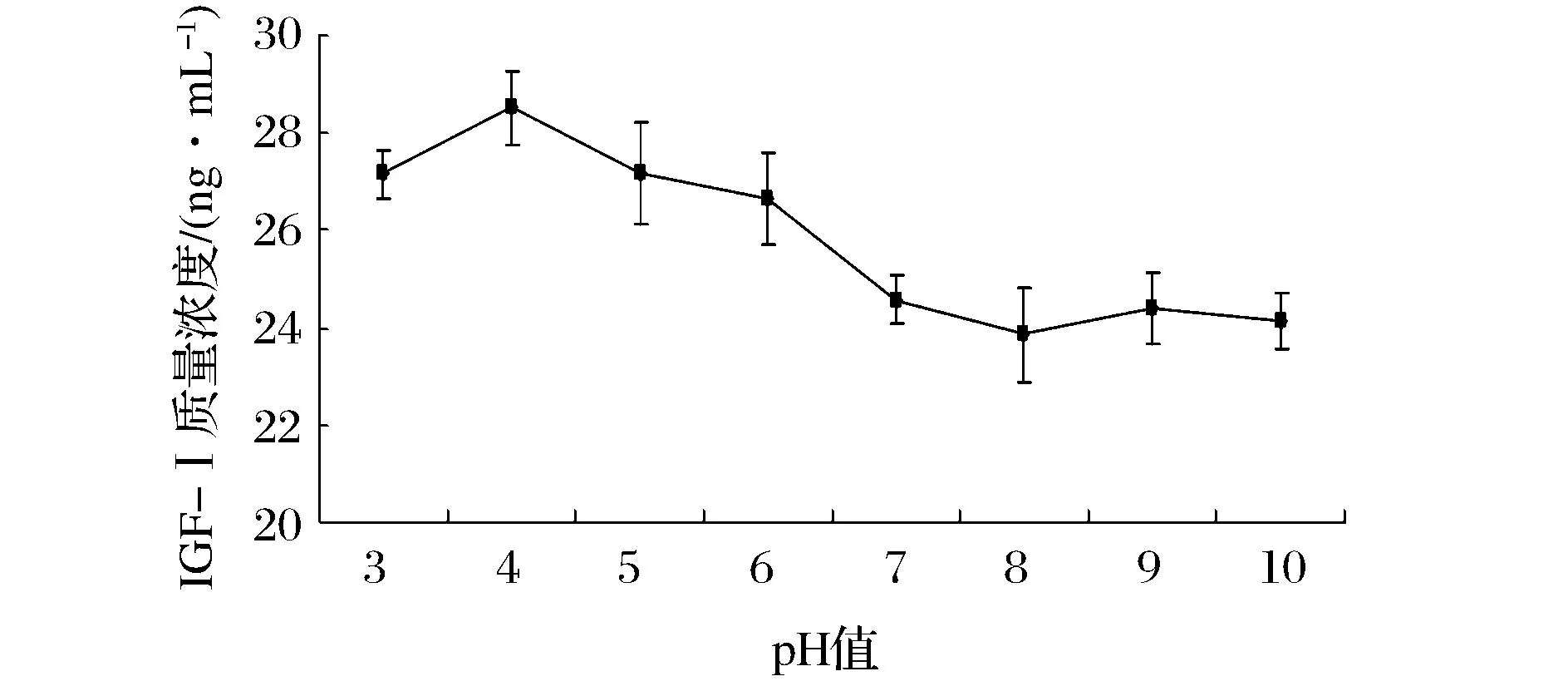
图3 pH对羊乳中IGF-I质量浓度的影响Fig. 3 Effects of pH on IGF-I concentrations in goat milk
当羊乳的pH值小于4时,随着pH值的升高,IGF-I的浓度逐渐增高;当羊乳的pH值为4时,IGF-I的浓度((28.53±1.11) ng/mL)最高,当羊乳的pH值高于4时,随着pH值的升高,IGF-I的浓度逐渐降低;当羊乳的pH值为8时,IGF-I的浓度((23.85±1.53) ng/mL)最低;当羊乳的pH值高于9时,羊乳中IGF-I的浓度又开始逐渐降低。由此可知,在pH值为4时,羊乳中IGF-I的浓度最高。方差分析表明,当羊乳分别在不同的环境(酸性与碱性)中时,IGF-I的浓度差异显著(P<0.05),但在同一种环境(酸性或者碱性)中时,IGF-I的浓度差异不显著(P>0.05)。当羊乳的酸性增强(pH<3)或者碱性增强(pH>9),都会破坏羊乳中IGF-I的二级结构,致使其浓度降低。又因为IGF-I的pI值为8.2,当羊乳从pH=4增大到pH=8的过程中,由于羊乳的pH与IGF-I的pI越来越接近,造成IGF-I的浓度不断降低,在pH=8时,IGF-I 共价聚集在一起,致使IGF-I的浓度最低。云振宇[25]也认为羊乳在酸性环境中的浓度高于在碱性环境中的浓度,在pH值等于8时,IGF-I浓度最低,与本研究中pH对IGF-I浓度影响的研究结果一致。
2.4IGF-I的pH稳定性
羊乳中IGF-I的pH稳定性如图4所示。

图4 IGF-I的pH稳定性Fig.4 pH stability of IGF-I in goat milk
随着处理时间的延长,羊乳中IGF-I浓度均呈下降的趋势,但在不同pH下处理相同时间时,IGF-I下降程度有所差异。在pH 3~5和pH 9~10的处理过程中,随着时间的延长,IGF-I的浓度均呈显著下降趋势(P<0.05)。在pH值为6~8的处理过程中,前60 min内,IGF-I的浓度呈显著下降趋势(P<0.05),而在60~120 min间,IGF-I的浓度下降不显著(P>0.05)。由于IGF-I中存在 3 个α-螺旋和2 个β-折叠结构。而IGF-I 的二级和三级结构是依赖于pH值的,过低或者过高的pH会使乳液的酸性或者碱性增强,很可能会破坏羊乳中IGF-I的α-螺旋或者β-折叠结构,造成IGF-I变性或降解,致使其浓度迅速下降。
2.5紫外线对IGF-I浓度的影响
紫外线对羊乳中IGF-I浓度的影响如图5所示。

图5 紫外线照射时间对羊乳中IGF-I浓度的影响Fig. 5 The affections of ultraviolet radiation time on IGF-I concentrations in goat milk
随着紫外线照射时间的延长,IGF-I的浓度呈下降趋势。刚开始进行紫外线照射时,IGF-I的浓度降低较为缓慢,照射15 min时,IGF-I的浓度为(28.84±1.27) ng/mL(P>0.05)。但随着照射时间的延长,IGF-I浓度呈急剧下降趋势。不同照射时间(照射15、30、60、120 min)的羊乳样品之间,IGF-I的浓度差异极显著(P<0.01),当照射120 min时,IGF-I浓度仅剩(7.26±0.57) ng/mL(P<0.01)。由此可见,紫外线会影响羊乳中IGF-I的浓度,随着紫外照射时间的延长,IGF-I浓度会极显著降低(P<0.01),这与罗素菊[26]的结果基本相似。产生这种结果的原因可能是因为IGF-I是一个由70个氨基酸构成的多肽,而紫外线具有较高的能量,长时间照射会破坏IGF-I的二级结构,从而使其浓度降低。
2.6金属离子对IGF-I浓度的影响
金属离子对IGF-I浓度的影响如表1所示。

表1 金属离子对羊乳中IGF-I浓度的影响 单位:ng/mL
注:表1中空白为不添加金属离子的乳样。
从表1中可以看出,不同金属离子对羊乳中IGF-I浓度具有不同的影响。添加Mg2+、Fe2+时,IGF-I浓度几乎无明显变化;而添加Na+、Ca2+、Al3+、Zn2+时,IGF-I的浓度降低,表明Na+、Ca2+、Al3+、Zn2+对IGF-I的浓度具有抑制作用。同时添加1 mmol/L的Fe3+、Cu2+时,IGF-I浓度较低,而添加5 mmol/L的Fe3+、Cu2+时,IGF-I的浓度升高,表明低浓度的Fe3+、Cu2+对IGF-I的浓度具有抑制作用,而高浓度的Fe3+、Cu2+对IGF-I的浓度具有激活作用。金属离子对IGF-I浓度的影响可能与金属离子是乳中各种酶的必需组分或者辅助因子有关,不同金属离子对酶的结构和功能所起的作用不相同[27]。KIRCHGESSNER等[28]报道,适宜的Cu2+浓度在体外能激活胃蛋白酶,促进类胰岛素生长因子结合蛋白(insulin-like growth factor binding protein I, IGFBP-I)的水解,使IGF-I的浓度增加。而Na+、Ca2+、Al3+、Zn2+在体外可能会抑制胃蛋白酶,抑制IGFBP-I的水解,使IGF-I的浓度降低。
3结论
通过对羊乳中IGF-I浓度的温度、pH值、紫外线以及金属离子等影响因素的研究。结果表明,IGF-I在20 ℃时浓度较高,且在40 ℃时具有较高的热稳定性,在温度高于100 ℃时,乳中IGF-I浓度显著下降;IGF-I浓度受pH影响较大,在pH 4时具有较高浓度,且在pH 6~8时稳定性较高,在pH 3~5和pH 9~10时,IGF-I浓度迅速下降;随着紫外照射时间的延长,IGF-I的浓度损失较大。不同金属离子对羊乳中IGF-I的浓度具有一定的影响,Na+、Ca2+、Al3+、Zn2+对IGF-I的浓度具有抑制作用,低浓度的Fe3+、Cu2+对IGF-I的浓度具有抑制作用,而高浓度的Fe3+、Cu2+对IGF-I的浓度具有激活作用。
参考文献
[1]HAENLEIN W G F.Goat milk in human nutrition[J].Small Ruminant Research,2004,51(2): 155-163.
[2]YOUNG G P,TARANTO T M,JONAS H A,et al. Insulin-Like growth factor and the developing and mature rat small intestine:receptor and Biogical vactions [J].Digestion,1990,46 (Suppl 2):240-252.
[3]ZHANG W,FRANKEL W L,ADAMSON W T,et al. Insulin-like growth factors1 improves mucosal structure and function in transplanted rat small intestine [J].Trans-Plantation,1995,59(5): 755-761.
[4]ZUMKELLER W. Relationship between insulin-Like growth factorⅠand IGF-Ⅱand IGF-binding proteins in milk and the gastrointestinal tract:growth and Development of the gut [J].Pediatr Gastroenterol Nutr, 1992,15:357-369.
[5]FRANCIS G L,UPTON F M,BALLARD F J,et al.Insulin-like growth factors 1 and 2 in bovine colostrums:sequences and biological activities compared with those of a potent truncated form [J].Biochem,1988,251(1):95-103.
[6]吴晓,李明.人胰岛素生长因子Ⅰ基因的克隆及其表达[J]. 中国生化药物杂志, 2002, 23(1): 1-3.
[7]SVOBODA M E,VAN J J,KLAPPER D G,et al. Purification of Somatomedin-C from human plasma: Chemical and Biological properties,partial sequence analysis and relationship to other somatomedins[J].Biochem,1980,19(4):790-797.
[8]SIMPSON H L, UMPLEBY A M, RUSSELL-JONES D L. Insulin-like growth factor-I and diabetes. A review[J]. Growth Hormone and IGF Research,1998,8(2):83-95.
[9]XIAN C J,SHOUBRIGE C A, READ L C.Degradation of IGF-I in the adult rat gastrointestinal tract is limited by a specific anti-serum or the dietary protein casein[J]. Endocrinol, 1995,146(2):215-225.
[10]KIMURA T,MURAKAWA Y,OHNO M,et al. Gastrointestinal absorption of recombinant human insulin-like growth factor-1 in rats[J]. Pharm and Exper Therap,1997,283(2):611-628.
[11]LIDIA E,HELENA L M, MARIE P,et al. Immunoglobulins, growth factors and growth hormone in bovine colostrum and the effects of processing[J], International Dairy Journal,2002,12(11):879-887.
[12]KANG S H,KIM J U,IMM J Y,et al.The effects of dairy processes and storage on insulin-like growth factor-i(IGF-I) content in milk and in model IGF-I-fortified dairy products[J], International Dairy Journal,2006,89:402-409.
[13]PIA O, KLAUS M. Determination of insulin-like growth factor-1 and bovine insulin in raw milk and its casein and whey fractions after microfiltration and ultrafiltration[J],International Dairy Journal,2013,28(2):83-87.
[14]HANSEN P J.To be or not to be—Determinants of embryonic survival following heat shock[J], Theriogenology, 2007,68 Suppl 1(4):540-548.
[15]JOUSAN F D,HANSEN P J. Insulin-like Growth Factor-I as a survival factor for the bovine preimplantation embryo exposed to heat shock[J],Biology of Reproduction,2004,71(5): 1 665-1 670.
[16]LORENZO C, LI XIAONING,ANDREA A,et al. An immunoenzymatic assay to measure insulin-like growth factor 1 (IGF-1) in buffalo milk with an IGF binding protein blocking pre-treatment of the sample[J]. International Dairy Journal, 2011, 21(6): 421-426.
[17]HIRAYAMA T, KATOH K, OBARA Y.Effects of heat exposure on nutrient digestibility,rumen contraction and hormone secretion in goats[J], Anim Science Journal, 2004, 75: 237-243.
[18]SHARON M,DONOVAN,RAYMOND L,et al. Rosenfeld. Insulin-like growth factors I and II and their binding proteins in human milk: effect of heat treatment on IGF and IGF binding protein stability[J], Journal of Pediatric Gastroenterology and Nutrition,1991, 13(3): 242-253.
[19]RANGMAR G,EVA H,KLAUS H,et al.Effects of different CMV-heat-inactivation-methods on growth factors in human breast milk[J], International Pediatric Research Foundation, Inc. 2009, 65(4): 458-461.
[20]MCGUIRE M A,BEEDE D K,COLLIER R J,et al.Effects of acute thermal stress and amount of feed intake on concentrations of somatotropin, insulin-like growth factor (IGF)-I and IGF-II, and thyroid hormones in plasma of lactating Holstein cows[J],Journal of Animal Science, 1991, 69(5):2 050-2 056.
[21]ALEXANDER V,SIROTKIN.Effect of two types of stress (heat shock/high temperature and malnutrition/serum deprivation) on porcine ovarian cell functions and their response to hormones[J],The Journal of Experimental Biology,2010,213:2 125-2 130.
[22]SETTIVARI R S,SPAIN J N,ELLERSIECK M R,et al. Relationship of thermal status to productivity in heat-stressed dairy cows given recombinant bovine somatotropin[J],International Dairy Journal,2007, 90(3):1 265-1 280.
[23]RHOADS M L,RHOADS R P,VANBAALE M J,et al. Effects of heat stress and plane of nutrition on lactating Holstein cows: I. Production, metabolism, and aspects of circulating somatotropin[J]. International Dairy Journal,2009,92(5):1 986-1 997.
[24]PIA O, ANNE-MARIA R.Effects of heat-treatment on insulin-like growth factor-I in bovine milk[J], International Dairy Journal,2012,23(2):73-78.
[25]云振宇,蔡晓湛,王安平,等.牛初乳IGF- I在常用乳品加工条件下的稳定性研究[J],食品工业科技, 2009(1):72-74.
[26]罗素菊,彭振辉,郑焱,等.窄谱中波紫外线对角质形成细胞肝素结合表皮生长因子样生长因子mRNA的影响[J], 西安交通大学学报(医学版), 2007, 28(2): 211-214.
[27]刘晓波,罗旭刚,张荣强.高剂量铜对猪促生长作用机理的研究进展[J],动物营养学报, 1997, 9(3): 1-6.
[28]KIRCHGESSNER M,BEYER M G,STEINHART H. Activation of pepsin by heavy metal ions Including a contribution to the mode of action of copper sulfate in pig nutrition[J], Br J Nut,1976,36(1): 15-21.
Investigation on the characteristics of IGF-I in goat milk
HOU Yuan-lin1, ZHANG Fu-xin1*, LI Long-zhu2, YU Ling-ling1,YUN Dan1, LEI Fei-yan1
1(College of Food Engineering and Nutritional Science of Shaanxi Normal University, Xi’an 710062,China)2(Beilin Food and Drug Administration of Xi'an, Xi’an 710000,China)
ABSTRACTEffects of Insulin-like growth factor-I characteristic factors in goat milk were studied to lay the theoretical foundation for the further development of active functional goat products which contained higher IGF-I concentrations. Effects of temperature, pH, ultraviolet and metal ion on IGF-I concentrations in goat milk were studied by double antibody sandwich enzyme-linked immunosorbent assay. The results showed that IGF-I concentrations reached the highest level to (29.91±0.91) ng/mL at 20 ℃ in goat milk(P<0.05)and had higher thermal stability at 40 ℃. IGF-I concentrations were the highest at pH4 with 28.53±1.11 ng/mL(P<0.05), and more stable at pH6~8. IGF-I concentrations in goat milk decreased severely on the condition of ultraviolet radiation(P<0.05). IGF-I concentrations would be inhibited if added Na+,Ca(2+),Al(3+),Zn(2+) in goat milk while Mg(2+),Fe(2+) had no effect on this. IGF-I concentrations were inhibited at lower concentrations of Fe(3+) and Cu(2+) . However,it could be activated at higher concentrations of Fe(3+) and Cu(2+). The research evaluate the effect of temperature, pH ultraviolet and metal ion on IGF-I concentrations in goat milk. It provides the basis and guidance for the active functional goat products which contained higher IGF-I concentrations.
Key wordsgoat milk; insulin-like grouth factor-I(IGF-I); characteristics; double antibody sandwich enzyme-linked immunosorbent assay
收稿日期:2015-06-21,改回日期:2015-08-17
基金项目:“十二五”农村领域国家科技计划项目(2013BAD18B00);农业部公益性行业(农业)科研专项(201103038);陕西省农业攻关项目(2014K01-17-05)
DOI:10.13995/j.cnki.11-1802/ts.201603006
第一作者:硕士研究生(张富新教授为通讯作者,E-mail:891685945@qq.com)。
