动物双歧杆菌乳亚种BZ11的耐氧驯化及降胆固醇性能的研究
2016-05-09王猛熊江张玲李翠芹何腊平陈平范劲
王猛,熊江,张玲,李翠芹,何腊平,3*,陈平,范劲
1(贵州大学 酿酒与食品工程学院,贵州 贵阳,550025) 2(贵州大学 贵州省发酵工程与生物制药重点实验室,贵州 贵阳,550025) 3(贵州省农畜产品贮藏与加工重点实验室,贵州 贵阳,550025) 4(贵州大学 化学与化工学院,贵州 贵阳,550025) 5(贵州大学理学院,贵阳,550025)
动物双歧杆菌乳亚种BZ11的耐氧驯化及降胆固醇性能的研究
王猛1,2,熊江1,3,张玲1,2,李翠芹4,何腊平1,2,3*,陈平5,范劲1
1(贵州大学 酿酒与食品工程学院,贵州 贵阳,550025)2(贵州大学 贵州省发酵工程与生物制药重点实验室,贵州 贵阳,550025)3(贵州省农畜产品贮藏与加工重点实验室,贵州 贵阳,550025)4(贵州大学 化学与化工学院,贵州 贵阳,550025)5(贵州大学理学院,贵阳,550025)
摘要为了提高动物双歧杆菌乳亚种BZ11对有氧环境的耐受性,采用逐渐增加培养基中的氧分压和有氧、厌氧条件下交替培养两种方案对其进行了耐氧驯化。通过对驯化前后菌株的生长特性进行分析得出逐渐增加培养基中的氧分压的驯化方案取得了更好的效果。经最优方案驯化后的菌株在有氧条件下培养20 h后,活菌数可达到6.30×108 CFU/mL,是初始菌株的2.24倍。驯化后菌株的降胆固醇率为27.31%± 0.80%,与初始菌株相比没有显著性差异(P>0.05)。通过鉴定得出,动物双歧杆菌乳亚种BZ11在耐氧驯化前后保持了相似的形态及生理生化特征。因此,驯化后的菌株有望作为1株潜在益生菌被开发利用。
关键词双歧杆菌;耐氧驯化;降胆固醇;鉴定
双歧杆菌是一种专性厌氧、不运动、不产芽孢的革兰氏阳性杆菌,其染色不规则[1],最早是由法国巴斯德研究所的HENRY于1899年从母乳喂养婴幼儿的粪便中分离得到[2],后来发现其广泛存在于人和动物的肠道、女性生殖道、反刍动物的瘤胃等环境中,是母乳喂养婴幼儿肠道的主要微生物[3]。
双歧杆菌作为一种能够定植肠道的微生物,已被证实可以通过多种机制对人体健康产生有益的影响[4]。最近,它们的降胆固醇特性已经引起了人们的广泛关注[5]。目前,已经有不少体内实验报道服用含一定数量益生菌的产品能够有效降低人体系统中的胆固醇水平和血脂浓度,这对由高血清胆固醇而引起的人类心脑血管疾病的治疗是一个利好消息[6]。通常采用传统药物对心脑血管疾病进行治疗时,收效甚微,且副作用较大;而双歧杆菌可通过同化吸收和菌体吸附等多种机制有效清除肠道中的胆固醇,降低人体对其的吸收利用,不产生有害代谢产物,且不影响人体对其他营养物质的吸收利用[7]。
然而,多数双歧杆菌属于专性厌氧菌,当将其作为功能性成分添加到食品中时,由于周围环境中氧化压力的存在,不可避免的会对其活菌数及益生特性产生影响,而人们在消费时通常选择和接受的产品所含的益生菌活菌量为106个/g[8],这给双歧杆菌的实际应用带来了较多不便。经研究发现,有些专性厌氧菌株经人工耐氧驯化后可以在有氧的环境中生长。目前,国内外学者从多方面对双歧杆菌的耐氧机理进行了探讨,并采用不同的方法对双歧杆菌进行了耐氧驯化,如逐渐增加培养基中的氧分压[9],在有氧和厌氧环境下交替培养[10],进行物理或者化学方法诱变[11],原生质体融合及基因转导技术[12]等,这些方法起到了较好的驯化效果。
本实验室从香猪源筛选得到1株动物双歧杆菌乳亚种BZ11(CGMCC No.10224),经实验发现该菌株在耐氧驯化前具有一定的降胆固醇能力,为了进一步提高菌株的耐氧能力,本研究采用逐渐增加培养基中氧分压和有氧、厌氧条件下交替培养两种方案对该株菌进行了耐氧驯化,并考察其耐氧驯化后的生长及降胆固醇能力,为后期进一步研究该株菌的高密度发酵和实际应用奠定基础。
1材料和方法
1.1材料
1.1.1菌株来源
菌株BZ11为本实验室从贵州省特色资源小香猪肠道内溶物中筛选得到,并经中国普通微生物菌种保藏管理中心(CGMCC)鉴定为动物双歧杆菌乳亚种(Bifidobacterium animalissubsp.lactis),保藏编号为:CGMCC No.10224。
1.1.2双歧杆菌的基础培养基
PTYG培养基[13]:胰蛋白胨 5 g、大豆蛋白胨5 g、酵母粉10 g、葡萄糖10 g、吐温80 1 mL、L-半胱氨酸盐酸盐0.05 g、盐溶液4 mL、蒸馏水1 000 mL;调pH 值7.0,121 ℃,灭菌20 min。
盐溶液配方:CaCl20.2 g、K2HPO41.0 g、KH2PO41.0 g、MgSO4·7H2O 0.48 g、Na2CO310 g、NaCl 2 g、蒸馏水1 000 mL,溶解后备用。
降胆固醇培养基[14]:将胆固醇胶束加入到PTYG培养基中使其中含有胆固醇质量浓度为0.1 mg/mL。1 000 mL的液体培养基含0.1 mg/mL胆固醇胶束的制备:用分析天平准确称取0.1 g胆固醇放入小烧杯中,然后依次称取0.2 g胆盐,0.1 g蔗糖八乙酸酯,1 mL吐温80于小烧杯中搅拌均匀,然后移取5 mL的冰乙酸加热溶解,超声处理15 min后快速加入到液体PTYG培养基中,边加入边搅拌,最终使其形成均一稳定的胶体溶液,调pH 值7.0,121 ℃灭菌20 min。
1.1.3实验设备
厌氧培养箱,上海新苗医疗器械制造有限公司;SW-185I水套式二氧化碳培养箱,上海三腾仪器有限公司;SPX型生化培养箱,上海科恒实业发展有限公司;立式压力蒸汽灭菌锅,江阴滨江医疗设备有限公司;SKY-100C恒温摇床,上海百典仪器设备有限公司;SHHW2恒温水箱,上海东星建材试验设备有限公司;GBJS-5LS自动发酵罐,上海百仑生物科技有限公司;TGL 20M台式高速冷冻离心机,长沙迈佳森仪器设备有限公司;海尔超低温保存箱;SW-CJ-2D型双人净化工作台,苏净集团;JM-A15002电子天平,余姚市纪铭称重校检设备有限公司;CX21FS1型OLYMPUS显微镜,奥林巴斯中国有限公司;pH计,上海鸿盖仪器设备公司;T6新世纪紫外分光光度计,北京普析通用仪器有限责任公司。
1.2实验方法
1.2.1培养方法
将在-80 ℃低温冰箱里甘油保藏的菌种管取出,在37 ℃恒温水箱快速解冻,然后采用PTYG 培养基进行活化,置于厌氧培养箱(CO2-5%,H2-10%,高纯N2-85%)37 ℃培养48 h,挑取单菌落进行划线纯化[13],取同批次活化后的初始菌株进行耐氧驯化。
1.2.2菌体形态观察
采用革兰氏染色,显微镜镜检法[15]。
1.2.3菌体OD600值的测定
利用可见分光光度计, 以未接种的PTYG液体培养基为空白对照,在600 nm 波长下进行光电比浊测定,记录光密度值[15]。
1.2.4活菌数的测定
采用平板菌落计数法[15]。
1.2.5pH 值的测定
三角瓶实验利用pH计进行测定,发酵罐扩大培养实验通过发酵罐配套使用的pH电极进行测定,通过控制面板进行读数。
1.2.6初始菌株生长能力测定
将经厌氧培养箱活化后的初始菌株在PTYG平板上进行多次划线纯化后,挑取单菌落到37 ℃生化培养箱进行培养,32 h后按2%的接种量进行液体传代培养1次,每隔4 h取样测定菌株在培养32 h生长过程中的吸光值,活菌数及pH的变化情况,绘制生长曲线。
1.2.7双歧杆菌的耐氧驯化及生长能力测定
1.2.7.1耐氧驯化方案一
通过逐渐增加液体培养基中氧分压的方案进行驯化。首先,在无菌条件下挑取纯化培养后的初始菌株单菌落接种到PTYG培养基在20% CO2培养箱进行培养;然后,采用2%的接种量在20% CO2培养箱进行传代培养,连续传代5次后转到生化培养箱培养;最后,在转速为150 r/min的摇床上振荡培养[9]。每次培养时间均为32 h,培养温度均为37 ℃,所采用的培养装置为250 mL带棉筛三角瓶,装液量为50 mL。驯化完毕后,测定菌株在生化培养箱中培养32 h过程中的生长状况。
1.2.7.2耐氧驯化方案二
通过在厌氧和有氧条件下交替培养的方案进行驯化。首先,在无菌条件下挑取纯化培养后的初始菌株单菌落接种到PTYG培养基在20% CO2培养箱进行培养,32 h后挑取菌悬液在PTYG平板上划线培养;然后,挑取单菌落接种到PTYG培养基在生化培养箱培养,按此方法在20% CO2培养箱和生化培养箱中交替培养10次,之后完全在生化培养箱中进行传代培养5次[10]。所采用的培养装置同上。驯化完毕后,测定菌株在生化培养箱中培养32 h过程中的生长状况。
1.2.8耐氧驯化前后菌株的形态及生理生化鉴定
观察菌株在耐氧驯化前后进行有氧培养时的菌落形态,挑取单菌落进行革兰氏染色,观察菌体形态,并采用双歧杆菌生化鉴定管对耐氧驯化前后的菌株进行生理生化鉴定。
1.2.9耐氧驯化后菌株发酵罐扩大培养生长性能测定
将经最优驯化方案驯化的菌株在5 L发酵罐进行扩大培养,接种量为2%,培养温度为37 ℃,转速150 r/min,培养基初始pH 7.0。每隔4 h从发酵罐中进行取样,测定菌株在培养48 h生长过程中吸光值,活菌数及pH的变化情况,绘制生长曲线。
1.2.10耐氧驯化前后菌株的降胆固醇能力的测定。
将耐氧驯化前后的菌株活化并纯化培养3次后,挑取单菌落接种到PTYG培养基中在20% CO2培养箱中静置培养48 h后,分别将菌液在10 000 r/min,4 ℃离心10 min收集菌体,调整菌浓度后按10%的接种量接种于降胆固醇培养基中,在20% CO2培养箱中培养48 h后参照邻苯二甲醛法(OPA)[14]测定菌株在耐氧驯化前后的降胆固醇能力。
1.3数据分析
所有试验均重复进行3 次,所得数据表示为均值±SD,运用Origin Pro7.5进行作图,并用SPSS Statistics 19进行统计学分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2结果与分析
2.1动物双歧杆菌的耐氧驯化
将经两种方案耐氧驯化后的菌株及初始菌株分别按照2%接种量接种于有氧条件下进行培养。测定菌株在培养32 h生长过程中的OD600值、活菌数和pH值,绘制生长曲线并进行对比。结果如图1,图2和图3所示。

图1 耐氧驯化前后动物双歧杆菌的生长过程OD600值变化的比较Fig.1 Time courses of OD600 values of oxygen-resistant and original strains

图2 耐氧驯化前后动物双歧杆菌的生长过程活菌数变化比较Fig.2 Comparison of live bacterium number between oxygen-resistant and original strains

图3 耐氧驯化前后动物双歧杆菌的生长过程pH 变化的比较Fig.3 Time courses of growth pH of oxygen-resistant and original strains
由图1,图2,图3及统计分析表明,与初始活菌数相比,菌株在耐氧驯化前后均可以在有氧条件下显著生长(P<0.05),菌株在培养4 h后便可以进入对数生长期(P<0.05)。按第一种方案驯化后的菌株在培养16 ~28 h处于稳定期(P>0.05),在20 h处活菌数达到最大为6.30×108CFU/mL,培养液OD600值为0.938,pH值下降到3.38。按第二种方案驯化后的菌株也在培养16 h后进入稳定期,在20 h处活菌数达到最大为3.80×108CFU/mL,培养液OD600值为0.928,pH值下降到3.49。而未经过驯化的菌株,在培养4 h后进入快速增长期,8 h后进入缓慢增长期,28 h后进入衰亡期,在培养24 h后活菌数达到最大为2.82×108CFU/mL,此时培养液OD600值为0.923,pH值下降到3.54。对耐氧驯化前后的菌株在有氧条件下培养32 h过程中的达到的最大活菌数检测结果及方差分析见表1、表2。

表1 不同方案驯化动物双歧杆菌乳亚种BZ11的实验结果
注:1) 标有同一字母的数据间差异不显著;2) 方差分析采用Duncan新复极差法。

表2 不同方案驯化动物双歧杆菌乳亚种BZ11
注:1)F0.05(2,6)=5.14;2) F0..01(2,6)=10.92;2) * *表示显著性P<0.01。
由表1结果可知,经方案一驯化后的菌株活菌数最大,是驯化前初始菌株的2.24 倍。表2方差分析表明,几种驯化方案驯化效果差异显著。采用Duncan新复极差法可知,方案一与方案二差异显著。另对最大活菌数对应的pH值分析表明,驯化后的菌株较驯化前产酸能力更强(P<0.05)。因此,确定方案一为最优驯化方案。
2.2耐氧驯化前后菌株形态及生理生化特征的比较
2.2.1形态特征
将耐氧驯化前后菌株在有氧条件下进行活化培养后进行平板稀释涂布,观察所长出的菌落的形态特征,挑取单菌落进行革兰氏染色并在显微镜下观察菌体形态,对比结果如表3,图4和图5所示。

表3 耐氧驯化前后动物双歧杆菌乳亚种BZ11形态特征

图4 耐氧驯化前动物双歧杆菌乳亚种BZ11菌体形态(×1000)Fig.4 Morphological photography of B. animalis subsp.lactis BZ11 before oxygen domestication

图5 耐氧驯化后动物双歧杆菌乳亚种BZ11菌体形态(×1000)Fig.5 Morphological photography of B. animalis subsp.lactis BZ11 after oxygen domestication
2.2.2耐氧驯化前后菌株的生理生化鉴定
采用双歧杆菌生化鉴定管对耐氧驯化前后的菌株进行鉴定,鉴定管内液体呈黄色为阳性,如呈现紫色或紫灰色为阴性。鉴定结果如表4所示。
从表3、表4及图4、图5得出的菌株在耐氧驯化前后的形态及生理生化特征基本保持一致,所以确定菌株在耐氧驯化后没有发生变异。

表4 耐氧驯化前后动物双歧杆菌乳亚种BZ11的
注:表中“+”表示阳性反应;“-”表示阴性反应。
2.3驯化后菌株在发酵罐扩大培养生长能力的测定
将经第一种方案驯化后的菌株在5 L发酵罐中进行扩大培养,生长曲线如图6所示。由图6看出,在培养过程中驯化后的动物双歧杆菌没有明显的延滞期,在培养4 h后便进入对数生长期,在24 h处活菌数达到最大为5.50×108CFU/mL,比初始活菌数显著提高了近两个数量级(P<0.05)。另外,OD600值在32 h处达最大为1.442,OD600值是活菌数和死菌数总体变化情况,所以最大OD600值时间与最大活菌数时间并不一致。
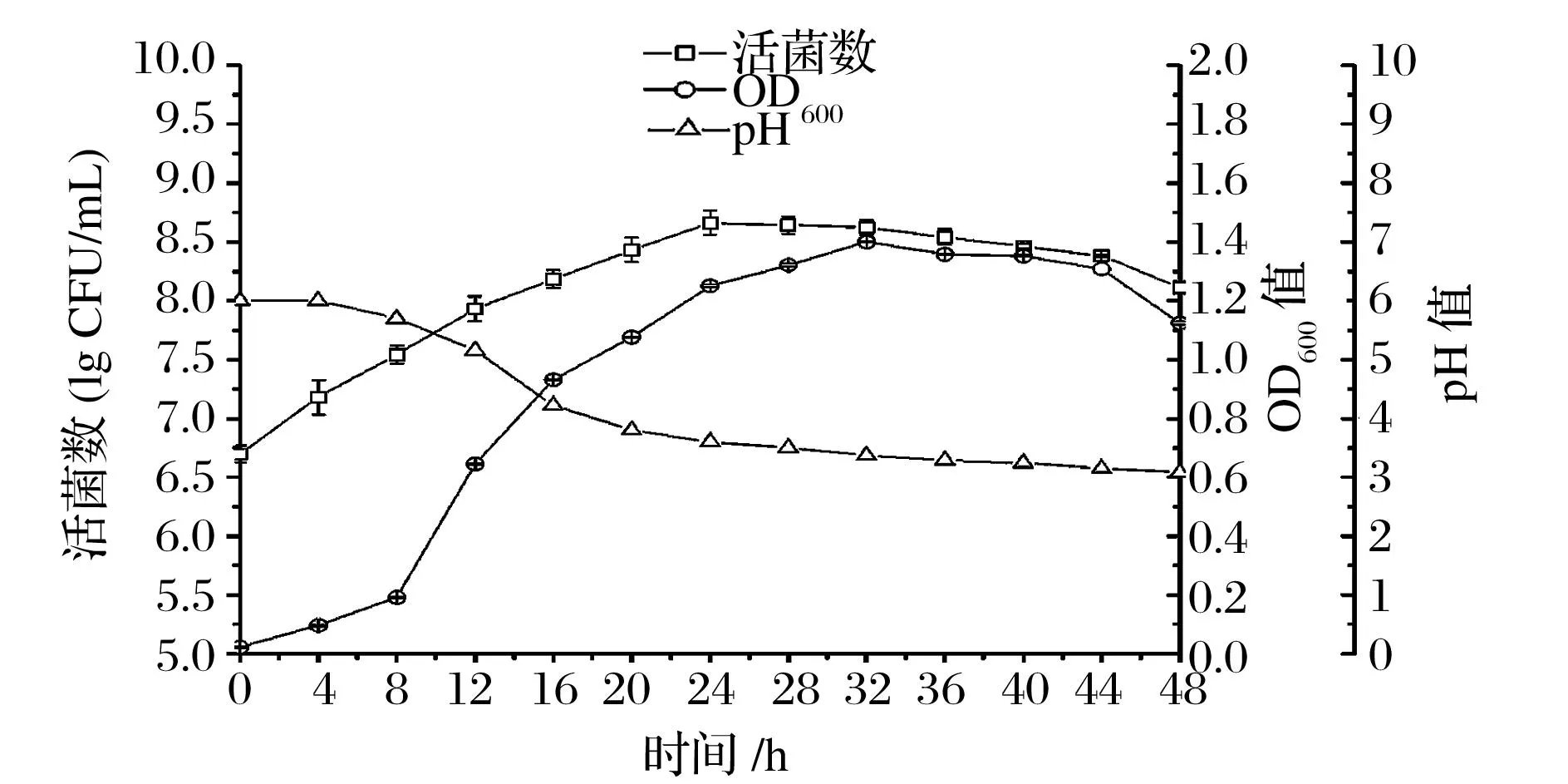
图6 5 L发酵罐中耐氧驯化后动物双歧杆菌BZ11发酵曲线图Fig.6 Fermentation curve of domesticated B. animalis subsp.lactis BZ11 in 5L fermentor
2.4耐氧驯化前后菌株的降胆固醇能力的测定
按照OPA方法分别测定了耐氧驯化前后菌株在培养48 h后菌株降胆固醇率,耐氧驯化后菌株的降胆固醇率达到27.31%±0.80%,耐氧驯化前菌株的降胆固醇率为27.10%±0.92%,将菌株耐氧驯化前后的降胆固醇率进行t检验得出无显著性差异(P=0.823>0.05)。因此得出,菌株在耐氧驯化前后降胆固醇能力并未受到较大影响。
3讨论
本文研究结果表明当采用逐渐增加培养基中氧分压对动物双歧杆菌乳亚种BZ11进行耐氧驯化后,可以促进菌株更好地适应有氧环境。驯化后的菌株较驯化前在培养过程中推迟达到稳定期,且活菌数也有显著提高。杜少平[9]也曾采用逐渐增加培养基中氧分压的方法对两歧双歧杆菌进行耐氧驯化取得了较好的效果,与本研究的不同之处在于所采用的CO2浓度为5%,而本实验过程中采用的CO2浓度为20%。KAZUAKI[16]曾采用不同的CO2浓度对长双歧杆菌培养,发现了当CO2浓度为20%时,所获得的细胞量和胞外多糖量均可达到最大。由此得出,适当增加CO2的浓度有助于厌氧菌株更好地进行生长和代谢。当然也有其他的驯化方案,如吴敏[17]曾采用了逐渐降低培养基中的抗氧化剂含量对婴儿双歧杆菌进行耐氧驯化,李丽[12]也成功运用了原生质体融合技术显著改善了德氏乳杆菌的耐氧性。
关于双歧杆菌的耐氧机制,国内外多位学者已对其进行了探讨,TALWALKAR等[18]研究表明, 不同的氧气浓度能促使双歧杆菌的NADH 氧化酶活力和NADH过氧化物酶活力提高1.5~3倍,从而能抵制氧的毒性作用。然而KAWASAKI等[19]发现,NADH 氧化酶和NADH 过氧化物酶活力不是造成它们耐氧性差异的主要原因,并进一步研究表明:在pH 5.0~6.0时, 耐氧性高的双歧杆菌的NADH 氧化酶以NADH-H2O 活性为主,而耐氧性低的双歧杆菌的NADH 氧化酶以NADH-H2O2活性为主, 这表明NADH 氧化酶的类型也影响着双歧杆菌的耐氧性。赵建云[20]研究了长双歧杆菌在氧气胁迫下菌体生长以及葡萄糖代谢中关键酶基因mRNA的变化情况,得出长双歧杆菌耐氧性与葡萄糖代谢酶有一定关联。左芳雷[21]曾对B.longum BBMN68的耐氧机制进行了探讨,提到该菌对氧胁迫的应答是一个涉及到全基因组的全面而复杂的过程,包括一系列的抵御和适应性机制,进一步对其氧胁迫相应中的差异表达基因的功能进行验证,得出AhpC是双歧杆菌清除有氧产生的内源氧化物的主要酶类。关于本实验所采用的动物双歧杆菌所涉及到的耐氧机制有待进一步深入研究。
对经最优驯化方案驯化前后菌株的降胆固醇能力进行了测定,发现耐氧驯化前菌株的降胆固醇率为27.10%±0.92%,而耐氧驯化后菌株的降胆固醇率达到了27.31%±0.80%,菌株在耐氧驯化前后降胆固醇能力并没有受到太大的影响。HOV等[22]曾研究发现干酪乳杆菌GL-03能够明显降低高血脂老鼠的总胆固醇和甘油三酯的水平,其中降胆固醇率能够达到56.11%±3.58%。MUKESH等[23]曾对培养24 h后干酪乳杆菌和德氏乳杆菌的降胆固醇能力进行测定,发现降胆固醇率分别达到了22%和26%,后来用富含2株菌的饲料喂养小鼠发现能够明显降低小鼠血清总胆固醇水平而其他组织没有发现病理性变化。而目前关于耐氧性能好且能降胆固醇的双歧杆菌还少有报道。LYE[24]曾对5种乳酸菌在模拟肠道环境下降胆固醇的机制进行了研究,提到了5种主要机制分别是菌株生长过程中的同化吸收;细胞表面的黏附;胆固醇胶束的裂解;胆盐的解离和酸性环境下胆盐水解酶的酶解。关于何种降胆固醇机制起主导作用有待进一步深入研究。
将驯化后菌株在5 L发酵罐进行扩大培养,菌株在培养24 h后活菌数最高可达5.50×108CFU/mL,说明了驯化后的菌株在有氧条件下已具备一定的生长能力,且满足双歧杆菌挥益生作用的浓度。经形态学及生理生化鉴定得出驯化后的菌株较驯化前并未发生变异。在对其进行安全评价通过后有望被添加到食品制品中进行扩大生产和利用,从而能更好地满足人们的生活需求。
参考文献
[1]闫磊,王毳,曾庆祝,等.双歧杆菌的功能特性及其应用前景[J].现代食品科技,2007,23(3):86-89.
[2]熊三玉,管斌,孔青,等.两歧双歧杆菌耐氧耐酸耐胆盐优良菌株的选育[J].中国酿造,2007,26(6):32-35.
[3]NINOMIYA K,MATSUDA K, KAWAHATA T,et al. Effect of CO2concentration on the growth and exopolysaccharide production of Bifidobacterium longum cultivated under anaerobic conditions[J].Journal of Bioscience and Bioengineering,2009,107(5):535-537.
[4]NAGPAL R,KUMAR A,KUMAR M, et al. Probiotics, their health benefits and applications for developing healthier foods:a review[J].FEMS Microbiology Letters,2012,334(1):1-15.
[5]BORDONI A,AMARETTI A,LEONARDI A,et al. Cholesterol-lowering probiotics:in vitro selection and in vivo testing of bifidobacteria[J].Applied microbiology and biotechnology,2013,97(18):8 273-8 281.
[6]JONES M L,TOMARO-DUCHESNEAU C,MARTONI C J,et al. Cholesterol lowering with bile salt hydrolase-active probiotic bacteria,mechanism of action,clinical evidence,and future direction for heart health applications[J].Expert opinion on Biological Therapy,2013,13(5):631-642.
[7]国立东,杨丽杰,霍贵成.乳酸菌降胆固醇机制的研究进展[J].食品与发酵工业,2013,39(2):117-122.
[8]LACROIX C, YILDIRIM S. Fermentation technologies for the production of probiotics with high viability and functionality[J].Current Opinion in Biotechnology,2007,18(2):176-183.
[9]杜少平,杨础华,石笛,等.两歧双歧杆菌耐氧耐酸优良菌株的选育[J].现代食品科技,2009,25(8):916-919.
[10]韩雪,冯镇,易华西,等.两株双歧杆菌的耐氧驯化及生长特性研究[J].食品科技,2010,35(9):37-40.
[11]MOZZETTI V, GRATTEPANCHE F, MOINE D,et al. New method for selection of hydrogen peroxide adapted bifidobacteria cells using continuous culture and immobilized cell technology[J].Microbial Cell Factories, 2010,9:60.
[12]李丽.利用原生质技术选育耐氧德氏乳杆菌菌株的研究[D].合肥:安徽农业大学, 2012.
[13]张刚.乳酸细菌:基础,技术和应用[M].北京化学工业出版社生物.医药出版分社, 2007:427.
[14]张汝娇,何腊平,李翠芹,等.邻苯二甲醛法(OPA)与高效液相色谱法(HPLC)测定降胆固醇的双歧杆菌的对比[J].食品与发酵工业,2014,40(7):177-181.
[15]刘国生.微生物学实验技术[M].北京:科学出版社,2007,14-131.
[16]NINOMIYA K,MATSUDA K,KAWAHATA T,et al. Effect of CO2concentration on the growth and exopolysaccharide production of Bifidobacterium longum cultivated under anaerobic conditions[J].Journal of Bioscience and Bioengineering,2009,107(16):535-537.
[17]吴敏,胡颖,罗爱平,等.婴儿双歧杆菌的耐氧驯化及应用特性研究[J].食品与机械,2012,28(2):18-22.
[18]TALWALKAR A,KAILASAPATHY K.Metabolic and biochemical responses of probiotic bacteria to oxygen [J].Journal of Dairy Science,2003,86(8):2 537-2 546.
[19]KAWASAKI S,MIMURA T,SATOH T,et al. Response of the microaerophilic Bifidobacterium species,B. boum and B. thermophilum, to oxygen[J].Applied and Environmental Microbiology,2006,72(10):6 854-6 858.
[20]赵建云,马会勤,肖满,等.氧气胁迫对长双歧杆菌葡萄糖代谢关键酶基因表达的影响[J].食品工业科技, 2011,32(10):220-224.
[21]左芳雷.长双歧杆菌BBMN68氧胁迫应答机制的转录组学研究及差异表达基因的功能分析[D].北京:中国农业大学,2014.
[22]HOU H-M,GUO D-Q,ZHANG G-L,et al. Characteristics of cholesterol-lowering Lactobacillus casei subsp. casei strain GL-03 isolated from cheese[J].Journal of the Korean Society for Applied Biological Chemistry,2014, 57(5):597-603.
[23]SINGH M K,SINGLA R,SINGH A,et al. Survival of probiotic strains in non-dairy indian spice condiment exhibiting cholesterol reducing properties[J].Food Science and Biotechnology,2012,21(5):1 309-1 315.
[24]LYE H-S, RAHMAT-ALI G R, LIONG M-T.Mechanisms of cholesterol removal by lactobacilli under conditions that mimic the human gastrointestinal tract[J].International Dairy Journal,2010,20(3):169-175.
Studies on oxygen domestication and cholesterol degradation property ofBifidobacteriumanimalissubsp.lactisBZ11
WANG Meng1,2,XIONG Jiang1,3,ZHANG Ling1,2, LI Cui-qin4,HE La-ping1,2,3*,CHEN Ping5,FAN Jin1
1(School of Liquor and Food Engineering,Guizhou University, Guiyang 550025,China)2(Key Laboratory of Agricultural and Animal Products Store & Processing of Guizhou Province, Guiyang 550025,China)3(Fermentation Engineering and Biopharmacy,Guizhou University,Guiyang 550025,China)4(School of Chemistry and Chemical Engineering,Guizhou University,Guiyang 550025,China)5(College of Science,Guizhou University,Guiyang 550025,China)
ABSTRACTTo improve the aerotolerant capacity of Bifidobacterium animalis subsp.lactis BZ11 in aerobic environment, two ways including gradual increase of the partial pressure of oxygen in medium and alternate incubation between aerobic and anaerobic were taken. After analyzing the growth characteristics of the strain pre- and post- domestication, the first method obtained a better effect and cell concentration of the domesticated strain reached 6.30×108 CFU/mL after cultivating in aerobic conditions for 20 h, which was 2.24 times of the concentration of the original strain. The cholesterol degradation rate of the strain after oxygen-domestication was 27.31%±0.80%, which didn’t show significant difference (P>0.05) compared with the original strain. Moreover, identification results indicated that the physiological and morphological characteristics of domesticated Bifidobacterium animalis subsp.lactis BZ11 kept similar to those of the original strain. So it can be used as a potential probiotics for further in-depth development and utilization.
Key wordsBifidobacterium; oxygen- domestication; cholesterol degradation; identification
收稿日期:2015-10-20,改回日期:2015-12-07
基金项目:国家自然科学基金(31160002);贵州省猪肉制品工程技术研究中心项目(黔科合农G字[2013]4001号);贵州省猪肉特色制品深加工关键技术研究及产业化示范(黔科合重大专项字[2015]6004号)
DOI:10.13995/j.cnki.11-1802/ts.201603001
第一作者:硕士研究生(何腊平教授为通讯作者,E-mail:helaping@163.com)。
