PDCD4、mTOR在乳腺癌中的表达及意义①
2016-04-14韩丽丽赵海丰孙庆玉
王 新,韩丽丽,赵海丰,王 博,孙庆玉
(佳木斯大学附属第一医院肿瘤科,黑龙江 佳木斯 154003)
PDCD4、mTOR在乳腺癌中的表达及意义①
王新,韩丽丽,赵海丰,王博,孙庆玉
(佳木斯大学附属第一医院肿瘤科,黑龙江 佳木斯 154003)
摘要:目的:检测PDCD4和mTOR蛋白在乳腺癌中的表达,分析与临床病理的关系。方法:运用免疫组化SP法测PDCD4和mTOR蛋白在50例乳腺癌及癌旁组织中的表达。结果:乳腺癌及癌旁组织阳性率(28%,80%)(χ2=29.543,P<0.05),PDCD4 的表达与乳腺癌的组织分化有关(χ2=11.952,P<0.05),临床分期有关(χ2=12.346,P<0.05),淋巴结转移有关(χ2=6.349,P<0.05),比较差异有统计学意义(P<0.05),与年龄无关(χ2=2.266,P>0.05),肿瘤大小无关(χ2=2.066,P>0.05),比较差异无统计学意义。乳腺癌及癌旁组织阳性率(72%,26%)(χ2=25.882,P<0.05),mTOR的表达与组织学分化有关(χ2=7.291,P<0.05),淋巴结转移有关(χ2=9.921,P<0.05),临床分期有关(χ2=5.062,P<0.05),比较差异有统计学意义(P<0.05),与年龄无关(χ2=0.734,P>0.05),与肿瘤大小无关(χ2=0.651,P>0.05),比较差异无统计学意义,Spearman分析,PDCD4和mTOR的表达呈负相关(r=-0.355,P<0.05)。结论:①PDCD4蛋白在乳腺癌中低表达,mTOR蛋白高表达;②两因子参与乳腺癌的发生发展。
关键词:PDCD4;mTOR;乳腺癌;临床意义
乳腺癌严重威胁妇女健康甚至生命,近年来发病率、死亡率在我国女性呈上升趋势且年轻化。人们对乳腺癌的认识从宏观到微观,从表象到本质,随分子生物学发展,乳腺癌病因、治疗也发展至亚细胞分子水平,癌基因激活,抑癌基因失活,细胞周期异常均参与乳腺癌发生发展,且涉及多条信号通路。PDCD4是AKT/PI3K/mTOR通路下游重要靶点之一,研究发现它是一种新的抑癌的基因[1]。在细胞凋亡过程中扮演重要角色,并对肿瘤细胞生长有调控作用,此作用通过蛋白质转录和翻译实现。近年,在PDCD4基因对程序性细胞死亡的调控,细胞蛋白质的翻译等方面进行了大量研究。mTOR能调控细胞蛋白质的合成,对细胞生长、增殖、血管生成也有重要作用。近年来发现[2],与mTOR相关的信号通路复杂且广泛,通路中多个元素异常都和肿瘤发生发展甚至侵袭转移有关。mTOR主要通过PI3k/Akt/mTOR信号通路对细胞周期等多种生理功能进行调控。许多相关的信号通路对乳腺癌的发生发展,侵袭及转移都有调控作用,其中PI3k/ Akt/ mTOR信号通路在乳腺癌中存在高频失调,最高可达70%[3],相关文献报导此通路的异常激活与乳腺癌的细胞增殖,对化疗及内分泌治疗耐药有关。
1材料与方法
1.1材料
1.1.1对象及标本
搜集2014-06~2015-06乳腺癌标本50例,来自佳木斯大学附属第一医院肿瘤科手术切除标本,对应的癌旁组织为对照,30例淋巴结转移的患者,无淋巴结转移的20例。患者术前未做化疗等治疗。肿瘤的大小以最大横径为计,所有患者的临床资料完整。年龄30~68岁。病理、淋巴结转移均经病理证实,皆为浸润性导管癌。所有标本取下后常规固定等程序后备用。
1.1.2实验用品
兔抗人PDCD4抗体及兔抗人mTOR抗体(北京博奥森生物技术有限公司),超净工作台,恒温箱,显色剂(DAB液),抗体稀释液。
1.2实验方法
1.2.1免疫组化步骤
通过病历号选取病理科存档的蜡块切片脱蜡、封闭、滴加兔抗人PDCD4、mTOR,然后加二抗、显色剂、复染,最后脱水、封片。阳性对照:已经染色阳性的片子作对照。阴性对照:用PBS片代替为阴性对照。
1.2.2结果判定
PDCD4阳性表达于胞浆或胞核,主要胞浆。mTOR主要在胞浆表达。最终判定:≤3分为阴性(-),4~5分为弱阳性(+),6~7分为阳性(),≥8分为强阳性()。评定方法以下两种结果相乘:染色强度分级:没有染色记为0分,淡黄色记为1分,黄色或者深黄色记为2分,褐色或者棕褐色记为3分。阳性细胞比例:≤50%为2分,50%~75%为3分,≥75%为4分。
1.3统计学方法
采用SPSS17.0统计软件处理。PDCD4和mTOR表达情况采用方差分析,各相关因素比较用秩相关,P<0.05为差异有统计学意义。
2结果
2.1PDCD4表达
PDCD4阳性表达主要位于胞浆。PDCD4在乳腺癌及癌旁组织中比较差异有统计学意义(χ2=29.543,P<0.05)见表1。

表1 乳腺癌及癌旁组织中PDCD4的表达情况
2.2mTOR表达
mTOR在乳腺癌旁组织及癌中表达比较差异有统计学意义(χ2=25.882,P<0.05),见表2。
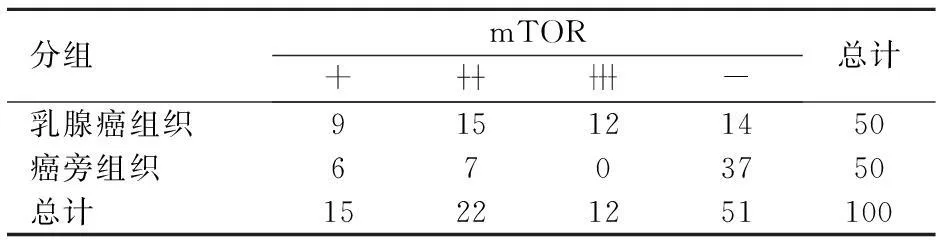
表2 乳腺癌及癌旁组织中mTOR蛋白的表达情况
2.3PDCD4与临床病理的关系
见表3。
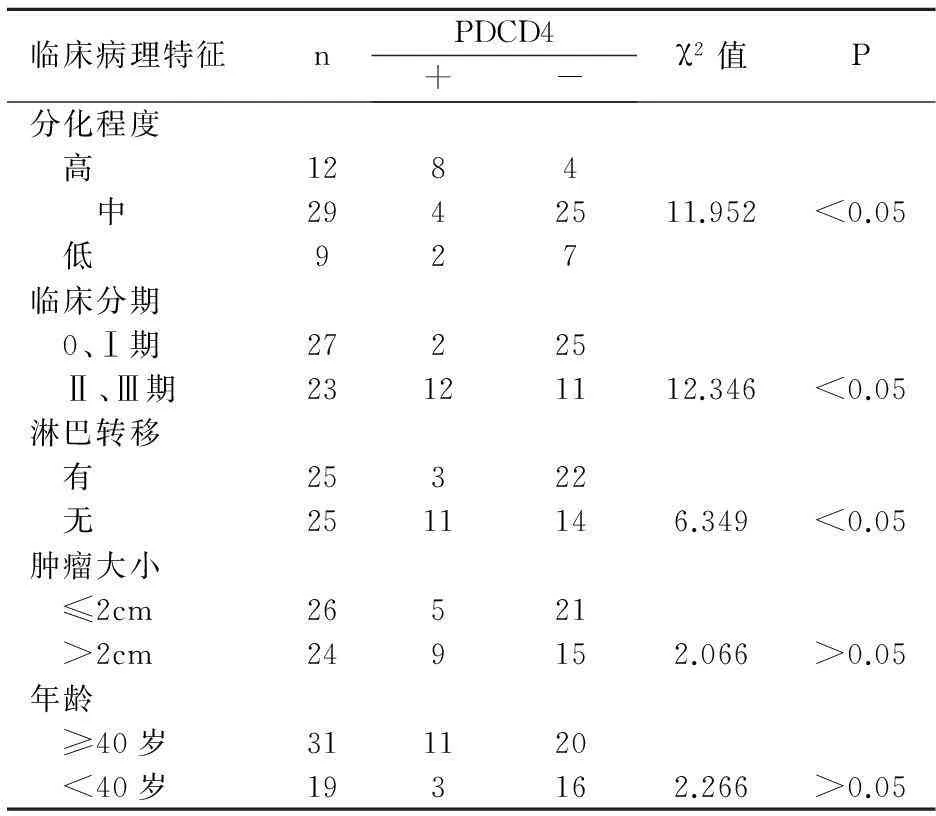
表3 PDCD4与临床病理之间的关系
2.4mTOR与临床病理之间的关系
见表4。
表4mTOR与临床病理之间的关系
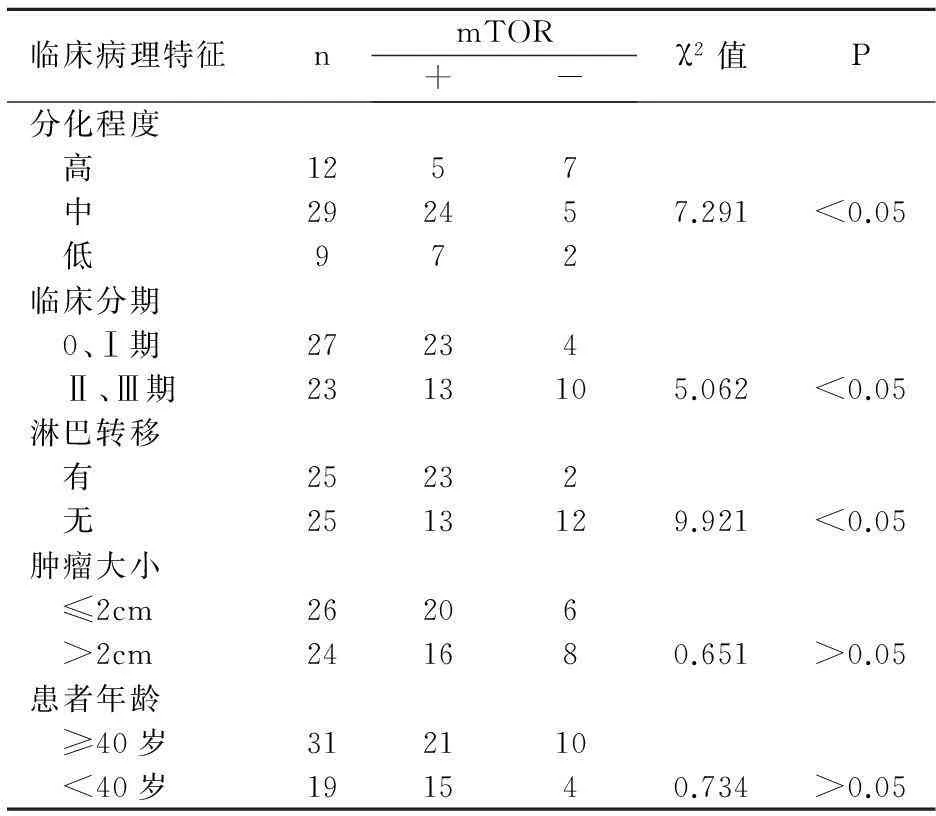
临床病理特征nmTOR+-χ2值P分化程度 高1257 中292457.291<0.05 低972临床分期 0、Ⅰ期27234 Ⅱ、Ⅲ期2313105.062<0.05淋巴转移 有25232 无2513129.921<0.05肿瘤大小 ≤2cm26206 >2cm241680.651>0.05患者年龄 ≥40岁312110 <40岁191540.734>0.05
2.5PDCD4与mTOR之间的关系
经分析PDCD4与mTOR表达负相关(r=-0.355,P=0.011)。见表5。
表5在乳腺癌中PDCD4与mTOR的相关

mTORPDCD4阳性阴性合计P阳性72936阴性7714合计143650<0.05
3讨论
乳腺癌是现今威胁女性生命健康较常见疾病,尽管普查体系日臻完善,以手术为主各种综合治疗手段得以实施,但复发、转移仍然是导致患者死亡主要原因。因此,研究热点仍集中在寻找有意义的检测因子,及寻找新的治疗靶点方面。
PDCD4是1995年小鼠实验时在其体内发现,证实为凋亡基因,位于10q24染色体,不少研究认为是新的抑癌基因。CHEN等[4]研究124例肺癌组织PDCD4的表达,发现下降或者缺失有84例,且与肿瘤恶性程度、预后有关。WEI等研究卵巢癌,发现PDCD4表达高的比低的术后生存期长。本实验也发现PDCD4在癌中明显低表达,且与组织学,TNM分期,淋巴结转移有关,而年龄,肿瘤大小不影响其表达。
mTOR是高度保守的丝/苏氨酸蛋白激酶,表达在神经元上[5]。此外,PI3K/AKT通路和AKT/TSC1-TSC2两条通路都对mTOR有调控,从而调节细胞增殖、生长。因此,mTOR通路任一点异常都可能形成肿瘤,所以可针对此通路开发抑制肿瘤药。林萍等[6]研究人结肠癌,发现mTOR在癌组织中高表达,且与肿瘤临床分期,淋巴结转移,浸润深度有关。与患者的年龄,性别无关。本实验同样发现乳腺癌组织中mTOR蛋白的表达显著高于癌旁组织,且mTOR蛋白在乳腺癌中的表达与临床病理之间的关系与其大体相同。相关性分析,PDCD4和mTOR表达呈负相关,推测PDCD4与mTOR参与乳腺癌的发生发展。
相关文献报道,mTOR、cox-2等多种因子对PDCD4有调控作用,其中mTOR/p7os6k通路起重要作用。Dorrello等发现在促细胞分裂素作用下,s6k1(核糖体p70s6激酶蛋白)被激活后使PDCD4在ser67处迅速磷酸化,与泛素连接酶SCFβTRCP结合后,PDCD4泛素化被蛋白酶降解。PDCD4含两个AKT磷酸化位点,ser67和ser457,无论体内或体外,PDCD4的ser67和ser457残基都能被AKT特异磷酸化,因此AKT也被认为参与PDCD4的磷酸化降解。 由于s6k1的活性主要受上游通路PI3K/AKT/mTOR调节, 因此任何能引起此此通路活性改变的因子均能通过影响s6k1而间接调控PDCD4的表达。mTOR是AKT下游重要作用靶点之一,磷酸化后的AKT能直接使TSC2磷酸化而激活mTOR。mTOR 通常是以mTORc1和mTORc2两种蛋白复合物形式存在。其中活化的mTORc1可以直接使下游的6k1和4EBP1磷酸化后活化。S6k1可以使核糖体蛋白s6磷酸化其下游的靶点PDCD4。S6k1是目前已知mTORc1直接作用的重要底物,是调控蛋白质翻译、细胞增殖及大小的重要因子。从以上叙述可看出乳腺癌的发生发展复杂,涉及多因子、信号通路,且各个环节相互作用制约,因此乳腺癌的未来治疗方向一定是采用针对个基因及多信号通路的共同抑制或激活的手段,才能达理想效果。通过控制PI3K/AKT/mTOR通路及其相关交叉通路,然后结合放化疗等多层次抑制乳腺癌细胞生长,促进细胞凋亡,已经成为治疗乳腺癌的新的思路。
参考文献:
[1]韩晓蓉,吴坤河,郜红艺,等.不同分子亚型乳腺癌细胞死亡因子4的表达及其与预后的关系[J].中国普外基础与临床杂志,2004,21(5):577-582
[2]郑鹏生,冀静.mTOR信号通路与肿瘤的研究进展[J].西安交通大学学报,2010,31(1):1-2
[3]Loper-Kknowles E ,O Toole SA,McNeil CM,et al.PI3K pathway activiation in breast cancer is associated with the basal-like phenotype and cancer-specific mortality[J].Int J cancer,2010, 126(5):1121-1131
[4]Chen Y,Knosel T,Kristiansen Q et al. Loss of PDCD4 expression in human lung cancer correlates with tumour progression and prognosis[J]. J Pathol,2003,200:640-646
[5]王显鹤,国添玉.发育期大鼠反复持续惊厥对皮层AMPK/mTOR表达及雷帕霉素的干预作用[J].黑龙江医药科学,2013,36(4):48-49
[6]林萍,邓涛,叶彦,等.人结肠直癌组织中mTOR、HIF-1α、PKM2的表达及临床意义[J].疑难病杂志,2015,14(4):380-383
(收稿日期:2015-05-24)
中图分类号:R737.9
文献标识码:B
文章编号:1008-0104(2016)01-0082-02
作者简介:王新(1963~)男,黑龙江佳木斯人,硕士,主任医师,教授,硕士研究生导师。通讯作者:韩丽丽(1986~)女,山东淄博人,在读硕士研究生。E-mail:1159518837@qq. com。
