运用手持技术探究银氨溶液的成分
2016-03-16任峰张典俊郭孝兵
任峰 张典俊 郭孝兵
摘要:从理论推导和实验探究两个方面,对硝酸银溶液与氨水反应制得的银氨溶液的碱性和主要成分进行了探讨,证明用该方法配制出来的银氨溶液呈弱碱性,其溶质主要成分不是Ag(NH3)2OH,而应是Ag(NH3)2NO3。
关键词:银氨溶液;成分分析;手持技术;实验探究
文章编号:1005–6629(2016)3–0073–03 中图分类号:G633.8 文献标识码:B
银氨溶液又称托伦试剂(Tollens reagent),用于检验和定量测定有机物中含有的醛基。银氨溶液检验醛基时发生的反应被称为银镜反应,该反应是大学及中学有机化学中鉴定醛基化合物的一个典型实验。人们常常认为银氨溶液中的溶质是Ag(NH3)2OH。例如,人教版高中教材《有机化学基础》中有关银氨溶液的制备实验的相关描述如下[1]:在洁净的试管中加入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴加入2%的稀氨水,至最初產生的沉淀恰好完全溶解为止,制得银氨溶液。并给出了银镜反应的化学方程式:
CH3CHO+2Ag(NH3)2OH△CH3COONH4+ 2Ag↓+3NH3+H2O。
由此可以看出,教材认为硝酸银与氨水生成的银氨溶液的主要成分是Ag(NH3)2OH。并且由于Ag(NH3)2OH是强碱,许多人就想当然地认为银氨溶液的碱性应该比配制银氨溶液所用的氨水碱性强。事实果真如此吗?此处所得银氨溶液中的溶质主要成分究竟是不是Ag(NH3)2OH?本文从反应原理分析和实验验证两个方面进行探讨。
银氨溶液的制备实验中发生的先后反应可以用化学方程式表示如下[1]:
①AgNO3+NH3·H2O=AgOH↓+NH4NO3
②AgOH+2NH3·H2O=Ag(NH3)2OH+2H2O
由反应②可见,实验中所得溶液的溶质主要成分似乎是Ag(NH3)2OH。但事实并非如此,因为Ag(NH3)2OH是强碱,其电离出的OH-必然会跟第①步中的产物NH4NO3电离出的NH4+结合生成NH3·H2O:
③Ag(NH3)2OH+NH4NO3=Ag(NH3)2NO3+ NH3·H2O
而③式生成的NH3·H2O又会作为反应物参与②式的化学反应。
因此,由①+②+③得:
④AgNO3+2NH3·H2O=Ag(NH3)2NO3+2H2O

所以Ag(NH3)2NO3只能呈微弱碱性,而Ag(NH3)2OH呈强碱性。因此,我们只要通过实验测定按教材中所用的方法制得的银氨溶液的pH,就可以证明银氨溶液的成分。
2.1 实验过程
为了验证上述推理,我们利用以下药品和器材完成了两个实验。
实验药品:2%的AgNO3溶液、约2%的氨水
实验器材:烧杯、pH传感器(已校准)、滴数传感器(已校准)、磁力搅拌器等
实验1 用pH传感器测定约2%氨水的pH,其pH为11.69。
实验2 按图1所示装置,边用磁力搅拌器搅拌边向25.00mL 2% AgNO3溶液中逐滴加入上述氨水,用pH传感器和滴数传感器同时测量烧杯内溶液的pH和所用氨水的体积,直到生成的沉淀完全溶解,继续滴加1~2mL氨水。实验测得溶液的pH随氨水加入体积的增加的变化曲线如图2所示。重复多次实验,所得曲线均与图2相似。
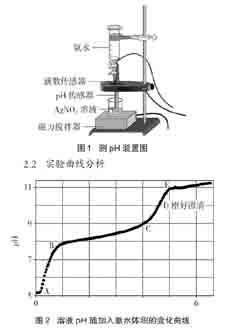
由图2可以看出,曲线起点A点AgNO3溶液的pH为5.16,呈酸性。这是因为AgNO3溶液水解的原因造成的。随着氨水的加入,AB之间pH快速升高,此时能看到有白色沉淀生成。B点pH为7.9左右。BC之间开始生成大量沉淀,后来沉淀又逐渐减少。C点后,沉淀量明显减少,溶液逐渐变得澄清,到达D点时溶液迅速变得澄清透明。此时D点pH为10.29,用去的氨水体积为4.71mL,约为AgNO3溶液体积的1/5。
图2中的pH曲线出现了两个突跃:AB段与CE段。在AB段,溶液由AgNO3溶液的弱酸性变为碱性,只需少量氨水即可,因而会出现pH的突跃;在C点,AgOH的溶解已经接近尾声,此时加入的氨水不会继续被反应物大量消耗,使得溶液中的OH-离子浓度快速升高,因而再次出现pH的突跃。CE段的pH突跃标志着配制银氨溶液的化学反应已经完成。
图2中的pH曲线出现了两个相对平缓的上升阶段:BC段与E点之后。在BC段,虽然加入了大量的氨水,但是pH并没有显著升高,这是因为加入的氨水主要用于AgOH的生成和AgOH的溶解,氨水被消耗殆尽,因而溶液中的OH-的浓度没有明显的变化。在E点之后,溶液的pH仅有缓慢升高,其原因显然是因为此时溶液的pH较大,氨水浓度的增大对pH影响就非常有限了。
2.3 实验数据分析
(1)查相关资料[2]可知:实验中使用的2%硝酸银溶液密度为1.015 g·mL-1,则其物质的量浓度为:
c(AgNO3)=1.015 g·mL-1×1000 mL·L-1×2%÷(170 g·mol-1)=0.120 mol·L-1。
(2)用浓氨水配制2%稀氨水时,由于浓氨水的质量分数不准确,导致稀释后的2%氨水浓度也不准确。因此用盐酸作为标准液标定本实验中使用的约2%氨水浓度为1.275 mol/L。则其OH-物质的量浓度为:
c(OH-)=[c(NH3·H2O)×Kb]1/2=[1.275×1.8×10-5]1/2 mol/L=4.79×10-3 mol/L
pH=11.68。
此计算值与实验1中测得的氨水的pH为11.69非常接近。由于2%氨水的物质的量浓度大约是2%硝酸银溶液的10倍,根据反应④,AgNO3~2NH3·H2O,所以实验2中所用氨水的体积约为AgNO3溶液体积的1/5。此比例关系恰恰也证明了所得银氨溶液的主要成分是Ag(NH3)2NO3。

近似:x很小,故b-2×(a-x)≈b-2a
a、b均为混合后体积增大后的浓度,其中a=0.120 mol/L×25.00mL÷(25.00+4.71)mL= 0.100 mol/L,b=1.275 mol/L×4.71mL÷(25.00+ 4.71)mL≈0.202 mol/L。
求得c(Ag+)=x≈a÷[(b-2a)2×Kf]=a÷[(b-2a)2×1.12×107]
=0.100÷[(0.202-2×0.100)2×1.12×107]
=2.2×10-3 mol/L。
由于Ag+浓度很低,水解程度又很小,因此其水解作用忽略不计。此时,c[Ag(NH3)2+]=a-x=(0.100-2.2×10-3) mol/L≈0.098 mol/L。c(NH3·H2O)=b-2a≈0.002 mol/L
因为c/Kb=0.002÷(1.8×10-5)<400,则c(OH-)=[-Kb+(Kb2+4cKb)1/2]÷2
=[-1.8×10-5+(1.82×10-10+4×0.002×1.8×10-5)1/2]÷2=1.81×10-4 mol/L pH=10.26。
此计算结果与实验2测定的溶液刚好澄清时的pH 10.29非常接近,比2%氨水的pH小得多。既然银氨溶液的碱性没有配制银氨溶液所用的氨水碱性强,那么就表明其主要成分的确为Ag(NH3)2NO3。
(4)与上述银氨溶液物质的量浓度相当的Ag(NH3)2OH溶液,即浓度为0.098 mol/L的Ag(NH3)2OH溶液,由于其完全电离出OH-,所以其pH=14+lg0.098=12.99。与实验2测定的溶液刚好澄清时的pH为10.29相比,Ag(NH3)2OH溶液的碱性要强得多。因此,实验所得银氨溶液中的溶质主要成分不可能是Ag(NH3)2OH。
3.1 方法分析
由于银氨溶液在反应中生成Ag(NH3)2NO3和 Ag(NH3)2OH时,溶液的pH差异较大,Ag(NH3)2NO3是配位化合物,在水溶液中完全电离生成Ag(NH3)2和NO3-,而Ag(NH3)2+只能微弱电离出Ag+和NH3,所以Ag(NH3)2NO3溶液的OH-主要来自于NH3·H2O的电离,故溶液中OH-浓度较小,溶液的碱性较弱;而Ag(NH3)2OH为强碱,在水溶液中则是完全电离的,与Ag(NH3)2NO3等物质的量浓度时,OH-浓度要大得多,溶液碱性自然要强一点。而且,实验过程中并无其他影响溶液pH的因素,所以,本实验着眼于该原理,通过测定溶液的pH及其变化,准确度是高的,方法也是合理的。
3.2 结果分析
从实验结果来看,实验数据的准确性和理论计算结果是非常吻合的。微弱的差别可能源于仪器的灵敏度、溶液浓度的准确性、环境温度等因素。所以,在实验过程中,我们尽可能地排除干扰因素,如对pH传感器做了多次校准,对溶液浓度进行了精确配制,对于氨水的物质的量浓度还进行了滴定处理等,以保障测量数据的准确性和实验结果的可靠性。
无论是反应原理分析还是实验探究结果均可以明确得出結论:硝酸银溶液与氨水反应制得的银氨溶液中溶质的主要成分不是Ag(NH3)2OH,而是Ag(NH3)2NO3;溶液的OH-主要来自于NH3·H2O的电离,故溶液仅呈弱碱性。基于上述推导和实验探究,建议在高中教材中对乙醛的银镜反应的化学方程式做适当的修改。修改以后的化学方程式为:
CH3CHO+2Ag(NH3)2NO3+H2O
CH3COONH4+2Ag↓+2NH4NO3+NH3。
参考文献:
[1]课程教材研究所,化学课程教材研究开发中心.有机化学基础(第二版)[M].北京:人民教育出版社,2007:53~54.
[2]北京师范大学.实用化学手册[M].北京:北京出版社,1980:6,208.
[3]李成刚,何小稳.用于银镜反应的银氨溶液成分及碱性的探究[J].化学教学,2013,(9):39~41.
