电解氯化亚铁溶液的理论分析和实验探究
2016-03-16叶望尧吴文中
叶望尧 吴文中
摘要:从热力学及动力学两个角度分析电解FeCl2溶液中阴、阳离子放电的可能性,并通过改变电解的电压、溶液pH和电解质浓度,探究电解FeCl2溶液阴、阳极电极反应的可能情况。得出阴极还原反应:Fe2+优先得电子析出银白色金属铁,而H+得电子析出H2与溶液pH和电解电压有关;阳极氧化反应:Fe2+优先失电子氧化为Fe3+,而Cl-失电子与电解电压有关的结论。
关键词:电解FeCl2溶液;电压;离子淌度;超电位;热力学;动力学
文章编号:1005–6629(2016)3–0076–03 中图分类号:G633.8 文献标识码:B
学习了电化学有关知识后,有学生提出用惰性电极电解FeCl2溶液时,电极反应如何书写?该问题让笔者想到近几年高考试题中有关电解FeCl2溶液的考查,如:2013年福建高考化学试题中考查了FeCl2溶液的电解(23题最后一问),2014年北京高考化学28题则详细探究了不同电压条件下电解FeCl2溶液,其阳极电极反应的可能情况。学者陈花[1]在“电解氯化亚铁溶液”一文中探究了电解氯化亚铁的一些具体实验。本文将从热力学和动力学两个角度出发,探究氯化亚铁溶液电解时,阴、阳电极在不同电压、浓度以及不同pH条件下的实验现象及其理论支撑。
惰性电极电解FeCl2溶液电极反应的可能情况分析如下。
2.1 阴极电极反应分析
(1)阴极反应:2H++2e-=H2↑
(2)阴极反应:Fe2++2e-=Fe
通电后,在电场的作用下,阳离子H+与Fe2+定向移动到阴极,它们可能会在阴极表面得到电子,那么究竟是H+还是Fe2+先得电子呢?
①从热力学角度分析:在标准状态下,因为Eθ(Fe2+/Fe)=-0.4402V [2],Eθ(H+/H2)=0.000V,因此H+更容易在阴极表面先得电子。但是由于存在析氢超电位现象(见表1),造成H+不易在阴极得电子,仅从超电位角度(热力学)分析,H+离子难以在石墨电极表面得到电子,但在铂电极表面能顺利得到电子产生氢气。
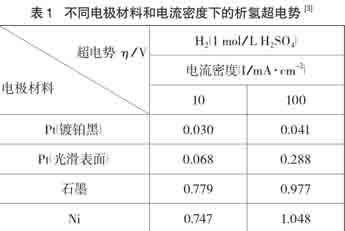
而阴极反应:Fe2++2e-=Fe的ΔG=-nFEθ=-2×96.487×(-0.4402)=84.95 kJ·mol-1>0,在没有外力作用下,反应不自发,但是在有电场外力作用下,该阴极电极反应就有可能。
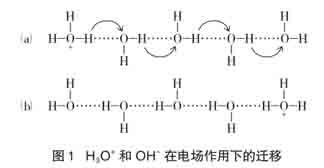
②从动力学角度分析,H+的迁移速率更大,更易到达电极表面,这是由于H3O+或OH-在水溶液电场作用下迁移的特殊性造成的,H3O+和OH-表现出很高的离子淌度(如表2)。

H3O+和OH-表现出的特殊迁移速率,是由于在通常的溶剂中的离子移动之外附加了跳跃机理,来自水合质子的氢离子可以跳跃到临近的水分子,是一个与水合氢离子在溶液中运动有相同效果的过程(如图1)。有人认为在水溶液中单个的溶剂质子化的传导实际通过一种质子传递机理,即Grotthuss机理[5],并不是质子本身从溶液的一端迁向另一端,而是质子从一个水分子传给另一个水分子,电流就很快沿着氢键传导,分子的排列形式从(a)到(b),以(b)排列方式的分子必须翻转,回复到(a)的排列状态而接受(或释放)质子。
当离子半径越小,极化率越大,电荷数越高,离子在电解质溶液中迁移速率越慢,淌度越小,因此Fe2+的离子淌度比H+小,在电场的作用下,H3O+和OH-优先到达阴极或阳极表面,更容易首先放电。但是,在电流密度不是很大的情况下,离子的迁移速率还是很小,其影响离子得失电子能力还是次要因素,因为溶液中的离子除了定向迁移外还有自由扩散运动的存在。
③在相同的惰性电极下,如果FeCl2溶液浓度比较大,Fe2+在阴极得电子的能力就强。相反如果溶液的pH小,酸性强,则H+就更易在阴极放电。
因此,在某浓度和pH下,Fe2+与H+放电顺序难以确定,需视具体情况再行确定。
2.2 阳极电极反应分析
(1)阳极反应:Fe2+-e-=Fe3+
(2)阳极反应:2Cl--2e-=Cl2↑
阳极反应的实质是具有还原性的离子在阳极表面失去电子,发生氧化反应,Fe2+和Cl-都具有还原性,那么究竟是Cl-还是Fe2+先失去电子呢?从以下几个方面加以分析。
①从热力学角度分析:根据标准电极电势Eθ(Fe3+/Fe2+)=0.770V,Eθ(Cl2/Cl-)=1.358V [6]看,应该是Fe2+容易在阳极表面先失去电子,发生氧化反应。从超电势角度分析,由于Cl2在阳极表面的超电势比较大,如电流密度为100 A·m-2时,Cl2在石墨Eθ(Cl2/Cl-)=0.251V [7]。金属离子的超电势相对比较小,当电流密度较大时,Fe2+的超电势也随之会增大,在电压和电流密度不是很大的情况下,Fe2+先氧化,在电极上优先失电子。
而阳极反应:Fe3++e-=Fe2+的ΔG=-nFEθ=-1×96.487×0.770=-74.29 kJ·mol-1,而Cl2+2e-=2Cl-的ΔG=-nFEθ=-2×96.487×1.358=-262.1 kJ·mol-1,由此可见Fe2+在阳极失电子的趋势比Cl-在阳极失电子的趋势更大。
②从动力学角度分析,结合表2的有关离子淌度数据,Cl-离子淌度U+=7.91×10-8 (m2·V-1·s-1),而Fe2+离子淌度U+=5.4×10-8 (m2·V-1·s-1),因此Cl-容易在阳极发生氧化反应。但是,Cl-失去電子生成Cl2并不能及时从溶液中逸出,若此时遇到Fe2+,则会发生2Fe2++Cl2=2Fe3++2Cl-,因此,从结果上看,就是Fe2+优先于Cl-放电。

为深入解析在不同条件下FeCl2溶液的电解情况,笔者通过系列单电解池电解实验作进一步的探究,得到的实验结果如表3、表4和表5所示。
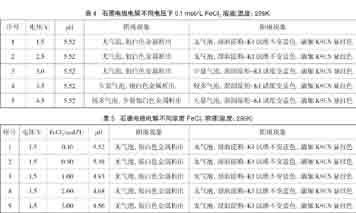
通过上述不同条件下的实验探究,结合理论分析,我们得出用惰性电极电解FeCl2溶液电极反应的某些规律。
(1)阴极电极反应:Fe2+和H+都有可能在陰极发生还原反应。Fe2+在阴极优先得电子发生还原反应:Fe2++2e-=Fe,在阴极可析出银白色金属。而H+在阴极得电子受到溶液pH和电压影响,当FeCl2溶液pH<1左右或电压在3.5V以上时,H+在阴极得电子发生还原反应:2H++2e-=H2↑。当溶液pH越小,电压越大,H+越易得到电子。
(2)阳极电极反应:Cl-和Fe2+都有可能在阳极发生氧化反应。Fe2+优先在阳极失去电子发生氧化反应:Fe2+-e-=Fe3+。而Cl-在阳极失去电子受到电压影响,如电压大于3.0V以上,Cl-在阳极发生氧化反应:2Cl--2e-=Cl2↑,有Cl2从阳极逸出。当电解电压越大,Cl-越易失去电子。
(3)外界条件(浓度、电压、pH)对电解的影响。结合表3、表4、表5的实验结果分析得到:FeCl2溶液浓度对电解影响不大;pH主要影响H+在阴极得电子,当溶液pH<1左右H+会在阴极得电子产生H2;电压主要影响Cl-在阳极失电子,当电压大于3.0V以上时Cl-会在阳极失电子产生 Cl2。
(4)电解过程是一个复杂的物理、化学过程,在电解的有关教学中,我们切不可把问题简单化,更不要设想企图找到一个“一语定乾坤”的规律,这不但难以做到,也不是严谨的科学态度。对于中学教学来说,如果说有这样的电解规律,那就只有阳极发生氧化反应、阴极发生还原反应这个规律,而所谓优先放电顺序等规律,都是在一定条件下的规律。
参考文献:
[1]陈花.实验探索:电解氯化亚铁溶液[J].福建教学研究,2014,(2):35~36.
[2][6]北京师范大学等.无机化学教研室编.无机化学·上册·第四版[M].北京:高等教育出版社:424,423.
[3][4]上海师范大学等合编.物理化学·下册·第三版[M].北京:高等教育出版社:441,389.
[5]伍艳辉,邵一凡,张惠敏,张海峰.质子交换膜中质子传递机理研究进展[J].电源技术,2010,(11):1206~1207.
[7]北京师范大学等.无机化学教研室编.无机化学·上册·第二版[M].北京:高等教育出版社,1987:399.
